
5.04.21
1
KOROZJA
PODSTAWY
TEORETYCZNE,
METODY POMIAROWE,
SPOSOBY
ZAPOBIEGANIA
I OCHRONY
PRZECIWKOROZYJNEJ
HENRYK SCHOLL
Katedra Chemii Ogólnej i Nieorganicznej
Wydział Chemii
Uniwersytetu Łódzkiego
e-mail: hscholl@chemul.uni.lodz.pl
ELEKTROCHEMIA STOSOWANA
W Y K Ł A D 5 (2008)

5.04.21
2
Ze zjawiskiem korozji związanych jest szereg ważnych terminów
i pojęć. Ze względu na często spotykane rozbieżności w
rozumieniu niektórych terminów związanych z korozją, niezbędne
jest posługiwanie się usystematyzowanymi terminami i pojęciami.
Definicje tych terminów i pojęć można znaleźć w
Polskiej Normie PN-EN ISO 8044 "Korozja metali i stopów.
Podstawowe terminy i definicje"
.
Norma
PN-EN ISO 8044
definiuje korozję jako oddziaływanie
fizykochemiczne między metalem i środowiskiem, w wyniku
którego powstają zmiany we właściwościach metalu, które
mogą prowadzić do znaczącego pogorszenia funkcji metalu,
środowiska lub układu technicznego, którego są częściami.

5.04.21
3
Ważnymi terminami ogólnymi z zakresu tematyki korozyjnej są:
-
czynnik korozyjny
- substancja, która w kontakcie z danym metalem
powoduje korozję;
-
środowisko korozyjne
- środowisko, w którym obecny jest co
najmniej jeden lub większa liczba czynników korozyjnych;
-
efekt korozyjny
- zmiana jakiejkolwiek części układu korozyjnego
spowodowana korozją;
-
produkt korozji
-substancja wytworzona w wyniku korozji;
-
szybkość korozji
- efekt korozyjny dotyczący metalu w jednostce
czasu. (Jednostki definiujące szybkość korozji zależą od układu
technicznego i rodzaju efektu korozyjnego.
Szybkość korozji
może być wyrażona jako
zwiększenie głębokości
skorodowania w czasie lub jako masa metalu przekształcona w
produkty korozji na jednostkę powierzchni i w jednostce czasu
.
Efekt korozyjny może zmieniać się w czasie i może nie być
jednakowy w każdym punkcie korodującej powierzchni.

5.04.21
4
-
odporność na korozję
- zdolność metalu do zachowania użyteczności
w danym układzie korozyjnym.
W normie
PN-EN ISO 8044
ujęte są także rodzaje korozji. Są to m.in.:
-
korozja elektrochemiczna
- korozja, podczas której zachodzi co
najmniej jedna reakcja anodowa i jedna reakcja katodowa;
-
korozja chemiczna
- korozja, podczas której nie zachodzą procesy
elektrochemiczne;
-
korozja atmosferyczna
- korozja, gdzie środowiskiem korozyjnym
jest atmosfera ziemska o temperaturze otoczenia;
-
korozja mikrobiologiczna
- korozja związana z działaniem
mikroorganizmów obecnych w układzie korozyjnym;
-
korozja ogólna
- korozja zachodząca na całej powierzchni metalu
eksponowanego w środowisku korozyjnym;
-
korozja równomierna
- korozja ogólna zachodząca z prawie taką
samą szybkością na całej powierzchni;
-
korozja lokalna
- korozja występująca wybiórczo, w wyróżnionych
miejscach powierzchni metalu poddanego działaniu środowiska
korozyjnego;

5.04.21
5
Korozja mikrobiologiczna –
powodowana jest przez określone rodzaje
bakterii, które w środowisku wodnym zawierającym jony
siarczanowe SO
4
2-
w reakcji zachodzącej z depolaryzacją katodową:
Reakcja anodowa:
4Fe – 8e 4 Fe
2+
Reakcja katodowa:
8H
2
O + 8e 8 H
ads
+ 8 OH
-
8 H
ads
+ SO
4
2-
4 H
2
O + S
2-
Reakcja w ogniwie korozyjnym:
4 Fe + 4 H
2
O + SO
4
2-
4 Fe
2+
+ S
2-
+ 8 OH
-
i następnie wytworzenie warstwy siarczku na
powierzchni żelaza:
S
2-
+ Fe
2+
FeS

5.04.21
6
-
korozja wżerowa
- korozja lokalna wywołująca tworzenie się
wżerów, tzn. wgłębień postępujących od powierzchni w głąb metalu;
-
korozja szczelinowa
- korozja lokalna związana i występująca w
wąskiej szczelinie, lub w bezpośrednim jej sąsiedztwie, lub w
prześwicie utworzonym między powierzchnią metalu i inną
powierzchnią (metalową lub niemetalową);
-
korozja selektywna
- korozja stopu, którego składniki wchodzą w
reakcje w innych proporcjach niż ich proporcje w stopie;
korozja międzykrystaliczna
- korozja występująca na granicach
ziaren metalu lub w obszarach do nich przylegających;
-
korozja cierna
- proces, w którym równocześnie występuje korozja
i tarcie między dwiema przesuwającymi się i stykającymi się ze
sobą powierzchniami;
-
korozja zmęczeniowa
- proces, w którym równocześnie występuje
korozja i przemienne odkształcenia metalu, często prowadzące do
jego pęknięcia;
-
korozja wodorowa
– proces, w wyniku którego następuje
zmniejszenie ciągliwości lub plastyczności metalu spowodowane
absorpcją wodoru pomiędzy krystality (skutkiem procesu korozji
wodorowej jest
kruchość wodorowa
).

5.04.21
7
POJĘCIA STOSOWANE W OPISIE PROCESÓW KOROZYJNYCH
-
potencjał korozyjny
- potencjał elektrodowy metalu w danym układzie
korozyjnym;
-
swobodny potencjał korozyjny
- potencjał korozyjny występujący przy
braku sumarycznego (zewnętrznego) prądu płynącego do lub od
powierzchni metalu;
-
potencjał korozji wżerowej
- najniższa wartość potencjału korozyjnego
przy której możliwe jest powstawanie wżerów na powierzchni pasywnej
w danym środowisku korozyjnym;
-
pasywacja
- zmniejszenie szybkości korozji przez wytworzoną na
powierzchni metalu warstwę pasywną;
-
potencjał pasywacji
- potencjał korozyjny, przy którym prąd korozyjny
ma najwyższą wartość, a powyżej tego potencjału znajduje się zakres
potencjałów, przy których metal jest w stanie pasywnym;

5.04.21
8
-
warstwa pasywna (pasywacyjna)
- cienka, przyczepna do podłoża
warstwa ochronna utworzona na powierzchni metalu w wyniku
reakcji metalu ze środowiskiem. Warstwa ta hamuje postęp korozji.
-
depasywacja
- wzrost szybkości korozji metalu znajdującego się w
stanie pasywnym, spowodowany przez całkowite lub miejscowe
usunięcie warstwy pasywnej;
-
stan aktywny
- stan powierzchni metalu korodującego, którego
potencjał jest mniejszy od potencjału pasywacji;
-
stan transpasywny
- stan metalu spolaryzowanego do potencjału o
wartości wyższej od zakresu potencjałów stanu pasywnego,
charakteryzujący się znacznym wzrostem prądu korozyjnego, ale
nie związanym z korozją wżerową;

5.04.21
9
U W A G A O Z A S A D N I C Z Y M
Z N A C Z E N I U:
Wymienione rodzaje korozji obejmują jedynie podstawowe typy
procesów korozyjnych.
W warunkach rzeczywistej eksploatacji metali i ich stopów
rzadko się zdarza zachodzenie tylko jednego typu procesu
korozyjnego.
Zwykle występują one w różnorodnych kombinacjach !!
I to jest podstawowa trudność we wprowadzaniu zabezpieczeń
antykorozyjnych.

5.04.21
10
Podstawowym zjawiskiem, od którego trzeba zacząć
omawianie korozji elektrochemicznej jest
polaryzacja elektrod.
Jest to zjawisko polegające na wytrąceniu elektrody ze stanu
równowagi dynamicznej.
Układ może być wytrącony z równowagi albo poprzez zewnętrznie
przyłożony potencjał albo po przez wymuszony przepływ prądu.
Jak już wiemy
w stanie równowagi
prąd anodowy jest równy co do
wartości prądowi katodowemu (i
a
=-i
c
), na skutek zmiany jednego z
omawianych czynników (prądu lub potencjału) powodujemy,
że jedna z reakcji, anodowa lub katodowa, przyśpiesza lub zwalnia
co powoduje, że i
a
-i
c
.
Zjawisko takie nazywamy polaryzacją ogniwa i będzie się ono
objawiać przepływem prądu przez układ. Przepływ prądu jest
miarą, zarówno odchylenia od stanu równowagi, jak i miarą
zdolności układu do powracania do stanu równowagi.
5.04.21
11
Polaryzacja aktywacyjna
.
W przypadku, kiedy najwolniejszym procesem zachodzącym w badanym
ogniwie jest proces przeniesienia ładunku,
M
0
– ne M
n+
prąd jest limitowany zgodnie z równaniem Volmera–Butlera.
Zastosowanie mają tutaj dwa przybliżenia dla tego równania,
czyli przypadek procesu odwracalnego jak i proces nieodwracalny,
czyli
równanie Tafela
. Przypadek polaryzacji aktywacyjnej przedstawia
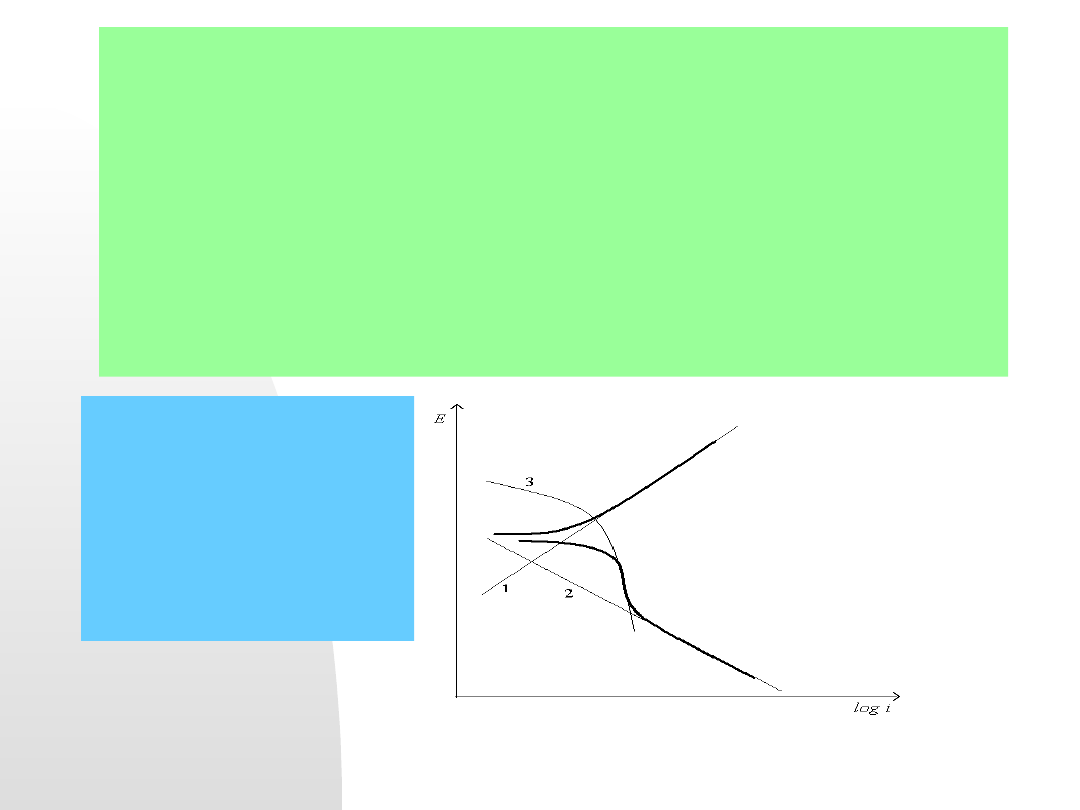
rysunek:
Krzywe polaryzacji metalu w stanie
aktywnym (np. żelazo w wodnym
roztworze NaCl).
1 – polaryzacja aktywacyjna
anodowa (utlenianie metalu),
2 – polaryzacja aktywacyjna
katodowa (redukcja jonów
wodorowych),
3- polaryzacja dyfuzyjna katodowa
(redukcja tlenu kontrola dyfuzyjna).
5.04.21
12
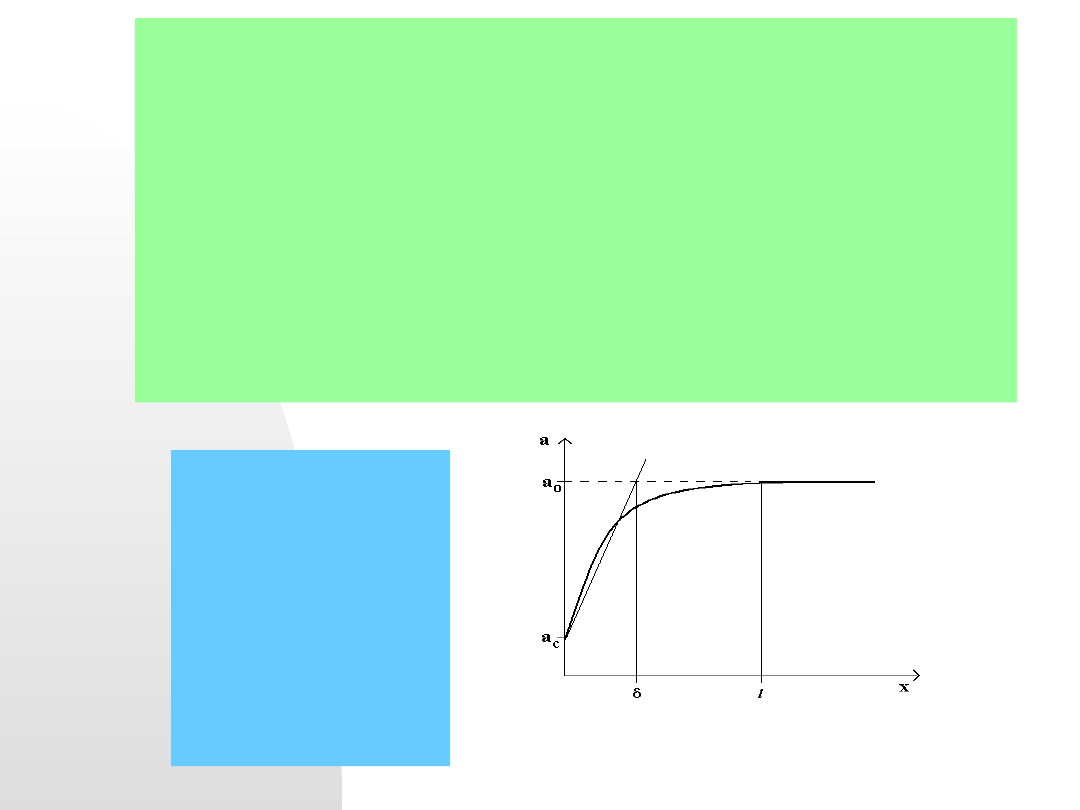
Polaryzacja stężeniowa (inaczej dyfuzyjna).
Jeżeli w rozpatrywanym układzie substraty lub produkty procesu
elektrodowego muszą być transportowane poprzez roztwór, wtedy
często dochodzi do sytuacji, kiedy szybkość dyfuzji jest mniejsza niż
szybkość procesów elektrodowych. Wtedy to właśnie wartość prądu
płynącego przez układ limitowana jest szybkością transportu (często
jest to właśnie dyfuzja, gdzie mamy do czynienia z rozkładem stężeń
w warstwie elektrochemicznej i w głębi roztworu).
Aktywność depolaryzatora w
funkcji odległości od
elektrody.
l- rzeczywista grubość
warstwy podwójnej,
- zastępcza grubość warstwy
podwójnej,
a
c
– aktywność
depolaryzatora przy
powierzchni eletrody,
a
o
– aktywność
depolaryzatora w głębi
roztworu

5.04.21
13
d
d
i
i
zF
RT
1
log
303
.
2
Nadpotencjał dyfuzyjny procesu opisuje równanie:
Polaryzacja omowa(opornościowa)
Nadpotencjał (
) omowy pojawia się na skutek przepływu prądu w
środowisku o niskim przewodnictwie elektrycznym.
= i R
Sytuacja taka dotyczy np. środowisk organicznych lub układów,
w których przy powierzchni elektrody gromadzi się duża ilość
produktów reakcji powodujących obniżenie przewodnictwa
roztworu. Ilustruje to rysunek:
5.04.21
14
Krzywe polaryzacyjne
elektrody I rodzaju
w roztworze elektrolitu
w stanie aktywnym
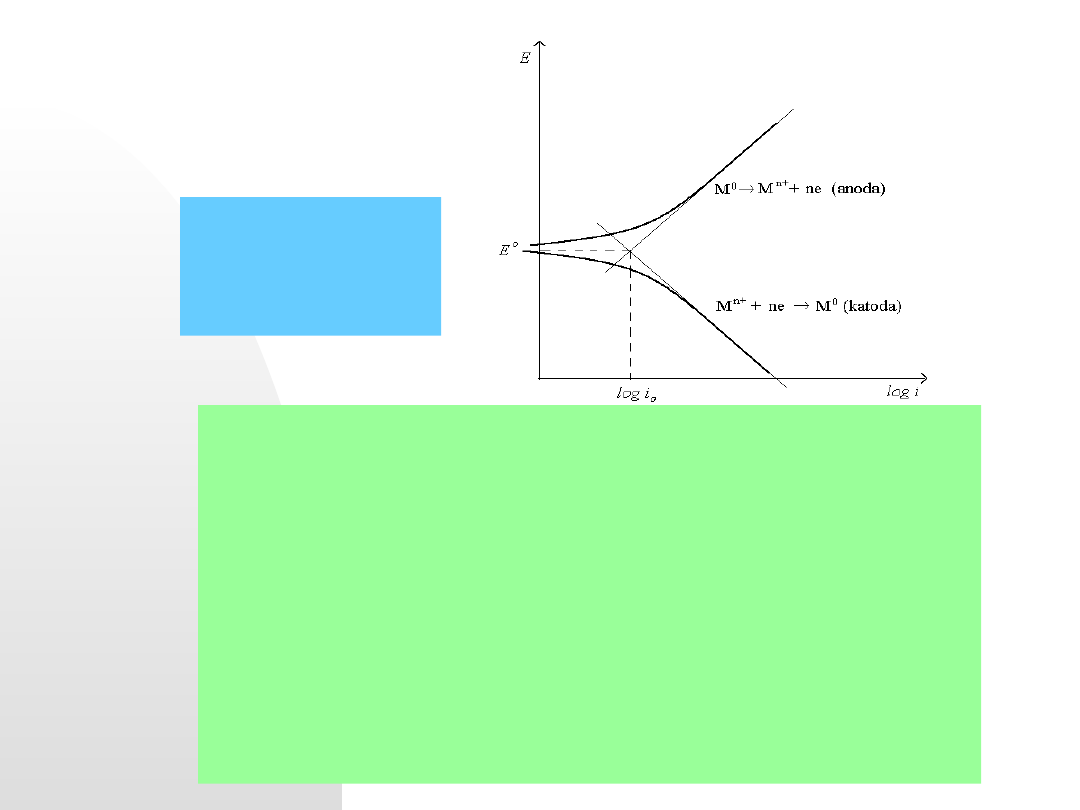
Wykres
przedstawia
krzywe
polaryzacyjne
elektrody
pierwszego rodzaju. Jest to elektroda zbudowana z metalu
zanurzonego do roztworu zawierającego jony tego metalu i jest
ona odwracalna względem kationu. W takim układzie zachodzą
następujące procesy:
Proces anodowy:
przechodzenie metalu do roztworu
M → M
n+
ne
Proces katodowy:
redukcja jonów metalu i osadzanie w postaci
zredukowanej na elektrodzie
M
n+
ne → M
lub katodowego wydzielania wodoru po redukcji jonu H
+

5.04.21
15
Zachodzące w układzie procesy można również przedstawić w formie
jednego sumarycznego równania reakcji.
M
n+
ne ⇄ M
Potencjał takiego układu zmierzony w warunkach równowagi jest
nazywany potencjałem równowagowym
(E
równ.
) i odpowiada mu
wartość prądu wymiany (i
równ.
) ).
Na poprzednim rysunku liniami ciągłymi pogrubionymi zaznaczono
krzywe polaryzacji anodowej i katodowej. Przedstawiają one
wypadkowe wartości prądów.
Liniami cieńszymi zaznaczono natomiast proste zależności Tafela dla
procesów anodowych i katodowych. Odpowiadają im wartości prądów
zgodne z równaniami Tafela dla procesów anodowego:
a
= a b log i
a
i katodowego:
k
= a b log i
c
5.04.21
16
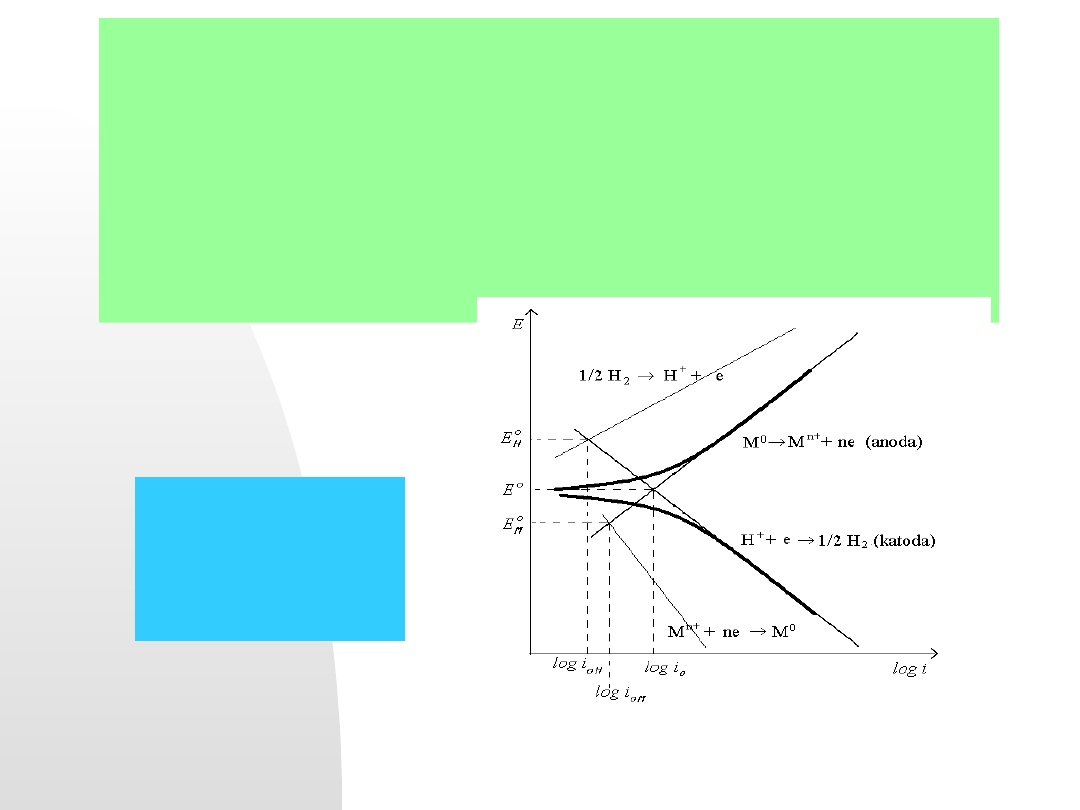
Następny rysunek przedstawia krzywe polaryzacyjne dla elektrody
mieszanej. Zaznaczone są tutaj liniami ciągłymi oba układy redoks
2H
+
/H
2
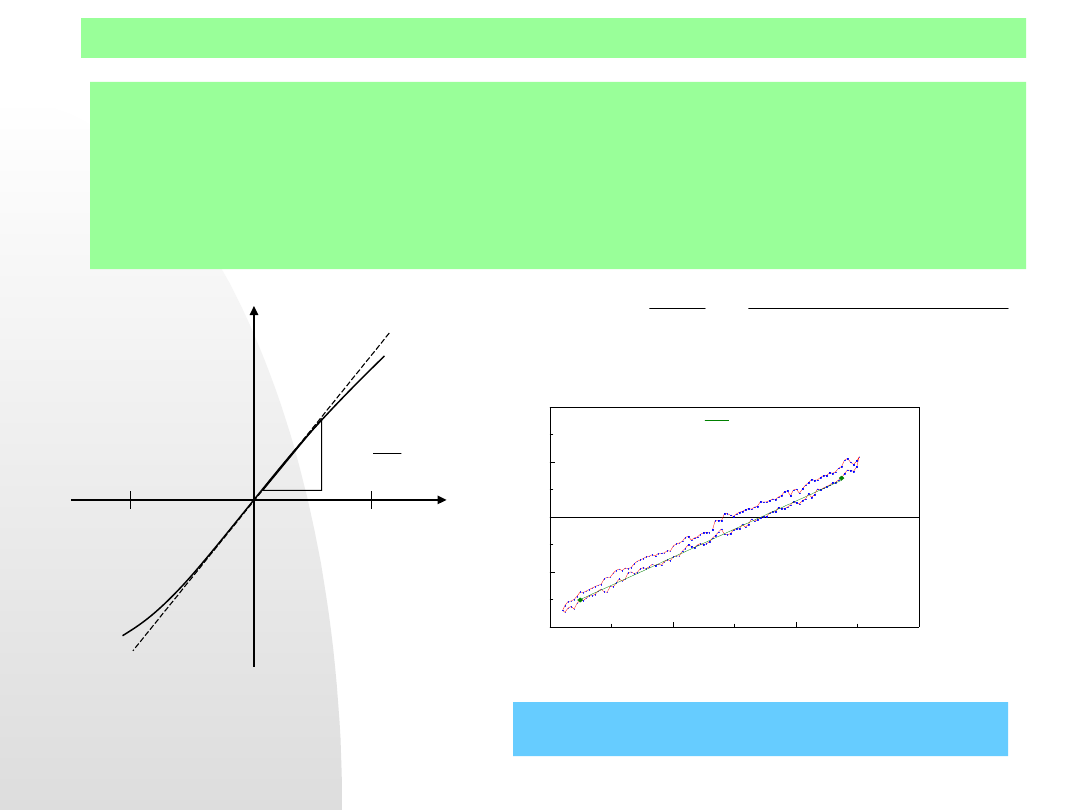
i M
n+
/M, pogrubione zostały linie tych procesów, które biorą
udział w równowadze stanu stacjonarnego. Zaznaczone zostały
potencjały równowagowe obu układów (i
0
) i ich prądy wymiany (log i
0H
,
log
i
0M
).
Krzywe polaryzacyjne
elektrody mieszanej w
roztworze elektrolitu w
stanie aktywnym
5.04.21
17
METODA POMIARU POLARYZACJI LINIOWEJ ( Metoda Sterna)
Stwierdzono, że jeżeli przeprowadzi się polaryzację próbki od
potencjałów o wartościach niewiele różniących się od
potencjału
korozyjnego
, to obserwuje się liniową zależność między gęstością prądu
zewnętrznego a potencjałem próbki.
)
(
3
.
2
c
a
corr
c
a
p
i
i
E
R
E
(V)
i
(A/cm
2
)
i
E
R
p
+0.02
-0.02
Corrosion Rate (mmPY)= 4.6197E-5
Rp (Ohms/cm
2
)= 4.8906E6
Io (Amp/cm
2
)= 5.3341E-9
Eo (Volts)= -0.33204
-0.375
-0.350
-0.325
-0.300
-1e-8
-5e-9
0
5e-9
1e-8
E (Volts)
I
(A
m
p
s/
cm
2
)
RpFit Result
Krzywe polaryzacyjne Ti (przed polaryzacją
anodową) w roztworze 0.1 mol/dm
3
KBr
5.04.21
18
KRZYWE POLARYZACYJNE I STAN PASYWNY
Opisywane przypadki przedstawiały możliwości występowania
określonych rodzajów równowag elektrochemicznych i były one
przedstawione jak układy izolowane. W praktyce, aby zbadać własności
elektrochemiczne metalu w danym środowisku należy wyznaczyć jego
podstawową charakterystykę w postaci
krzywej polaryzacyjnej
w pełnym
zakresie potencjałów. Taką przykładową krzywą przedstawia poniższy
rysunek Jest to zależność logarytmu prądu od wartości nadpotencjału,
na której zaznaczono ważne obszary polaryzacji.
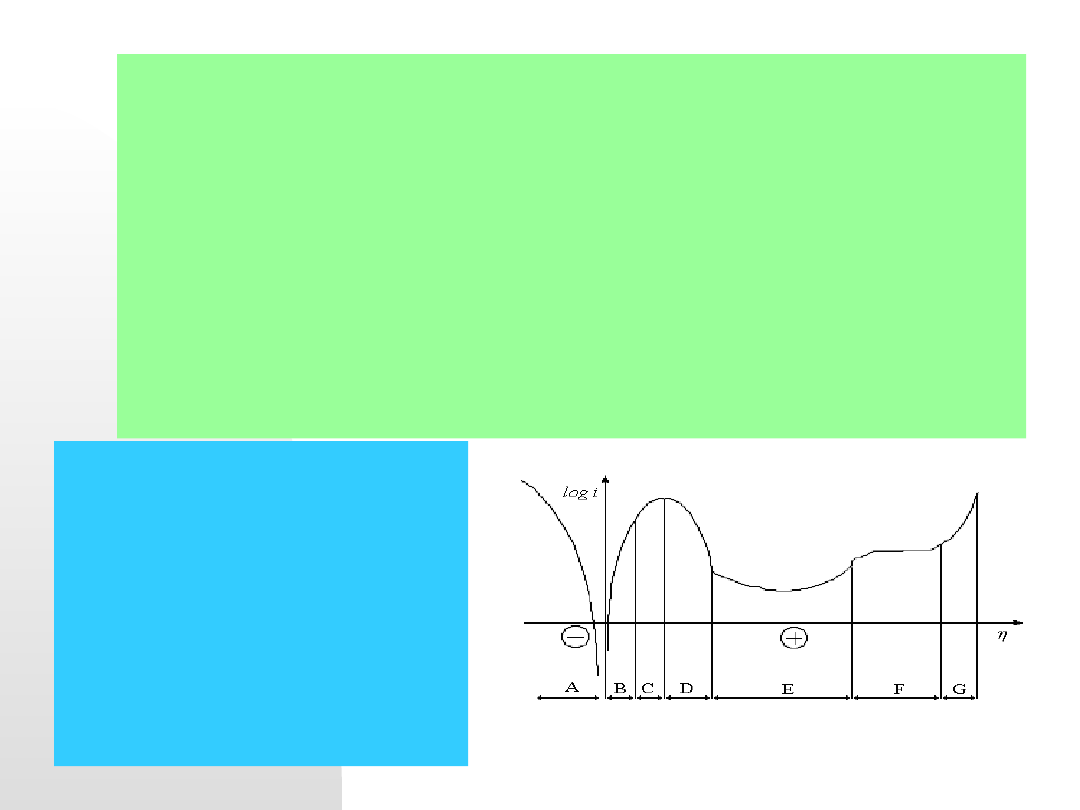
Typowa krzywa polaryzacyjna
(potencjodynamiczna) metalu w
roztworze elektrolitu w układzie
półlogarytmicznym.
A – strefa depolaryzacji wodorowej,
B-aktywne roztwarzanie metalu
(obszar Tafela), C-maksymalny prąd
aktywnego roztwarzania, D - przejście
do zakresu pasywacji (potencjał
Fladego), E - zakres pasywacji,
F-obszar transpasywacji, G-
depolaryzacja tlenowa lub anodowe
wydzielanie gazów

5.04.21
19
Z punktu widzenia
korozji i ochrony przed nią
, bardzo interesującym i
ważnym obszarem jest zakres potencjałów odpowiadających stanowi
pasywacji.
Pasywnością
, jak już wspomniano, nazywamy taki stan metalu,
w którym zachowuje on odporność chemiczną wobec otaczającego
środowiska mimo, że posiada potencjalną termodynamiczną skłonność
do reagowania z nim w danych warunkach.
Przyczyną tego zjawiska jest zahamowanie anodowego procesu korozji
elektrochemicznej poprzez wytworzenie na powierzchni metalu
warstwy tlenku lub nierozpuszczalnej soli tego metalu.
Istotne jest, aby prąd płynący przez elektrodę w stanie spasywowanym
był znacząco mniejszy niż maksymalny prąd aktywnego roztwarzania,
np. niższy o dwa rzędy wielkości.
WPROWADZENIE DO TEORII I PRAKTYKI STOSOWANIA
PODSTAWOWYCH METOD OCHRONY PRZED KOROZJĄ
5.04.21
20
Przeprowadzenie metalu w stan pasywny jest jedną z metod ochrony
przed korozją, tzw. ochroną anodową
. Jedną z metod osiągania takiego
stanu jest wprowadzenie do metalu dodatków stopowych o wysokim
potencjale elektrodowym stanowiących mikrokatody w czasie korozji
ma to na celu podniesienie potencjału korozyjnego do takiej wartości,
aby leżała ona w zakresie pasywnym metalu, co związane jest z
minimalną gęstością prądu.
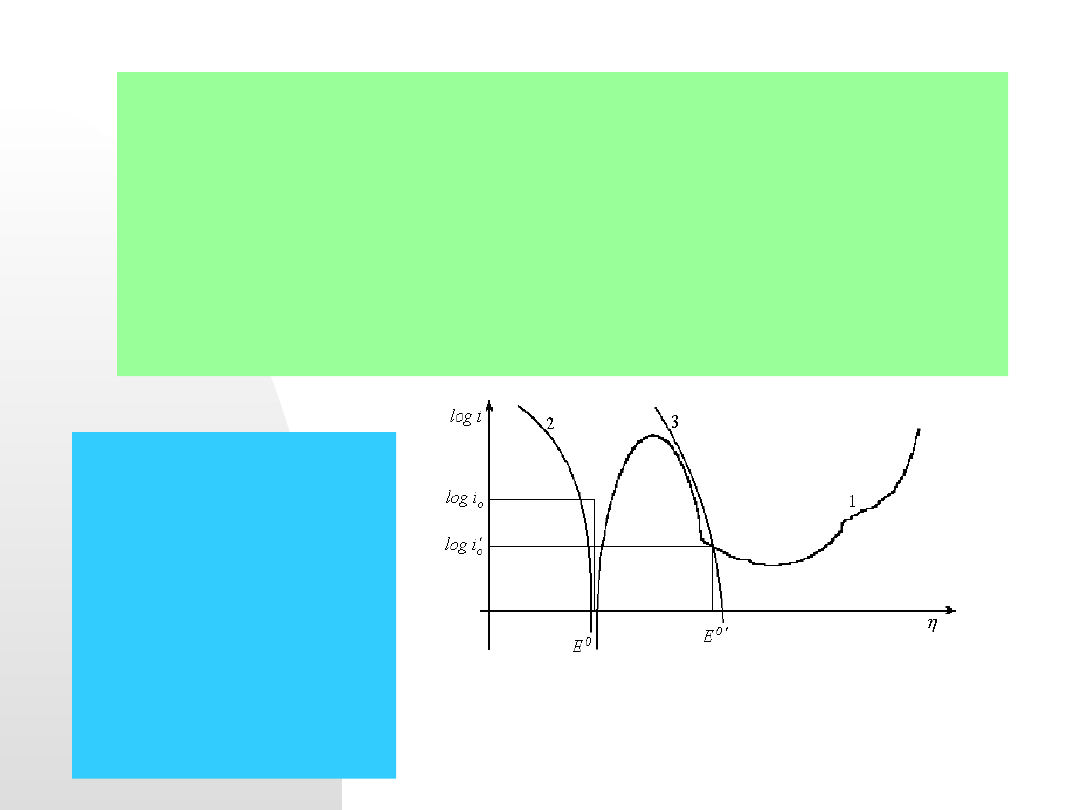
Wyjaśnienie tych procesów ilustruje rysunek:
Ilustracja zasady ochrony
anodowej poprzez
przesunięcie potencjału
korozji w obszar pasywacji
metalu.
1 – krzywa polaryzacji
anodowej metalu, 2 - krzywa
polaryzacji jonu wodorowego
i wydzielania wodoru
3- krzywa polaryzacji
katodowej metalu z
dodatkami metalu bardziej
szlachetnego.
5.04.21
21
0.0E+00
5.0E-04
1.0E-03
1.5E-03
0.0
0.5
1.0
1.5
2.0
2.5
U
W
[V]
I
W
[A]
0.0E+00
5.0E-04
1.0E-03
1.5E-03
2.18 2.20 2.22 2.24
U
b
Wyznaczanie potencjału przebicia (U
b
) warstwy pasywnej w układzie: Ti/TiO
2
/roztwór
elektrolitu
(H.Scholl, T.Blaszczyk A.Leniart – oral presentation at The 203rd ISE Congress, Paris,
April 27 – May 2, 2003)

5.04.21
22
SAMORZUTNE ROZTWARZANIE METALI.
DIAGRAMY POURBAIX
Zjawisko określone jako korozja metali polega na samorzutnym
roztwarzaniu metalu. Proces ten może zachodzić na drodze
chemicznej, elektrochemicznej lub biochemicznej
.
Ze względu na tematykę tego wykładu zajmiemy się oczywiście
korozją elektrochemiczną. Możemy stwierdzić, że proces
elektrochemiczny tego typu polega na anodowym utlenianiu
atomów metali do ich jonów. Jest to zjawisko zależne od
wielu czynników, które ogólnie można zebrać w dwóch grupach:
1)
czynniki zewnętrzne - kontakt powierzchni metalu z
roztworem elektrolitu, rodzaj elektrolitu, ewentualnie mieszaniny
elektrolitów, występowanie w roztworze substancji
powierzchniowo-czynnych,
2) czynniki wewnętrzne - rodzaj metalu, występowanie w fazie
metalicznej domieszek innych metali lub innych pierwiastków, np.
wtrącenia węgla w stali, kontakt metalu ze źródłem potencjału.
Oczywiście, że uwzględniamy stany pasywacji
5.04.21
23
Do zrozumienia zjawiska korozji niezbędne są diagramy Pourbaix
opisujące stany równowagowe wszystkich reakcji zachodzących w
badanym układzie. Pokażmy to na przykładzie układu Cu/H
2
O, gdzie
uwzględniono ok. 120-tu stanów równowagowych wszelkiego typu:
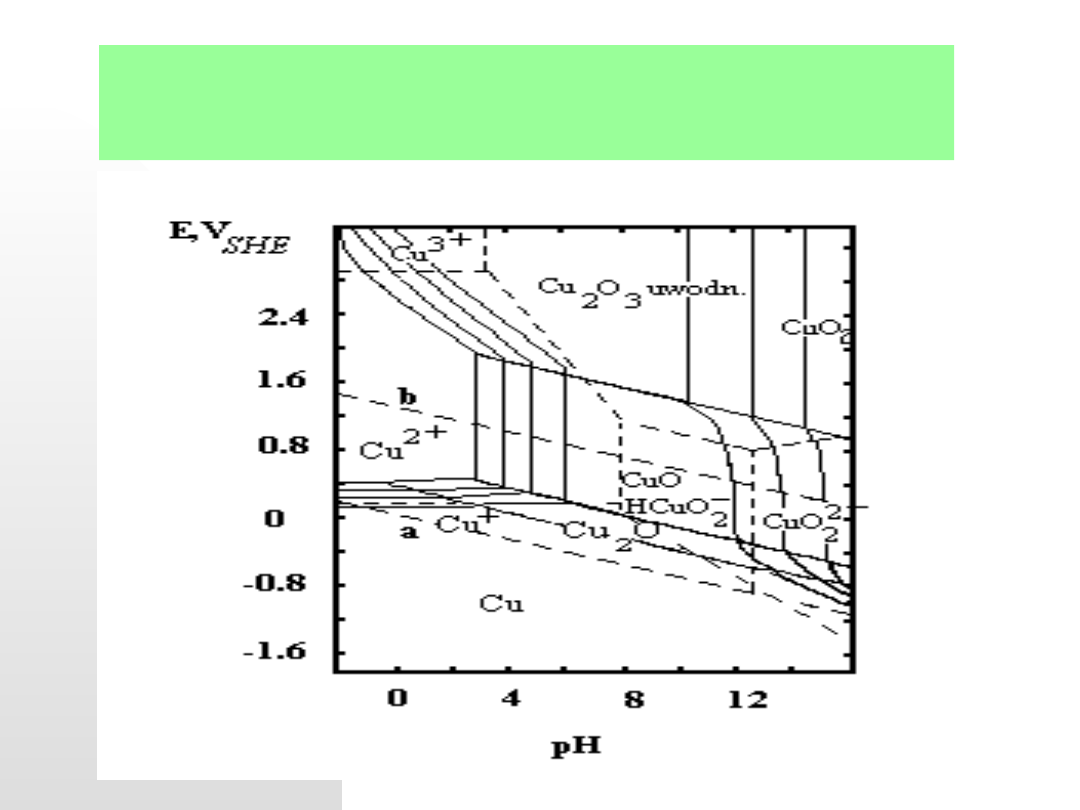
5.04.21
24
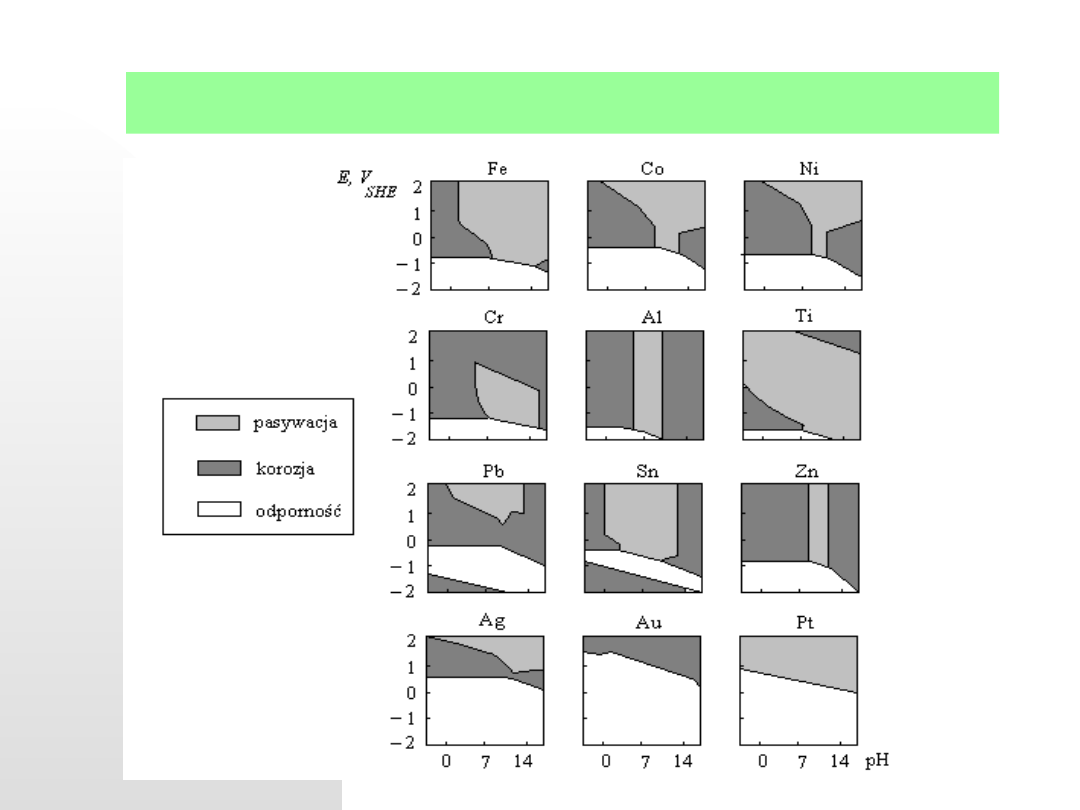
Przykładowe diagramy Pourbaix dla kilku metali podaje kolejny
rysunek:
5.04.21
25
Potocznie synonimem korozji jest "zardzewiałe" żelazo, tj. żelazo
pokryte ciemnobrązową, łuszczącą się warstwą produktów reakcji.
Żelazo jest metalem o najszerszym zastosowaniu konstrukcyjnym,
głównie w stopach zwanych żeliwami, stalami itp., toteż podobnie jak
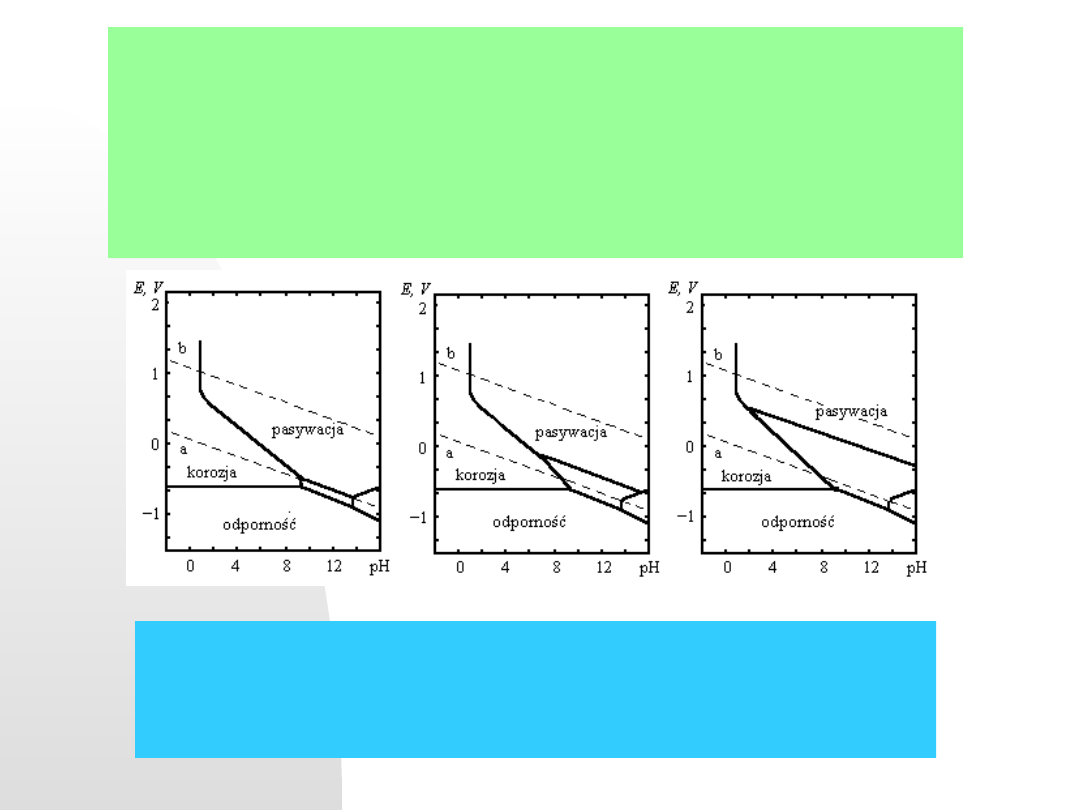
dla miedzi przedstawmy teraz diagram Pourbaix w prostym układzie
Fe - H
2
O :
Diagramy Pourbaix dla układu żelazo - woda. Zależności potencjał -pH
roztworu uwzględniają tworzące się tlenki żelaza. a - Fe
3
O
4
- zestarzały
getyt, b - Fe
3
O
4
- świeży getyt + FeOOH, c - Fe
3
O
4
– lepidokryt i FeOOH
5.04.21
26
Jedna z propozycji mechanizmu reakcji roztwarzania żelaza w
warunkach braku specyficznej adsorpcji jonów (np. chlorkowych,
wyraźnie przyspieszających proces korozji) i w środowisku kwaśnym
(np. kwasu siarkowego (VI) lub chlorowego (VII)) o pH w granicach
0,5 -1 opisana jest równaniami reakcji w następujących po sobie
etapach:
Fe + H
2
O Fe(H
2
O)
ads
Fe(H
2
O)
ads
Fe(OH
-
)
ads
+ H
+
Fe(OH
-
)
ads
Fe(OH)
ads
+ e
Sumując otrzymamy:
___
___
___
____
___
___
____
____
___
___
___
___
____
___
___
____
____
Fe + H
2
O Fe(OH)
ads
+ e + H
+
Etap decydujący o szybkości reakcji (rds):
(FeOH)
ads
FeOH
+
+ e
i ostatecznie: FeOH
+
+ H
+
Fe
++
+ 2 H
2
O
======================

5.04.21
27
CZYNNIKI WPŁYWAJĄCE NA KOROZYJNĄ ODPORNOŚĆ METALI I
STOPÓW. PRZYPOMNIENIE:
W przypadku metali "technicznych", a z takimi mamy z reguły do czynienia,
istnieje szereg czynników dodatkowo zmieniających szybkość reakcji korozji:
1. Niejednorodność fazowa i możliwość tworzenia układów mikroogniw
lokalnych daje zwykle początek tzw.
korozji wżerowej
.
2. Specyficzna adsorpcja jonów, głównie chlorków, powoduje również
powstawanie wżerów.
3. Powstanie wżeru staje się, przy sprzyjających warunkach, nowym
rodzajem korozji:
- w przypadku nałożenia się stałych naprężeń mechanicznych mamy do
czynienia z tzw.
korozją naprężeniową
,
- nałożenie się cykliczne zmieniających się naprężeń mechanicznych
(zmęczenie metalu) powoduje tzw.
korozję zmęczeniową
,
- naprężenie wewnętrzne pomiędzy kryształami metalu powodować
może tzw.
korozję śródkrystaliczną lub międzykrystaliczną
.
Oczywiste jest, że wszystkie procesy tu wymienione mogą występować
łącznie i wówczas
korozja szczelinowa
szybko posuwa się w głąb metalu (aż do
1 cm/h.!).

5.04.21
28
4.
Procesy tarcia
niszczą ochronną powłokę pasywną odsłaniając nowy
materiał zdatny do ponownej reakcji roztwarzania.
5. Turbulentny ruch cieczy powoduje tzw.
korozję kawitacyjną
, czyli
ciągłe niszczenie warstwy pasywnej pękającymi na niej
mikropęcherzykami gazu. Lokalne ciśnienia mogą osiągać wielkość
kilkuset hektopascali na centymetr kwadratowy!
Ten rodzaj korozji „cieszy się” szczególną uwagą konstruktorów i
technologów budowy statków i łodzi motorowych, gdzie korozja tego
typu niszczy układy napędowe i części dziobowe jednostki.
6.
Prądy błądzące
pojawiają się w wilgotnej glebie na skutek spływu
ładunków elektrycznych po wilgotnych izolatorach sieci prądu stałego
(np. sieć tramwajowa, prostowniki prądu) i dążą do anodowo
zachowujących się konstrukcji podziemnych (np. sieć wodno-
kanalizacyjna, ciepłociągi itd.).

5.04.21
29
50 m
Korozja szczelinowa po polaryzacji anodowej E
w
=-0.29 V
1.23 V -0.29 V
(E
ref
– elektroda kalomelowa w nas. Roztworze NaCl)
Próbka: Stal biomedyczna „Rex 734”. Obraz z mikroskopu optycznego.
Roztwór pomiarowy: wodny roztwór NaCl 0.5 mol/dm
3
5.04.21
30
Charakterystyka procesów korozyjnych metodami
zdjęcia krzywej polaryzacyjnej i pomiarów EIS w
wybranych potencjałach T.Błaszczyk, A.Leniart,
H.Scholl XLIX Zjazd PTChem., Gdańsk 2006
5.04.21
31
Rex 734
0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
1.6
1.8
10
-9
10
-8
10
-7
10
-6
10
-5
10
-4
10
-3
10
-2
10
-1
E ( Volts)
I(
A
m
ps
/c
m
2
)
I
D
C
B
A
F
H
G
E
0
5000
10000
15000
-15000
-10000
-5000
0
Z'
Z''
eis0900.z
eis0900_fit.z
Punkt E
0
10
20
30
-20
-10
0
10
Z'
Z''
eis1100.z
eis1100_fit.z
Punkt F
-50
0
50
100
-150
-100
-50
0
Z'
Z''
eis1300.z
eis1300_fit.z
2.5 5
.0 7
.5 10
.0 1
2.5
-1
0
.0
-7
.5
-5
.0
-2
.5
0
Z
'
Z''
Punkt G
-100
0
100
200
-100
0
100
200
Z'
Z''
eis1500.z
eis1500_fit.z
0
5
1
0 15 2
0
-2
0
-1
5
-1
0
-5
0
Z
'
Z''
Punkt H
0
10000
20000
30000
40000
-40000
-30000
-20000
-10000
0
Z'
Z''
eis0253.z
eis0253_fit.z
eis0775.z
eis0775_fit.z
Punkty
A i I
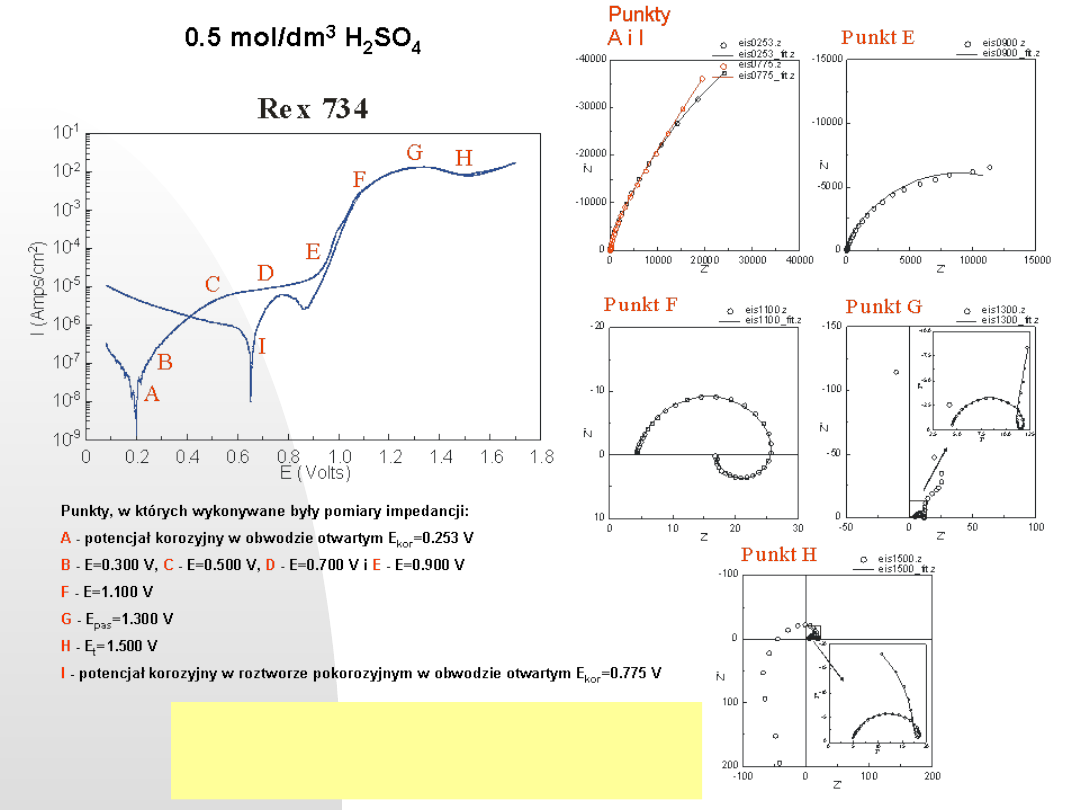
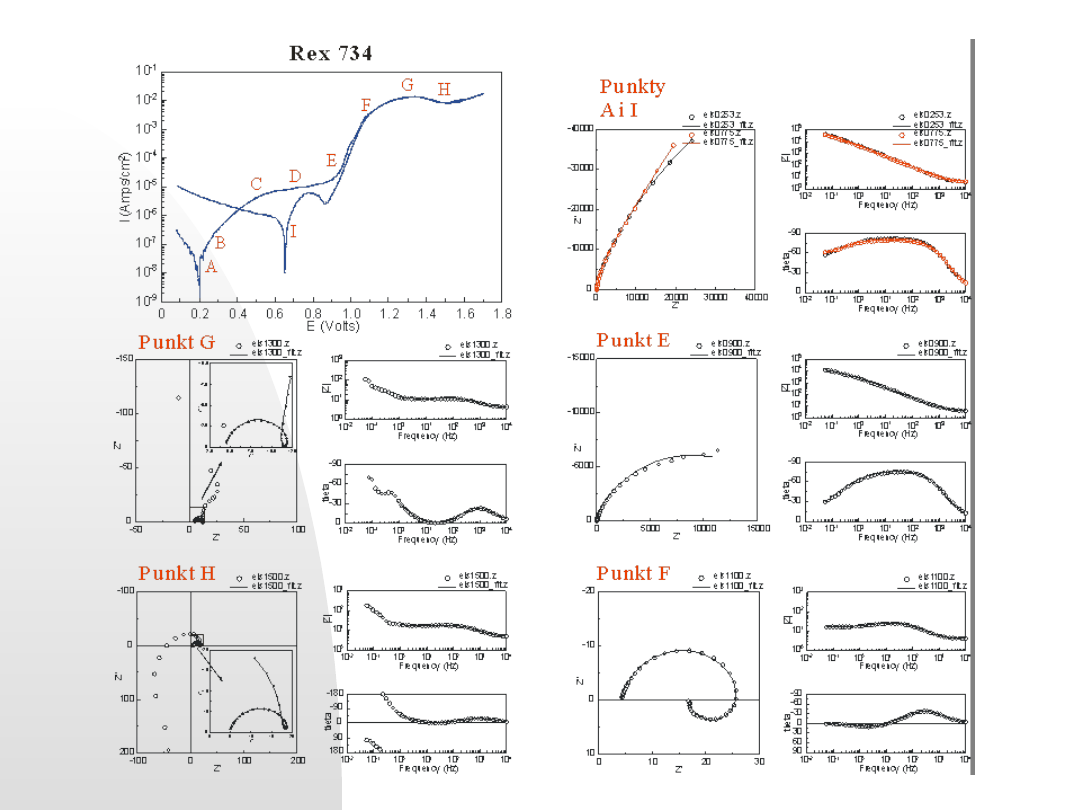
Punkty, w których wykonywane były pomiary impedancji:
A
-potencjał korozyjny w obwodzie otwartym E
kor
=
0.253 V
B
-E=0.300 V,
C
-E=0.500 V,
D
-E=0.700 V i
E
-E=0.900 V
F
-E=1.100 V
G
-E
pas
=1.300 V
H
-E
t
=1.500 V
I
-potencjał korozyjny w roztworze pokorozyjnymw obwodzie otwartym E
kor
=
0.775 V
0.5 mol/dm
3
H
2
SO
4
Charakterystyka korozyjna stali biomedycznej
metodami krzywej polaryzacyjnej i metodą EIS
w wybranych potencjałach. XLIX Zjazd PTChem.
5.04.21
32

5.04.21
33
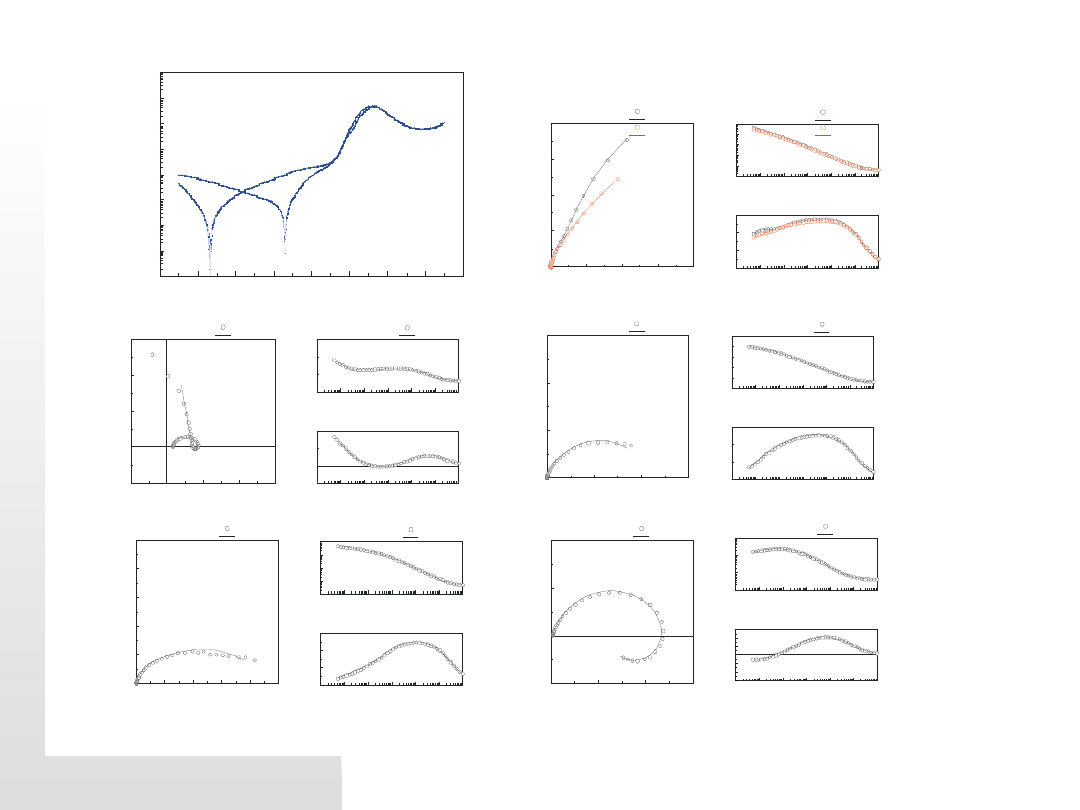
Punkty, w których wykonywane były pomiary impedancji:
A
- potencjał korozyjny w obwodzie otwartym E
kor
=0.253 V dla stopu Rex 734 i
E
kor
=0.263 V
dla stopu Panacea P558
B
- E=0.300 V,
C
- E=0.500 V,
D
- E=0.700 V i
E
- E=0.900 V dla obydwu stopów
F
- E=1.100 V dla stopu Rex 734 i E=1.000 V dla stopu Panacea P558
G
- E
pas
=1.300 V dla stopu Rex 734 i E
pas
=1.125 V dla stopu Panacea P558
H
- E
t
=1.500 V dla stopu Rex 734 i E
t
=1.400 V dla stopu Panacea P558
I
- potencjał korozyjny w roztworze pokorozyjnym w obwodzie otwartym
E
kor
=0.775 V dla stopu Rex 734 i E
kor
=0.793 V dla stopu Panacea P558
5.04.21
34
0
0 . 2
0 . 4
0 . 6
0 . 8
1 . 0
1 . 2
1 . 4
1 . 6
1 0
- 9
1 0
- 8
1 0
- 7
1 0
- 6
1 0
- 5
1 0
- 4
1 0
- 3
1 0
- 2
1 0
- 1
E ( V o l t s )
I
(
A
m
p
s
/
c
m
2
)
I
D
C
B
A
F
H
G
E
P a n a c e a P 5 5 8
0
1 0 0 0 0
2 0 0 0 0
3 0 0 0 0
4 0 0 0 0
- 4 0 0 0 0
- 3 0 0 0 0
- 2 0 0 0 0
- 1 0 0 0 0
0
Z '
Z
''
e is 0 2 6 3 . z
e is 0 2 6 3 _ fi t. z
e is 0 7 9 3 . z
e is 0 7 9 3 _ fi t. z
1 0
- 2
1 0
- 1
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
1 0
5
F re q u e n c y ( H z )
|Z
|
e i s 0 2 6 3 . z
e i s 0 2 6 3 _ fi t. z
e i s 0 7 9 3 . z
e i s 0 7 9 3 _ fi t. z
1 0
- 2
1 0
- 1
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
- 9 0
- 6 0
- 3 0
0
F re q u e n c y ( H z )
t
h
e
ta
P u n k ty
A i I
0
5 0 0 0
1 0 0 0 0
1 5 0 0 0
- 1 5 0 0 0
- 1 0 0 0 0
- 5 0 0 0
0
Z '
Z
''
e is 0 9 0 0 . z
e is 0 9 0 0 _ fi t. z
1 0
- 2
1 0
- 1
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
1 0
5
F re q u e n c y ( H z )
|Z
|
e is 0 9 0 0 . z
e is 0 9 0 0 _ fi t. z
1 0
- 2
1 0
- 1
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
- 9 0
- 6 0
- 3 0
0
F re q u e n c y ( H z )
t
h
e
t
a
P u n k t E
0
1 0 0
2 0 0
3 0 0
- 2 0 0
- 1 0 0
0
1 0 0
Z '
Z
''
e is 1 0 0 0 . z
e is 1 0 0 0 _ fi t. z
1 0
- 2
1 0
- 1
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
1 0
0
1 0
1
1 0
2
1 0
3
F r e q u e n c y ( H z )
|Z
|
e is 1 0 0 0 . z
e is 1 0 0 0 _ fi t. z
1 0
- 2
1 0
- 1
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
- 9 0
- 6 0
- 3 0
0
3 0
6 0
9 0
F r e q u e n c y ( H z )
t
h
e
t
a
P u n k t F
- 2 5
0
2 5
5 0
7 5
- 7 5
- 5 0
- 2 5
0
2 5
Z '
Z
''
e is 1 1 2 5 . z
e is 1 1 2 5 _ fi t. z
1 0
- 2
1 0
- 1
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
1 0
0
1 0
1
1 0
2
1 0
3
F r e q u e n c y ( H z )
|Z
|
e is 1 1 2 5 . z
e is 1 1 2 5 _ fi t. z
1 0
- 2
1 0
- 1
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
- 1 2 0
- 6 0
0
6 0
F r e q u e n c y ( H z )
t
h
e
t
a
P u n k t G
0
1 0 0 0
2 0 0 0
3 0 0 0
4 0 0 0
5 0 0 0
- 5 0 0 0
- 4 0 0 0
- 3 0 0 0
- 2 0 0 0
- 1 0 0 0
0
Z '
Z
''
e is 1 4 0 0 . z
e is 1 4 0 0 _ fi t. z
1 0
- 2
1 0
- 1
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
F re q u e n c y ( H z )
|Z
|
e is 1 4 0 0 . z
e is 1 4 0 0 _ fi t. z
1 0
- 2
1 0
- 1
1 0
0
1 0
1
1 0
2
1 0
3
1 0
4
- 9 0
- 6 0
- 3 0
0
F re q u e n c y ( H z )
t
h
e
t
a
P u n k t H
5.04.21
35
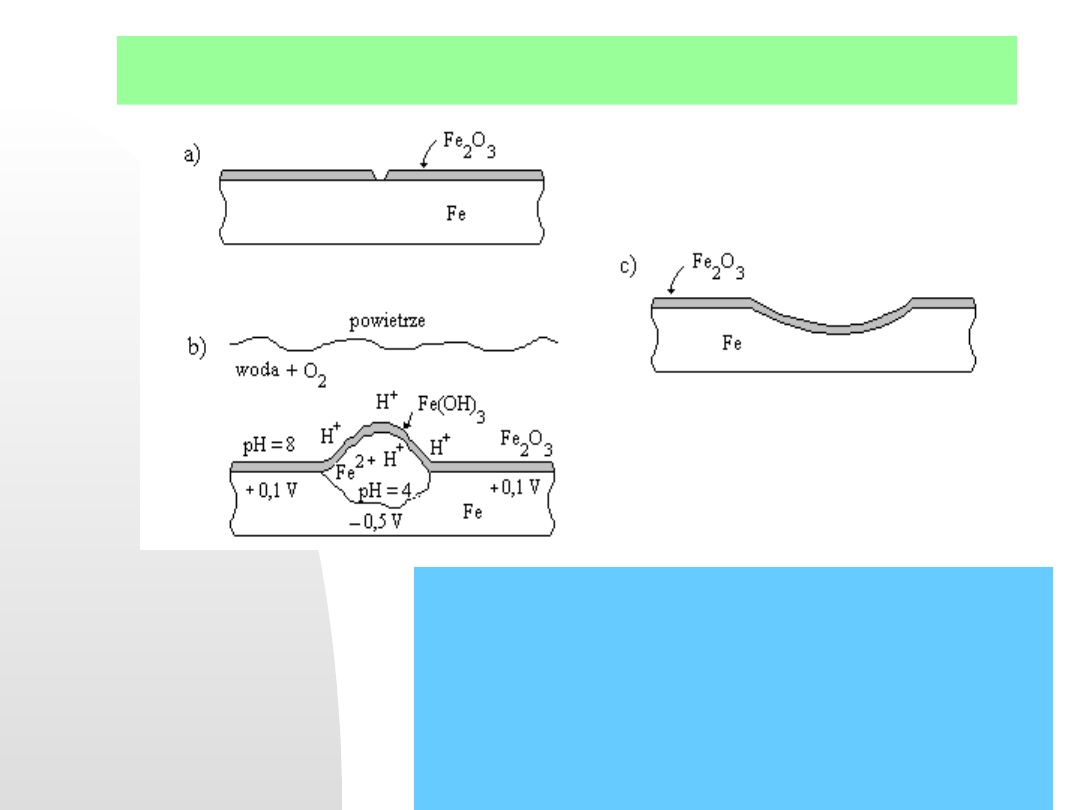
Kilka prostych rysunków ilustruje omawiane procesy tworzenia
wżerów:
Powstawanie mikroogniw na niejednorodnej powierzchni
korodującego metalu. a) pęknięcie powłoki tlenkowej jest
potencjalnym miejscem lokalnej korozji, b) w lokalnym
ogniwie występuje zróżnicowanie pH i rozkład
potencjałów, c) powstał ubytek korozyjny (wżer – w
angielskim słownictwie określa to termin
pit, a proces
tworzenia wżerów to pitting
)
5.04.21
36
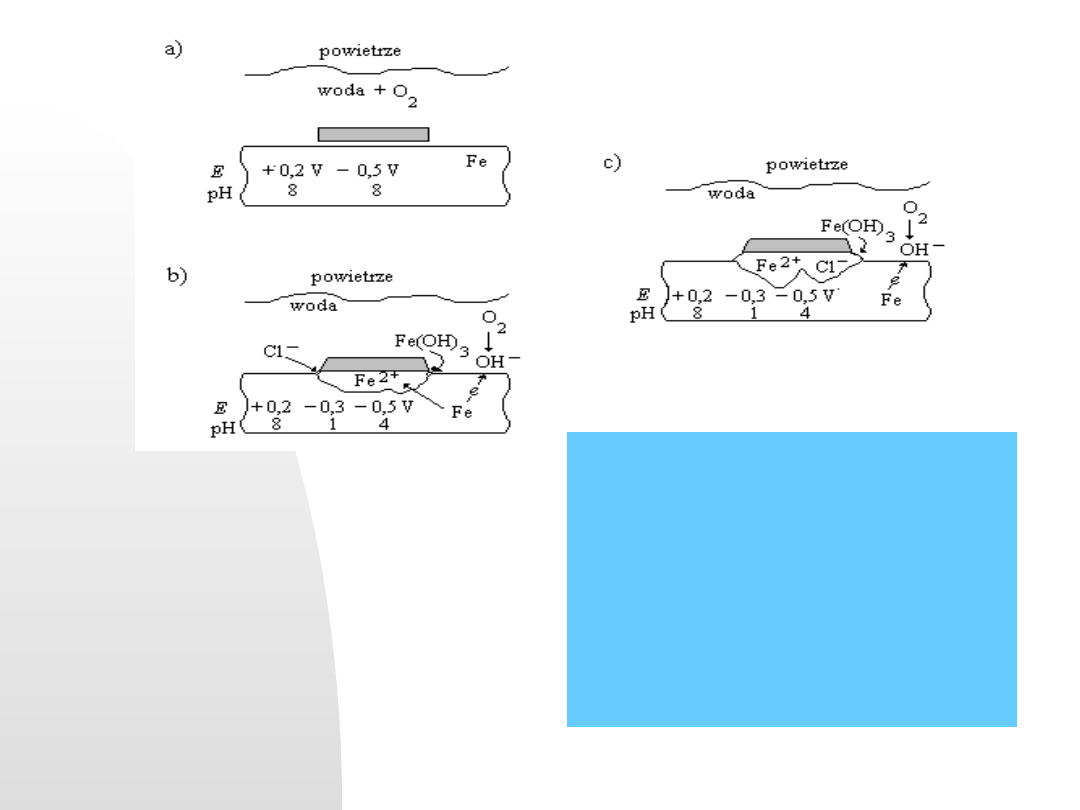
Zanieczyszczenie na powierzchni metalu
(pył, smar, itp..) pod warstwą wilgoci i w
obecności tlenu sprzyja wytworzeniu
mikroogniwa (a),
jony chlorkowe przyspieszają korozję
lokalną (b),
pod warstewką tlenku tworzy się ukryty
wżer korozyjny (c)

5.04.21
37
Przykłady wżerów korozyjnych na powierzchni tytanu
H.Scholl, T.Błaszczyk, A.Leniart, P.Niedzielski „The 203rd International Meeting of The international Society of
Electrochemistry, Paris, April 27 – May 2, 2003

5.04.21
38
Obraz zniszczenia korozyjnego na krawędzi wżeru ( badania własne)
5.04.21
39
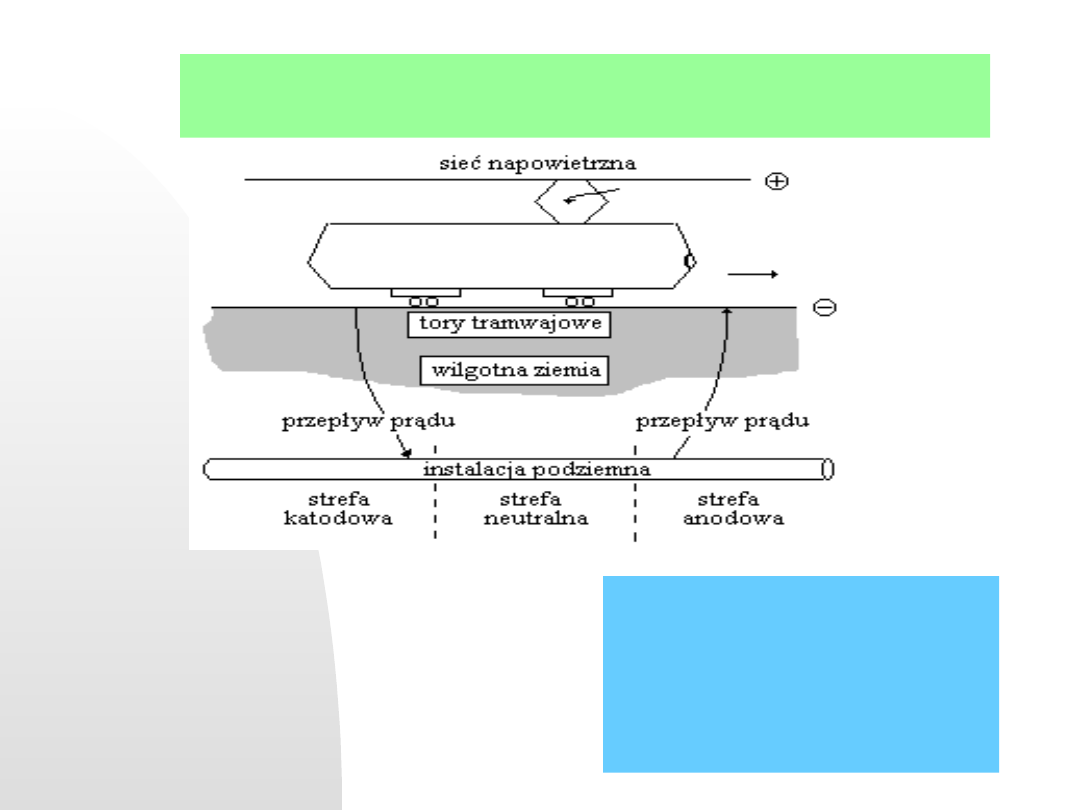
Prąd błądzący. Upływność prądu
stałego z trakcji elektrycznej
poprzez wilgotną ziemią do lokalnej
instalacji podziemnej powoduje
tworzenie lokalnych
makroogniw
korozyjnych.
Wielki problem miast o komunikacji tramwajowej.
Korozja z udziałem prądów blądzących

5.04.21
40
ZASADY OCHRONY ANTYKOROZYJNEJ I STOSOWANE
METODY OCHRONY
Ochrona przed korozją jest obecnie ogromną dziedziną wiedzy i
praktyki - jej szczegółowe przedstawienie wymagałoby odrębnej
specjalizacji - toteż wykład ten sygnalizuje jedynie pewne zasady
postępowania wiążące się z tym problemem:
1.
Najskuteczniejszą ochroną przed korozją
jest staranny i
przemyślany dobór materiału pracującego w określonym środowisku
oraz właściwe warunki eksploatacji maszyn i urządzeń.
Tak więc, dla przykładu, nie można stosować zbiorników i maszyn
zbudowanych ze stali kwasoodpornych do eksploatacji w
środowisku zasadowym.
Zadanie to wymaga od konstruktorów i technologów ścisłej
współpracy z tzw. korozjonistą, specjalistą od zabezpieczeń
przeciwkorozyjnych.

5.04.21
41
2. Stosuje się
powłoki ochronne
z metali, farb, lakierów,
polimerów, powłoki pasywne itp.
Warunki, jakie mają spełniać powłoki ochronne, by zapewnić
skuteczność stosowania, to odporność chemiczna, szczelność
i dobre przyleganie do metalu.
Niezwykle istotnym działaniem jest
właściwe i staranne
przygotowanie podłoża.
Stosuje się w tym celu takie metody jak:
- mechaniczne szlifowanie, polerowanie itp.;
-chemiczne oczyszczanie powierzchni dla usunięcia warstw
tlenkowych lub nierozpuszczalnych soli pasywujących metal lub
innych związków znajdujących się na powierzchni (np. śladów
poprzedniej warstwy ochronnej);
- odtłuszczanie powierzchni stosując różnego typu substancje
chemiczne (roztwory mydeł, alkohole, aceton itd..).
Bardzo często niewłaściwe przygotowanie podłoża i nałożenie
powłoki powoduje bardzo groźną w skutkach, początkowo
niewidoczną) tzw.
korozję podpowłokową
.

5.04.21
42
Rodzaje pokryć powłokami ochronnymi można podzielić na kilka
grup:
1)
Pokrycia galwaniczne
metalem o wyższej odporności korozyjnej
niż metal podłoża. Po oczyszczeniu powierzchni galwanicznie osadza
się warstwę pośrednią (np.. miedź na żelazo i jego stopy)polaryzując
żelazną (lub stalową) katodę do potencjału elektroosadzania miedzi.
By otrzymać ściśle przylegającą i gładką warstwę Cu, stosuje się
zwykle roztwór elektrolitu zawierający kompleksy miedzi typu
[Cu
2+
(L)
n
]
2
dla ligandów obojętnych, np. NH
3
lub amin, albo jony
Kompleksowe o różnej wartościowości jeśli ligand jest obdarzony
ładunkiem (np. CN
-
) .
Na warstwę miedzi w kolejnej kąpieli galwanicznej nanosi się
właściwy metal (lub stop elektrochemiczny) spełniający rolę ochronną
Znane są powłoki ochronne żelaza: Fe/Cu/Ni lub Fe/Cu/Ni
(1-x)
Cr
x
.

5.04.21
43
2) Naturalne lub anodowo wytwarzane
warstwy pasywne
o
dobrych własnościach mechanicznych. W anodowym pasywowaniu
wykorzystuje się zakres potencjałów
E
z uzyskanej
półlogarytmicznej krzywej polaryzacyjnej
Szczególnie przydatne są układy fazowe:
Al/Al
2
O
3
; Ni/NiO; Ti/TiO
2
; Cr/Cr
2
O
3
; Pb/PbSO
4
3) Stosowane dawniej tzw.
powłoki oksydowane
wytwarzane po
zanurzeniu w oleju roślinnym metalu rozgrzanego blisko jego
temperatury topnienia.
4)
Powłoki ochronne otrzymywane termicznie
. Znana jest tzw. blacha
ocynkowana otrzymywana przez zanurzenie blachy żelaznej w
stopionym cynku. Stosowana powszechnie w pokryciach dachowych,
pokryciach zewnętrznych parapetów okiennych, rynnach itp.

5.04.21
44
5)
Powłoki malarskie
. Obecnie powłoki malarskie nanosi się zwykle na
reaktywną warstwę podkładową. Są to preparaty zawierające związki
chemicznie wiążące się z podłożem na drodze odpowiedniego procesu
chemicznego.
W przemyśle samochodowym przed lakierowaniem karoserie zanurza
się w wannach z gorącym H
3
PO
4
. Wytworzona warstwa polifosforanów
żelaza spełnia zasadniczą rolę warstwy ochronnej.
6)
Plazmowe i próżniowe nanoszenie warstw metalicznych lub
węglowych
, jak np. nanoszenie warstw diamentopodobnych (Diamond
Like Carbon Covers (DLCC) ) na stale specjalne lub tytan i jego stopy
medyczne wykorzystując metan (CH
4
) jako źródło węgla.
Nanoszone warstwy maja zwykle strukturę nano-krystaliczną.
5.04.21
45
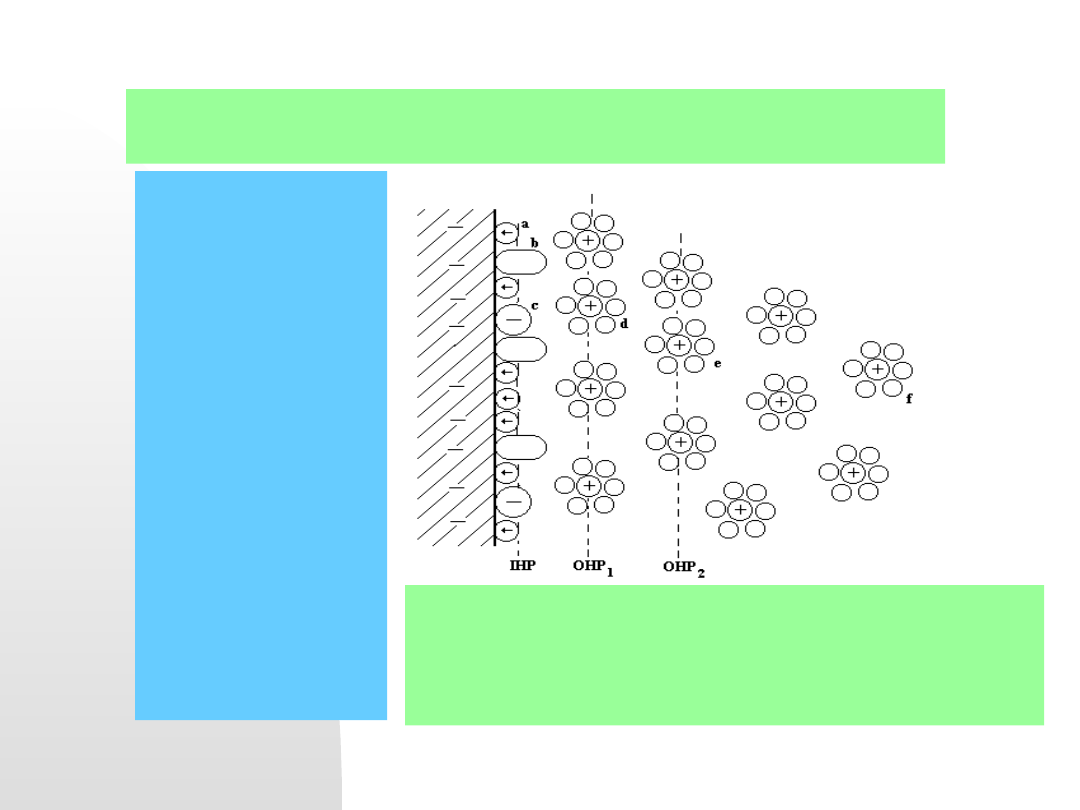
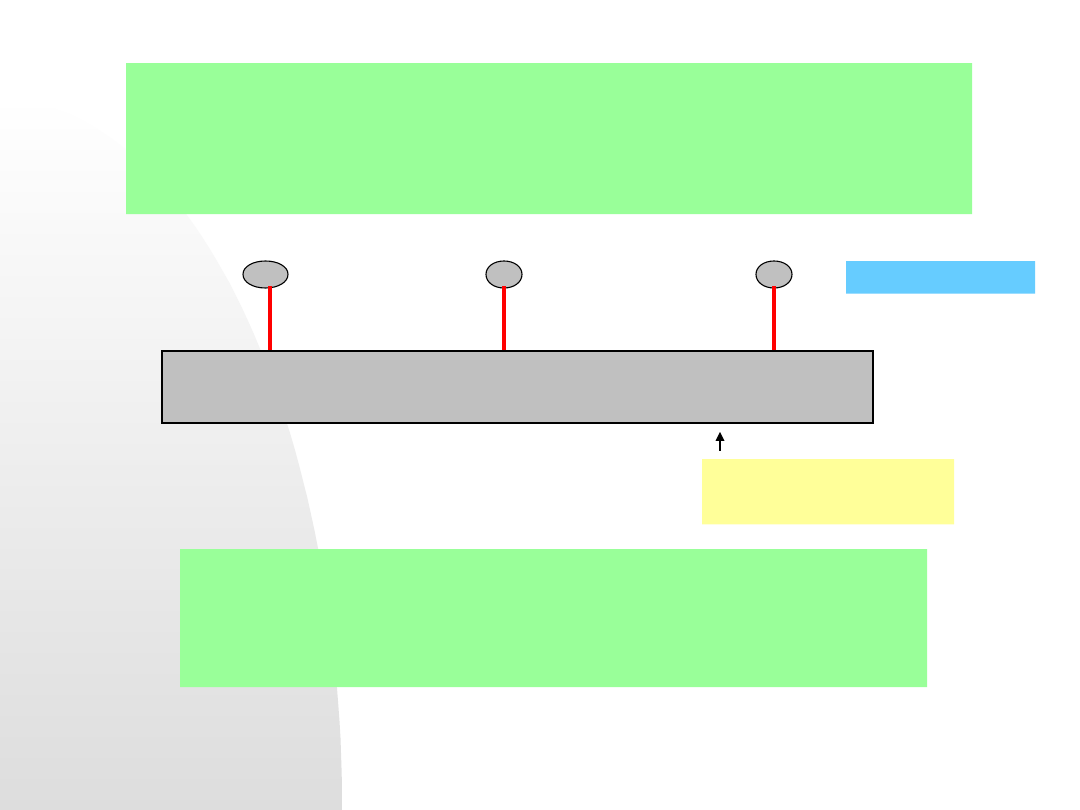
7) Stosowanie
inhibitorów antykorozyjnych
. Przypomnijmy
budowę warstwy elektrochemicznej:
Model warstwy
elektrochemicznej w
roztworze
zawierającym
inhibitor:
a)- dipole wody,
b)- zaadsorbowane
molekuły organiczne
inhibitora, c) –
specyficznie
zaadsorbowane
aniony,
d) - hydratowane jony
tworzące warstwę
OHP
1
w odległości
oddziaływań dipoli
wody w IHP,
e) - OHP
2
odległa w
zależności od
oddziaływań molekuł
f) - hydratowane jony
w warstwie dyfuzyjnej
Cząstki inhibitora mogą całkowicie wyprzeć
specyficznie zaadsorbowane aniony (np. Cl
-
) i
przesunąć położenie warstw OHP
1
i OHP
2
. Zmienia
się wówczas pojemność różniczkowa warstwy
elektrochemicznej potencjał korozyjny.
5.04.21
46
8)
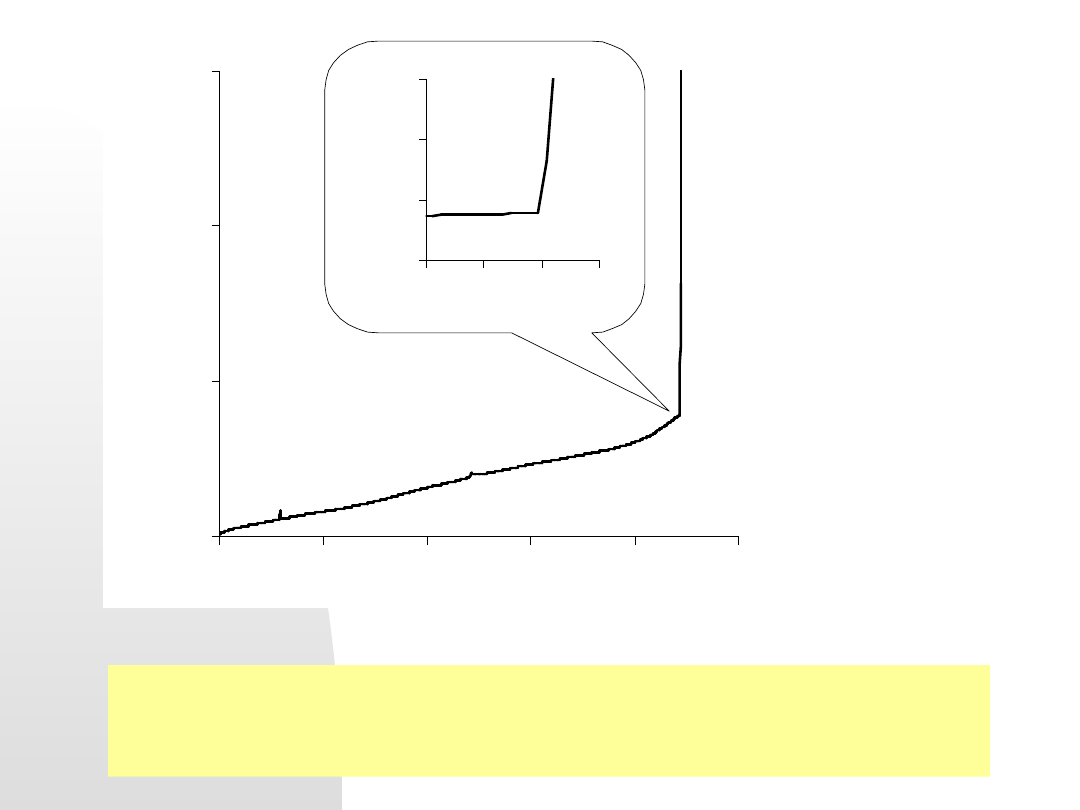
Bierna ochrona katodowa
. Zasadą jest odwrócenie potencjałów
metali stanowiących potencjalne ogniwo korozyjne. Ilustruje to
rysunek przykładowej ochrony rurociągu zakopanymi obok w
ziemi cynkowymi protektorami:
Anody cynkowe
Rurociąg stalowy
(katoda)
W takim makroogniwie zachodzą reakcje anod cynkowych
(tzw. protektorów)
Zn Zn
2+
+ 2e
Zużyte protektory zastępuje się nowymi.

5.04.21
47
9)
Czynna ochrona katodowa
. Stosowana jest szczególnie
w kilkuset kilometrowych ( lub więcej) ropociągach lub
gazociągach.
Nie ma tutaj wymagań by materiał protektorów był z
natury anodowy, ponieważ ich sieć zasilana jest z
zewnętrznych źródeł prądu stałego (anodowo), a rurociąg
jest polaryzowany katodowo.
Schemat ochrony jest taki sam jak na poprzednim
rysunku z uwzględnieniem zewnętrznych stacji
zasilających.
Oczywiście równocześnie stosowana jest szczelna
zewnętrzna izolacja chronionego rurociągu.

5.04.21
48
MIKRO- I NANOELEKTROCHEMICZNA KOROZJA PODZESPOŁÓW
I OBWODÓW ELEKTRONICZNYCH
Układy elektroniczne podlegają procesowi korozji i jest to
czynnik, który odpowiada za brak wiarygodności pracy urządzeń.
Korozja dotyczy:
-układów scalonych ( IC ), które są złożonymi połączeniami
technologicznymi składającymi się z drukowanych płyt obwodów
(miedź), złącz (miedź, srebro, lut cynowy) i styków(złoto,platyna,
stopy platynowo-palladowe, itp.), półprzewodniki typu n lub p.
-A WIĘC PEŁNA GAMA PIERWIASTKÓW Z TABLICY MENDELEJEWA!!
- magnetycznych nośników danych, które przechowują dane o
wysokiej gęstości zapisu i jest to najważniejszy problem związany
z jakością ich działania ( stacje dysków, głowice magnetofonowe,
telefony komórkowe,m itp.).
Korozja może spowodować bezpośrednie uszkodzenie urządzenia,
ale także prowadzi do pogorszenia jego pracy. Urządzenie
elektroniczne może ulec uszkodzeniu po utracie
mniej niż 1
pikograma metalu
.

5.04.21
49
Metale w układach scalonych pełnią kilka funkcji. Zapewniają lokalne złącza,
łączą globalne elementy układu z dalekimi obszarami urządzenia oraz
dostarczają elementom sygnałów prądowych wejścia i wyjścia ( I/O ).
Sieć obwodów elektrycznych w chipie ( kostka ) składa się z kilku warstw
metalu rozdzielonych izolującymi warstwami dielektryka ( IDL ).
Wierzchnia warstwa metaliczna kostki chipu jest chroniona warstwą
pasywacyjną w postaci wzorca z niewielkimi płytkami umożliwiającymi
połączenie elektryczne ( kwadraty o boku 100 µm ).
Warstwami pasywacyjnymi są: dwutlenek krzemu (SiO
2
), szkła
fosfokrzemianowe otrzymywane metodą chemicznego osadzania z fazy
lotnej (par) ( CVD ) oraz osadzony plazmowo azotek krzemu.
Ponieważ urządzenia i układy scalone podlegają coraz większej
miniaturyzacji
(NASA buduje podzespoły z klasterów kilkuatomowych !!)
,
sieć połączeń w chipie jest odpowiedzialna za coraz większą część
całkowitego czasu opóźnienia przepływu prądu przez obwód, dlatego też
występuje tendencja do tworzenia układów z udziałem lepiej
przewodzących metali np. miedzi i izolatorów o niższej wartości stałej
przenikalności elektrycznej ().

5.04.21
50
Zanieczyszczenia powodujące korozję wprowadzane są podczas produkcji
i użytkowania. Są to na ogół zanieczyszczenia chlorkami powstające w wyniku
trawienia powierzchni roztworami elektrolitów zawierających reaktywne jony
(np. jony chlorkowe).
Obudowa układów scalonych
Istnieją dwa zasadnicze typy systemów ochrony układów scalonych:
- obudowy ceramiczne i hermetyczne ( CHP )
- obudowy plastikowe ( PEM )
Urządzenia klasy CHP są wykonane z ceramiki, a osłona układu jest
zamknięta hermetycznie, dzięki czemu można dokładnie kontrolować
otoczenie chipu. Technologia ta jest stosowana obecnie tylko
w urządzeniach specjalnego przeznaczenia o wysokiej jakości.
W urządzeniach klasy PEM chip jest połączony z metalowym podłożem lub
przymocowany do ramy głównej i cały układ jest zatopiony wewnątrz
osłony plastikowej z żywicy epoksydowej lub silikonu wypełnionego
cząsteczkami nieorganicznymi.
Obecnie w związku z postępem technologicznym nastąpiła poprawa pracy
tych
urządzeń
i
stanowią
one
ponad
97%
światowego
rynku
elektronicznego.

5.04.21
51
Płytki wyeksponowane w oknach warstwy pasywacyjnej chipu są połączone
z ramą za pomocą cienkich połączeń ze złota lub glinu, albo miedzi lub srebra.
Rama główna wykonana jest ze stopu Ni - Fe, stopu Cu lub pokrytej miedzią stali
nierdzewnej. Rama główna tworzy również zewnętrzne połączenie na poziomie
płyty. Na „gołą” ramę nanosi się nikiel, lub stop niklu i kobaltu, a następnie
całość pokrywa się złotem, srebrem lub palladem, co zwiększa odporność
na korozję oraz zmniejsza oporność styku.
Magnetyczne nośniki danych
Wszystkie komputery korzystają z długoterminowego przechowywania danych.
Nośniki danych wykazują znaczną podatność na korozję. Każda stacja dysków
składa się z dysku posiadającego
twardą warstwę magnetyczną
przechowującą informację oraz głowicy, która wykorzystuje miękki materiał
magnetyczny do zapisu danych na dysku i odczytywania ich z dysku.
Stacje twardych dysków wykorzystują dyski z cienkich filmów metali,
otrzymywanych na drodze elektroosadzania i są nośnikami danych. Warstwą
magnetyczną jest stop na bazie kobaltu, pokryty warstwą ochronną z
napylonego węgla ( COC ), która nie jest w stanie całkowicie pokryć warstw
leżących głębiej i wystawia metale na działanie czynników korozyjnych. Może
to spowodować powstanie na powierzchni dysku stosunkowo dużej warstwy
produktów korozji.

5.04.21
52
W stacjach dysków stosuje się kilka konfiguracji głowic zapisujących dane.
Elementy odczytujące wykorzystują zjawisko
magnetooporu ( MR )
, które polega
na zmianie oporności materiału w funkcji wartości pola magnetycznego.
Większość sensorów MR wykorzystuje warstwy antyferromagnetyczne,
np. stop Mn – Fe zawierający 50% każdego z metali.
Stop ten jest bardzo podatny na korozję !
Adsorpcja wody
W warunkach atmosferycznych woda adsorbuje się na powierzchni metali
i tlenków metali tworząc cienką warstwę, której grubość zależy od wilgotności
względnej ( RH ) i rodzaju podłoża. Szybkość korozji zależy z kolei od grubości
tej warstwy. Poziom krytyczny wilgotności, to poziom powyżej którego
szybkość korozji ulega znacznemu zwiększeniu. Powyżej poziomu krytycznego
zaadsorbowana woda stanowi wsparcie elektrochemicznych reakcji
przeniesienia ładunku.
W mikroelektronice adsorpcja wody związana jest ze zjawiskami fizycznymi
w małej skali np. między włóknami przewodów, powierzchniami styków
i złączy oraz w defektach osłon plastikowych, gdzie może występować
kondensacja kapilarna.
Kondensacja ta lokalnie może dawać wilgotność względną równą 100%.

5.04.21
53
Temperatura urządzenia
ma wpływ na proces adsorpcji wody; wyższa
temperatura powoduje jej desorpcję dla danego poziomu wilgotności,
a tym samym zmniejszenie szybkości korozji.
W wielu układach IC po włączeniu zasilania następuje wzrost
temperatury spowodowany wydzielaniem ciepła na oporach wewnętrznych
układów scalonych. Następuje desorpcja powierzchniowa i usuwanie wody
z osłony układu. Jakość pracy urządzeń rośnie ze wzrostem wartości stosunku
pracy urządzenia do czasu bezczynności, co wynika z efektów związanych
z wilgocią.
Zanieczyszczenia o charakterze jonowym
Korozja zachodzi szybciej, gdy w powietrzu znajduje się duża ilość
odpowiednich cząstek (średnica aerodynamiczna 0,05 do 2µm) bogatych
w wodorosiarczan amonu, oparów tlenków kwasowych, halogenków,cząstek
pochodzenia antropogenicznego, których nie można usunąć przez
filtrowanie
powietrza. Takie związki jonowe występują powyżej pewnego poziomu RH.
Źródłem niepożądanych związków chemicznych mogą być materiały
stosowane w mikroelektronice np. fosfor będący składnikiem szkieł
pasywacyjnych lub żywice epoksydowe, które zawierają organiczny związek
bromu.

5.04.21
54
Mechanizmy korozji urządzeń nano- i mikroelektronicznych
.
W urządzeniach mikroelektronicznych występuje wiele materiałów
metalicznych podlegających korozji zachodzącej według mechanizmów,
które dzielą się na dwie ogólne kategorie:
korozja w obecności przepływu prądu elektrycznego
– a więc obecność
praktycznie nieograniczonej liczby mikroogniw korozyjnych
podlegających korozji pod kontrolowanym potencjałem
i
korozja w warunkach bezprądowych
, tj. w warunkach obecności
lokalnych prądów korozyjnych lub równowagowych
wynikających z zestawienia układów katoda/roztwór/
elektrolitu/anoda
Korozja obwodów elektronicznych w obecności pola
elektrycznego
W urządzeniach mikroelektronicznych wartości wykorzystywanego
potencjału są niewielkie ( < 5V ), ale powstające pola elektryczne mogą
mieć bardzo duże gęstości prądu lokalnego ze względu na rozmiary
elementów i odległości między nimi. Korozja zachodzi na drodze trzech
różnych mechanizmów elektrolitycznych przedstawionych na rysunku.
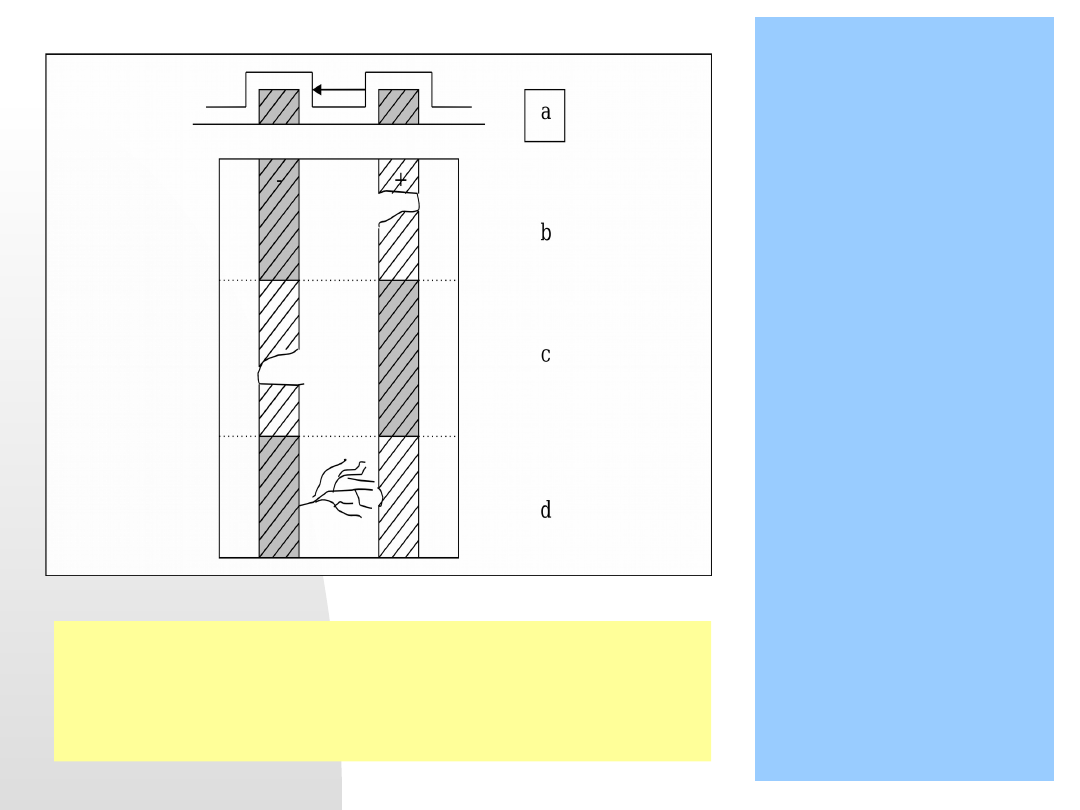
5.04.21
55
Mechanizmy korozji urządzeń
nano- i mikroelektronicznych w
obecności pola elektrycznego
[wg Philippe Marcus “Corrosion
Mechanisms in Theory and Practice”.
Second edition, revised and expanded”
2002, Chapter 18 “Corrosion of
microelectronic and magnetic data –
storage devices”, Contributors: Gerard
S. Frankel and Jeffrey W.
Braithwaite
( pp. 643-682 )
a)Różnica
potencjałów
na
każdej
granicy
faz
metal–
elektrolit
umożliwia
reakcje
elektrochemiczne redox.
b)anodowo naładowany element
może
doprowadzić
do
uszkodzenia
w
wyniku
przerwania
obwodu
elektrycznego na linii anodowej
.
c) mechanizm degradacji jest
specyficzny
dla
metali
amfoterycznych, takich jak glin.
Metal jest amfoteryczny, a więc
wzrost wartości pH powoduje
rozpuszczenie
ochronnej
warstwy
tlenkowej
na
powierzchni
linii
katodowej.
Metal
ulega
szybkiemu
roztwarzaniu
i
urządzenie
przestaje działać w wyniku
przerwania obwodu
na linii
katodowej. Wzrost wartości pH
powoduje
rozpuszczenie
ochronnej warstwy tlenkowej na
powierzchni
linii
katodowej.
Metal szybko się roztwarza i
przerwany jest obwód na linii
katodowej
d) Jony metalu roztwarzającego się na anodzie są transporto-
wane przez film powierzchniowy elektrolitu i ulegają redukcji
elektrolitycznej na katodzie. Dendryty metalu narastają od
katody w kierunku anody i w wyniku zwarcia sąsiednich
przewodników następuje uszkodzenie – urządzenie przestaje
działać

5.04.21
56
ALE NIE MARTWMY SIĘ ZBYTNIO !
WSPÓŁCZESNY ROZWÓJ TECHNIK INFORMATYCZNYCH
I WPROWADZANIA NOWYCH SYSTEMÓW
OPERACYJNYCH NARZUCA NAM RACZEJ KUPOWANIE
NOWYCH I CORAZ TAŃSZYCH URZĄDZEŃ, ZANIM NASZE
STARE SKORODUĄ!

5.04.21
57
K O N I E C
D Z I Ę K U J Ę Z A U W A G Ę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
Wyszukiwarka
Podobne podstrony:
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
Korozja metali i jej sposoby zapobiegania, technik bhp
Podstawy teoretyczne
Przewlekłe powikłania cukrzycy u dzieci i młodzieży – sposoby zapobiegania
terapia dzieci z trudnosciami w czytaniu i pisaniu - podstawy teoretyczne, Studia - pedagogika
02 16PF PODSTAWY TEORETYCZNE I ANALIZA WYNIKÓW
Podstawy teoretyczne zarzadzania?zpieczeństwem informacji
Czynniki lokalizacji przedsiębiorstwa podstawy teoretyczne (wyklad 2)
Kopia Podstawy teoretyczne termowizji
NR6, 1. Podstawy teoretyczne.
hyraulika, sprawozdanie1, Podstawy teoretyczne
Podstawy teoretyczne i praktyczne leczenia otyłości CM UMK
ZŚ W2 podstawy teoretyczne zś
PODSTAWY TEORETYCZNE HIGIENY ZYWIENIA
więcej podobnych podstron