
Układ okresowy pierwiastków,
struktura,
grupy pierwiastków,
odmiany alotropowe

Idea uporządkowania pierwiastków według wzrastających mas i
doszukiwanie się periodyczności cech chemicznych stały się podstawą
fundamentalnego, w zakresie uporządkowania pierwiastków,
prawa okresowości sformułowanego przez Dymitra
Mendelejewa.
Pierwiastki uszeregowane według wzrastających mas
atomowych wykazują cykliczność w występowaniu
podobnych właściwości chemicznych.
`
Dymitrij Iwanowicz Mendelejew
(ur. 27 stycznia 1834 w Tobolsku
zm. 20 stycznia 1907 w Sankt
Petersburgu) –
chemik rosyjski

Tablica Mendelejewa w wersji anglojęzycznej,
przygotowanej przez samego Mendelejewa w 1891 r
oryginalna tablica Mendelejewa była w zasadzie
prostą tabelą z listą pierwiastków wg
wzrastającej masy atomowej i przypisaniem
do określonego okresu

Mendelejew twierdził, że własności chemiczne i fizyczne pierwiastków
zmieniają się w sposób ciągły, ale powtarzają się okresowo, jeśli ułoży
się je według wzrastajścego ciężaru atomowego. Za podstawę
porównania pierwiastków przyjął podobieństwo wartościowości w
stosunku do tlenu i do wodoru. Pierwiastki ułożone w porządku
wzrastającego ciężaru atomowego przejawiają wzrost wartościowości
względem tlenu od 1do 7. Zmiana wartościowości pierwiastków
względem wodoru jest inna, początkowo wzrasta od 1 do 4, a potem
zmniejsza się do jedności.
Uszeregowane na tej zasadzie pierwiastki wykazały powtarzające się
podobieństwo chemiczne najpierw co 7, a następnie co 17
pierwiastków. Szereg pierwiastków pomiędzy dwoma
jednowartościowymi metalami o zbliżonych własnościach
chemicznych i fizycznych nazwał Mendelejew okresem.
Okres krótki zawierał 7 pierwiastków,okres długi - 17. Po odkryciu
gazów szlachetnych i wstawieniu ich do tablicy powtarzanie własności
okresowości zjawiło się co 8 lub co 18 pierwiastków.

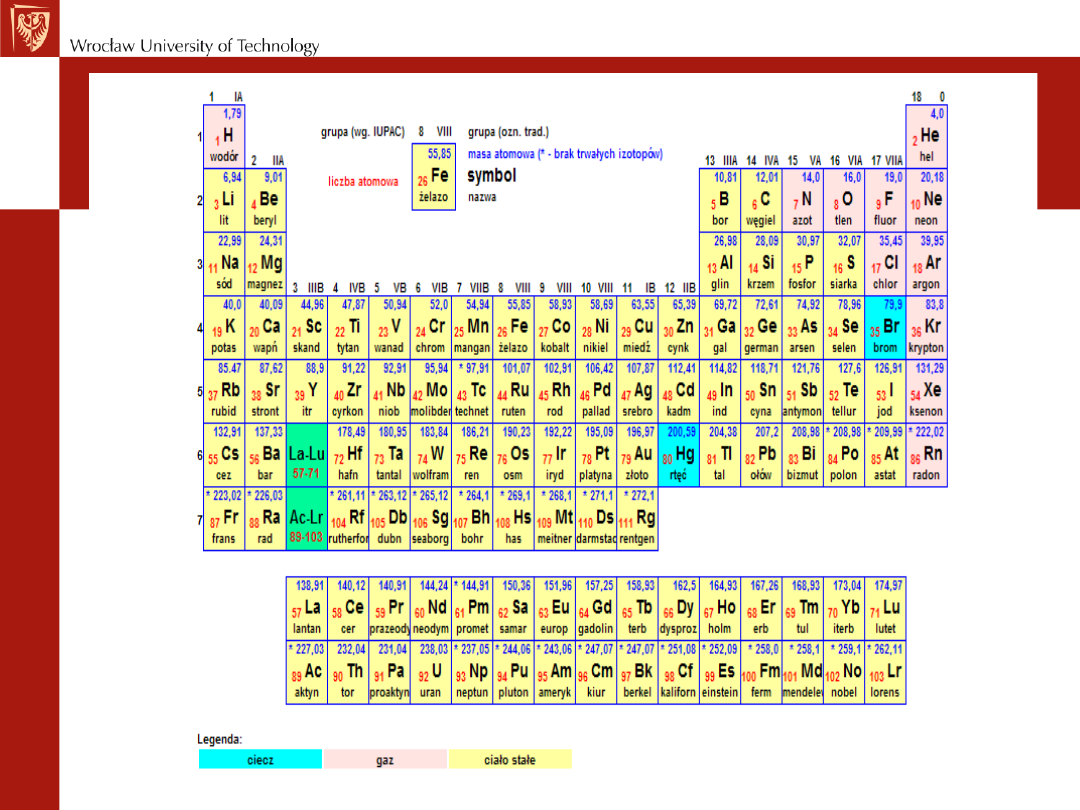
Układ okresowy pierwiastków
jest to zestawienie wszystkich pierwiastków chemicznych w
postaci rozbudowanej tabeli, uporządkowane według ich
rosnącej liczby atomowej, grupujące pierwiastki według ich
cyklicznie powtarzających się podobieństw właściwości. Jest
to zbiór sztucznie i naturalnie stworzonych pierwiastków.

Współczesny wygląd układu okresowego zawdzięczamy Nielsowi
Bohrowi, który podzielił go na grupy i okresy.
Grupy wypisuje się w kolumnach, a okresy w rzędach. Grupy dzieli się
na grupy główne i grupy poboczne.
W grupach głównych okresy występują co osiem kolejnych atomów
W grupach głównych wszystkie elektrony z powłoki walencyjnej zajmują
orbitale typu: s i p
, w grupach pobocznych
orbitale: s i d
, a w grupie
lantanowców i aktynowców
orbitale: s, d i f
.
Jest to podstawą do podzielenia układu okresowego na
bloki
:
s
i
p
(grupy główne),
d
(grupy poboczne) oraz
f
(lantanowce i
aktynowce). W większości współczesnych, graficznych przedstawień
układu okresowego grupy główne są rozdzielone za drugą grupą całym
blokiem d, a blok f jest "wyciągnięty" pod połączone bloki s, p i d
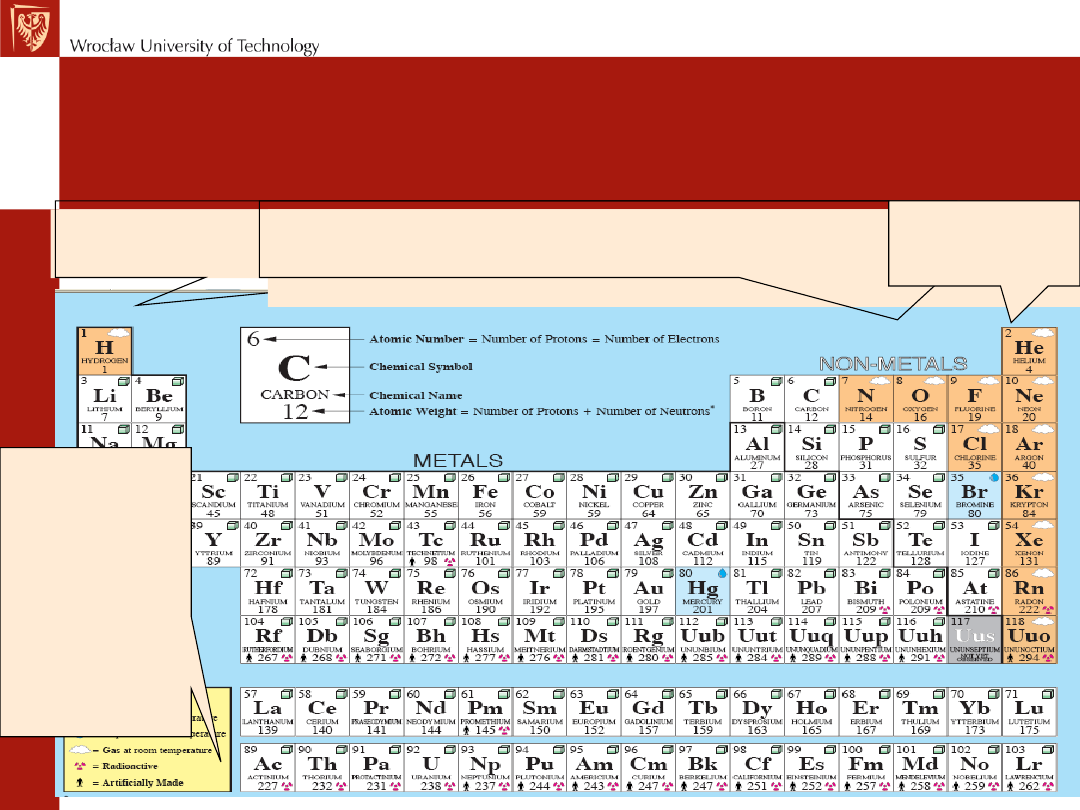
Współczesny układ okresowy (z rozdzielonymi blokami s,
p, d i f) jest dobrym sposobem na przedstawienie
zależności własności chemicznych od miejsca w układzie.
Pierwsze dwie grupy główne (oprócz wodoru) grupują atomy o bardzo
silnych własnościach metalicznych
grupy 15, 16 i 17 (grupy VA, VIA i VIIA) grupują atomy o
mniej lub bardziej wyraźnych własnościach
niemetalicznych
Gazy
szlachetne
Wszystkie
atomy
grup
pobocznyc
h, a także
lantanowc
e i
aktynowce
to typowe
metale
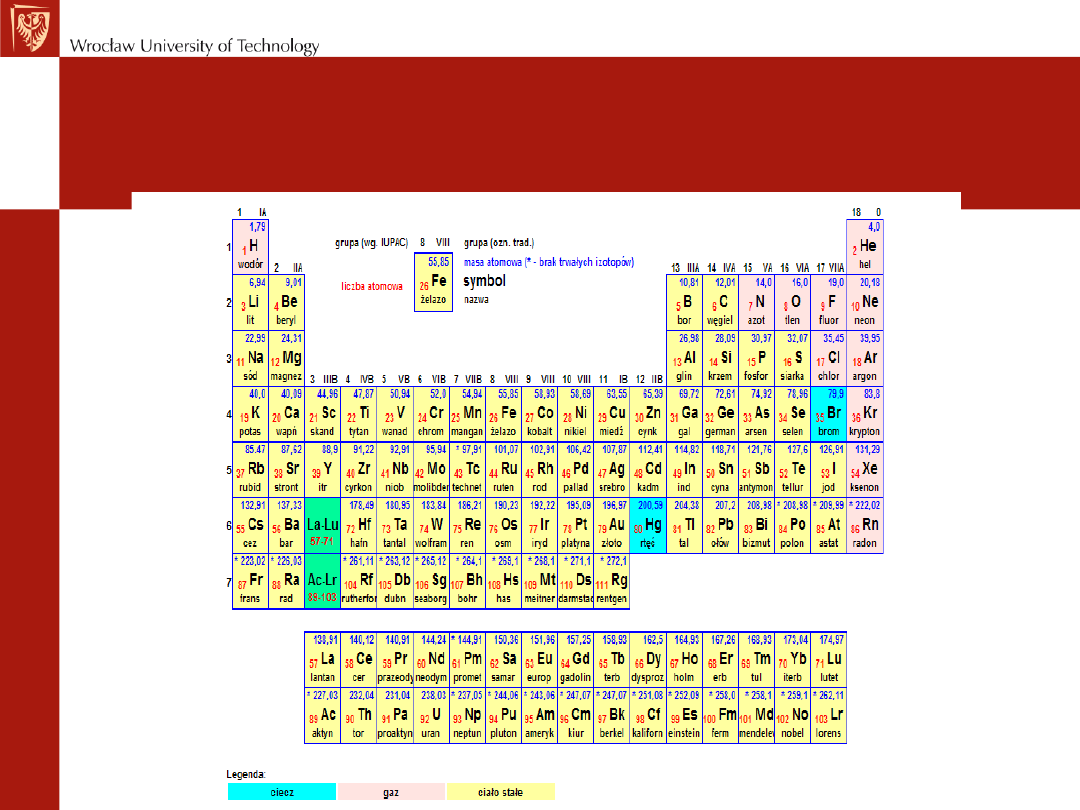
Inne informacje, które można uzyskać z układu okresowego:
STAN SKUPIENIA

Korzystanie z układu
okresowego
Powłoka
1, 2, 3, 4, 5, 6, 7
K L M, N, O, P, Q
Ilość elektronów na powłoce
2, 8, 18, 32, 50, 72, 98
Pierwiastki danego
okresu
mają tę samą
liczbę powłok
elektronowych.
Pierwiastki należące do tej samej
grupy
charakteryzują się tą samą
liczbą elektronów
walencyjnych
, a w konsekwencji podobnymi właściwościami chemicznymi.
PRZYKŁADY:
konfiguracja elektronowa pierwiastka: 4s
2
4p
2
Położenie w układzie: 4 okres – 4 grupa główna
15
P (fosfor liczba atomowa 15)
zapełnione powłoki K (2 e) +L (10 e) + M (5 e walencyjnych)
Więc: 3 okres – 5 grupa główna
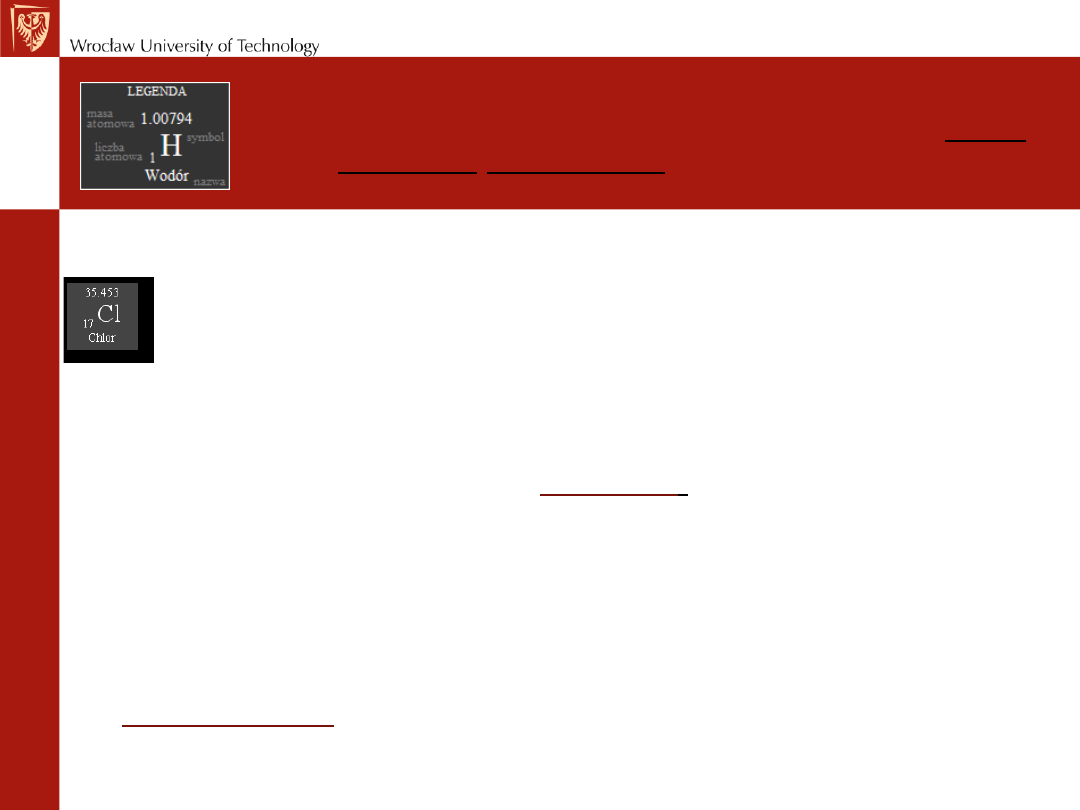
Podaje ona masę danego atomu w jednostkach mas atomowych
(j.m.a.) (u).
u = 1,660*10
-24
g.
Duża część pierwiastków charakteryzuje się masami atomowymi
będącymi liczbami niecałkowitymi.
Niecałkowite wartości mas atomowych biorą się z faktu
występowania w przyrodzie
izotopów
(
odmian pierwiastków,
których jądra zawierają różne ilości neutronów
).
Chlor - w przyrodzie występują dwa izotopy o A= 35 i A = 37.
Jądro izotopu
35
Cl zawiera 17 protonów i 18 neutronów, a izotopu
37
Cl 17 protonów i 20 neutronów. Obydwie odmiany izotopowe
mają oczywiście tę samą ilość 17 elektronów krążących wokół
jądra.
Masa atomowa
jest średnią ważoną mas atomowych obu odmian
izotopowych z uwzględnieniem ich rozpowszechnienia w
przyrodzie.
Ważną wielkością umieszczaną przy symbolu
pierwiastka w układzie okresowym jest masa
atomowa pierwiastka

Zwykle wszystkie izotopy oznaczane są tym samym symbolem.
Reguła ta nie dotyczy wodoru, którego izotopy noszą nazwy:
prot,
deuter
i
tryt
i niekiedy oznaczane są symbolami
D
i
T
.
Prot:
1H (ma jeden proton i nie ma neutronów) - trwały,
Deuter
: 2H (D) (ma jeden proton i jeden neutron) - trwały,
Tryt
: 3H (T) (ma jeden proton i dwa neutrony) - nietrwały.
Deuter (2H, D) – jest stabilnym izotopem wodoru z naturalną obfitością
jednej części w 7000 częściach wodoru. Deuter może zastąpić normalny
wodór w cząsteczkach wody, tworząc ciężką wodę (D
2
O), mającą
charakterystyczną właściwość spowalniania neutronów, dzięki której jest
stosowana przy wytwarzaniu energii jądrowej
Tryt w minimalnych ilościach występuje w atmosferze, jednak głównym
źródłem jego pozyskiwania są reakcje jądrowe. Używany jest jako wskaźnik
izotopowy np. do określania wieku przedmiotów czy badań mechanizmów
reakcji chemicznych i procesów biologicznych.

• Ze względu na różnicę mas atomowych izotopy mają różne niektóre
własności fizyczne, przy czym różnice te są tym większe, im większy jest
rozrzut ich mas względem siebie. Różnice w masach atomowych
izotopów powodują, że w formie czystej mają one inną gęstość,
temperaturę wrzenia, topnienia i sublimacji.
Izotopy dzielą się na:
• trwałe
(nie ulegają samorzutnej przemianie na izotopy innych
pierwiastków),
• nietrwałe
zwane
izotopami
promieniotwórczymi
(ulegają
samorzutnej przemianie na inne izotopy zazwyczaj innego pierwiastka).
Izotopy promieniotwórcze -
atomy, których jądra są niestabilne i
samorzutnie ulegają przemianie promieniotwórczej, dając w wyniku tego
inne atomy (cząstki elementarne) oraz wydzielając energię w postaci
promieniowania gamma i energii kinetycznej produktów przemiany.
Izotopy promieniotwórcze charakteryzuje czas
połowicznego rozpadu
, tj.
czas w którym zanika połowa jąder danego pierwiastka.

• Naturalne radionuklidy syntezowane są w gwiazdach, szczególnie
podczas wybuchów supernowych. Niektóre z nich (np. uran) posiadają
wystarczająco długi okres półtrwania, aby nie ulegały one samorzutnemu
rozpadowi w ciągu miliardów lat. Niektóre izotopy (np.
14
C) są tworzone
podczas zderzeń wysokoenergetycznych cząstek pochodzących z kosmosu z
budulcami atmosfery ziemskiej.
• Sztuczne radionuklidy są wytwarzane przez człowieka głównie w
reaktorach jądrowych oraz akceleratorach
• Izotopy promieniotwórcze
stosowane są
w wielu dziedzinach badań
technicznych (np.: w badaniach przepływów – śledząc z zewnątrz układu
przemieszczanie się w nim płynu zawierającego domieszkę izotopu
promieniotwórczego lub w badaniach zużycia materiałów – implantując
izotop w elementy konstrukcyjne np. silnika i badając zmiany aktywności
tego izotopu w oleju silnikowym w czasie pracy), znajdują zastosowanie w
przemyśle (izotopowe czujniki poziomu, wagi izotopowe, izotopowe czujniki
przeciwpożarowe), medycynie (radiofarmaceutyki, zasilacze izotopowe),
biologii
(śledzenie
obiegu
i
roli
mikroelementów),
geologii
(radiometryczne metody geologiczne) oraz w badaniach podstawowych
(metoda atomów znaczonych, badania dyfuzji, badania strukturalne itd.).
Izotopy promieniotwórcze stosuje się również do modyfikacji cech
przedmiotów
naświetlanych:
wywoływania
mutacji,
sterylizacji,
wywoływania
zmian
w
strukturze
polimerów,
zabijania
tkanek
nowotworowych.

Związki chemiczne
- jednorodne połączenia co najmniej dwóch pierwiastków
chemicznych za pomocą dowolnego wiązania chemicznego posiadające zerowy
sumaryczny ładunek elektryczny.
Mieszanina
- połączenie dwóch lub więcej pierwiastków albo związków
chemicznych, które po zmieszaniu nadal wykazują swoje właściwości.
Mieszaninę można zazwyczaj stosunkowo łatwo rozdzielić różnymi metodami
mechanicznymi lub fizycznymi, takimi jak filtracja, ekstrakcja, sedymentacja,
destylacja, krystalizacja itp.
Mieszanina
Związek chemiczny
Powstaje przez zwykłe
zmieszanie dwu lub
większej liczby
substancji
Powstaje w wyniku
połączenia się różnych
substancji prostych
Składniki zachowują swoje
właściwości przed i po
zmieszaniu
Ma inne właściwości niż
składniki z których
powstał
Można rozdzielić na
składniki z
wykorzystaniem różnic
we właściwościach
fizycznych
poszczegolnych
składników
Można rozłożyć z
wykorzystniem bodzca
zewnętrzego
(temperatura, prąd,
światło, itp.)
Substancje złożone dzielą się na
mieszaniny i związki chemiczne
SUBSTANCJE CHEMICZNE
PROSTE
ZŁOŻONE
Pierwiastki związki chem.
mieszaniny

W zależności od stopnia rozdrobnienia substancji mieszaniny można
podzielić na jednorodne i niejednorodne.
Mieszaniny niejednorodne
to
takie, których składniki można odróżnić gołym okiem lub z użyciem
mikroskopu. Składników
mieszaniny jednorodnej
nie można
wyodrębnić nawet z pomocą mikroskopu.
MIESZANINY CHEMICZNE
JEDNORODNE
NIEJEDNORODNE
Sól i woda
piasek i woda
Alkohol i woda
sól i siarka
Stopy metali
siarka i żelazo
Powietrze
granit

Mieszaniny mogą występować w trzech stanach
skupienia. Mieszaniną gazową jest powietrze,
mieszaninami
ciekłymi
roztwory,
stopy
są
mieszaninami stałymi
Roztwór – mieszanina jednorodna składająca się z co
najmniej dwóch składników:
- rozpuszczalnika
- substancji rozpuszczonej
Skład roztworu określa się ilościowo za pomocą
wielkości
zwanej
stężeniem
,
wyrażającej
zawartość
substancji
rozpuszczonej
w
określonej ilości rozpuszczalnika lub roztworu
.

CHEMIA
Rodzaje
stężeń

Stężenie
Skład roztworu określa się ilościowo
za
pomocą
wielkości
zwanej
stężeniem
, wyrażającej zawartość
substancji
rozpuszczonej
w
określonej ilości rozpuszczalnika
lub roztworu.

Sposoby określania stężeń
▪ Procentowe (c
p
)
▪ Molowe (c
m
)
▪ Molalne (c)
▪ Ułamek molowy (x
A
)

Stężenie procentowe
Jest to liczba gramów substancji rozpuszczonej,
zawartej w 100 g roztworu, czyli procent
wagowy substancji w stosunku do masy
roztworu, którą przyjmuje się za 100%.
c
p
= m
s
/m
r
× 100% [%]
c
p
= m
s
/(m
s
+ m
a
) × 100% [%]
m
r
= m
s
+ m
a
m
s
– masa substancji rozpuszczonej
m
r
– masa roztworu
m
a
– masa rozpuszczalnika

Stężenie procentowe –
przykłady
Alkohol etylowy
bezwodny 99%
spirytus 96%
wódka ~40%
Powietrze
• azot 78%
• tlen 21%
• argon <1%
• inne
Stal
• max do 2%
węgla
Stal nierdzewna
• min 10,5% Cr
oraz
• max 1,2% C

Przykład
Rozpuszczono w wodzie 30 g NaOH, otrzymując
roztwór 12,5%. Ile gramów wody użyto do
sporządzenia tego roztworu?
c
p
= m
s
/(m
s
+ m
a
) x 100% [%]
m
a
= m
s
x 100% / c
p
– m
s
= m
s
(100%/c
p
– 1)
m
a
= 30 g (100%/12,5% -1) = 210 g
Albo:
12,5g NaOH – 100 g r-ru
30g NaOH - x r-ru
x=(30
x
100)/12,5 [g r-ru]
Masa r-ru = woda +NaOH (30
x
100)/12,5 =
woda
+12,5
Jest to liczba moli substancji
rozpuszczonej w 1 dm
3
roztworu
Stężenie molowe
Tuzin (12), kopa (6), mendel (15), gros (144) [elementów-
makroobiektów]
1 mol = 6,023 × 10
23
elementów materii [mikroobiektów]
ilość atomów w 12 gramach izotopu węgla
12
C (liczba Avogadra)
Masa molowa jest to masa 1 mola substancji
Masę molowa g/mol.
Masa molowa atomów danego pierwiastka jest równa
liczbowo jego masie atomowej, a masa molowa cząsteczek
związku chemicznego jest równa liczbowo jego masie
cząsteczkowej.

Ilość moli substancji rozpuszczonej w 1 dm
3
roztworu
c
m
= n
s
/ V [mol/dm
3
]
n
s
– liczność substancji
rozpuszczonej
V – objętość całego roztworu
Roztwór jednomolowy = roztwór zawierający w objętości
1 dm
3
1 mol danej substancji
np. 1 M HCl (1 M = 1 mol/dm
3
)
Stężenie molowe
Przykład
W 300 cm
3
roztworu znajduje się 18 g NaOH.
Obliczyć stężenie molowe roztworu.
c
m
= n / V
r
[mol/dm
3
]
n = m
s
/ M
c
m
= m
s
/MV
r
c
m
= 18 g / (40 g/mol x 0,3 dm
3
) = 1,5
mol/dm
3

Ułamek molowy
Jest to stosunek liczby moli danego składnika roztworu do
sumy moli wszystkich składników roztworu.
Jest to względna zawartość substancji A w roztworze
zawierającym n
A
moli substancji A, n
B
moli substancji B itd.
Roztwór zawiera subs. A i sub. B
x
A
= n
A
/(n
A
+n
B
)
Roztwór zawiera subs. A + sub. B +inne
x
B
= n
B
/(n
A
+n
B
+…)
n
A
– liczba moli substancji A
n
B
– liczba moli substancji B
Σ x
i
= 1
Ułamki molowe są liczbami niemianowanymi
.

Przykład
Podać w ułamkach molowych skład 70% wodnego
roztworu alkoholu etylowego.
Roztwór składa się z dwóch substancji: C
2
H
5
OH i H
2
O.
x
C2H5OH
= n
C2H5OH
/ n
C2H5OH
+ n
H2O
x
H2O
= n
H2O
/ n
C2H5OH
+ n
H2O
n
C2H5OH
= 70 g /46 g/mol = 1,52
n
H2O
= 30 g / 18 g/mol =1,67
x
C2H5OH
= 1,52 / (1,52 + 1,67) = 0,48
x
H2O
= 1,67 / (1,52 + 1,67) = 0,52 0,48 + 0,52
= 1

Przeliczanie stężeń
Stężenie molowe roztworu można przeliczyć na stężenie
procentowe i odwrotnie znając gęstość roztworu i korzystając z
następujących zależności:
n = m
s
/M → m
s
= n × M (liczba moli substancji rozpuszczonej)
d
r
= m
r
/V → m
r
= d
r
× V
r
(gęstość roztworu)
c
m
= n/V
r
c
m
= m
s
/M x d
r
/m
r
c
m
= (c
p
x d
r
) / (100% x
M)
c
p
=
(c
m
x 100% x M)/d
r

Przykład
Obliczyć stężenie molowe 60% roztworu kwasu
H
2
SO
4
. Gęstość kwasu wynosi 1,498 g/cm
3
.
c
m
=
(c
p
x d
r
) / (100% x M)
1,498 g/cm
3
= 1498 g/dm
3
c
m
= (60% x 1498 g/dm
3
) / (100% x 98 g/mol) = 9,17
mol/dm
3

Mieszanie roztworów o różnych
stężeniach procentowych
Dane: c
p1
i c
p2
Szukane: c
p
c
p1
>c
p
>c
p2
m
s
= m
s1
+ m
s2
m
r
= m
r1
+ m
r2
m
r
x c
p
/ 100% = m
r1
x c
p1
/100% + m
r2
x c
p2
/100%
(m
r1
+ m
r2
) x c
p
/ 100% = m
r1
x c
p1
/100% + m
r2
x
c
p2
/100%
(m
r1
+ m
r2
) x c
p
= m
r1
x c
p1
+ m
r2
x c
p2

Rozcieńczanie roztworów
c
p2
= 0
(m
r1
+ m
r2
) x c
p
= m
r1
x c
p1

Reguła mieszania
c
p
p2
c
c
p1
c
p1
c
p
-
c
p
p2
c
-
c
p1
p2
c
czesci wagowych roztworu
czesci wagowych roztworu

Przykład
W jakim stosunku wagowym należy zmieszać 4% roztwór amoniaku z
roztworem 1% aby otrzymać 60 g roztworu 1,5%?
1,5%
4%
1%
4-1,5 = 2,5
1,5 - 1 = 0,5
Założenie m =
60 g
Założenie m = 60g
60-x
0,5
2,5
x
=
x = 10 60 - 10 = 50

ppm, ppb, ppt
• % 10
-2
• ppm 10
-6
part per million (np. mg/kg)
•
określa ile cząsteczek związku chemicznego
przypada na
1 milion cząsteczek roztworu
• ppb 10
-9
part per billion (np. μg/kg)
• ppt 10
-12
part per trillion (np. ng/kg)
przedrost
ek
nazwa przeliczn
ik
m
mili
10
-3
μ
mikro
10
-6
n
nano
10
-9
p
piko
10
-12
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
PrawoUpadłościoweINaprawcze Wykład zaoczne całość 2012
pp program wykladu zaoczne 03, wisisz, wydzial informatyki, studia zaoczne inzynierskie, podstawy pr
Wyklad 6 Zaoczni
wykład 3 zaoczne
Wyklad 4 5 Zaoczni
wyklady 1-3 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklad 6 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklady 4-5 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklady 7-8 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklad 9 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
Wyklad 3 Zaoczni
Ekonomia społeczna Wyklady zaoczne
controlling wyklad zaoczne
kryminologia wykladydadak zaoczni
Wyklad 4 5 Zaoczni
więcej podobnych podstron