
Elementy krystalografii
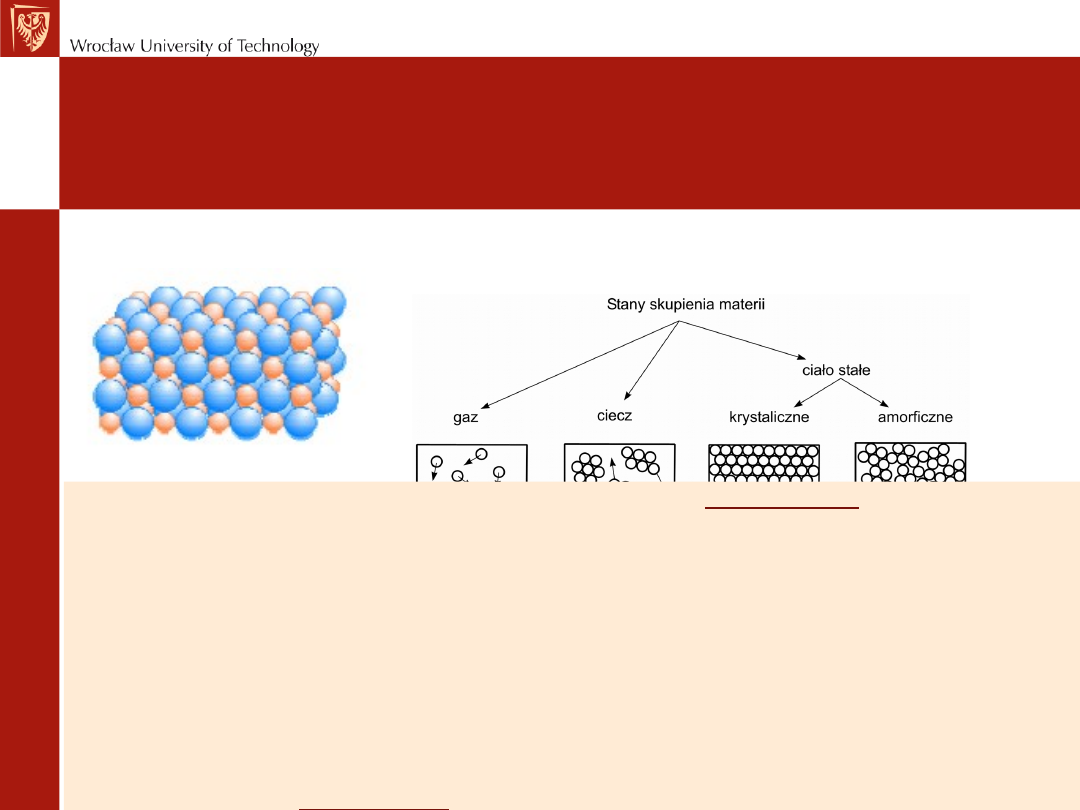
Czym różnią się między sobą stany skupienia:
-uporządkowaniem, odległościami między cząsteczkami
-ruchem cząsteczek
Wielkością sił między cząsteczkami
Krystalografia
•
dział nauki zajmujący się opisem, klasyfikacją i badaniem kryształów, krystalitów oraz
substancji o strukturze częściowo uporządkowanej.
Krystaliczne ciała stałe są najbardziej uporządkowane
KRYSZTAŁ - ciało posiadające trójwymiarowe periodyczne uporządkowanie
atomów, jonów lub molekuł, z których kryształ jest zbudowany.
W ciałach stałych
amorficznych
występuje tylko uporządkowanie bliskiego zasięgu
Ciało krystaliczne
Ciało amorficzne
Kryształy wykazują ciekawą właściwość, tzw. anizotropię, polegającą na
uzależnieniu właściwości fizycznych od kierunku, w którym się je bada. W pewnych
kierunkach elementy strukturalne mogą być z sobą związane słabiej niż w innych.
Wówczas kryształ wykazuje zmniejszoną wytrzymałość mechaniczną i łatwo daje się
łupać wzdłuż pewnych płaszczyzn, przy czym próba nie powiedzie się przy
uderzeniu wzdłuż płaszczyzny do niej prostopadłej.
Oprócz anizotropii mechanicznej, różne wartości dla różnych kierunków może
wykazywać
współczynnik
załamania
światła,
współczynnik
sprężystości,
współczynnik rozszerzalności liniowej, przewodnictwo cieplne, przewodnictwo
elektryczne, względna przenikalność elektryczna (stała dielektryczna) i inne. Ciała
bezpostaciowe są izotropowe, tzn. we wszystkich kierunkach mają identyczne
właściwości mechaniczne, optyczne i elektryczne, podobnie jak w gazach i w
cieczach.

Polikrystaliczny kwarc
Monokryształ kwarcu
Gips
Kryształy
naturalne
Bardzo często mamy do czynienia z substancjami
polikrystalicznymi rzadko monokryształami
Monokryształ
–
materiał będący w całości jednym
kryształem (np. kryształ cukru, soli)
Polikryształ -
ciało stałe będące zlepkiem wielu monokryształów,
zwanych ziarnami.
Polikrystaliczny
piryt

Kryształ
ciało posiadające trójwymiarowe periodyczne uporządkowanie
atomów, jonów lub molekuł, z których kryształ jest zbudowany.
(Kryształ można sobie wyobrazić jako powtarzające się w przestrzeni,
identyczne bryły geometryczne-----
KOMÓRKI ELEMENTARNE)
KOMÓRKA ELEMENTARNA
Jest to najmniejsza jednostka, z której można
zbudować kryształ, poprzez dodawanie jej
(powielanie) w trzech prostopadłych kierunkach
Komórka elementarna powtarza się we wszystkich trzech
kierunkach, tworząc zamkniętą sieć przestrzenną, której główną
cechą jest symetria. Komórka elementarna ma zawsze kształt
równoległościanu.
Poprzez translacje komórki elementarnej o wektory będące
całkowitymi wielokrotnościami wektorów sieci krystalicznej
otrzymuje się całą sieć krystaliczną kryształu.
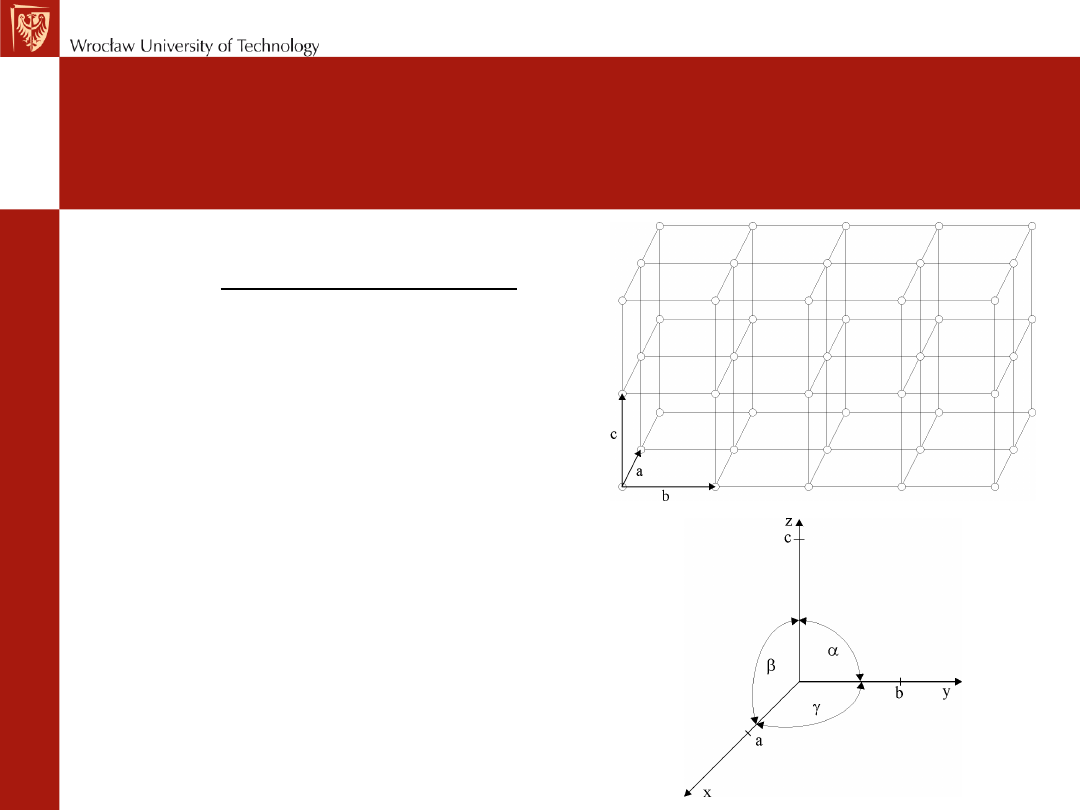
Geometria komórki
elementarnej
• W krystalografii (a, b, c) są
nazywane stałymi sieciowymi lub
parametrami sieciowymi. Układ
współrzędnych przyjmuje się w ten
sposób, aby oś x leżała wzdłuż
krawędzi a, oś y - wzdłuż krawędzi
b, a oś z - wzdłuż krawędzi c.
Relacja
między
kątami
i
krawędziami jest następująca: kąt
α jest między krawędzią b i c, kąt
β między a i c i kąt γ między a i b.
• Powtarzanie komórki elementarnej
- ściana do ściany - w trzech
wymiarach tworzy całą strukturę
krystaliczną. Podstawową cechą
komórki elementarnej jest to, że
reprezentuje ona w pełni całą
strukturę krystaliczną.
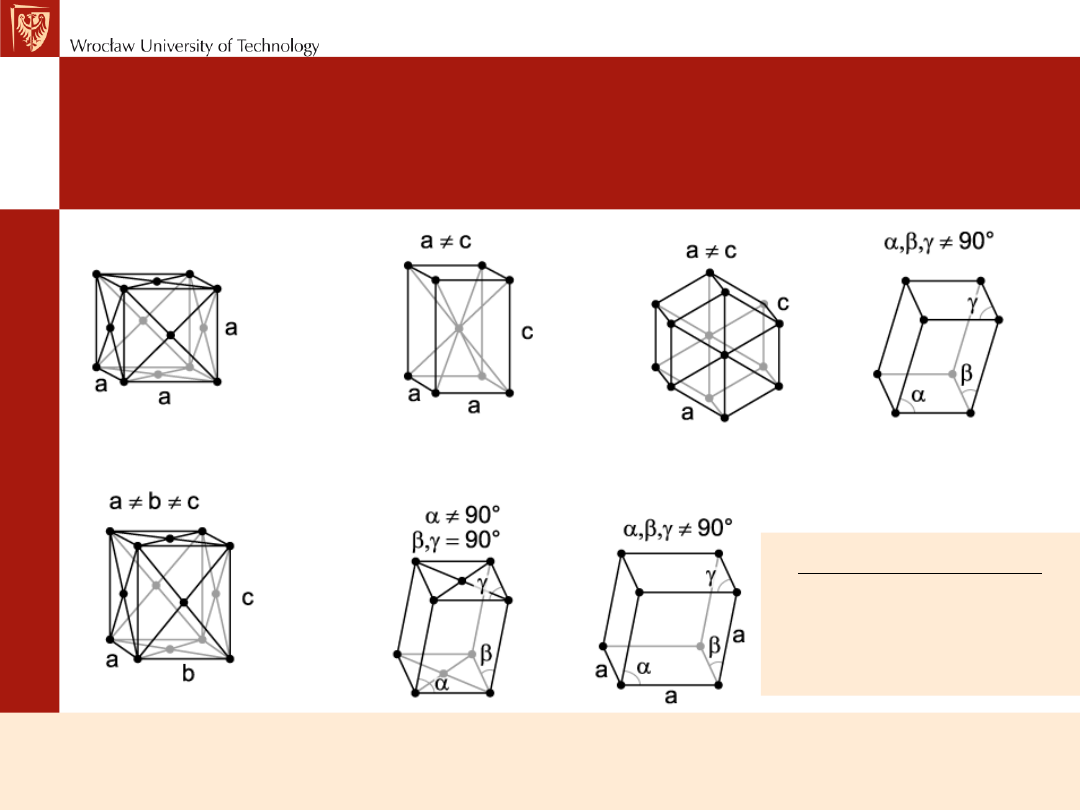
Przykłady komórek elementarnych
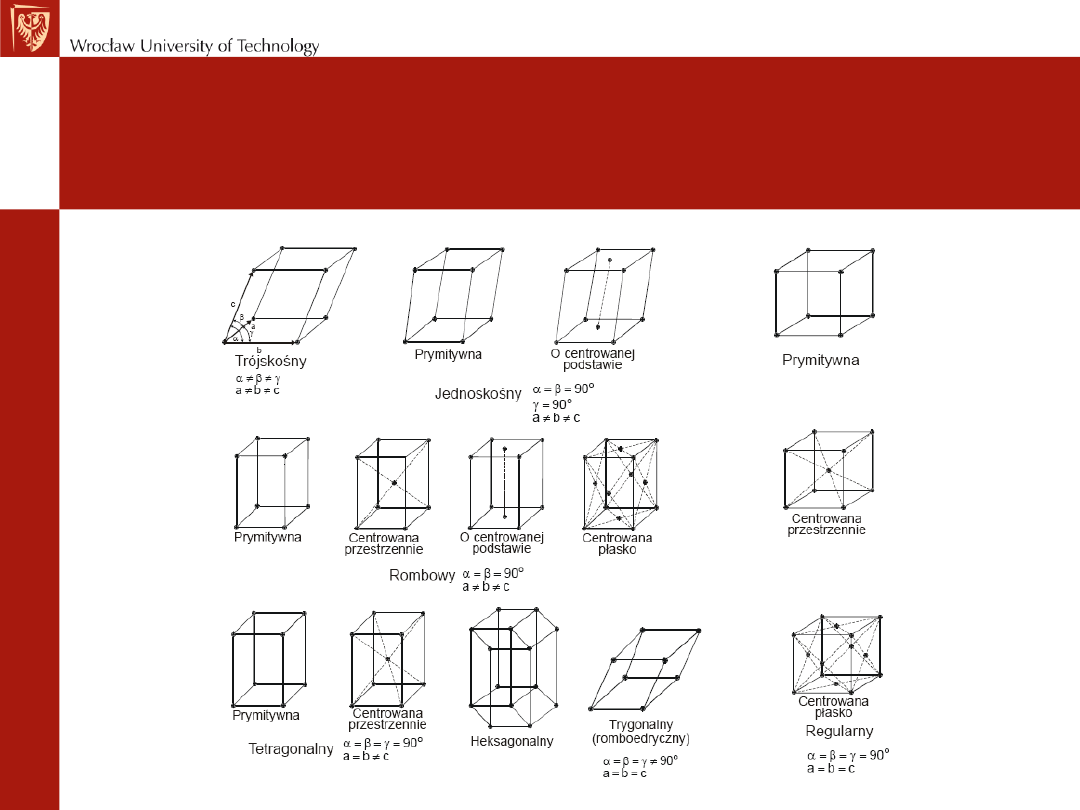
Układy krystalograficzne
a=b=c, α=β=γ=90
0
a=b≠c, α=β=γ=90
0
a=b≠c α=β=90
0
γ =120
0
a=b=c α=β=γ≠90
0
układ regularny układ tetragonalny układ heksagonalny układ
trygonalny
a≠b≠c, α=β=γ=90
0
a≠b≠c α=γ=90
0
β≠90
0
a≠b≠c α≠γ≠β≠90
0
układ rombowy układ jednoskośny układ trójskośny
Komki elementarne charakteryzuje
sześć parametrów sieci:
Okresy identyczności sieci: a, b, c
Kąty: α, β, γ
Tworzą one równoległościan
elementarny
Opis struktur krystalicznych za pomocą komórek elementarnych jest bardzo dogodny, gdyż wszystkie
możliwe struktury zostają zredukowane do siedmiu różniących się kształtem komórek elementarnych,
których powtarzanie - ściana do ściany - wypełnia ściśle trójwymiarową przestrzeń.
Są one nazywane siedmioma układami krystalograficznymi

• oprócz parametrów sieci a, b i c; α, β i γ strukturę krystaliczną
charakteryzują:
• liczba najbliższych sąsiadów, zwana liczbą koordynacyjną,
• odległość między najbliższymi atomami w krysztale,
• liczba atomów w komórce elementarnej,
• współczynnik upakowania, czyli stosunek objętości kryształu
zajętej przez atomy (traktowane jako „kulki”) do całkowitej
objętości kryształu.
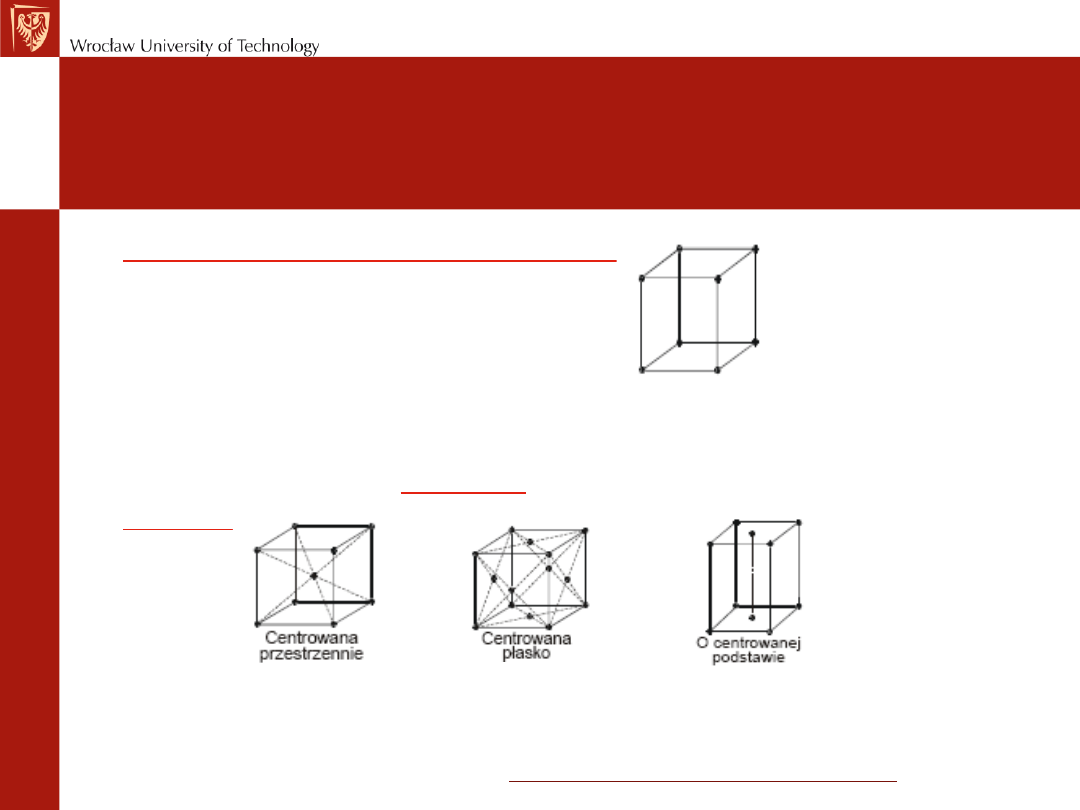
Rodzaje komórek
elementarnych
• Komórka elementarna prosta
–
(P) jeden atom przypada na jedną
komórkę elementarną. Atomy w
narożach komórki
• Inne rodzaje komórek
elementarnych to
komórki
centrowane
–
przestrzennie
(I) i
płasko
(F)
Ogólnie istnieje 14 rodzajów komórek
odpowiadających 14 rodzajom sieci Bravais
14 rodzajów sieci Bravais

Poprzez translacje komórki elementarnej o
wektory będące całkowitymi wielokrotnościami
wektorów sieci krystalicznej otrzymuje się całą
sieć krystaliczną kryształu.
Translacja - to izometria polegająca na równoległym przesunięciu figury,
zbioru lub innego zwykle geometrycznego obiektu o pewien ustalony
wektor na prostej, płaszczyźnie, w przestrzeni euklidesowej lub na
dowolnej innej rozmaitości. Translacja nie zmienia kształtu figury ani
żadnych wewnętrznych relacji pomiędzy jej elementami, natomiast
zmienia położenie figury w stosunku do innych (nie podlegających
translacji) figur.

(Kryształ ciało posiadające trójwymiarowe periodyczne
uporządkowanie atomów, jonów lub molekuł, z których kryształ
jest zbudowany)
Uporządkowanie te daje się stosunkowo prosto
opisać przez podanie własności symetrii. Symetrię
kryształu definiuje się poprzez podanie operacji
symetrii przekształcających kryształ sam w siebie.
Przekształceniami symetrii są:
translacje, obroty
,
inwersja
,
obroty inwersyjne
i
płaszczyzny odbicia
.

Oś symetrii: dana figura (częśc
figury) powtarza się n razy przy
obrocie wokół pewnej prostej stale o
ten sam kąt (mieszczący się całkowitą
liczbę n razy w 360
0
) n=360
0
C
nazywa się krotnością osi


Środek symetrii (inwersja) – w
jednakowej odległości wzdłuż dowolnej
prostej przechodzącej przez środek
symetrii znajdują się jednakowe części
figury (jednakowy motyw)

Płaszczyzna symetrii:
dwie
figury (lub części jednej figury)
pozostają względem siebie w
takim stosuku jak przedmiot do
swego obrazu w płaskim
zwierciadle


KLASYFIKACJA KRYSZTAŁÓW ZE WZGLĘDU NA RODZAJ
SIŁ WIĄŻĄCYCH:
Kryształy są sklasyfikowane w czterech grupach;
• cząsteczkowej
• jonowej
• kowalencyjnej
• metalicznej
Oznacza to, że w węzłach sieci znajdują się albo cząsteczki,
albo jony, albo atomy

Kryształy cząsteczkowe
-
takie struktury, w których pojedyńcze cząsteczki utrzymywane są w sieci krystalicznej
w wyniku odziaływania:
• sił van der Waalsa
• dipolowego
Oddziaływanie dipolowe spotyka się w ciałach stałych złożonych z
cząsteczek biegunowych, np. w przypadku lodu, a oddziaływanie van der
Waalsa we wszystkich cząsteczkowych ciałach stałych.
Ponieważ całkowite oddziaływanie międzycząsteczkowe w zasadzie jest
słabe, kryształy cząsteczkowe mają niskie temperatury topnienia. Ponadto
są one zwykle dość miękkie, ponieważ cząsteczki mogą być łatwo
przemieszczane z jednego położenia w inne. Są one złymi przewodnikami
elektryczności, ponieważ elektron związany z jedną cząsteczką z trudem
przeskakuje do innej cząsteczki. Większość substancji, które w
temperaturze pokojowej są gazami, tworzy cząsteczkowe ciała stałe.
Ten typ kryształu występuje częściej w związkach organicznych.
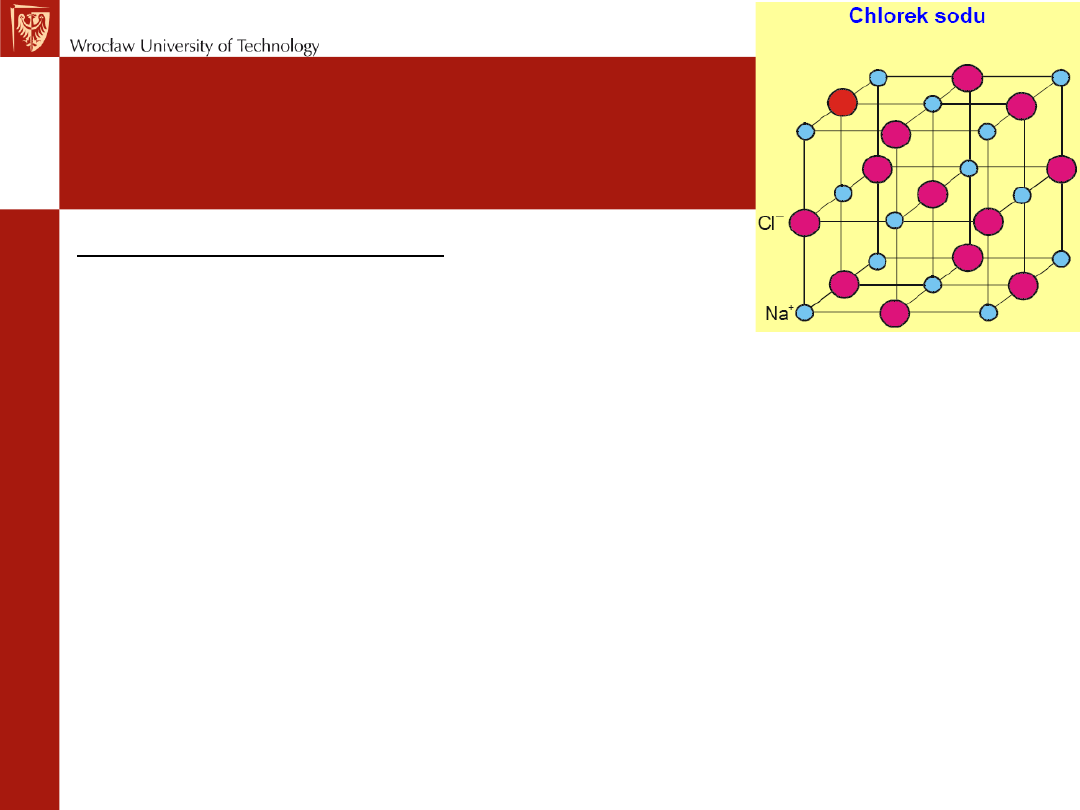
Kryształy jonowe
Kryształ taki jest zatem utworzony z jonów dodatnich i ujemnych oddziaływujących ze
sobą siłami elektrostatycznymi, przy czym jony te są tak uszeregowane, że siły
przyciągania pomiędzy jonami różnoimiennymi przeważają nad siłami odpychania
pomiędzy jonami jednoimiennymi. Rozkład ładunku wokół każdego jonu w krysztale
jonowym będzie miał w przybliżeniu symetrię kulistą, zaburzoną nieco w pobliżu styku z
„sąsiadami”.
– Kryształy jonowe tworzą pierwiastki z I i VII (np.KCl) oraz (w nieco mniejszym stopniu) II i
VI (np.MgO) grupy głównej układu okresowego.
• kryształy jonowe są twarde, mają wysoką temperaturę topnienia (znaczne
wartości energii
wiązania)
• nie ma wyróżnionego kierunku wiązania (zamknięte powłoki elektronowe o
symetrii sferycznej),
• kryształy są złymi przewodnikami ciepła i prądu (brak elektronów swobodnych),
W kryształach jonowych dochodzi do niemal
całkowitego przechwycenia chmur elektronów
walencyjnych z atomów jednego rodzaju przez
atomy drugiego rodzaju.
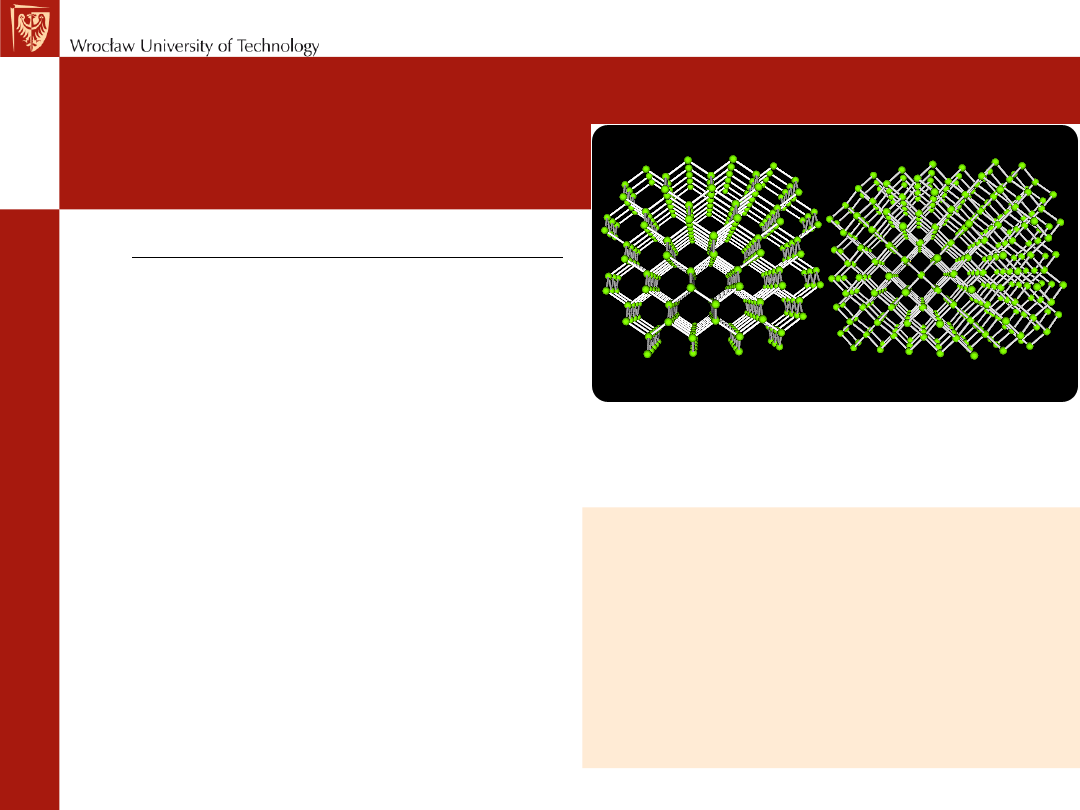
Kryształy kowalencyjne
W kryształach kowalencyjnych
atomy
są
związane
z
sobą
wiązaniami atomowymi.
Atomy przyjmują stabilną
konfigurację
elektronową
odpowiedniego gazu szlachetnego
poprzez uwspólnienie elektronów.
Przykładem kowalencyjnej
struktury krystalicznej może być
sieć krystaliczna diamentu, w której
każdy atom jest otoczony czterema
innymi
atomami
węgla
rozmieszczonymi w narożnikach
czworościanu.
Sieć krystaliczna
diamentu
Kryształy kowalencyjne
• kryształy twarde, niepodatne na odkształcanie
(sztywność struktury elektronowej),
• izolatory w niskich temperaturach (elektrony
walencyjne związane z atomami),
• przewodniki w wyższych temperaturach (wtedy
energia drgań cieplnych jest wystarczająca do
zerwania niektórych wiązań i uwolnienia pewnej liczby
elektronów),
•

Kryształ metaliczny
•
Budowę metalu najprościej można opisać w ten sposób, że od każdego atomu
metalu odczepiają się elektrony walencyjne, których liczba jest zależna od jego
położenia w układzie okresowym i które w sieci przestrzennej, utworzonej przez
pozostałe dodatnie jony, poruszają się mniej lub bardziej swobodnie jako gaz
elektronowy i wywołują przez to np. dobre przewodnictwo elektryczne, tak jak i
wszystkie
inne
cech
typowo
metaliczne.
Elektrony te przynależą jednocześnie do wszystkich atomów i tworzą wiązanie
między
jonami.
Wiązanie metaliczne:
• nie ma charakteru wiązania skierowanego (metale są plastyczne),
• łatwość zamiany atomów (występowanie stopów i łatwość łączenia
metali),
• metale nieprzezroczyste (promieniowanie zakresu widzialnego silnie
absorbowane przez
• swobodne elektrony).

Klasyfikacja struktur
Typ
Jednostki
struktural
ne
wiązanie
Właściwości
Przykłady
JONOWY
Kationy i
aniony
elektrostatyczne,
niekierunkowe
Twarde kruche,
wysoka t.t,
izolatory, stopione
przewodzą
Halogenki
alkaliczne np.. NaCl
KOWALENCY
JNY
atomy
kowalencyjne
Bardzo twarde,
wysokie t.t,
izolatory
Diament, krzem
MOLEKULAR
NY
cząsteczki
kowalencyjne
wewnątrz cząsteczek,
wodorowe i van der
Waalsa pomiędzy
Miękkie, niskie t.t,
duży współczynnik
rozszerzalności
termicznej
Lód, związki
organiczne
METALICZNY
atomy metalu
metaliczne
W stanie czystym –
miękkie,
wytrzymałość
zależy od defektów,
przewodniki
Glin, cyna, miedź,
żelazo

Defekty struktury
Stan krystaliczny charakteryzuje się dużym uporządkowaniem i
bardzo regularnym rozmieszczeniem atomów, cząsteczek lub
jonów w przestrzeni. Większość kryształów występujących w
przyrodzie nie jest jednak idealna. Występują powszechnie
defekty struktury. Mają one duży wpływ na własności
mechaniczne i fizykochemiczne ciał krystalicznych.
Nieprawidłowości struktury sieciowej spotykane w rzeczywistych
strukturach krystalicznych można podzielić na trzy grupy:
• • defekty punktowe,
• • defekty liniowe,

Defekty punktowe
---zakłócenia budowy krystalicznej umiejscowione wokół punktu.
Najprostszym defektem tego typu jest brak atomu w węźle sieci
przestrzennej, zwany wakansem albo luką.
Wakanse powstają przede wszystkim wskutek drgań cieplnych sieci,
które są tym większe, im wyższa jest temperatura. Przy określonej
amplitudzie drgań atom może wypaść ze swego średniego położenia w
węźle sieci i zająć pozycję międzywęzłową. Powstaną wówczas
jednocześnie dwa defekty punktowe: wakans i atom wtrącony
międzywęzłowo.
Atom wtrącony powoduje
rozsunięcie sąsiednich atomów
na odległość większą od
normalnej -defekt Frenkla
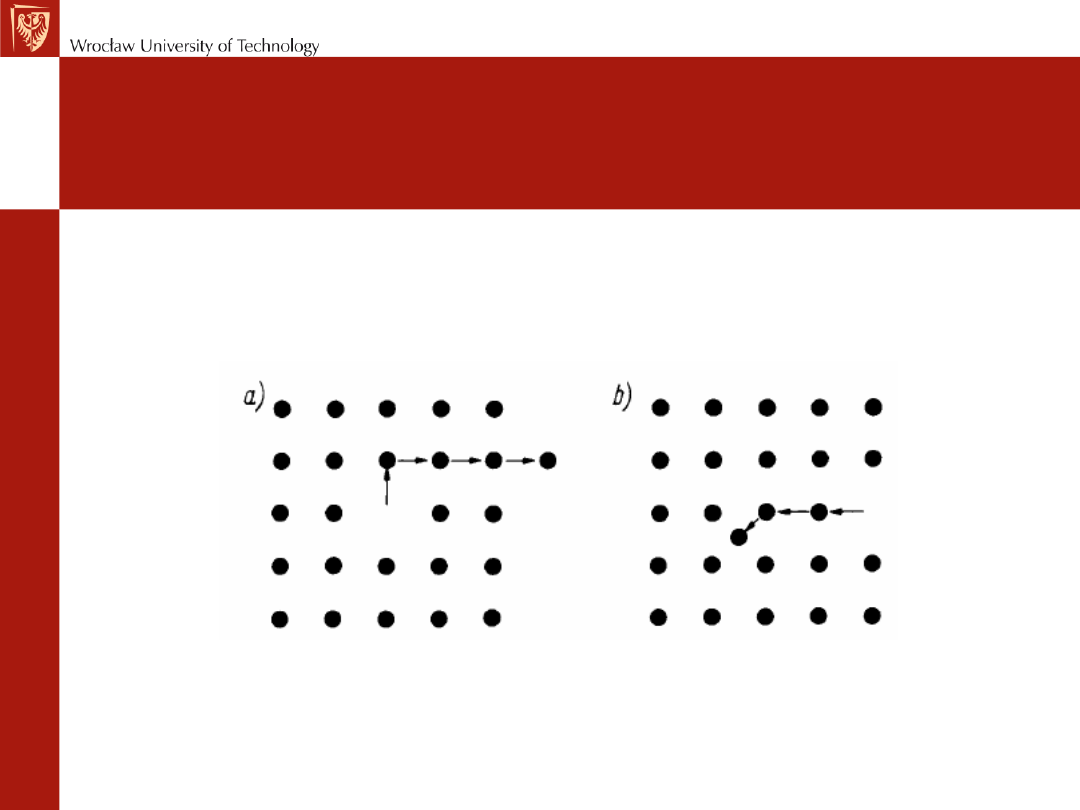
W zwarcie wypełnionych sieciach krystalicznych tworzą się, defekty
punktowe, polegające na powstawaniu wakansu i wywędrowaniu atomu,
który ten wakans utworzył, na powierzchnię kryształu. Ten typ defektu
nazywa się defektem Schottky'ego i jest powszechny w kryształach
metali.
Defekt Schotky’ ego
Defekt Frenkla

Punktowe defekty sieci tworzą również znajdujące się w niej obce atomy.
Możliwe są tu następujące przypadki. Jeśli obcy atom ma średnicę atomową dużo
mniejszą od średnicy atomowej atomów metalu, to zajmuje on położenie
między węzłowe, wywołując lokalne rozsunięcie sąsiednich atomów i
powiększenie parametrów sieci.
W typowych sieciach krystalicznych metali przestrzenie międzywęzłowe są
niewielkie, położenie międzywęzłowe mogą zajmować w nich tylko atomy azotu,
wodoru, węgla i boru, mające najmniejsze średnice atomowe. Wtrącone atomy
innych pierwiastków mogą zajmować wyłącznie pozycje węzłowe zastępując
atomy metalu podstawowego. Jeśli obcy atom ma większą średnicę od atomu
metalu podstawowego— występuje lokalne rozsunięcie sąsiednich atomów
(powiększenie parametrów sieci), jeśli mniejszą — lokalne zbliżenie atomów
(zmniejszenie parametrów sieci)
Wakans atom międzywęzłowy atom obcy węzłowy atom obcy międzywęzłowy

Defekty liniowe
----zakłócenia budowy krystalicznej, które w jednym kierunku mają
wymiar kilku odległości atomowych, a w drugim — całego ziarna
lub znacznej jego części. Rozróżnia się dwa zasadnicze rodzaje
defektów liniowych: dyslokację krawędziową i dyslokację
śrubową.
• Dyslokację krawędziową wywołuje obecność w przestrzennej
sieci krystaliczne dodatkowej półpłaszczyzny obsadzonej atomami
(zw. ekstrapłaszczyzną), której krawędź stanowi dowolna linia
brzegowa, nazywana linią dyslokacji.
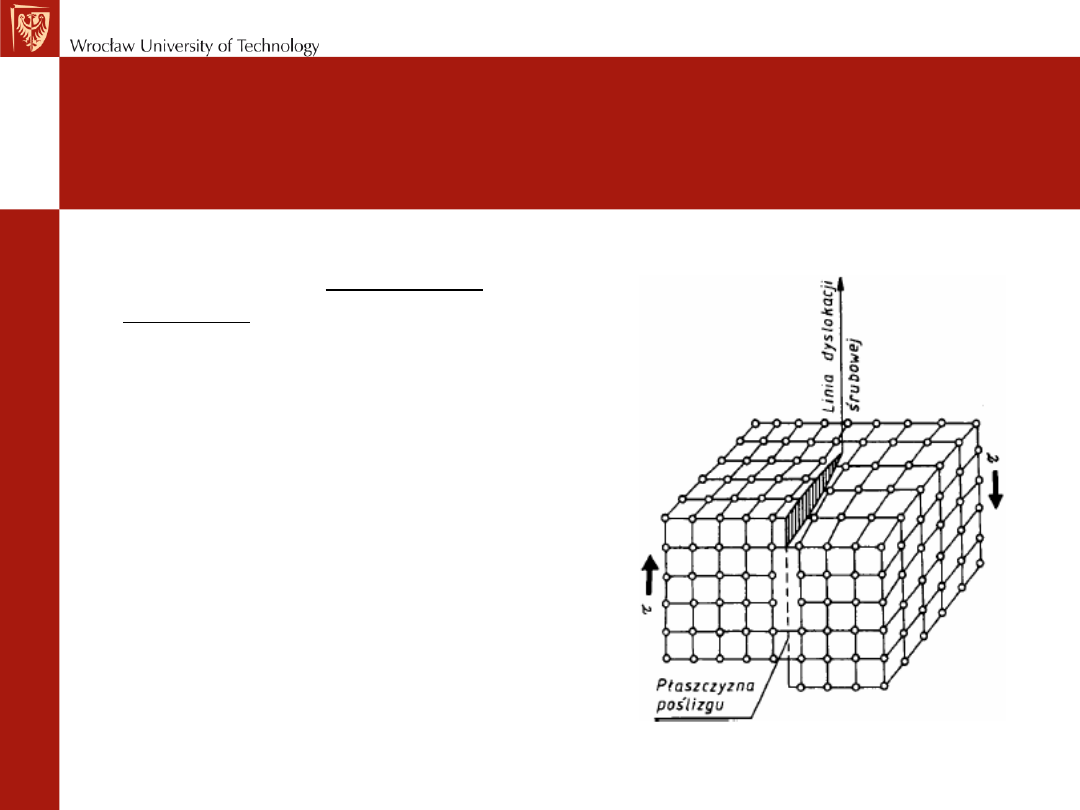
Drugim prostym rodzajem
dyslokacji jest dyslokacja
śrubowa, wyznaczająca
granicę między przesuniętą i
nieprzesuniętą częścią
kryształu. Granica ta
przebiega równolegle do
kierunku poślizgu a nie
prostopadle, jak to ma miejsce
w przypadku dyslokacji
krawędziowej.

Skąd wiemy jak wyglądają
kryształy?
Strukturę krystaliczną badamy za pomocą dyfrakcji
fotonów, neutronów, elektronów lub innych lekkich
cząsteczek
Dyfrakcja to zjawisko polegające na zaburzeniu prostoliniowego
rozchodzenia się promieni świetlnych.
Dyfrakcji ulega światło tylko na takich przeszkodach (szczelinach),
których rozmiary są porównywalne z długością fali świetlnej.
d >> λ – dyfrakcja nie występuje,
d ≈ λ – dyfrakcja zachodzi.

1912 – Max von Laue zauważył, że długości fali
promieniowania X sa porównywalne z odległościami
międzyatomowymi w krysztale
• Sieć krystaliczna może pełnić rolę siatki dyfrakcyjnej dla
promieni rentgenowskich ponieważ promieniowanie X jest
falą elektromagnetyczną o długościach porównywalnych z
odległościami między węzłami sieci (prostymi i
płaszczyznami sieciowymi
Promieniowanie elektromagnetyczne
Promieniowanie elektromagnetyczne
radiowe
mikrofale IR UV/VIS X γ
do 30cm
300 – 1 m 1000 – 0.77μm 770 – 10nm
10 – 0.005nm > 0.5nm
Promieniowanie rentgenowskie
od 0.05 do 100 Å
w metodzie XRD
0.2 do 2.5 Å
Skąd wiemy jak wyglądają
kryształy?
Otrzymywanie promieniowania
rentgenowskiego:
Lampy rentgenowskie,
Sztuczne izotopy promieniotwórcze
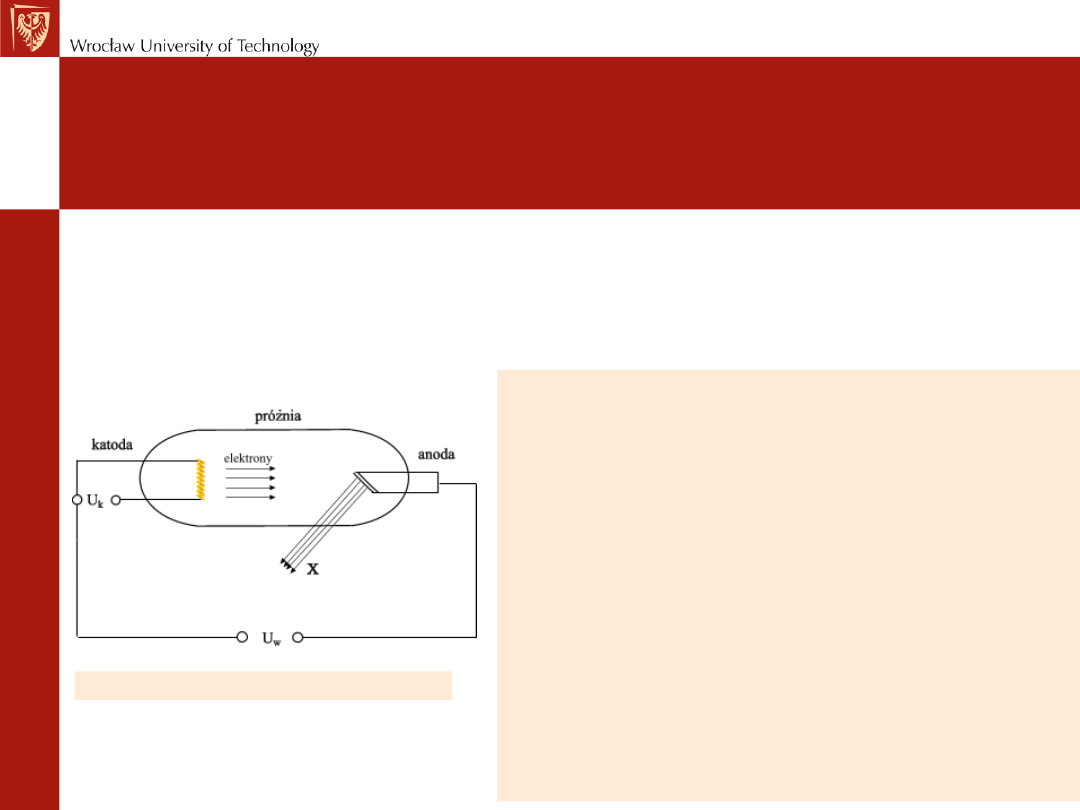
Schemat lampy rentgenowskiej
Promieniowanie rentgenowskie jest
promieniowaniem elektromagnetycznym o
długości fal od 0.1 do kilku Å. Do
wytwarzania promieni rentgena służą
specjalne lampy, w których rozpędzone w
polu elektrostatycznym elektrony uderzają
w metalową antykatodę. Podczas tych
zderzeń elektron traci energię w skutek
dwóch niezależnych procesów. Pierwszy z
nich to hamowanie w polu elektrycznym
atomów antykatody . Drugi to wzbudzenie
elektronów rdzeni atomowych atomów
antykatody. Oba procesy powodują
pojawienie się wysokoenergetycznych
fotonów .
.

• PRAWO BRAGA
Model kryształu- zbiór
odbijających równoległych
płaszczyzn o odległościach
między płaszczyznowych d
2dsin
= n
.
Promienie Rentgena padające
na kryształ pod kątem
ulegają odbiciu od
poszczególnych płaszczyzn
sieciowych odległych od
siebie o d. Jeśli różnica dróg
optycznych będzie równa
całkowitej wielokrotności
długości fali nastąpi
wzmocnienie
Alotropia
•
Polimorfizmem
lub
alotropią
nazywamy występowanie
tego samego pierwiastka lub związku w postaci dwóch lub
kilku odmian krystalicznych, a odmiany te nazywamy
alotropowymi. Przemiany alotropowe zachodzą przy stałych
temperaturach i towarzyszy im wydzielanie lub
pochłanianie utajonego ciepła przemiany (w zależności od
kierunku jej zachodzenia).
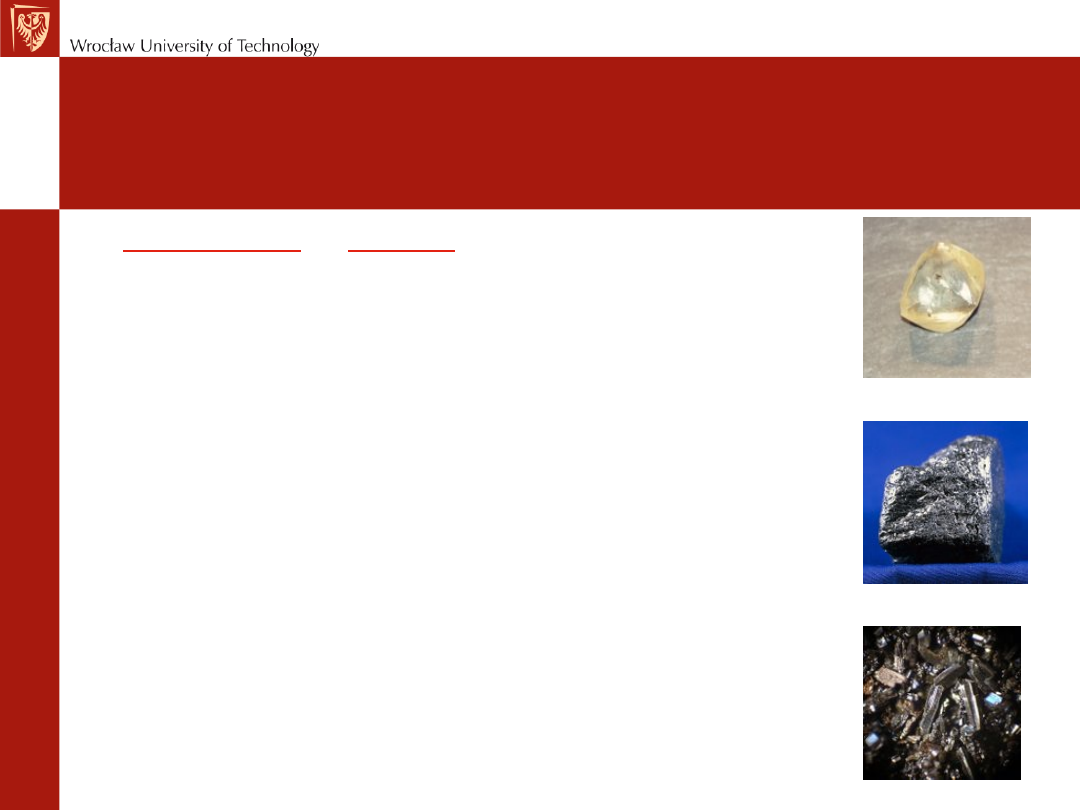
DIAMENT
GRAFIT
FULEREN
Odmiany alotropowe nie są różnymi stanami skupienia materii
Najbardziej znane pierwiastki tworzące odmiany alotropowe:
węgiel występujący w formie diamentu, grafitu, fulerenu
fosfor występujący w formie fosforu czerwonego, białego,
fioletowego i czarnego
siarka występująca w formie romboidalnej, jednoskośnej i
polimerycznej.
żelazo o sieci regularnej przestrzennie centrowanej (α i δ) oraz
regularnej ściennie centrowanej (γ).
Od greckiego:
�allos-inny, obcy;
�tropos-kształt, postać.

Odmiany węgla - diament:
�
Struktura kubiczna
przestrzennie centrowana
� Każdy atom węgla otoczony
jest 4 sąsiadami, z którymi tworzy
wiązania kowalencyjne o tej samej
długości tworząc w przestrzeni
czworościan foremny (tetraedr);
�Najtwardszy naturalny minerał,
gęstość 3,51 g/cm3;
�Izolator
�Wiązania o charakterze
kowalencyjnym
hybrydyzacja sp3

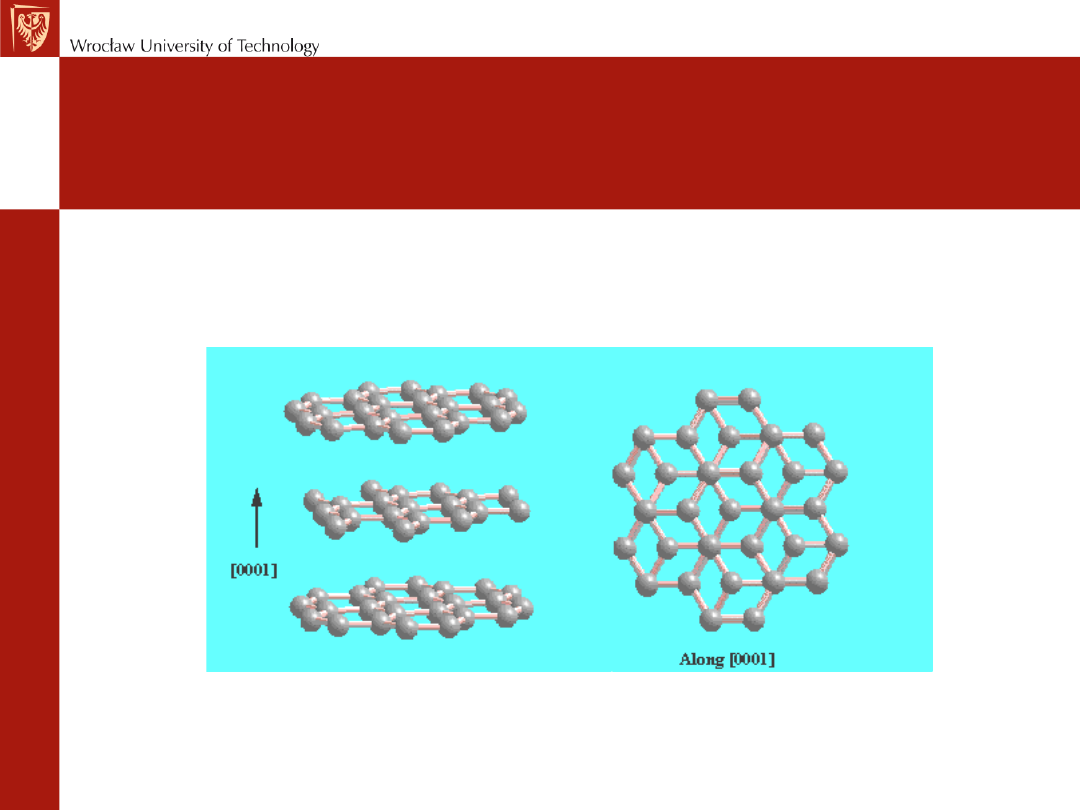
Odmiany węgla - grafit:
•
�
Układ płaskich pierścieni
heksagonalnych połączonych
wiązaniami kowalencyjnymi;�
W płaszczyźnie hybrydyzacja sp
2
stąd są jeszcze niesparowane,
swobodne elektrony -materiał jest
przewodnikiem elektrycznym;
Odległość pomiędzy
płaszczyznami ok. 0,3 nm, tj. 2,5
razy więcej niż długość wiązań w
pierścieniu węglowym, stąd mała
gęstość grafitu 2,25 g/cm3;
Pomiędzy płaszczyznami słabe
oddziaływanie typu vander
Waalsa, stąd kryształ jest typu
„soft”

Odmiany węgla - fuleren:
Nazwa pochodzi od
nazwiska architekta
amerykańskiegoRicharda
BuckminsteraFullera, który
stosował w budownictwie
bryły ograniczone
pięciokątami i
sześciokątami, wcześniej
niż odkryto takie struktury
węglowe;
Każda cząsteczka
zawiera parzystą liczbę
atomów węgla i jego
struktura składa się z 12
pierścieni pięciokątnych i
„m” sześciokątnych:
m= (n-20)/2;

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
Wyklad 2 Zaoczni
PrawoUpadłościoweINaprawcze Wykład zaoczne całość 2012
pp program wykladu zaoczne 03, wisisz, wydzial informatyki, studia zaoczne inzynierskie, podstawy pr
Wyklad 6 Zaoczni
wykład 3 zaoczne
wyklady 1-3 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklad 6 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklady 4-5 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklady 7-8 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
wyklad 9 zaoczne, Administracja UŁ, Administracja I rok, Zasady tworzenia i stosowania prawa
Wyklad 3 Zaoczni
Ekonomia społeczna Wyklady zaoczne
controlling wyklad zaoczne
kryminologia wykladydadak zaoczni
Wyklad 4 5 Zaoczni
więcej podobnych podstron