
Wskaźniki kwasowo-
zasadowe
to związki, które w zależności od odczynu roztworu
zmieniają barwę.

Wskaźniki
Wskaźniki są to przeważnie słabe kwasy lub zasady
organiczne, których cząsteczka w postaci
niezdysocjowanej ma inne zabarwienie niż
powstający w wyniku dysocjacji produkt
są ogólnie słabymi kwasami lub słabymi zasadami
organicznymi. Zmiana barwy wskaźnika ze zmianą
pH roztworu nie jest ostra, lecz następuje w
zakresie jednej lub dwóch jednostek pH. Wynika to
z istnienia równowagi chemicznej między dwiema
różnie zabarwionymi postaciami wskaźnika. Na
przykład wskaźnik będący słabym kwasem o
ogólnym wzorze HIn w zależności od środowiska
będzie miał postać kwasową lub zasadową.
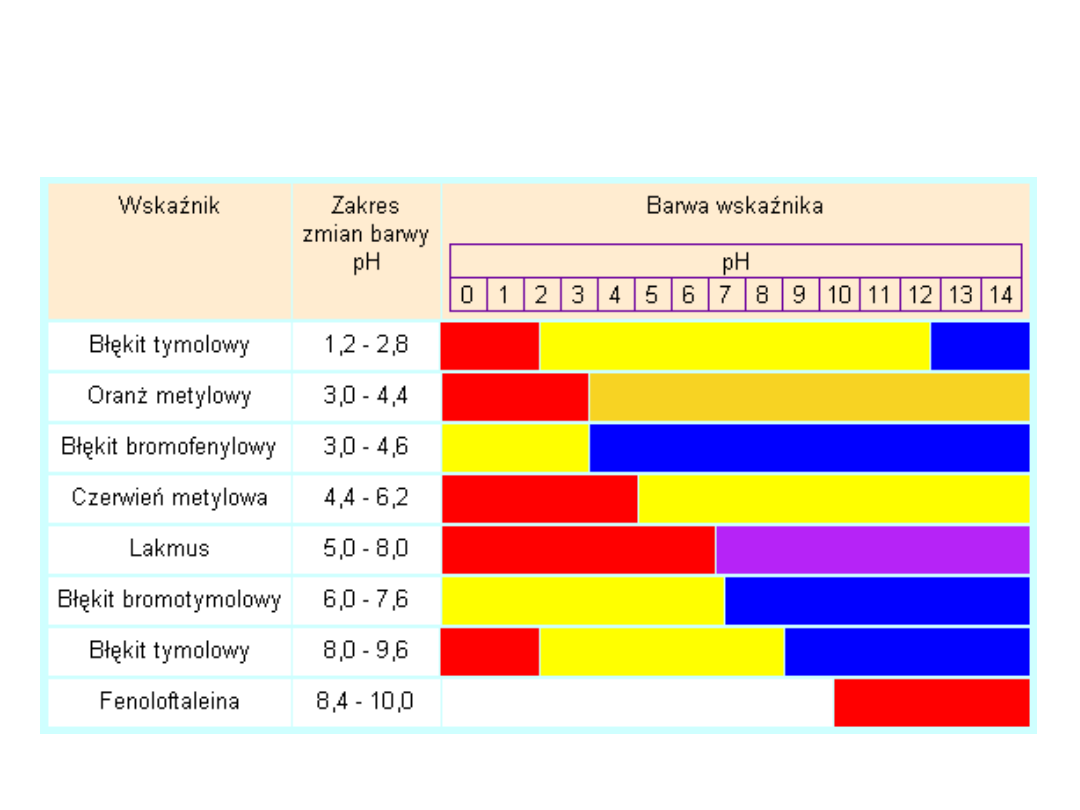
Przykłady kilku indykatorów oraz
odpowiadające im zakresy zmiany
zabarwienia.

Błękit tymolowy
to chemiczny wskaźnik pH, który przybiera barwę
od czerwonej do żółtej w zakresie pH 1,2 - 2,8 i od
żółtej do niebieskiej w zakresie pH 8,0 - 9,6. Dwa
zakresy zmiany barwy tego wskaźnika związane
są z dwoma etapami jego dysocjacji.

Oranż metylowy
postać niezdysocjowana ma kolor czerwony, a postać
zdysocjowana żółty:
HR
H
+
+ R
-
W środowisku kwaśnym równowaga będzie przesunięta
w lewo i roztwór zabarwi się na czerwono. W
środowisku zasadowym równowaga przesunie się w
kierunku odwrotnym – w kierunku żółtego zabarwienia

Błękit bromofenylowy
Poniżej pH 3,0 ma barwę żółtą, zaś powyżej
wartości 4,6 staje się niebiesko-fioletowy. Barwnik
ten jest stosowany w alkacymetrii, a także jako
marker do kontroli procesu elektroforezy żelowej
z użyciem agaru oraz poliakrylamidów

Czerwień metylowa
W temperaturze pokojowej jest to ciemnoczerwone,
krystaliczne ciało stałe.Zmienia barwę od
ciemnoczerwonej do jasnożółtej w zakresie pH od 4,2
do 6,3. Czerwień metylowa, podobnie jak oranż
metylowy jest stosowana w alkacymetrii. Oprócz tego
stosuje się ją w mikrobiologii do detekcji zmiany pH
zachodzącej w czasie fermentacji glukozy.

Lakmus
Postać kwasowa HIn lakmusu ma zabarwienie
czerwone, a postać niebieska opisana wzorem In
-
ma zabarwienie niebieskie. Działanie wskaźnika
jest następujące;
w roztworach kwaśnych, w których stężenie [H
+
] jest
duże, równowaga przesuwa się w lewo, wskaźnik
przybiera postać kwasową (zabarwienie wskaźnika
jest czerwone)
w roztworach zasadowych, o małym stężeniu [H
+
],
równowaga jest przesunięta w prawo, a wskaźnik
przechodzi niemal całkowicie w postać zasadową
(zabarwienie wskaźnika jest niebieskie).

Błękit bromotymolowy
Czerwony proszek, rozpuszczalny w alkoholu
etylowym, słabo rozpuszczalny w wodzie, który
przybiera w środowisku kwaśnym barwę żółtą, w
zasadowym błękitną, a w środowisku obojętnym
zieloną. Zakres zmiany barwy pH 6,2–7,6.
Powstaje w wyniku bromowania błękitu
tymolowego w środowisku kwasu octowego

Błękit tymolowy
przybiera barwę od czerwonej do żółtej w zakresie
pH 1,2 - 2,8 i od żółtej do niebieskiej w zakresie
pH 8,0 - 9,6. Dwa zakresy zmiany barwy tego
wskaźnika związane są z dwoma etapami jego
dysocjacji.

Fenoloftaleina
zmienia formę z bezbarwnej w środowisku kwaśnym
lub obojętnym na malinowoczerwoną w
środowisku zasadowym. Służy głównie do
miareczkowania roztworów o odczynie
zasadowym. Jest też stosowana przy produkcji tzw.
papierków uniwersalnych. Zakres pH zmiany
barwy: 8,3 – 10,0. W skrajnych wartościach pH
zachodzą dodatkowe zmiany barwy: w roztworach
silnie kwaśnych (pH<0) fenoloftaleina przybiera
kolor pomarańczowy wskutek przejścia w formę
karbokationu trytylowego, natomiast w środowisku
silnie zasadowym (pH>12) staje się bezbarwna

Fenoloftaleina

Ciekawostki
Najczęściej spotykanymi w naszym otoczeniu
wskaźnikami są: esencja herbaciana, wywar z
czerwonej kapusty, wywar z czerwonych buraków czy
sok z czarnych jagód.
Na przykład fioletowe zabarwienie wywaru z czerwonej
kapusty zmienia się na różowe w obecności kwasu.
Fenoloftaleina w lecznictwie stosowana niekiedy jako
środek przeczyszczający. Stosowana także w produkcji
znikających tuszy. Tu zmieszana jest z wodorotlenkiem
sodu (NaOH), który reaguje w powietrzu z
dwutlenkiem węgla, tworząc węglan sodu (Na2CO3).
Zmiana pH powoduje zanik zabarwienia.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
1ta - wskaźniki kwasowo-zasadowe, dydaktyka, konspekty
Wskaźniki kwasowo zasadowe 2
WYZNACZANIE STAŁEJ DYSOCJACJI WSKAŹNIKA KWASOWO-ZASADOWEGO METODĄ ABSORPCJOMETRYCZNĄ, NAUKA, WIEDZA
Wyznaczanie stałej dysocjacji wskaźnika kwasowo zasadowego metodą?sorpcjometryczną
Wyznaczanie stałej dysocjacji wskaźnika kwasowo-zasadowego, Wyznaczanie stałej dysocjacji wskaźnika
Wyznaczanie stałej dysocjacji wskaźnika kwasowo zasadowego
Wyznaczanie stałej dysocjacji wskaźnika kwasowo zasadowego metodą?sorpcjometryczną
Wskaźniki kwasowo zasadowe 2
Równowaga kwasowo zasadowa fizjot3
Rˇwnowaga kwasowo zasadowa
Równowaga kwasowo zasadowa fizjot3
Mechanizm wodno elektrolitowy i kwasowo zasadowy
Fizjologia kolo RKZ, II rok, II rok CM UMK, Giełdy, od Joe, FIZJOLOGIA, KOLOKWIA, RÓWNOWAGA KWASOWO-
woda jako składnik żywności oraz równowagi kwasowo- zasadowe w żywności, żywienie człowieka i ocena
01 rownowaga kwasowo zasadowa
SPEKTROFOTOMETRYCZNE?DANIE RÓWNOWAG KWASOWO ZASADOWYCH W ROZTWORACH WODNYCH sprawozdanie równowag
więcej podobnych podstron