
1
PEPTYDY
BIOLOGICZNIE CZYNNE
Aleksander Kołodziejczyk
Gdańsk 2013
2
Peptydy należą do bardzo rozpowszechnione związków w
przyrodzie; pośród nich są:
hormony
,
regulatory
, antybiotyki,
toksyny
,
glikopeptydy
,
lipopeptydy
, substancje sygnałowe.
Przykłady peptydów naturalnych
Glutation -
GSH
COOH
CH
2
SH
H
2
N-CH-CH
2
CH
2
CO-NH-CH-CO-NH-CH
2
COOH
Glu
Cys
Gly
-Glu-Cys-Gly
Biosynteza
Glu
+
Cys
ATP
enzym
-Glu-Cys
GSH
Gly, ATP
enzym
Występuje we wszystkich komórkach zwierząt
wyższych i u wielu mikroorganizmów. Znane są jego
naturalne analogi, w których zamiast
Glu
występuje
Asp
lub
pGlu
.
GSH
2
[O]
[H]
GSSG
+ HOH
Jest składnikiem koenzymów:
hydrolazy acyloglutationowej
,
dehydrogenazy foraldehydowej
, tautomerazy
indolilopirogronowej i innych ciał czynnych.
pozyskiwany
jest z drożdży
bierze udział
w reakcjach redoks
3
Tyreoliberyna, uwalnia
tyreotropinę
.
pGlu
-
His
-
ProNH
2
Jeden z
syntetycznych analogów TRF
jest
aktywniejszy od
hormonu natywnego
.
[1-Me-His
2
]TRF
TRF
- Thyreotropin Releasing Factor
N
O
O
NH
CH
2
N
N
CH
3
H
N
CONH
2
O
C
C
C
pGlu
1-Me-His
Pro-NH
2
Peptydy opioidowe – ich nazwa wywodzi się od opium.
Z produktów naturalnych wyizolowano kilkanaście peptydów
opioidowych, a syntetycznie otrzymano kilka tysięcy ich analogów.
Poszukuje się peptydu opioidowego odziałaniu przeciwbólowym,
ale pozbawionego niekorzystnych cech
morfiny
. Zsyntezowano
peptydy opioidowe znacznie aktywniejsze od
morfiny
w działaniu
przeciwbólowym, ale one też wykazują
właściwości narkotyczne
,
uszkadzają organy wewnętrzne,
działają szkodliwie na układ
oddechowy i krążenia
.

4
Enkefaliny, są to pentapeptydy, początkowo odkryte w mózgu, stąd
ich nazwa (gr. enkephalos = mózg), później okazało się, że występują
prawie we wszystkich tkankach.
Tyr-Gly-Gly-Phe-
Leu
Leu-
enkefalina
Tyr-Gly-Gly-Phe-
Met
Met-enkefalina
Prekursorem
enkefalin
jest białko –
proenkefalina A
– zawierające
271 reszt AA,
w tym 6 sekwencji
Met-enkefaliny
i 1 sekwencje
Leu-enkefaliny
.
Peptydy opioidowe oddziałują z tymi samymi receptorami co
morfina
: i.
Aktywność opiatów i opioidów sprawdza się za pomocą testów, np.
dawniej
gorącej płytki
czy
cofania szczurzego ogona
, a obecnie
in vitro:
GPI
– jelita skrętnego świnki morskiej (quina pig ileum)
MVD
– nasieniowodu myszy (mouse vas deferens)
HVD
– nasieniowodu chomika
RVD
– nasieniowodu szczura

5
Enkefaliny jak większość peptydów szybko ulega
enzymatycznej
hydrolizie
tracąc aktywność. Zwiększoną odporność enkefalin na
biodegradację uzyskano poprzez:
- zastąpienie
L-AA
aminokwasami
D-AA
,
- modyfikację C-końca –
amidowanie
,
redukcja
-COOH,
- modyfikację N-końca –
N-alkilowanie
,
N-acylowanie
,
- wprowadzenie
wiązań izosterycznych
czy
cyklizację
.
Tyr-
D
-Ala-Gly-Phe-Leu
[
D
-Ala
2
]-Leu-enkefalina
[
D
-Ala
2
,
D
-Leu
5
]-Leu-enkefalina
Tyr-
D
-Ser-Gly-Phe-Leu-Thr
Tyr-
D
-Ala-Gly-N-MePhe-Gly-ol
Enkefaliny modyfikowane:
6
Tabela Aktywność przeciwbólowa i selektywność
morfiny
i opioidów
Analgetyk
IC
50
(nM)
Selektyw-
ność
(/)
MVD/GPI
GPI
MVD
Morfina
70
390
5,6
Met-enkefalina
157
15
0,1
Leu-enkafelina
246
11
0,05
-endorfina
67
82
1,2
Dermorfina
3
29
9
Dynorfina A(1-13)
231
162
0,1
[-Ala]-Met-enkefalina
>150
0
>300
0
>2
[Ala
1
]-dynorfina A(1-13)
750
25
500
34
Tyr-Ala-Gly-
NHCH(CH
3
)CH
2
CH(CH
3
)
2
>5.10
4
>5.10
4
~1
Na podstawie aktywności w testach
GPI
i
MVG
można oszacować
względną selektywność preparatu wobec receptorów i
Tyr-
D
-Met-Gly-MePhe-ol
(syndyphalin)
>10
5
7
Morfina
i enkefaliny są zupełnie różnymi związkami; różnią się
składem i kształtem.
Morfina
jest sztywnym policyklicznym
związkiem, a cząsteczki enkefalin są elastyczne, a to pozwala im
przyjmować różne kształty, w tym zbliżone do pewnych fragmentów
morfiny
. W
morfinie
i w enkefalinach występuje podobny
strukturalnie fragment przypominający
tyraminę
– endogenną
aminę.
O
H
CH
2
CH
2
NH
2
tyramina
N CH
3
O
H
CH
2
CH
O
H
O
morfina
enkefalina
nalokson
N CH
2
-CH=CH
2
O
H
CH
2
CH
O
O
O
H
CH
2
CH
NH
2
Gly-Gly-Phe-Leu
O C
Tyr
(Met)

8
Endorfiny – endogenne morfiny
Znane są, , i endorfiny; różnią się one długością łańcucha
peptydowego (około 30 AA) i nieznacznie składem AA.
-endorfina
człowieka
1 5 10
15
Thr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys-Ser-Gln-Thr-Pro-Leu-
Val-
20 25
30
-
Thr- Leu-Phe-Lys-Asn-Ala-Ile-Ile-Lys-Asn-Ala-Tyr-Lys-Lys-
Gly-Glu
Endorfiny występują w wielu tkankach, np. w mózgu, płynie
mózgowo-rdzeniowym, nerkach, we krwi, w żołądku, jelitach, a
nawet w łożysku.
Wysiłek fizyczny, zadowolenie z osiągniętego sukcesu akupunktura i
stres wywołują wydzielanie się endorfin. Przyjmowanie
egzogennnych endorfin prowadzi do uzależnienia.
Inne peptydy opioidowe:
dynorfiny
, kazomorfiny,
dermorfiny
.

9
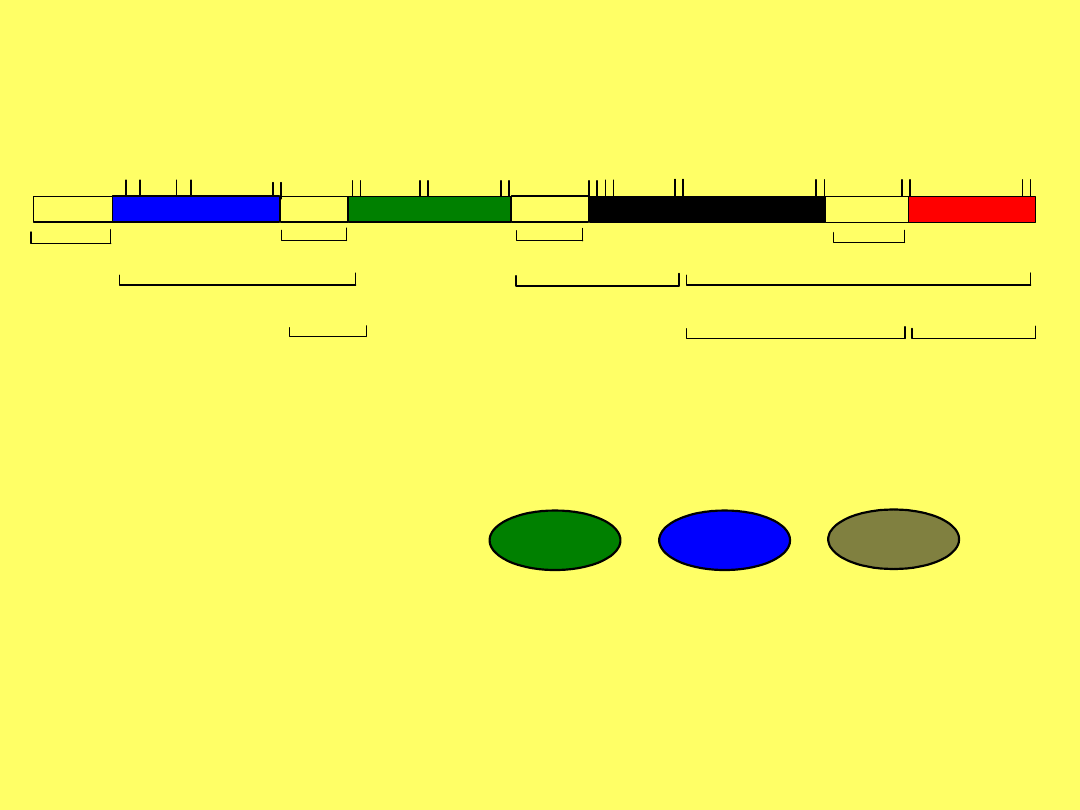
Adrenokortykotropina – ACTH, (
kortykotropina
), 39-peptyd,
wykryty w latach 50. XX w., pierwsza syntezę przeprowadzono w
1963 r.
Hormon produkowany przez przedni płat przysadki mózgowej, działa
w nadnerczach, gdzie stymuluje wytwarzanie kortykosterydów
1 5 10
15
Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-
Gly-Lys-
20 25
30
-Lys-Arg-Arg-Pro-Val-Lys-Val-Tyr-Pro-Asn-Gly-Ala-Glu-Asp-
Glu-
35 39
-Ser-Ala- -Glu-Ala-Phe-Pro-Leu-Glu-Phe
ACTH
ludzkie
W
ACTH
różnych ssaków obserwuje się niewielkie różnice w
składzie AA. N-końcowy fragment 1-24 zachowuje pełną aktywność
biologiczną.
AA 5-10 stanowią
miejsce aktywne hormonu
11-18 miejsce
wiążące z receptorem
11-24
adres
25-39 specyficzność
gatunkowa
Syntetyczne analogi ACTH (głównie 1-24), produkowane od 1967
r., są stosowane klinicznie do leczenia alergii, zapalenia stawów i
innych organów, stymulowania przysadki, w onkologii, hematologii,
endokrynologii, dermatologii ...
10
Prekursorem
ACTH
jest glikoproteina -
proopiomelanokortyna
.
Z niej powstają także melanotropiny, lipotropiny oraz peptydy
opioidowe.
C C
C C
R-K
R-R
K-R
K-R
K-K R-R
K-R
K-K
K-R
K-K
1 20 40 60 80 100 120 140 160 180 200 220 240 260
ACTH
-MSH
-MSH
-MSH
peptyd
sygnałowy
peptyd N-terminalny
3
-MSH
-LPH
-LPH
-endorfina
Melanotropina –
MSH
Przysadka mózgowa
wytwarza
trzy melanotropiny:
Stymulują one syntezę
melaniny
i regulują dystrybucję tego
barwnika w skórze. Poziom
MSH
regulują
melanoliberyna
i
melanostatyna
.
Żaby i jaszczurki pod wpływem MSH dostosowują swoje
zabarwienie do koloru otoczenia. Syntetyczny analog
[Nle
4
,D-
Phe
7
]-MSH
jest znacznie aktywniejszy i działa dłużej niż peptyd
natywny.
(13 AA)
(18 AA)
(12 AA)
1 10
Ac-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-NH
2
-MSH

11
Oksytocyna i
wazopresyna
9-peptydy wytwarzane w podwzgórzu i magazynowane w
przysadce; należą do
neuropeptydów
, czyli hormonów
peptydowych wydziela-nych przez tkankę nerwową. Nazywane są
też a hormonami tylnego płata przysadki mózgowej.
Są znane również
hormony tkankowe
, wytwarzane przez tkanki
pełniące inne funkcje (np. w żołądku wydzielana jest
gastryna
) i
hormony gruczołowe
(wydzielane przez specjalne gruczoły
dokrewne, np. androgeny, estrogeny czy kortykosteroidy)
Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH
2
oksytocyna
1 2 3 4 5 6 7 8 9
Cys-Tyr-Phe-Gln-Asn-Cys-Pro-Arg-Gly-NH
2
wazopresyna
1 2 3 4 5 6 7 8 9
OT
Oksytocyna
i
wazopresyna
są cyklicznymi nonapeptydami.
AVP
ludzka i wołowa

12
Oksytocyna
wywołuje skurcze mięśni gładkich ciężarnej macicy –
aktywność oksytotyczna
,
wraz z
prolatyną
stymuluje laktację –
aktywność laktacyjna
.
Wpływa na zespół zachowań macierzyńskich
- ZZM
.
Podana dziewiczym samicom szczura wywołuje
ZZM
u >40% samic;
podana dziewiczym samicom szczura wraz z estrogenami wywołała
ZZM
w >80% przypadków.
Jest odpowiedzialna za
aktywność socjalną
.
Wazopresyna
reguluje stężenia moczu, jest to
aktywność
antydiuretyczna
.
Zagęszcza promocz
do dziesięciu razy.
Nazywana jest też
antydiuretyną
(
hormonem antydiuretycznym
).
Brak lub małe stężenie
AVP
wywołuje moczówkę prostą.
AVP
wpływa na zwiększenie ciśnienia tętniczego krwi jest to
aktywność presyjna
. Stymuluje także proces zapamiętywania i
uczenia się.

13
Zbliżona budowa
OT
i
VP
są odpowiedzialne
za resztkową hormonalną aktywność obu
peptydów
Peptyd
Aktywność [jednostki międzynarodowe IU]
oksytotyczn
a
laktacyjna
antydiu-
retyczna
presyjna
OT
520
475
4
4
AVP
14
70
323
369
[Thr
4
]OT
923
543
0,9
0,5
[Phe
2
,Orn
8
]OT
~1
7
0,6
124
dVDAVP
~8
-
1230
antagonist
a
dDAVP
-
3
1200
0,4
14
Otrzymywanie oksytocyny
Oksytocynę wytwarza się syntetycznie metodą SPPS.
Z-Cys(Bzl)-Tyr(Bzl)-Ile-Gln-Asn-Cys(Bzl)-Pro-Leu-Gly-
P
NH
3
/MeOH
Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH
2
[O]
Cys-Tyr-Ile-Gln-Asn-Cys-Pro-Leu-Gly-NH
2
Z-Cys(Bzl)-Tyr(Bzl)-Ile-Gln-Asn-Cys(Bzl)-Pro-Leu-Gly-NH
2
Na/NH
3
liq
Znana jest również synteza enzymatyczna
OT
Boc-Cys(Acm)-Tyr-Ile-Gln-Asn-Cys(Acm)-Pro-Leu-Gly-NH
2
CT: chymotrypsyna; CP: chymopapaina; P: papaina; Y:
karboksypeptydaza;
PPSE: postprolinowa specyficzna endoproteaza
P CT Y CP CP
P PPSE Y

15
Insulina
51-peptyd wytwarzany w trzustce należy do jednych z najlepiej
znanych peptydów, ponieważ jest powszechnych lekiem dla
diabetyków. Zaliczana jest czasami do białek, ponieważ tworzy
dimery, a nawet heksamery zawierające ponad 100 reszt AA.
Została odkryta w 1921 r. a jej odkrywcy otrzymali nagrodę Nobla
już w 1923 r.
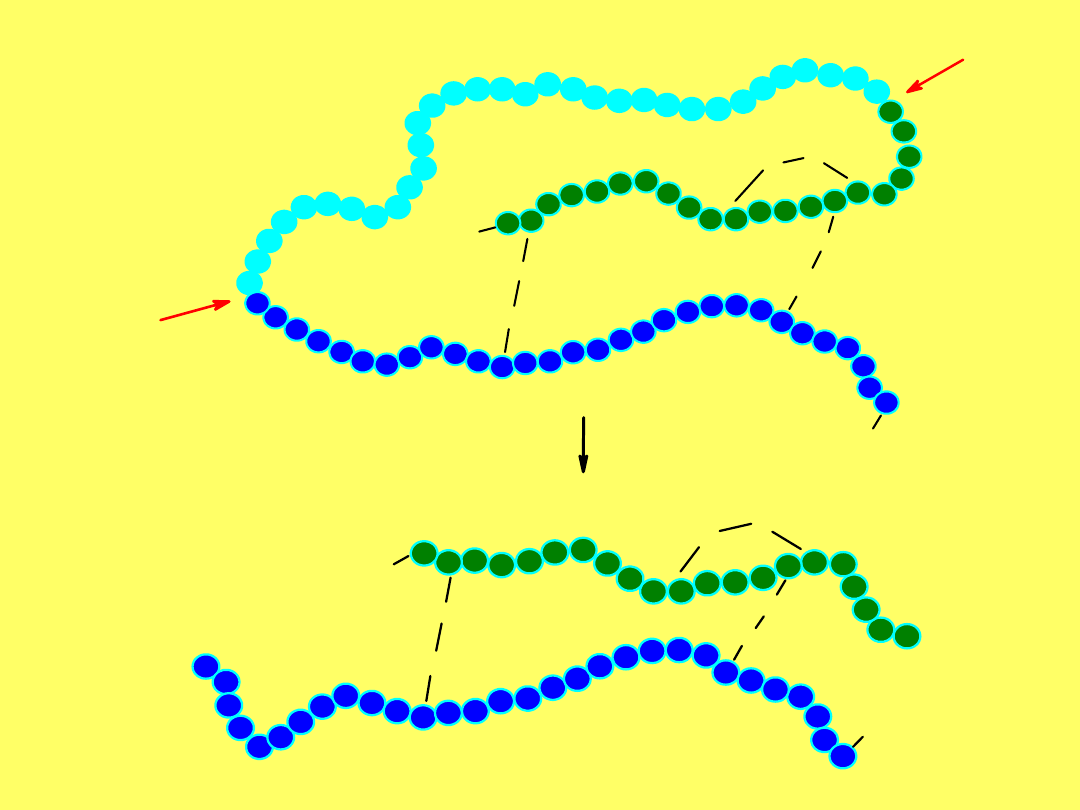
Insulina
zbudowana jest z dwóch łańcuchów: A, w
którym jest 21 reszt AA i B, zawierającym 30 reszt. Oba łańcuchy
połączone są dwoma mostkami disilfidowymi, a ponadto w łańcuchu
A znajduje się trzeci mostek disulfidowy.
Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg
22
Gly
30 29 28 27 26 25 24
Phe
23
Tyr
Phe
Thr
Pro
Lys
Thr
S-S
S-S
S
S
A
B

16
Insulina jest lekiem ratującym życie diabetykom. Przez
dziesiątki lat w terapii stosowano
insulinę
izolowaną z trzustek
zwierząt rzeźnych – wołową i wieprzową. Z 1 kg trzustek wołowych
otrzymuje się około 2000 IU
insuliny
, a jednorazowa dawka
lecznicza wynosi kilkaset IU.
Insulina
wieprzowa i wołowa wykazują aktywność biologiczną
prawie identyczną z HI, jednak po długotrwałym stosowaniu mogą,
jako obce białka, wywoływać reakcje alergiczne, nawet groźne dla
życia.
1 mg insuliny = 24 IU
Chemiczna synteza HI jest ekonomicznie nieopłacalna, nie można jej
również ze względów oczywistych pozyskiwać z materiału ludzkiego.
W latach 80. XX w. rozpoczęto produkcję HI dzięki inżynierii
genetycznej wykorzystując bakterie E. coli zawierające gen
odpowiedzialny za wytwarzanie tego hormonu.
Produkcję prowadzi się dwoma sposobami:
a. wytwarzanie
proinsuliny
i jej hydrolizę do
insuliny
b. osobną syntezę obu łańcuchów i utlenianie ich do HI
17
S
S
S
S
S
S
OOC
H
3
N
5
10
15
20
25
30
5
10
15
20
5
10
10
15
20
25
-
+
33
proinsulina
84 AA
S
S
S
S
S
NH
3
OOC
S
5
5
10
15
20
10
15
20
25
-
+
insulina
51 AA

18
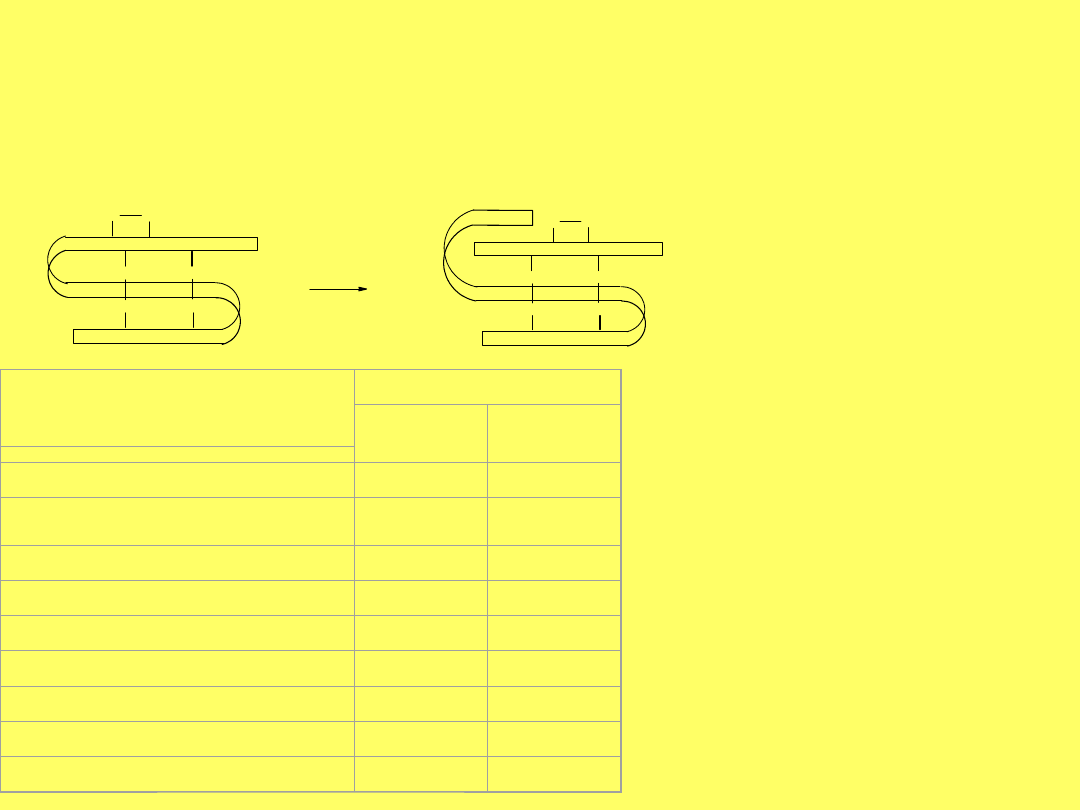
W drugiej metodzie łączenie obu łańcuchów
A
i
B
tak, żeby powstała
insulina
początkowo napotykało na ogromne trudności. Utlenianie
obu łańcuchów prowadzi do powstania wielu produktów:
monomerów, oligomerów liniowych i cyklicznych, w tym tylko 1-
2% właściwej HI.
Powstają 4 monomery:
3 A
i
1 B
; dimerów jest więcej:
57 A
2
,
2 B
2
,
12 AB
; tworzy się ~ 3000 trimerów:
A
3
,
B
3
,
A
2
B
,
AB
2
;
ponadto tetramery i wyższe oligomery.
SH SH
SH
SH
SH
SH
A
B
[O]
S S
S
S
[O]
S S
S
S
+
S
S
S
S
+
AA
S
S
BB
[O]
S S
S
S
S
S
HI
S
S
S
S
S
S
+
S
S
S
S
S
S
+
S
S
S
S
S
S
+
S S
S
S
S
S
+
S
S
S
S
S
S
+
+

19
O
3
SS
SSO
3
S
S
O
3
SS
O
3
SS
SO
3
30
B
Phe
1
2
3
4
5
6
7
8
9
10
11
12
14
15
17
28
13
16
Cys
24
23
18
19
20
21
22
25
27
29
26
Phe
Val
Asn
Gln
His
His
Leu
Gly
Gly
Gly
Ser
Leu
Leu
Leu
Val
Val
Glu
Glu
Ala
Tyr
Tyr
Cys
Arg
Phe
Thr
Pro
Lys
Thr
1
A
Gly
Ile
Val
Glu
Gln
Cys
Cys
Cys
Thr Ser
Ile
Ser
Leu
Tyr
Gln
Leu Glu Asn
Tyr
Cys
Asn
13
16
2
3
4
5
6
7
8
9
10
11
12
14
15
17
18
19
20
21
-
O
3
S
-
-
-
-
-
+
DTT
DTT – odczynnik Clelanda
S
H
O
H
OH
SH
butano-2,3-diol-1,4-ditiol
HI 50%
S S
S
S
1
A
Gly
Ile
Val
Glu
Gln
Cys
Cys
Cys
Thr Ser
Ile
Ser
Leu
Tyr
Gln
Leu
Glu
Asn
Tyr
Cys
Asn
13
16
2
3
4
5
6
7
8
9
10
11
12
14
15
17
18
19
20
21
S
S
B
Phe
1
2
3
4
5
6
7
8
9
10
11
12
14
15
17
28
13
16
Cys
24
23
18
19
20
21
22
25
27
26
Phe
Val
Asn
Gln
His
His
Leu
Gly
Gly
Gly
Ser
Leu
Leu
Leu
Val
Val
Glu
Glu
Ala
Tyr
Tyr
Cys
Arg
Phe
Thr
Pro
Lys
Thr
30
29
20
Znana jest także mikrobiologiczno-chemiczna metoda otrzymywania
HI.
Są drożdże wytwarzające peptyd zbliżony budową do HI, tzw
des(B30)
, znany jako
insulina jednołańcuchowa
. Ma ona mostki
disulfidowe w tych samych miejscach co HI, brakuje jej jednak
Thr
30
.
des(B30)
przekształca się w HI w reakcji transpeptydacji za
pomocą
trypsyny
w obecności estru
Thr
.
S
S
S
S
S
S
Lys-Gly
Asn
Phe
S
S
S
S
S
S
Gly
Asn
Phe
Lys-Thr-OR
Thr-OR
T
Proces
Zawartość
białka
drożdży
[ppm]
SCI lub
HI
[%]
(HPLC)
Fermentacja
drożdżowa
Odwirowanie
komórek
drożdżowych
Oczyszczanie
na
jonitach
>15
000
90
Krystalizacja
<10
97
Transpeptydacja
do
estru HI
Filtracja
żelowa,
oddzielenie
Oczyszczanie
na
jonitach
Usuwanie
osłony
estrowej
Preparatywna HPLC
<1
>99,5
Insulina
do celów
farmakologicznych musi
być dokładnie oczyszczona
Insulina
jednoskładnikowa
–
jeden pik w HPLC

21
Od końca XX w.
insulinę
zaczęto wykorzystywać do dopingu.
Pomaga ona zwiększać masę mięśni, działa synergicznie ze
sterydami anabolicznymi i
hormonem wzrostu
. Podana wraz z
glukozą
bezpośrednio przed zawodami
zwiększa wydolność
zawodnika
, ponieważ zwielokrotnia szybkość spalania glukozy.
Egzogenna insulina jest
trudna do wykrycia
, gdyż trudno ją
odróżnić od endogennej, a ponadto połowiczny czas rozpadu
insuliny
wynosi tylko kilka minut.
Insulina
jest nie tylko
nielegalnym anabolikiem
, ale i
substancją
niezwykle groźną dla zdrowia i życia
.
Niszczy system
immunologiczny
, degeneruje organy wewnętrzne,
wywołuje
bezpłodność
, a przedawkowanie prowadzi do
śpiączki
i
zgonu
.

22
Tuftsyna, jest to tetrapeptyd –
Thr-Lys-Pro-Arg
– o
właściwościach immuno-regulacyjnych, antybakteryjnych,
antywirusowych i antykancerogennych, wyizolowany został z
krwi ssaków. Pomimo wielu prób i otrzymaniu dużej liczby analogów
nie znalazła zastosowania terapeutycznego; szybko ulega
biodegradacji.
Proktolina– peptydowy hormon owadzi –
Arg-Tyr-Leu-Pro-Thr
.
Działa jako
neurotransmiter
i
czynnik miotropowy
– wywołuje
skurcze odbytnicy, mięśni gładkich, szkieletowych, serca, jelit i
jajowodów. Prowadzono próby wykorzystania
proktoliny
do
zwalczania niepożądanych owadów.
Bombezynę I wyizolowana ze skóry żab europejskich rodzaju
Bombina.
pGlu-Gln-Arg-Leu-Gly-Asp-Gln-Trp-Ala-Val-Gly-His-Leu-Met-
NH
2
Obniża ciśnienie krwi, wywołuje skurcze mięśni gładkich, silnie
oddziałuje na central-ny układ nerwowy, zaburza działanie
mechanizmu utrzymującego stałą temperaturę ciała ssaków. 1 ng
wprowadzony do mózgu szczura przetrzymywanego w pomiesz-
czeniu o temp. 4
o
Cpowoduje obniżenie temperatury jego ciała do
5
o
C w ciągu 15 min.

23
Somatotropina
– STH,
hormon wzrostu
– GH
Ludzka STH zawiera 191 reszt AA, jest więc białkiem, jednak
zwykle omawia się ją razem z h. peptydowymi. Nazwa
somatotropina
pochodzi od tego, że oddziałuje na całe ciało –
działa anabolicznie.
Jej
synteza
zachodzi w przednim płacie przysadki mózgowej.
Stymuluje wzrost ciała (stąd
h. wzrostu
), wpływa głównie na
podłużny wzrost kości, co umożliwia rozrost tkanek miękkich.
Syntezę STH uruchamia
somatoliberyna
, a wstrzymuje
somatostatyna
.
Brak STH w okresie wzrostu prowadzi do
karłowatości
; zdarza się
kilkanaście przypadków na 1 mln urodzeń. Nadmiar STH w okresie
wzrostu prowadzi do
gigantyzmu
, a w wieku dorosłym wywołuje
akromegalię
– przerost kończyn, języka, nosa, podbródka i uszu.
Karłowatość
można leczyć
somatoliberyną
. W wielu przypadkach
trzeba jednak stosować STH. Za pomocą tego hormonu można
zwiększyć wzrost o 20 cm, a nawet więcej. Hormon należy podawać
od momentu wykrycia karłowatości do osiągnięcia wieku dorosłego.
Koszt kuracji –
tysiące euro miesięcznie
.
STH stosuje się też w przypadku zespołu Turnera, rzadkiego
schorzenia
dziewcząt wynikającego z braku u nich drugiego chromosomu X.
Podawanie takim dziewczynkom STH nie leczy, ale zmniejsza objawy
schorzenia poprzez przyspieszenie wzrostu pacjentek i zapewnia
zachowanie żeńskich proporcji ich ciała.
Nie leczy z bezpłodności

24
Chemiczna synteza STH jest nierealna, otrzymuje się nią z 1%
wydajnością i 2% aktywnością. Pozyskiwanie STH z ludzkich zwłok
jest mało wydajne i niebezpieczne ze zdrowotnego punktu widzenia.
STH innych ssaków jest nieaktywne dla ludzi.
STH jest pierwszym białkiem, którego produkcja została
uruchomiana dzięki inżynierii genetycznej.
STH jest szeroko stosowana w terapii, między innymi do leczenia
oparzeń,
niepłodności
,
dystrofii mięśniowej
,
rzeszotowienia
kości
,
odleżyn i złamań
, przewlekłej niewydolności nerek,
zaburzeń
okresu przekwitania
. Przedawkowanie STH prowadzi do
cukrzycy
i
nowotworów
.
Pod koniec XX w. STH zaczęto stosować jako środek dopingowy. Jest
również reklamowana jako cudowny eliksir młodości.
Wykorzystywanie STH w sporcie jest zakazane!
Ze względu na obecność endogennej STH wykrycie stosowania jej
jako dopingu było bardzo trudne. Początkowo domyślano się
wykorzystywania STH jako dopingu na podstawie wzmożonego
przemytu tego preparatu przed ważnymi zawodami. Obecnie można
wykryć endogenny STH w próbce krwi pobranej od zawodnika.

25
Toksyny
Wiele toksyn ma budowę peptydową. Zawierają one często AA
niebiałkowe, w
tym
D
-AA i
-rozgałęzione, co utrudnia ich biodegradację w
organizmie, a więc przeciwdziała szybkiej utracie aktywności.
Podobną rolę pełni cykliczna budowa toksycznych peptydów.
N
H
CH
3
OS
CH
2
R''
HC
N
H
OH
CO
CH
3
NH-CH-CO-NH-CH-CO-NH-CH
2
-CO
CO-CH-NH-CO-CH-NH-CO-CH
2
-N
H
2
C-COOR'''
NH
CH-CH-CH
2
-CH
3
CO
RCHR
CHCH
3
Amatoksyna
toksyczny peptyd
jadu
muchomora sromotnikowego
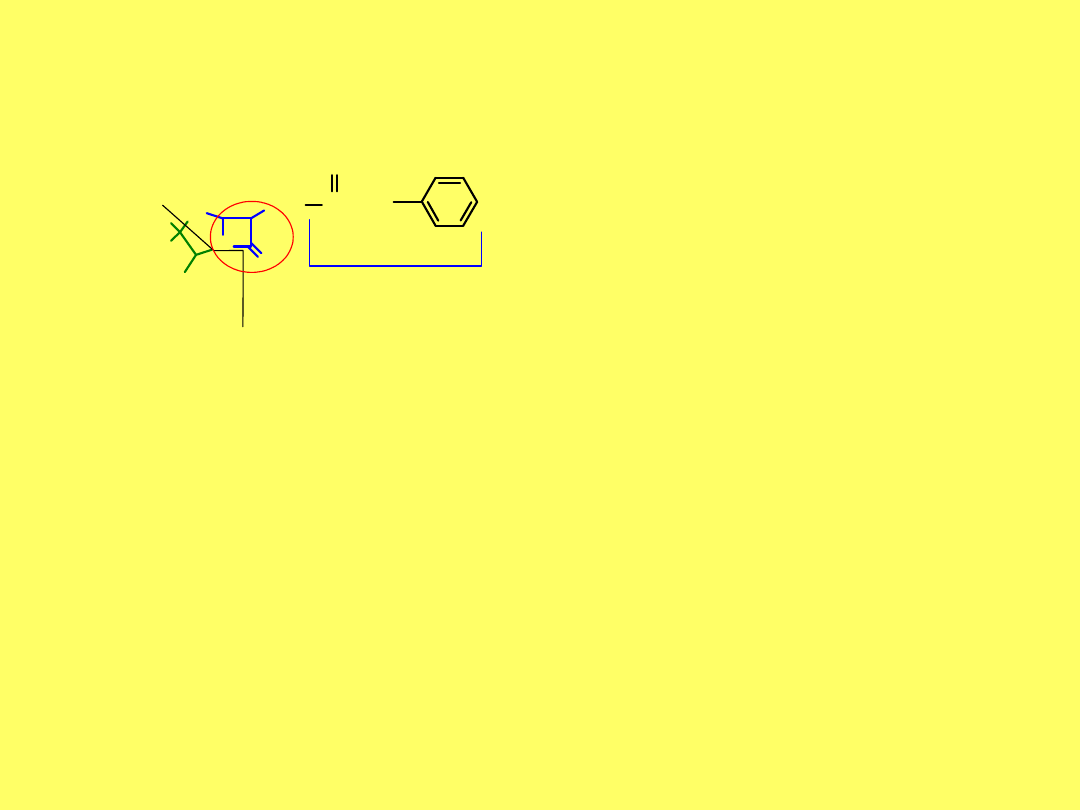
26
Antybiotyki peptydowe
Do antybiotyków peptydowych należą m.i. penicyliny i
cefalosporyny.
O
NH
N
S
C
H
3
C
H
3
HOOC
C-CH
2
O
Val
Cys
RCO-
benzylopenicylina
(
penicylina G
)
Wydzielana przez pleśń Penicilinum notatum
penicylina G
, odkryta
przez Fleminga w 1929 r. została w terapii zastosowana w 1942 r.
W 1945 r. Fleming oraz Florey i Chain otrzymali nagrodę
Nobla.
W 1998 r. czytelnicy Polityki uznali
penicylinę
za największe
odkrycie
XX w.
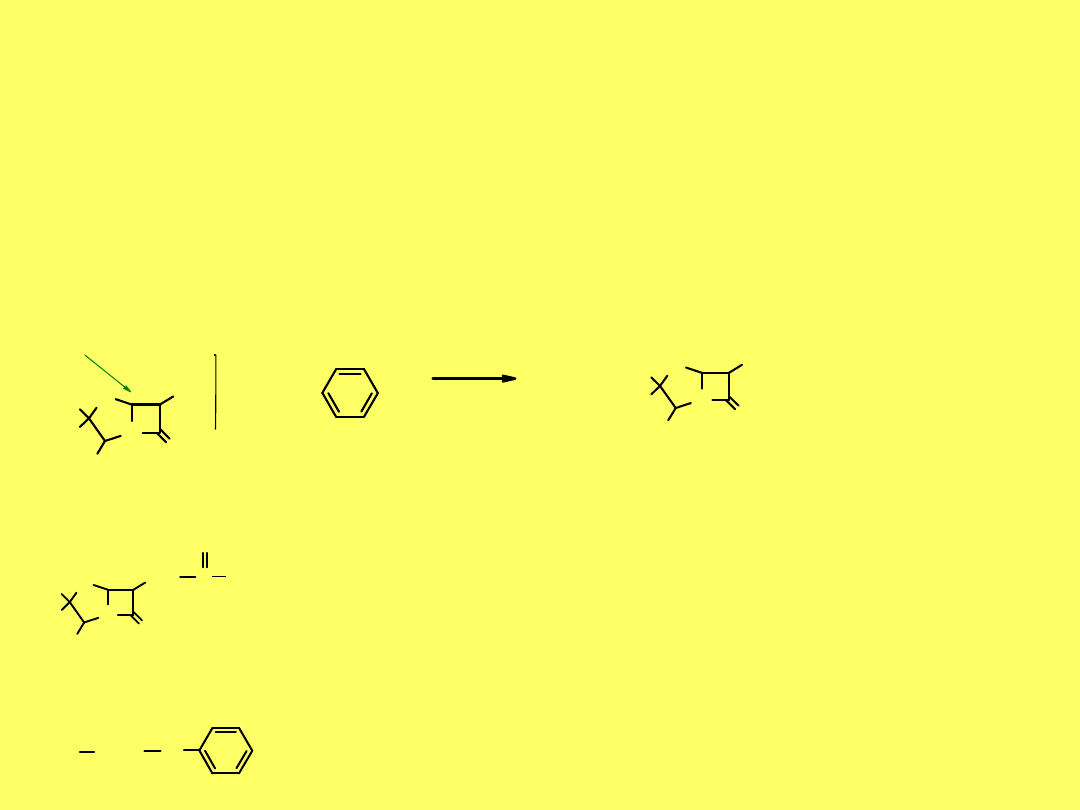
27
Penicylina G
przez dziesiątki lat była najczęściej stosowanym
antybiotykiem.
Później wprowadzono do terapii jej półsyntetyczne analogi,
odporniejsze
na działanie
-laktamazy; są one przyjmowane
doustnie
lub pod
innym względem
przewyższają związek
macierzysty.
Produkcja penicylin półsyntetycznych oparta jest na aminokwasie –
6-AP
(
kwasie 6-aminopenicylanowym
) otrzymywanym z
penicyliny G
w
reakcji
hydrolizy
, enzymatycznej lub chemicznej
O
NH-CO-CH
2
-
N
S
C
H
3
C
H
3
HOOC
hydroliza
enzymatyczna
lub chemiczna
O
NH
2
N
S
C
H
3
C
H
3
HOOC
penicylina G
kwas 6-aminopenicylanowy
6-AP
pierścień
tiazolidynowy
Kwas 6-AP można acylować dowolnym kwasem.
O
NH
N
S
C
H
3
C
H
3
HOOC
R
O
C
R
O
H
2
C
V-cylina
–
fenoksymetylopenicylina
, zawiera resztę
kwasu fenoksyoctowego, powstaje fermentacyjnie
po dodaniu
kwasu fenoksyoctowego
do brzeczki
fermentacyjnej
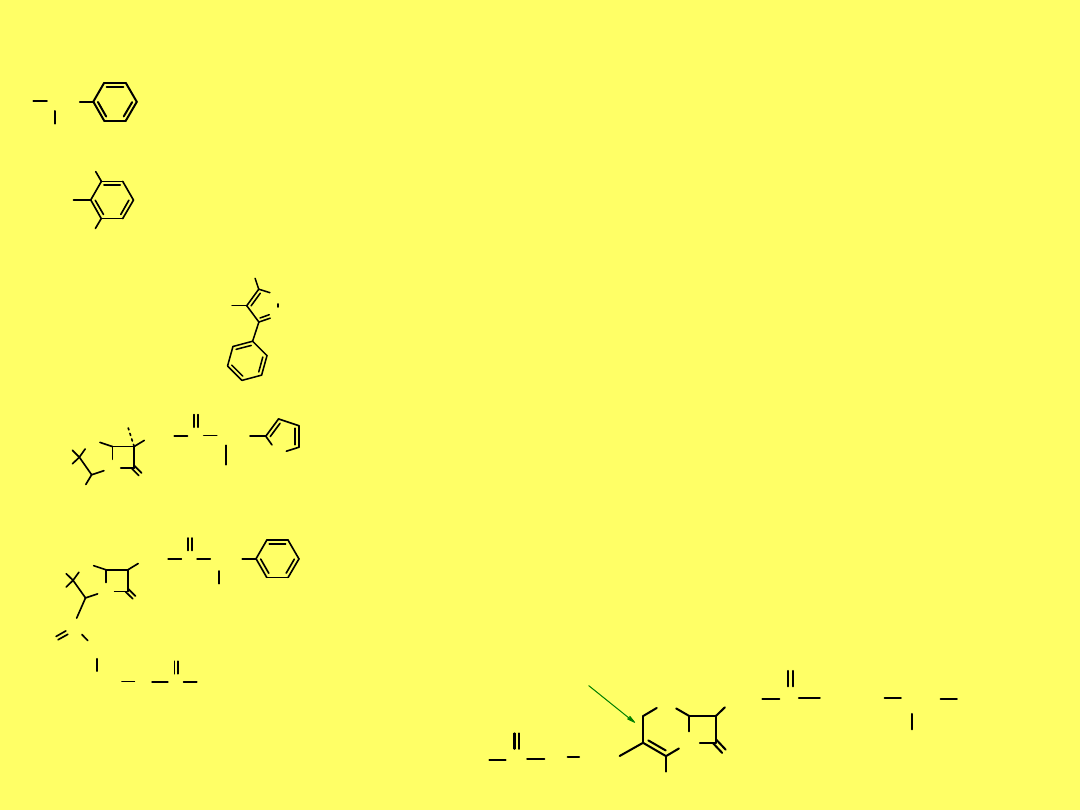
28
N
O
C
H
3
oksacylina
–
3-fenylo-5-metylo- 4-
izoksazolilopenicylina
,
reszta kwasu 3-fenylo-5-
metyloizoksazolokarboksylowego
O
NH
N
S
C
H
3
C
H
3
HOOC
MeO
O
CH
S
COOH
C
temocylina
– metoksypenicylina, bardzo
odporna na działanie -laktamaz
O
NH
N
S
C
H
3
C
H
3
O
O
O
O
O
C(CH
3
)
3
CH
NH
2
CH
2
C
C
C
piwampicylina
– wchłania się szybko i
prawie całkowicie z przewodu
pokarmowego
S
CH
2
N
O
NH
COOH
O
O
C
H
3
(CH
2
)
3
O
CH
NH
2
COOH
C
C
cefalosporyna C
pierścień
tetrahydrotiazynowy
penicyliny półsyntetyczne
ampicylina
–
aminofenylometylopenicylina
, reszta
fenyloglicyny.
MeO
MeO
metycylina
–
2,6-dimetoksyfenylopenicylina
reszta
kwasu
2,6-dimetoksybenzoesowego
CH
NH
2

29
Bacytracyny są wytwarzane przez Bacillus licheniformis
11-peptyd
Antybiotyk bardzo toksyczny dla ludzi; używany zewnętrznie, w
postaci kropel, maści lub proszku.
N
H
2
N
S
CH
3
-CH
2
-CH-CH
CO
H
C
H
3
H
H
bacytracyna A
Leu
D
-Glu Ile
Lys
D
-Orn
Ile
D
-Phe
His
D
-Asp
Asn
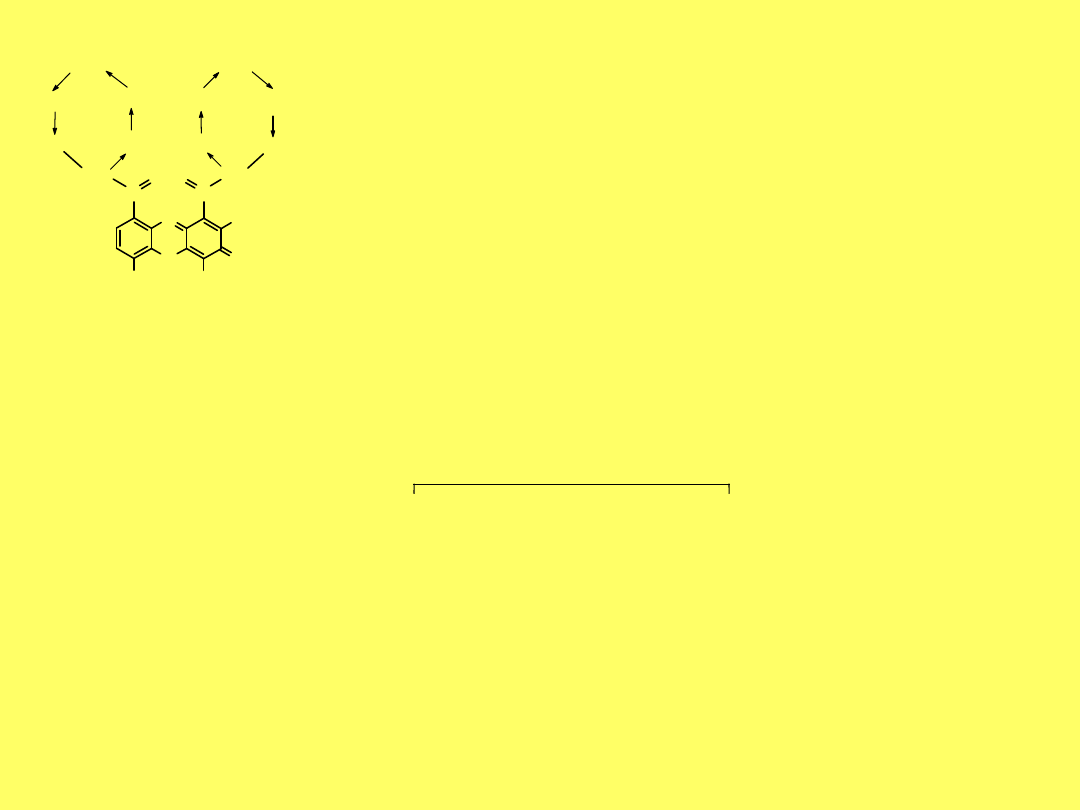
30
Aktynomycyny są wytwarzane przez szczepy Streotomyces
O
N
CH
3
CH
3
NH
2
O
Thr
O O
Thr
O
O
C
C
D
-Val
MeVal
Pro
Sar
D
-Val
Pro
Sar
MeVal
Dwa pierścienie pentadepsipeptydowe
przyłączone do barwnego układu
aminofenoksazonowego –
kwasu 2-amino-
4,6-dimetylo--3-okso-3H-fenoksazono-1,9-
dikarboksylowego
.
Należą do chromopeptydów, barwnych związków zawierających
chromofory.
Polimyksyny są wytwarzane przez bakterie Bacillus polymyxa
i-oktanoilo-
A
2
bu-Thr-A
2
bu-A
2
bu-A
2
bu-D-Phe-A
2
bu-A
2
bu-Thr
polimyksyna B
2
N-acylowane cykliczne dekapeptydy , bardzo aktywne przeciw
bakteriom Gram-ujemnym; toksyczne dla ludzi. Stosowane są
zewnętrznie, np. w kroplach do oczu i uszu.
Aktomycyna D
2
(
daktynomycyna
); ma pomarańczowe zabarwienie.

31
Walinomycyna
Cykliczny 12-peptyd o
właściwościach jonoforowych
trzykrotnie powtarzający się
tetradepsipeptyd:
L
-mle-
Val
-
D
-HO-i-wal-
D
-Val
L
-mle:
kwas
L
-mlekowy
D
-HO-i-wal: kwas
D
-
hydroksyizowaleraianowy
D
-Val
Val
L
-mle
D
-HO-i-wal
Val
D
-Val
L
-mle
D
-HO-i-wal
Val
D
-Val
L
-mle
D
-HO-i-wal
O
N
O
O
H
CH
3
CH
3
O
CH
3
N
O
O
O
H
CH
3
CH
3
CH
3
C
H
3
N
O
H
O
O
C
H
3
CH
3
N
C
H
3
O
H
C
H
3
C
H
3
O
N
C
H
3
C
H
3
O
O
H
C
H
3
C
H
3
O
N
C
H
3
CH
3
O
H
CH
3
CH
3
O
C
H
3
O

32
Gramicydyny są wytwarzane przez Bacillus brevis
Mają właściwości jonoforowe
Leu
Orn
Val
Pro
D
-Phe
Leu
Orn
Val
Pro
D
-Phe
gramicydyna S
dwukrotnie
powtórzony
fragment
pentapeptydowy
Zagnieżdża się w błonach
komórkowych tworząc wyrwy,
przez które transportowane
są protony i jony metali
alkalicznych, co zaburza
gospodarkę mineralną komórki
K
+
Gramicydyna A
jest liniowym 15-peptydem, który
przyjmuje kształt
helisy z hydrofobowymi grupami bocznymi
ustawionymi na zewnątrz
Taka helisa w postaci dimeru ogon-ogon
zagnieżdżając się w błonie komórkowej tworzy
transbłonowy kanał
transportujący jony
kationów metali alkalicznych, np. Na
+
Pojedynczy kanał jest w stanie
przetransportować
10
7
kationów/sek
-Val
Gly
Ala
D
-Leu
D
-Val
Val
Trp
D
-Val
Ala
D
-Leu
Trp
D
-Leu
Trp
Trp
D
-Leu
-NH-CH
2
-CH
2
OH
CHO
1
5
10
15
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
Związki biologicznie czynne w dietoterapii chorób dietozależnych Cz II
Związki biologicznie czynne w dietoterapii chorób dietozależnych cz I
substancje biologicznie czynne, SUBSTANCJE BIOLOGICZNIE CZYNNE
SUBSTANCJE BIOLOGICZNIE CZYNNE W ROŚLINACH, Kosmetologia
Rozróżniać składniki biologicznie czynne kosmetyków w powiązaniu z ich działaniem na skórę
substancje czynne, SUBSTANCJE BIOLOGICZNIE CZYNNE
2 substancje biologicznie czynne
Substancje biologicznie czynne wykorzystywane w kosmetologii
Kos, Roślinne substancje biologicznie czynne
Roslinne substancje biologicznie czynne
Biologicznie czynne pochodne, Biochemia, prace
32.Biologicznie czynne pochodne aminokwasów, Notatki AWF, Biochemia
31.Biologicznie czynne pochodne aminokwasów, Notatki AWF, Biochemia
Substancje biologicznie czynne z łubinu
substancje biologicznie czynne w preparatach kosmetycznych, kurs kosmetyczny, kosmetologia, składnik
Witaminy+subst, SUBSTANCJE BIOLOGICZNIE CZYNNE
więcej podobnych podstron