
Elektroforeza
Ruch substancji rozpuszczonej zachodzący
pod wpływem przyłożonej zewnętrznie różnicy
potencjałów.
Prędkość ruchu danej cząsteczki jest stała,
jeżeli podczas procesu stałe pozostają:
-różnica potencjałów
-natężenie prądu
-pH środowiska
-temperatura
-przewodnictwo i lepkość roztworu
Ruch zależny jest od:
-ładunku cząsteczki
-rozmiaru i geometrii
cząsteczki

Rodzaje
elektroforezy
1. Ze względu na rodzaj nośnika np.
bibułowa
2. Ze względu na rodzaj stosowanego
prądu np. elektroforeza pulsacyjna
3. Ze względu na rozdzielany
materiał białka, aminokwasy, DNA,
RNA

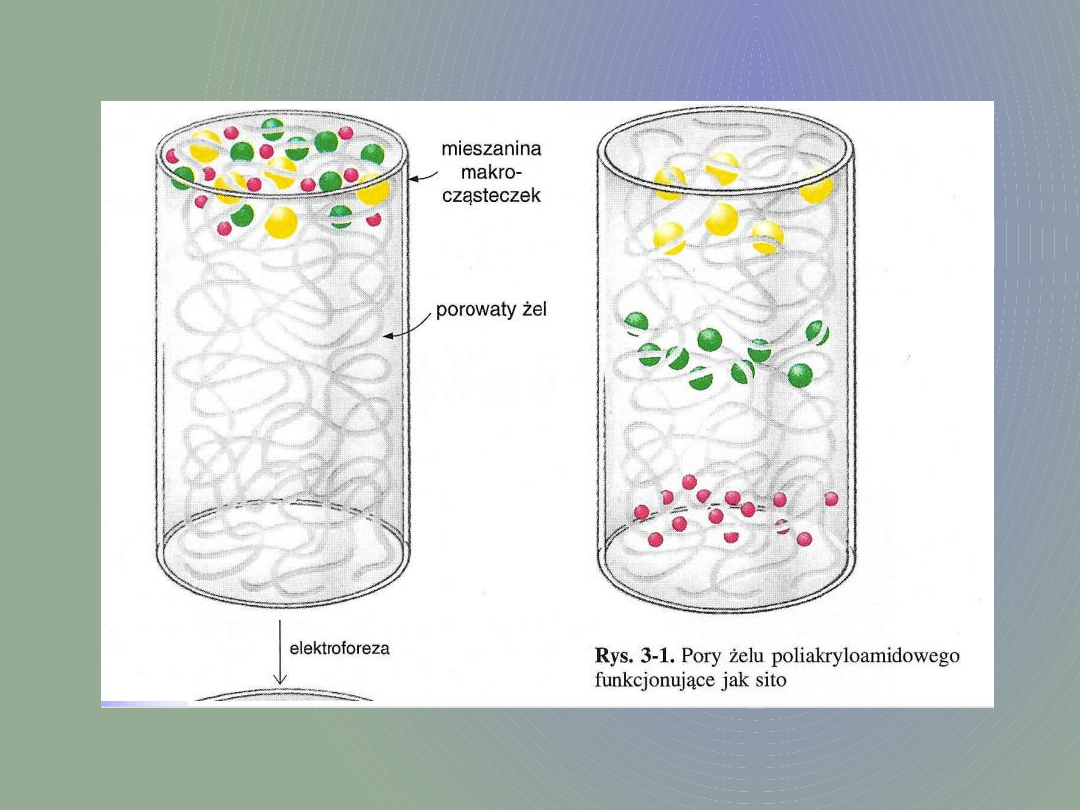
Elektroforeza polega na rozdziale
mieszaniny makrocząsteczek pod
wpływem przyłożonego pola
elektrycznego. Cząsteczki wędrują
w żelu w zależności od ich
ładunku, rozmiaru, kształtu oraz
oporów ruchu środowiska
(gęstości żelu). Elektroforezę
najczęściej prowadzi się na żelach
poliakrylamidowych.
Elektroforetyczny
rozdział białek
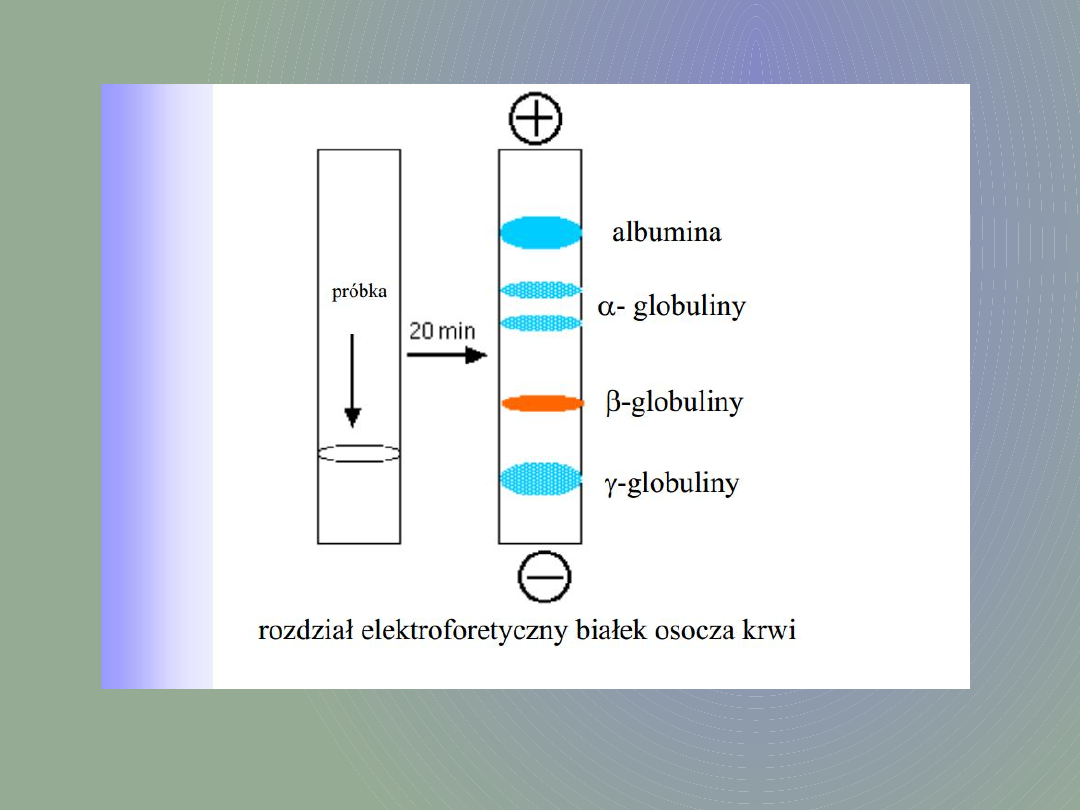
Żele działają dodatkowo
jako sita molekularne:
- żele skrobiowe
- żele celulozowe
- PAGE
(żele
poliakryloamidowe)

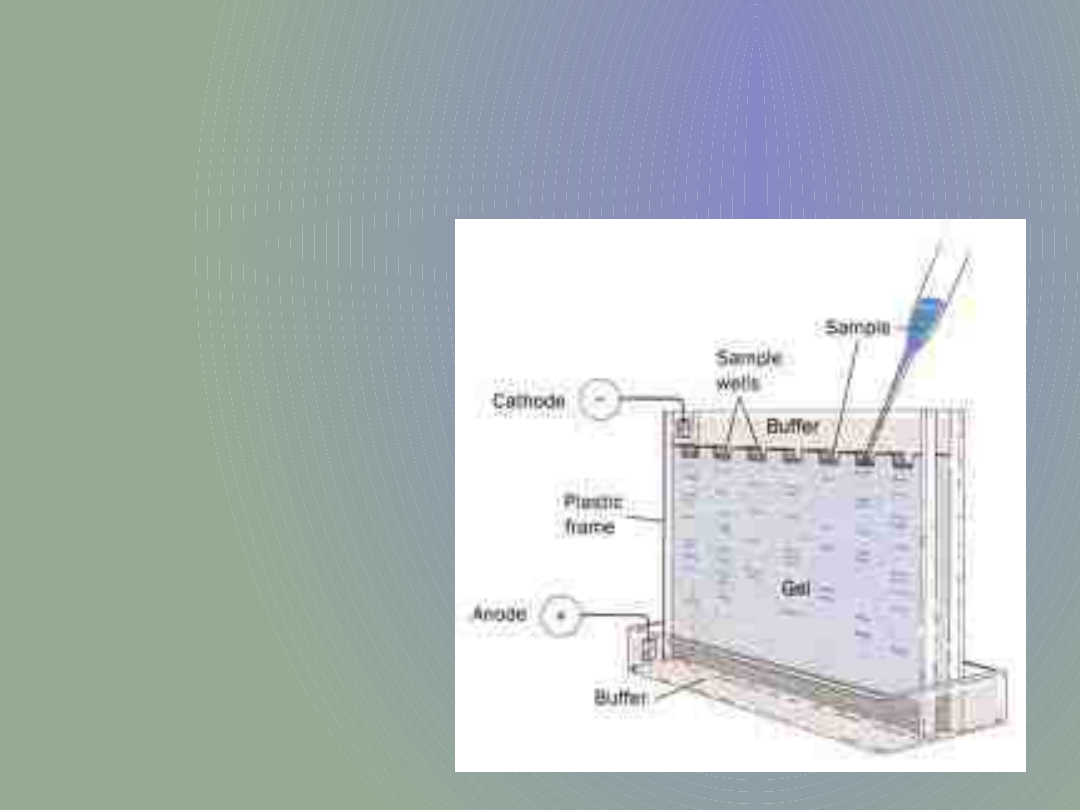
Żele poliakrylamidowe
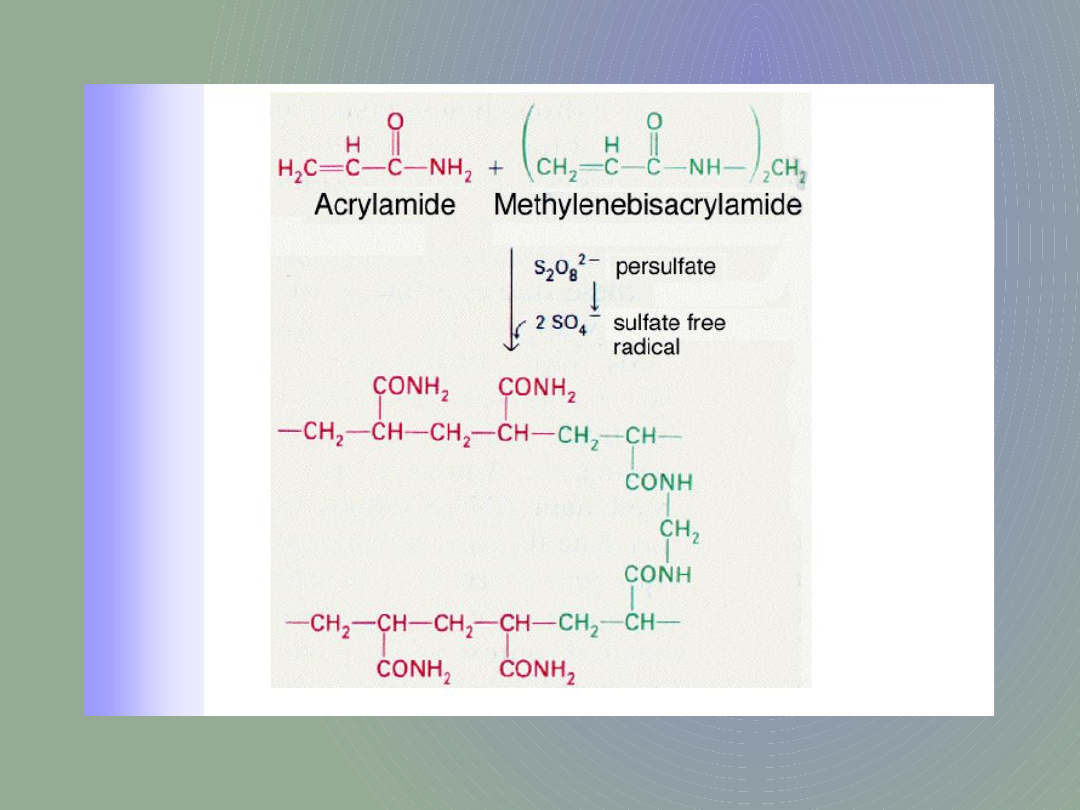
Żele poliakrylamidowe używane w metodzie western-blot do rozdziału białek są polimerami akrylamidu i bis-akrylamidu.
Od proporcji tych dwóch składników zależy gęstość i wymiary porów żelu. Wybór gęstości żelu uzależniony jest od
wielkości i masy cząsteczkowej analizowanych cząsteczek. Wysoko-cząsteczkowe białka rozdziela się na żelach o niższej
gęstości natomiast nisko-cząsteczkowe na żelach bardziej gęstych.

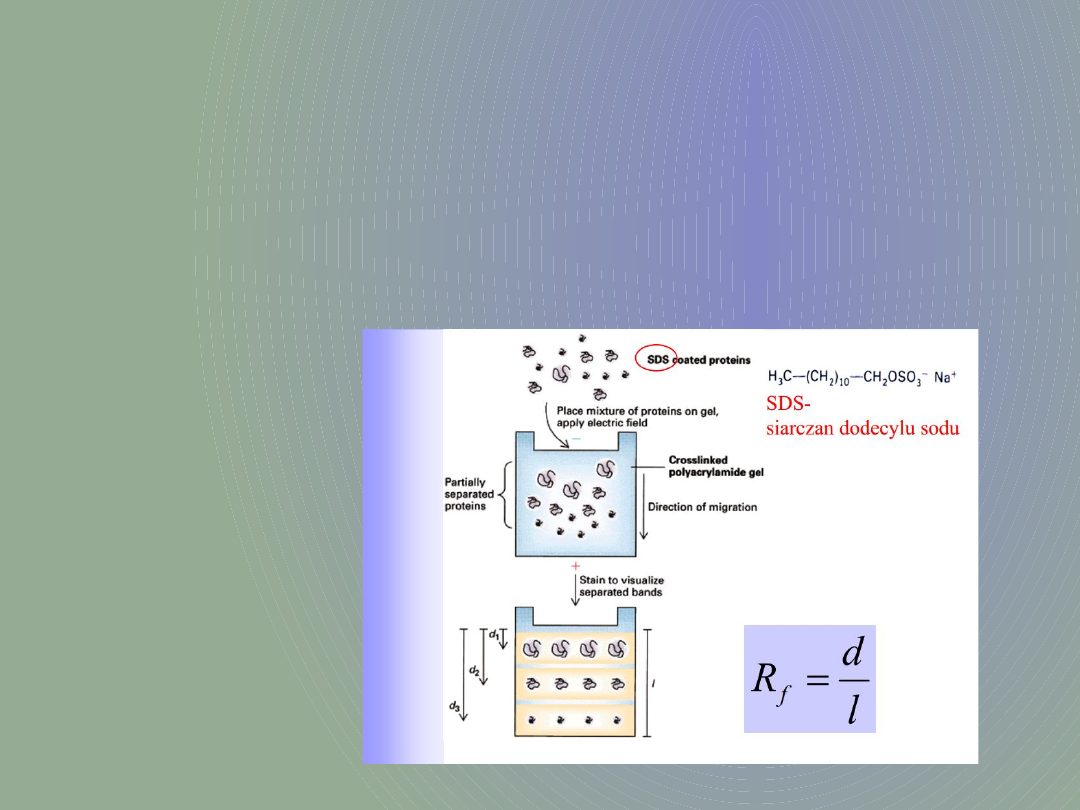
Bardzo często żele poliakrylamidowe
wzbogacane są w siarczan dodecylu –SDS
(SDS-PAGE). Dzięki któremu rozdział
elektroforetyczny zachodzi ze względu na
ciężar cząsteczkowy rozdzielanych białek
a nie ich ładunek (SDS opłaszcza białka
nadając im wypadkową ujemną wartość
-przez co maskuje ich pierwotny
ładunek). W polu elektrycznym ujemnie
naładowane białka migrują w kierunku
dodatniej elektrody.
Istotnym czynnikiem wpływającym na dobry
rozdział białek w żelu poliakrylamidowym jest:
-odpowiednia szybkość reakcji. (Zbyt szybka
migracja białek w żelu może powodować ich
niecałkowity rozdział).
-temperatura buforów. (zbyt wysokie napięcie
może skutkować podwyższeniem temperatury i
denaturacją badanych białek).

Elektroforeza białek w żelu
poliakrylamidowym w
obecności SDS
Elektroforeza w żelu poliakrylamidowym jest techniką
powszechnie stosowaną w analizie białek. W zależności
od zastosowanego układu można uzyskać rozdział
polipeptydów stosownie do różnych właściwości
fizykochemicznych. Przyjmuje się, że elektroforeza w
obecności SDS frakcjonuje białka zależnie od ich masy.
Ten typ elektroforezy jest obecnie najczęściej
stosowany i może być użyty jako jedna metoda
analityczna lub stanowić element szeregu dalszych,
bardziej skomplikowanych badań (np. elektroforeza
dwuwymiarowa, preparatywna, Western blotting
).

Złożem, w którym następuje rozdział białek jest
żel poliakrylamidowy, w czasie polimeryzacji oraz
w trakcie elektroforezy ustawiony w pozycji
pionowej. Standardowo SDS PAGE jest używana w
wersji tzw. disc electrophoresis, umożliwiającej
maksymalne wykorzystanie zdolności
rozdzielczych tej metody. W praktyce ta
nieciągłość dotyczy zarówno żelu, który składa się
jakby z dwóch warstw, jak również buforu do
elektroforezy: innego w górnym, innego w dolnym
zbiorniku aparatu do elektroforezy. Próbki
nakładane na żel w tym układzie mogą mieć
stosunkowo dużą objętość, ponieważ w czasie
przechodzenia przez górną warstwę żelu zostają
zagęszczone do wąskiego pasma, które w dolnym
żelu rozdziela się na pojedyncze, ostre prążki.
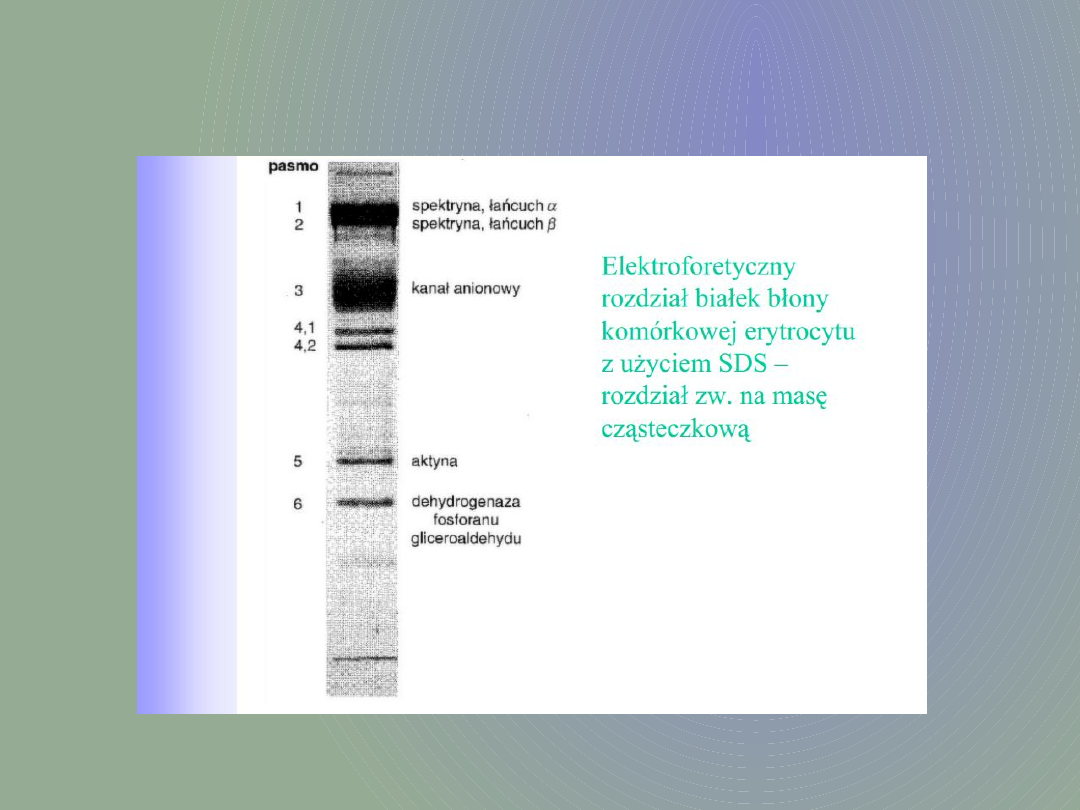

W rzeczywistości białka rozdzielane są w SDS
PAGE na zasadzie filtracji, analogicznie do
metody chromatograficznej sączenia
molekularnego.
Ponieważ frakcjonowanie zachodzi w
zależności od długości łańcucha
polipeptydowego, można ustalić masę danego
białka przez porównanie z odpowiednimi
standardami. Jest to metoda pozwalająca na
oznaczenie masy białka z dokładnością do 5-
10%, ale niestety nie każdy polipeptyd można
w ten sposób scharakteryzować (jednym z
wyjątków są białka histonowe).
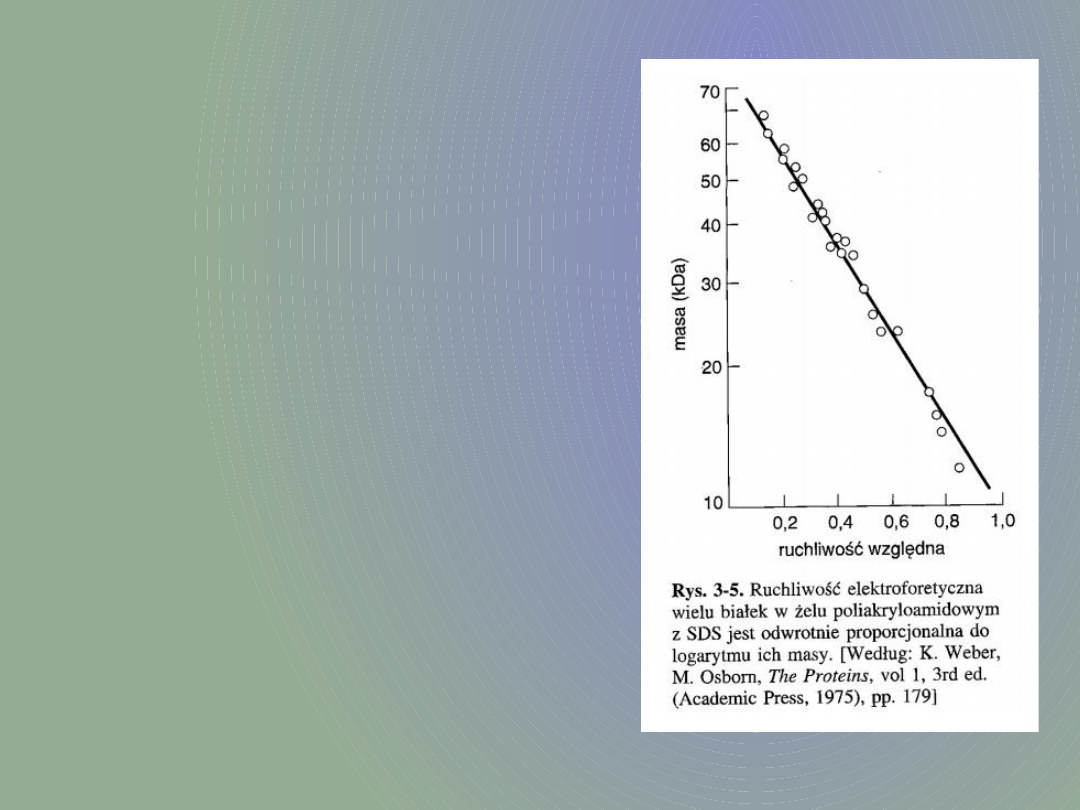
Przyjmuje się, że
statystycznie jeden anion
dodecylosiarczanowy
przypada na dwie reszty
aminokwasowe. Ponadto do
rozdzielanych próbek
dodaje się silne środki
redukujące, które redukują
mostki disiarczkowe
obecne w białkach. Można
przyjąć, że tempo migracji
białek jest zależne tylko od
ich masy i jest wprost
proporcjonalne do jej
logarytmu, dlatego też
możliwe jest stosowanie
tzw. standardów wielkości
białek.

Należy pamiętać o tym, że
jakość rozdziału w SDS PAGE
zależy od poprawnego i
solidnego wykonania szeregu
prostych czynności. Dlatego
też mimo, iż technika nie jest
skomplikowana, może
zajmować sporo czasu,
kilkakrotnie więcej niż
elektroforeza agarozowa
służąca do rozdziału
preparatów DNA.

Wady elektroforezy
SDS-PAGE
Technika elektroforetyczna SDS-PAGE, mimo iż
jest bardzo powszechnie stosowana, nie jest
wolna od wad. Pierwsza z nich wynika z faktu,
iż pH żelu rozdzielającego jest zasadowe
(pH=8,8). Zasadowy odczyn powoduke
powolną hydrolizę żelu, prowadzącą do
słabszego usieciowania żelu i w konsekwencji
spadku zdolności rozdzielczej, co sprawia, że
żele SDS-PAGE nie mogą być przechowane
dłużej niż 1-2 miesiące. Zasadowe środowisko
elektroforezy powoduje również tworzenie się
mostków disiarczkowych, zaś odczynniki
redukujące nie migrują wraz z białkami, co
również może mieć negatywny wpływ na
rozdział białek.

Ponadto, wraz z przebiegiem elektroforezy,
pH żelu rozdzielającego rośnie do wartości
powyżej 9,5, co sprzyja zachodzeniu reakcji
ubocznych, takich jak deaminacja białek
oraz addycja niespolimeryzowanego
akrylamidu do grup aminowych i tiolowych
w łańcuchach bocznych aminokwasów.
Zachodzące modyfikacje białek mogą
utrudniać dalszą ich analizę technikami
spektrometrii mas. Kolejną wadą jest
wysoka temperatura podczas denaturacji
próbek białek, mogąca prowadzić do
hydrolizy wiązania peptydowego.

Obecność SDS przynosi szereg korzyści:
-niska cena stosowanych odczynników.
- zdecydowana większość
białek jest rozpuszczalna w elektrolitach
zawierających SDS
- separacja białek odbywa się zgodnie z ich
masami cząsteczkowymi
-barwienia kompleksów białko-SDS jest
znacznie wydajniejsze niż samego białka
-Obecność SDS skutecznie eliminuje
enzymatyczną degradację białek w trakcie
separacji.
Zalety elektroforezy
SDS-PAGE
Document Outline
- Elektroforeza
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Wady elektroforezy SDS-PAGE
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
Elektroliza Kopia
Elektrotechnika 3 - Kopia, ZiIP Politechnika Poznańska, Elektrotechnika i elektronika
Elektrotechnika 4 - Kopia, ZiIP Politechnika Poznańska, Elektrotechnika i elektronika
bezpieczeństwo elektryczne kopia do foliogramów
elektronika Kopia
Elektrotechnika 2 - Kopia, ZiIP Politechnika Poznańska, Elektrotechnika i elektronika
Kopia Elektrotechnologie egzamin
Kopia (2) pchrezonans, Energetyka I stopień PŚk, sem1 Elektrotechnika, Laboratorium elektrotechnika,
Kopia pchrezonans, Energetyka I stopień PŚk, sem1 Elektrotechnika, Laboratorium elektrotechnika, rez
KOPIA(~2, Szkoła, penek, Przedmioty, Elektrotechnika, Laborki
Kopia Elektrotecnika temat 4 i 5
Elektronika sciaga Kopia
Kopia ściąga bmikroskopowe stali węglowych wyżarzonych i żeliw, Elektrotechnika, dc pobierane, pnom
Kopia spawanie elektr
Kopia zad 5 elektrochemia
Kopia Spawanie elektryczne
Działanie prądu elektrycznego na organizm człowieka Kopia
więcej podobnych podstron