1.Historia odkrycia i rozpowszechnienie w skorupie ziemskiej
Odkryty
przez: Hans Christian Oersted
Miejsce
odkrycia: Dania
Rok
odkrycia: 1825
Pochodzenia
nazwy: od greckiego "alumen" oznaczającego ałun
Związki
glinu (w szczególności ałuny) były znane i stosowane już w
starożytności. W 1825 roku H. Oersted
ogrzewając pod zmiejszonym ciśnieniem chlorku
glinu amalgamatem potasu(czyli
stoniem potasu i rtęci )
Minerały glinu rozpowszechnione są na całym świecie. Złoża boksytów znajdóją się w Australi, Jamajka, Francja i zach. Afryka a także na Węgrzech i Albanii.
2.Właściwości glinu
Liczba
elektronów: 13
Liczba
neutronów: 14
Liczba
protonów: 13
Stopień
utlenienia: +3
Przewodność
elektryczna: 369*105
1/(*m)
Gęstość
(293 K): 2.702 g/cm3
Temperatura
topnienia: 660,25°C, 933,25 K
Temperatura
wrzenia: 2467°C, 2740 K
Ciepło
topnienia: 10,79 kJ/mol
Ciepło
parowania: 293,4 kJ/Liczba
Czysty glin jest srebrzystobiałym, kowalnym i ciągliwym metalem.
Ma duże znaczenie praktyczne jako lekki materiał konstrukcyjny oraz dobry przewodnik ciepła i elektryczności.
Wadą czystego glinu jest jego miękkość; dodanie niewielkiej ilości krzemu i żelaza (mniej niż 1%) zwiększa jednak twardość i wytrzymałość glinu.
Glin jest uważany za metal odporny na utlenienie. Ściśle mówiąc, świeża powierzchnia glinu pokrywa się natychmiast ochronną warstewką tlenku. Bez takiej warstewki glin zostałby szybko zniszczony przez gazy powietrza i wilgoć. Nawet jednak warstewka tlenku nie może ochraniać glinu wiecznie; świadczy o tym fakt, że glin nie występuje w przyrodzie w stanie wolnym. Glin należy do borowców - pierwiastków tworzących grupę 13 układu okresowego. Podobnie jak inne pierwiastki tej grupy, np. bor i gal, glin tworzy związki głównie na stopniu utlenienia III.
W przyrodzie występuje wyłącznie glin-27. Pozostałe izotopy są promieniotwórcze iotrzymywane sztucznie
Podgrzewany reaguje z tlenem obecnym w powietrzu tworząc tlenek. Glin łatwo roztwarza się w mocnych zasadach , takich jak NaOH lub KOH wypieraj wodór i przechodząc w tetrahydroksyglinian:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑.
reaguje z zasadą ale zachowuje się jak kwas
Al(OH)3¯ + 3HCl à AlCl3+ 3H2O
Wodorotlenek glinu przereagował z kwasem i zachował się jak zasada
Al(OH)3+ 3NaOH à Na3 [Al(OH)6]
Wodorotlenek glinu przereagował z zasadą i zachował się jak kwas
Al2O3+6HClà 2AlCl3 + 3H2O
3. Otrzymywanie glinu
Glin produkuje się metodą Halla. Opiera się ona na zasadniczo prostym procesie elektrolitycznym, dostosowanym do skali przemysłowej. Jako elektrolit stosuje się tlenek glinu Al2O3, łatwo otrzymywany z naturalnego boksytu( ilasta skała osadowa składająca się głównie z wodorotlenków glinu ).
Elektrolitem jest mieszanina tlenku glinu z kriolitem (Na3AlF6 nieorganiczny związek kompleksowy, podstawowy składnik minerału kriolitu.Syntetyczny fluoroglinian sodu stosowany jest jako topnik obniżający temperaturę w procesie produkcji elektrolitycznej aluminium) i fluorytem (CaF2 W przyrodzie występują kryształy o różnych barwach; żółty, zielony, niebieski, fioletowy, fioletowo czarny, o szklistym połysku rzadko bezbarwnym. Charakteryzuje się doskonałą łupliwością.jest stosowany w przemyśle szklarskim do produkcji kwasu fluorowodorowego i wyrobu tworzyw sztucznych
w przemyśle ceramicznym ). Dodatki te stanowią topniki, obniżające temperaturę topnienia elektrolitu. podczs elektrolizy przebiega reakcja:
2Al2O3
---> 4Al + 3O2
(tlenek
glinu ---> glin + tlen
W wyniku reakcji na katodzie wydziela się stopiony glin; katodę stanowi węglowa wykładzina elektrolizera; glin opada na dno, skąd jest odprowadzany i odlewany w bloki.
4.Wazniejsze zwiąski chemiczne glinu
Najważniejsze związki glinu to tlenek glinu i amfoteryczny wodorotlenek glinu.
Tlenek glinu
[nazwa systematyczna: tlenek glinu(III)], Al2O3 – nieorganiczny związek chemiczny, tlenek glinu na stopniu utlenienia.Podstawową rudą (kopalina, czyli skała lub minerał, z której uzyskuje się jeden lub więcej składników. Ruda w sensie przemysłowym to minerał zawierający związki metali.) aluminium z której uzyskiwany jest tlenek glinu, są boksyty. Tak uzyskany tlenek glinu może posłużyć do produkcji aluminium(( glin o czystości technicznej, zawierający różne ilości zanieczyszczeń, zależnie od metody otrzymywania.).
Największym producentem tlenku glinu na świecie jest korporacja Alcoa, dalej Alcan i Rusal.
Największymi wytwórcami aluminium są połączone Rio Tinto i Alcan, za nimi Rusal i Alcoa.
Amfoteryczność
Zdolność do wykazywania zarówno właściwości kwasowych, jak i zasadowych przez niektóre pierwiastki chemiczne i ich związki (głównie tlenki i wodorotlenki) oraz niektóre związki organiczne zawierające w cząsteczce jednocześnie grupy kwasowe i zasadowe (np. aminokwasy). Wobec mocnych kwasów zachowują się one jak zasady, zaś wobec mocnych zasad – jak kwasy.
Cząsteczkowy zapis równania reakcji:

Reakcja glinu z kwasem solnym jest typowš reakcjš metalu z kwasem nieutleniajšcym, w wyniku której powstaje sól i wydziela się wodór.
Amfoteryczny glin Al w reakcji z mocnym kwasem (w zapisie jonowym z H+) zachowuje się jak zasada i przechodzi w postać kationu prostego - kationu glinu Al3
Reakcja Al z mocnš zasadš,np. z zasadš potasowš KOH.
czšsteczkowy zapis równania reakcji:
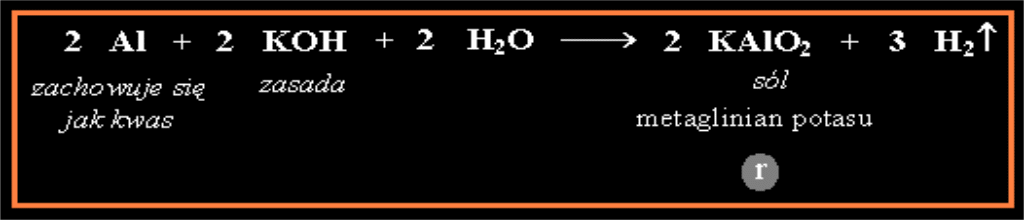
Ponieważ glin w tej reakcji zachowuje się jak kwas, należałoby wyprowadzić kwasowó formę zawierający glin.
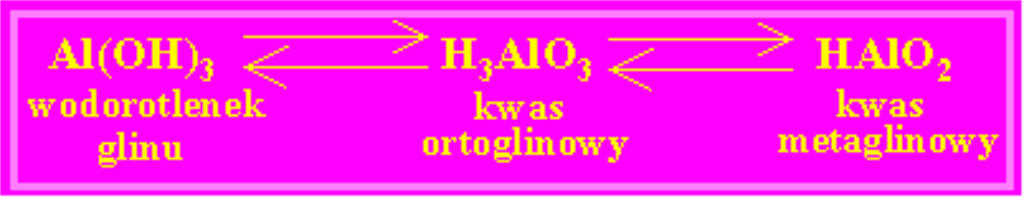
Ponieważ w cząsteczce kwasu musi być wodór, a w glinie nie ma wodoru, więc formę kwasowš wyprowadzamy z wodorotlenku glinu, a nie z glinu:
W reakcji glinu z mocnš zasadą powstaje sól i wydziela się wodór (podobnie jak w reakcji glinu z mocnym kwasem). W reakcji tej udział bierze również woda.
Amfoteryczny glin Al w reakcji z mocną zasadą (w zapisie jonowym z OH-) zachowuje się jak kwas i przechodzi w postać anionu złożonego - anionu metaglinianowego AlO-2.
Wodorotlenek glinu
(o wzorze Al(OH)3) –amfoteryczny , nieorganiczny zwi¹zek chemiczny o ogólnym wzorze Al2O3·nH2O.
---Jest on stosowany w produkcji papieru, mydła, kosmetyków, środków na nadkwaśność żołądka (w połączeniu z wodorotlenkiem magnezu ) oraz w lecznictwie (substancja ścierająca i polerująca przy produkcji proszków i past do zębów). Z uwagi na wydzielanie wody w podwyższonej temperaturze, dodaje się go do izolacji specjalnych kabli energetycznych w celu zwiększenia ich odporności na ogień.
---Ogrzewanie
wodorotlenku glinu prowadzi do powstania tlenku
glinu :
2Al(OH)3→
Al2O3+
3H2O
Podczas
działania zasad na roztwory soli glinu wytrąca się bezpostaciowy
osad — żel, o zmiennej zawartości wody
---Otrzymuje się go zwykle jako biały, krystaliczny osad w wyniku wprowadzenia dwutlenku wêgla do roztworu glinianu: 2[Al(OH)4]-+ CO2→ 2Al(OH)3+ CO32-+ H2O
Chlorek glinu
---nieorganiczny zwizek chemiczny , i glinu . Jest substancją dobrze rozpuszczalną w wodzie – forma uwodniona zawiera sześć cząsteczek wody: AlCl3·6H2O. -- ---Ogrzewanie zhydrolizowanego hydratu prowadzi do powstania tlenku glinu (Al2O3)[3] .
---Bezwodny chlorek glinu otrzymuje się m.in. w reakcji glinu z chlorem lub gazowym chlorowodorem[3]:
2Al + 3Cl2 → 2AlCl3
2Al + 6HCl → 2AlCl3 + 3H2
---W stanie stałym chlorek glinu ma strukturę krystaliczną, w stanie ciekłym i gazowym jest dimerem, zaś w wysokiej temperaturze przyjmuje formę monomeru w stanie gazowym
5. Aluminotermia
Aluminotermia– metoda otrzymywania niektórych pierwiastków chemicznych. Reakcja ta polega na redukcji tlenków tych pierwiastków glinem , zapoczątkowanej masą zapalającą, w której skład wchodzą: sproszkowany magnez , nadtlenek baru oraz chloran potas.
W tej wersij aluminotermi wykorzystuję się tzw. mieszankę termitową czyli mieszannę pyłu glinowego , tlenku żelaza (II), dwóżelaza (III) Fe3O4, znaną też jako składnik bomb zapalających, używanych podczas II wojny światowej.
6. Stopy glinu
Glin z innymi metalami tworzą stopy, które są roztworami jednego metalu w drugim. stopy a stanie stałym mają róznorodną struktórę i właściwość znaacznie różniczę się od ppszczegółnych składników.Oznaczają się wielką odpornościąmechaniczną i chemiczną, są twarte i bardzej wytrzymałena rozelwanie nisz czysty metal.
W tabeli przestawioną niektóre stopy letkkie
Wyszukiwarka
Podobne podstrony:
litowce, berylowce oraz glin zadania
Glin metal wióry
Glin
glin
Metale, Glin, WYSTĘPOWANIE
MB (Lab) - Różne ściągi, Ceramika budowlana ćw.5, Ceramika budowlana - wyroby uformwane z glin albo
obliczenia glin, Studia PŁ, Ochrona Środowiska, Monitoring skażeń, sprawka
Glin, wypracowania, chemia
glin, charakterystyka poszczególnych grup układu okresowego
glin sproszkowany, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
glin wstęp, Studia PŁ, Ochrona Środowiska, Monitoring skażeń, sprawka
Glin metal wióry
litowce, berylowce oraz glin zadania(1)
GLIN
Metoda archeomagnetyczna pozwala na określenie wieku obiektów z wypalonych glin ze stosunkowo dużą d
Glin
więcej podobnych podstron