
1
PRZEWODNIK DO ĆWICZEŃ
LABORATORYJNYCH
Z TOKSYKOLOGII
Skrypt dla studentów II roku ratownictwa medycznego
pod redakcją
Aleksandry DAMASIEWICZ-BODZEK,
Tomasza WIELKOSZYŃSKIEGO
ŚLĄSKI UNIWERSYTET MEDYCZNY W KATOWICACH

PRZEWODNIK DO ĆWICZEŃ
LABORATORYJNYCH
Z TOKSYKOLOGII

AUTORZY:
Aleksandra DAMASIEWICZ-BODZEK
Beata JANOSZKA
Krystyna LUKS-BETLEJ
Magdalena SZUMSKA
Krystyna TYRPIEŃ
Tomasz WIELKOSZYŃSKI

PRZEWODNIK DO ĆWICZEŃ
LABORATORYJNYCH
Z TOKSYKOLOGII
Skrypt dla studentów II roku ratownictwa medycznego
pod redakcją
Aleksandry DAMASIEWICZ-BODZEK,
Tomasza WIELKOSZYŃSKIEGO
ŚLĄSKI UNIWERSYTET MEDYCZNY W KATOWICACH

Recenzent
prof. dr hab. inż. Zygfryd Witkiewicz
Redakcja
Teresa Pawlok
Redaktorzy techniczni
Barbara Szwoba
Cezary Dobosz
© Copyright by Śląski Uniwersytet Medyczny w Katowicach
Katowice 2009
Wszelkie prawa zastrzeżone
Dzieło może być wykorzystywane na użytek
własny do celów naukowych, dydaktycznych lub edukacyjnych.
Zabroniona jest niezgodna z prawem autorskim reprodukcja,
redystrybucja lub odsprzedaż
Wydanie I
ISBN 978-83-7509-119-9
Skład komputerowy i łamanie
Wydawnictwo SUM
40-752 Katowice, ul. Medyków 12

5
SPIS TREŚCI
WSTĘP .................................................................................................................................................................. 6
1. PRZEPISY BHP, ĆWICZENIA WPROWADZAJĄCE ............................................................................... 7
1.1. Przepisy porządkowe i BHP ........................................................................................................................ 7
1.2. Pierwsza pomoc ........................................................................................................................................... 8
1.3. Wybrane reakcje jonów w roztworach wodnych......................................................................................... 8
1.4. Ćwiczenia praktyczne.................................................................................................................................. 9
2. SPOSOBY UNIESZKODLIWIANIA SUBSTANCJI CHEMICZNYCH ................................................. 13
2.1. Neutralizacja substancji chemicznych w organizmie człowieka ............................................................... 15
2.2. Wybrane przykłady neutralizacji substancji niebezpiecznych i toksycznych .......................................... 16
2.3. Ćwiczenia praktyczne................................................................................................................................ 17
3. TOKSYKOLOGIA ŚRODKÓW PSYCHOAKTYWNYCH ..................................................................... 19
3.1. Ćwiczenia praktyczne................................................................................................................................ 20
4. TOKSYKOLOGIA ROZPUSZCZALNIKÓW ORGANICZNYCH ........................................................ 26
4.1. Ćwiczenia praktyczne................................................................................................................................ 28
5. TOKSYKOLOGIA ZWIĄZKÓW NIEORGANICZNYCH I GAZÓW ................................................... 31
5.1. Ćwiczenia praktyczne................................................................................................................................ 32
6. TOKSYKOLOGIA LEKÓW I ŚRODKÓW POCHODZENIA ROŚLINNEGO .................................... 38
6.1. Ćwiczenia praktyczne................................................................................................................................ 38
7. TOKSYKOLOGIA WYBRANYCH ŚRODKÓW CHEMII GOSPODARCZEJ ..................................... 46
7.1. Ćwiczenia praktyczne................................................................................................................................ 47
ZALECANA LITERATURA ............................................................................................................................. 50

6
WSTĘP
Oddajemy do rąk Czytelników „Przewodnik do ćwiczeń laboratoryjnych z toksyko-
logii. Skrypt dla studentów II roku ratownictwa medycznego”, który w założeniu autorów ma
być zbiorem instrukcji do praktycznego wykonania ćwiczeń laboratoryjnych z przedmiotu
„Toksykologia” dla studentów II roku kierunku „Ratownictwo Medyczne” Śląskiego Uniwer-
sytetu Medycznego.
Opracowanie to, będące nowością na rynku wydawniczym, ma pomóc studentom
w przygotowaniu się do zajęć laboratoryjnych z toksykologii oraz wykonaniu poszczególnych
ćwiczeń. Skrypt składa się z 7 rozdziałów obejmujących zagadnienia współczesnej toksy-
kologii medycznej, a więc problemy, z którymi najczęściej może zetknąć się przyszły ratow-
nik medyczny. Dobierając treści programowe, kierowano się przede wszystkim zasadą pro-
stoty wykonania ćwiczeń oraz ich potencjalnej użyteczności praktycznej. Opisy wykonania
poszczególnych ćwiczeń poprzedzone są krótkimi informacjami na temat własności toksycz-
nych analizowanych substancji, ich występowania, klinicznych objawów zatrucia nimi oraz
mechanizmów reakcji zachodzących w trakcie wykonywania doświadczeń. Wszystkie ćwi-
czenia zostały zweryfikowane i stanowią wynik kilkuletniego doświadczenia autorów.
Mamy nadzieję, że skrypt ten będzie podstawową pomocą dydaktyczną do ćwiczeń
z toksykologii nie tylko dla studentów kierunku „Ratownictwo Medyczne”, ale również dla
studentów Wydziału Lekarskiego oraz innych osób zainteresowanych przedstawioną proble-
matyką.
Autorzy

7
1. PRZEPISY
BHP, ĆWICZENIA WPROWADZAJĄCE
Zasady pracy w laboratorium chemicznym
1.1. Przepisy porządkowe i BHP
1. Przed wejściem do sali ćwiczeń należy przebrać się w płaszcz ochronny, a okrycia
wierzchnie, torby, siatki itp. pozostawić w szatni.
2. Miejsce pracy należy utrzymywać w porządku i czystości. Do zlewu nie wolno wrzucać:
sączków, zapałek, papierków wskaźnikowych itp. Roztwory z osadami należy zlewać do
przeznaczonych do tego celu kolb stożkowych znajdujących się w każdym zlewie.
3. Na każdym stole butelki z odczynnikami oznaczone są innym kolorem i ponumerowane.
Należy dopilnować, aby w czasie ćwiczeń nie zostały zamienione między stołami, a na
danym stole były ułożone w odpowiedniej kolejności.
4. W celu oszczędnego gospodarowania odczynnikami we wszystkich doświadczeniach
należy stosować ich możliwie małe ilości.
5. Należy bezwzględnie przestrzegać zasady, że roztwór raz wylany z butelki nie może do
niej powrócić.
6. Aby zapobiec zanieczyszczeniu odczynników w wyniku zamiany korków z butelek, nie
należy odkładać ich na stół. Podczas nalewania roztworu i wykonywania odpowiednich
czynności korek należy trzymać w ręce, po czym zamknąć nim butelkę, z której został
wzięty.
7. Ze względu na szkodliwość większości substancji chemicznych, zabrania się:
badania smakiem jakichkolwiek substancji i roztworów,
pipetowania ustami jakichkolwiek roztworów (stosować należy wyłącznie nasadki do
pipet),
spożywania w laboratorium posiłków.
8. Wszelkie prace z trującymi gazami i stężonymi kwasami trzeba przeprowadzać pod
wyciągiem.
9. Z palników gazowych należy korzystać bardzo uważnie. W celu zapalenia palnika należy
najpierw zapalić zapałkę, a dopiero potem odkręcić kurek przewodu gazowego. W razie
„przeskoczenia” palnika, należy zamknąć dopływ gazu, zmniejszyć dopływ powietrza
i uruchomić palnik powtórnie. Gdy źródło ciepła przestaje być potrzebne, należy zamknąć
dopływ gazu do palnika.
10. Podczas nieumiejętnego ogrzewania cieczy w płomieniu palnika gazowego łatwo można
doprowadzić do jej przegrzania i wypryśnięcia z probówki. Aby temu zapobiec, probówkę
należy wypełnić cieczą maksymalnie do 1/3 objętości i nieustannie wstrząsając, trzymać
ją w płomieniu ukośnie. Aby zapobiec nieszczęśliwym wypadkom, wylot probówki nigdy
nie może być skierowany w stronę jakiejkolwiek osoby znajdującej się w pobliżu.

8
11. Przed opuszczeniem pracowni koniecznie należy umyć ręce.
12. O wszelkich wypadkach natychmiast zawiadomić asystenta prowadzącego zajęcia.
1.2. Pierwsza pomoc
1. W przypadku oparzenia lub kontaktu z kwasem oblane miejsce szybko spłukać dużą
ilością wody z kranu, a następnie roztworem kwaśnego węglanu sodu (NaHCO
3
).
2. W przypadku oparzenia ługiem oblane miejsce szybko spłukać dużą ilością wody z kranu,
a później roztworem rozcieńczonego kwasu octowego (CH
3
COOH). Oznakowane
roztwory neutralizujące znajdują się w sali ćwiczeń.
3. W razie oparzenia lub uszkodzenia oczu wskutek kontaktu z chemikaliami, głowę należy
przechylić do tyłu, oczy przepłukać obficie wodą, wprowadzając strumień wody pod
powieki, po czym założyć jałowy opatrunek na oko i niezwłocznie udać się do lekarza.
4. Miejsca oparzone termicznie natychmiast schłodzić strumieniem zimnej wody, po czym
założyć sterylny, wilgotny opatrunek.
1.3. Wybrane reakcje jonów w roztworach wodnych
W analizie chemicznej substancji niebezpiecznych wykorzystuje się najczęściej reak-
cje, których wynik jest wyraźnie dostrzegalny. Są to zwykle reakcje przebiegające z wy-
trąceniem trudno rozpuszczalnego osadu, odbarwieniem lub pojawieniem się produktu
barwnego, wydzielaniem gazowych produktów reakcji oraz doświadczenia, w których osad
powtórnie przeprowadza się do roztworu.
Analiza chemiczna umożliwia analizę jakościową i ilościową substancji chemicznych.
Do tego celu wykorzystuje się często nowoczesne techniki rozdzielcze i spektroskopowe. Za
pomocą jakościowej analizy nieorganicznej w badanej próbce identyfikuje się pierwiastki lub
jony, natomiast analiza ilościowa służy do określenia ilości zidentyfikowanych składników.
W czasie przeprowadzania ćwiczeń laboratoryjnych należy kierować się następu-
jącymi zasadami:
1. Reakcje przeprowadza się w probówkach lub w innych naczyniach według instrukcji.
2. Roztwory nalewa się nad stołem laboratoryjnym do probówek w niewielkich ilościach
(kilku kropli) tak, aby ciecz spływała powoli, po wewnętrznej ścianie probówki.
3. Ogrzewanie roztworów reakcyjnych, a także rozpuszczanie osadów przeprowadza się
w łaźni wodnej.
4. Aby wytrącić opornie powstający osad, należy zanurzaną w roztworze bagietką pocierać
wewnętrzną ściankę probówki – cząstki szkła służą jako zarodniki krystalizacji (niektóre
substancje trudno rozpuszczalne krystalizują powoli).
5. Zapach substancji lotnej można sprawdzać tylko i wyłącznie naganiając dłonią powietrze
u wylotu probówki w kierunku nosa z bezpiecznej odległości od twarzy.
6. Rozpuszczalność osadu w nadmiarze odczynnika należy sprawdzać, wykonując naprze-
miennie dozowanie kropli odczynnika i mieszanie zawartości probówki.
7. Oddzielenie osadu od roztworu przeprowadza się, przesączając mieszaninę reakcyjną
przez sączek bibułowy umieszczony na lejku lub dekantując, tzn. zlewając roztwór znad
osadu.
9
8. Obserwowany przebieg reakcji należy opisać (powstawanie osadu, zmiana barwy, postać
osadu: grubo-, drobnokrystaliczny, serowaty, koloidalny, barwny).
1.4. Ćwiczenia praktyczne
1.4.1. Reakcje strącania osadów
A. Osad grubokrystaliczny wodorowinianu potasu
Wykonanie ćwiczenia:
Do 1 cm
3
roztworu zawierającego jony K
+
dodać 1 cm
3
roztworu kwasu winowego
(0,5 mol/dm
3
), po czym w celu zobojętnienia powstałego kwasu solnego dodać około 0,5 cm
3
roztworu octanu sodu (0,5 mol/dm
3
). Zapoczątkować krystalizację przez potarcie bagietką
wewnętrznej ścianki probówki. Odczekać kilka minut.
B. Osad koloidalny wodorotlenku glinu
Wykonanie ćwiczenia:
Do 1 cm
3
roztworu zawierającego jony Al
3+
dodać l–2 krople roztworu wodorotlenku
sodu (2 mol/dm
3
). Nadmiar roztworu wodorotlenku sodu rozpuszcza powstały osad.
C. Osad galaretowaty siarczanu strontu
Wykonanie ćwiczenia:
Do 1 cm
3
roztworu zawierającego jony Sr
2+
dodać 0,5 cm
3
roztworu kwasu siar-
kowego (1 mol/dm
3
).
D. Osad serowaty chlorku srebra
Wykonanie ćwiczenia:
Do 0,5 cm
3
roztworu azotanu srebra (0,01 mol/dm
3
) dodać kilka kropli roztworu
kwasu solnego (1 mol/dm
3
).
KCl + H
2
C
4
H
4
O
6
KHC
4
H
4
O
6
↓ + HCl
lub jonowo:
K
+
+ HC
4
H
4
O
6
-
KHC
4
H
4
O
6
↓
SrCl
2
+ H
2
SO
4
SrSO
4
↓ + 2HCl
lub jonowo:
Sr
2+
+ SO
4
2-
SrSO
4
↓
AgNO
3
+ HCl AgCl↓ + HNO
3
lub jonowo:
Ag
+
+ Cl
-
AgCl↓
Al
2
(SO
4
)
3
+ 6NaOH 2Al(OH)
3
↓ + 3Na
2
SO
4
lub jonowo:
Al
3+
+ 3OH
-
Al(OH)
3
↓

10
E. Osad drobnokrystaliczny jodku ołowiu (II)
Wykonanie ćwiczenia:
Do 1 cm
3
roztworu zawierającego jony Pb
2+
dodać 1 cm
3
roztworu jodku potasu
(0,5 mol/dm
3
) i po chwili, kiedy osad opadnie, zlać roztwór (zdekantować) znad jego po-
wierzchni. Do pozostałego w probówce osadu jodku ołowiu dodać wody destylowanej. Pro-
bówkę ogrzewać, aż osad w znacznym stopniu się rozpuści, a następnie odstawić do statywu
do oziębienia. Zaobserwować kryształy, które wypadają z roztworu.
1.4.2. Reakcje związane z roztwarzaniem osadu
Osad nierozpuszczalny w wodzie może reagować z jakimś odczynnikiem, tworząc
substancję rozpuszczalną w wodzie. Obserwuje się wówczas zanikanie osadu.
A. Rozpuszczanie chlorku srebra w wodorotlenku amonu
W reakcji powstał rozpuszczalny w wodzie chlorek diaminasrebrowy, który dysocjuje:
Wykonanie ćwiczenia:
Zlać roztwór znad osadu chlorku srebra otrzymanego według punktu 1.4.1.D. Na
pozostały w probówce osad podziałać kilkoma kroplami roztworu wodorotlenku amonu
(1 mol/dm
3
) aż do jego rozpuszczenia.
B. Rozpuszczanie osadu w nadmiarze odczynnika wytrącającego
Wykonanie ćwiczenia:
Do 1 cm
3
roztworu chlorku rtęci (II) (0,25 mol/dm
3
) dodać l
2 krople roztworu jodku
potasu (0,5 mol/dm
3
) i zaobserwować wydzielanie się ceglastoczerwonego osadu jodku rtęci.
Zauważyć, że dodawanie dalszych kropli roztworu jodku potasu powoduje roztwarzanie
osadu, ponieważ powstaje rozpuszczalny w wodzie związek kompleksowy
jodortęcian (II)
potasu.
Pb(NO
3
)
2
+ 2KI PbI
2
↓ + 2KNO
3
lub jonowo:
Pb
2+
+ 2I
-
PbI
2
↓
HgCl
2
+ 2KI HgI
2
↓ + 2KCl
lub jonowo:
Hg
2+
+ 2I
-
HgI
2
↓
Rozpuszczenie powstałego osadu w nadmiarze odczynnika wytrącającego zachodzi według
reakcji:
HgI
2
↓ + 2KI
K
2
[HgI
4
]
lub jonowo:
HgI
2
↓ + 2I
-
[HgI
4
]
2-
AgCl↓ + 2NH
4
OH [Ag(NH
3
)
2
]Cl + 2H
2
O
[Ag(NH
3
)
2
]Cl [Ag(NH
3
)
2
]
+
+ Cl
-

11
Podobne doświadczenie można wykonać z osadem wodorotlenku ołowiu(II):
Wykonanie ćwiczenia:
Do 1 cm
3
roztworu azotanu ołowiu (II) (0,25 mol/dm
3
) dodać l
2 krople roztworu
wodorotlenku sodu (1 mol/dm
3
). Zaobserwować powstanie białego osadu wodorotlenku
ołowiu. Zwrócić uwagę na to, że dodawanie większej ilości roztworu wodorotlenku sodu
wywołuje znikanie osadu, co spowodowane jest powstawaniem rozpuszczalnego w wodzie
ołowianu (II) sodu.
1.4.3. Reakcje barwne (bez tworzenia osadu)
W wyniku reakcji powstaje produkt rozpuszczalny w wodzie, ale inaczej zabarwiony
niż substraty.
A. Rodanek potasu tworzy z jonami Fe
3+
rodanek żelaza (III) krwistoczerwonej barwy
Wykonanie ćwiczenia:
Do 1 cm
3
roztworu zawierającego jony Fe
3+
dodać kilka kropli roztworu rodanku
potasu (0,5 mol/dm
3
) i zaobserwować pojawienie się intensywnej krwistoczerwonej barwy.
B. Kwas szczawiowy odbarwia roztwór KMnO
4
Wykonanie ćwiczenia:
Do probówki wprowadzić 2
3 krople roztworu zawierającego manganian (VII) potasu
(0,5 mol/dm
3
) i około 1 cm
3
roztworu kwasu szczawiowego (0,5 mol/dm
3
), po czym
mieszaninę zakwasić, dodając 2 cm
3
roztworu kwasu siarkowego
(2 mol/dm
3
). Zawartość
probówki podgrzać w łaźni wodnej i po chwili zaobserwować zanikanie fioletowego
zabarwienia.
Pb(NO
3
)
2
+ 2NaOH Pb(OH)
2
↓ + 2NaNO
3
lub jonowo:
Pb
2+
+ 2OH
-
Pb(OH)
2
↓
Rozpuszczenie powstałego osadu zachodzi według reakcji:
Pb(OH)
2
↓ + 2NaOH Na
2
PbO
2
+ 2H
2
O
lub jonowo:
Pb(OH)
2
↓ + 2OH
-
PbO
2
2-
+ 2H
2
O
FeCl
3
+ 3KCNS
Fe(CNS)
3
+ 3KCl
lub jonowo:
Fe
3+
+ 3CNS
-
Fe(CNS)
3
5H
2
C
2
O
4
+ 2KMnO
4
+ 3H
2
SO
4
10CO
2
↑ + 2MnSO
4
+ K
2
SO
4
+ 8H
2
O
lub jonowo:
5C
2
O
4
2-
+ 2MnO
4
-
+ H
+
10CO
2
↑ + 2Mn
2+
+ 8H
2
O

12
1.4.4. Reakcje zachodzące z wydzielaniem produktu gazowego
A. Po zakwaszeniu roztworu węglanu sodu następuje intensywne wydzielanie CO
2
Wykonanie ćwiczenia:
Do probówki zawierającej 1 cm
3
roztworu węglanu sodu (0,5 mol/dm
3
) ostrożnie
dodać kroplami roztwór kwasu siarkowego
(1 mol/dm
3
). Zaobserwować intensywne wydzie-
lanie pęcherzyków gazu.
B. Powstawanie gazu może być wykryte przez pojawienie się charakterystycznego
zapachu
Wykonanie ćwiczenia:
Do probówki zawierającej 1 cm
3
roztworu chlorku amonu (salmiaku) (1 mol/dm
3
)
dodać 1 cm
3
roztworu wodorotlenku sodu (10
20%). Po chwili, trzymając probówkę w pew-
nej odległości od nosa, można wyczuć charakterystyczny zapach amoniaku.
Zwykle po dodaniu zasady zapach amoniaku jest słabo wyczuwalny. W takim wy-
padku roztwór należy lekko ogrzać, co przyspiesza reakcję i zmniejsza rozpuszczalność
amoniaku w roztworze.
Piśmiennictwo:
1. Bodzek D., Luks-Betlej K., Tyrpień K. (red.): Skrypt do ćwiczeń z chemii i chemii ogólnej dla studentów
I roku Wydziału Lekarskiego z Oddziałem Lekarsko-Dentystycznym w Zabrzu; wydanie IV. Śląski
Uniwersytet Medyczny, Katowice 2007.
Na
2
CO
3
+ H
2
SO
4
Na
2
SO
4
+ CO
2
↑ + H
2
O
lub jonowo:
CO
3
2-
+ 2H
+
CO
2
↑
+ H
2
O
NH
4
Cl + NaOH
NaCl + NH
3
↑ + H
2
O
lub jonowo:
NH
4
+
+ OH
-
NH
3
↑ + H
2
O

13
2. SPOSOBY UNIESZKODLIWIANIA SUBSTANCJI
CHEMICZNYCH
Do jednych z najgroźniejszych katastrof należą te związane z uwolnieniem się do
środowiska znacznych ilości niebezpiecznych substancji chemicznych, których liczba i róż-
norodność rośnie wraz z rozwojem przemysłu.
Pod pojęciem „substancji niebezpiecznej” rozumie się materiał, który
ze względu na
swoje właściwości chemiczne, biologiczne i promieniotwórcze
może w razie niepra-
widłowego obchodzenia się z nim lub celowego jego użycia (terroryzm) przyczynić się do
zagrożenia życia i zdrowia ludzi lub skażenia środowiska naturalnego.
Substancją niebezpieczną może być surowiec, półprodukt, produkt, odpad, a także
substancja uwalniana w wyniku awarii. Najpoważniejszym ich źródłem jest przemysł (ok.
75%), ale mogą również zostać uwolnione podczas transportu (ok. 25%).
Zespół czynności wykonywanych przez jednostki ratownictwa chemicznego, które
mają na celu neutralizację szkodliwego oddziaływania substancji niebezpiecznych na środo-
wisko, obiekty, ludzi i sprzęt, jest nazywany dekontaminacją albo odkażaniem.
Neutralizacją substancji chemicznych nazywamy proces lub zespół procesów, w wy-
niku których substancja niebezpieczna ulega takim przemianom fizycznym i/lub chemicznym,
że traci swoje niepożądane własności. W związku z tym bardzo często stosuje się roz-
cieńczanie i neutralizację chemiczną. Najczęściej wykorzystywanym rozcieńczalnikiem jest
woda. Należy pamiętać, że zastosowanie wody obniża stężenie związku chemicznego, lecz
nie zmienia go pod względem budowy i właściwości. Główną ideą neutralizacji chemicznej
jest to, aby związek chemiczny po dekontaminacji był mniej agresywny i niebezpieczny niż
po dekontaminacji prowadzonej inną techniką. Skuteczność neutralizacji zależy od ilości
użytego neutralizatora w odniesieniu do ilości neutralizowanego związku chemicznego, tem-
peratury i czasu reakcji.
W procesach unieszkodliwiania substancji niebezpiecznych wykorzystuje się reakcje
odpowiednie do rodzaju substancji:
reakcje zobojętniania
reakcje utleniania-redukcji (redoks)
reakcje hydrolizy
inne specyficzne reakcje chemiczne
Reakcja zobojętniania zachodzi pomiędzy kwasem a zasadą i w jej wyniku powstaje
obojętna sól i woda. Do neutralizacji kwasów, w celu podwyższenia wartości pH, używa się
roztworów wodorotlenku sodu (NaOH) i wodorowęglanu sodu (NaHCO
3
) oraz zawiesiny
wodorotlenku wapnia (Ca(OH)
2
) i węglanu wapnia (CaCO
3
). Do neutralizacji zasad, czyli
w celu obniżenia pH, stosuje się rozcieńczony kwas siarkowy (H
2
SO
4
) lub rozcieńczony kwas
chlorowodorowy (HCl). Należy pamiętać, że reakcja zobojętniania może powodować wzrost
temperatury środowiska reakcji.

14
W unieszkodliwianiu za pomocą reakcji redoks (reakcja przebiegająca ze zmianą
stopnia utlenienia substratów) jako utleniacze stosuje się np. chloran (I) sodu (NaClO),
chloran (I) wapnia (Ca(ClO)
2
) czy nadtlenek wodoru (H
2
O
2
).
Hydroliza to reakcja rozpadu związków chemicznych pod wpływem wody. Ulega jej
wiele niebezpiecznych substancji, np. bezwodniki, chlorki kwasowe, cyjaniany, nitryle itp.
Poprzez proces hydrolizy, który często jest łączony z utlenianiem, można również unieszko-
dliwiać niektóre bojowe środki trujące.
Wśród specyficznych reakcji wykorzystywanych do likwidacji substancji szkodliwych
można wymienić kompleksowanie (neutralizacja jonów cyjankowych w reakcji z siarczanem
żelaza (II), reakcje strącania osadów czy dysproporcjonownia (reakcje, podczas których ato-
my tego samego pierwiastka dwa razy zmieniają swój stopień utlenienia: raz się utleniają,
a drugi raz redukują).
Zdarzające się dość często przypadki skażeń, w których występują problemy z usta-
leniem rodzaju związku chemicznego, przyczyniły się do opracowania tzw. uniwersalnych
roztworów dekontaminacyjnych (RD). W razie konieczności neutralizacji substancji o nie-
ustalonym składzie chemicznym stosuje się kolejno następujące wodne roztwory dekonta-
minacyjne:
RD1 5% węglan sodu (Na
2
CO
3
) i 5% fosforan sodu (Na
3
PO
4
),
RD2 10% chloran (I) wapnia (Ca(ClO)
2
),
RD3 5% fosforan sodu (Na
3
PO
4
)
uniwersalny roztwór przeznaczony do spłukiwania
roztworów RD1 i RD2.
Do likwidacji skażeń substancjami niebezpiecznymi można również stosować piany
dekontaminacyjne. Piany powstające z pożarniczych środków pianotwórczych nie mają
chemicznego działania, tzn. nie wchodzą w reakcje chemiczne z usuwanymi substancjami.
Jednak zastosowanie ich może być pomocne w usuwaniu skażeń, dzięki działaniu
wchodzących w ich skład surfaktantów (substancji powierzchniowo czynnych), poprzez
procesy emulgowania i solubilizacji (zwiększania rozpuszczalności). Dotyczy to zwłaszcza
skażeń substancjami organicznymi, trudno rozpuszczalnymi w wodzie.
W ramach procesów dekontaminacyjnych stosuje się również sorpcję, która polega na
wykorzystaniu czynnika wiążącego substancję niebezpieczną, co ułatwia jej usunięcie z po-
wierzchni skażonej, zebranie do odpowiednich pojemników i przekazanie do dalszej neutrali-
zacji. Jest najczęściej używana w stosunku do związków chemicznych pozostających w nor-
malnych warunkach w postaci ciekłej. Dekontaminację sorpcyjną prowadzi się w przypadku
rozlewisk niebezpiecznych cieczy na utwardzonych, płaskich powierzchniach oraz ewentual-
nie na wodach powierzchniowych. Sorpcja z wykorzystaniem ogólnie dostępnych naturalnych
sorbentów (ciał porowatych) jest techniką niedrogą i łatwą do wdrożenia. Substancje wchło-
nięte przez sorbenty pozostają chemicznie niezmienione (nie następuje ich chemiczna neutra-
lizacja) i zachowują swoje niebezpieczne właściwości.
Przykładami sorbentów naturalnych są: piasek, trociny, słoma, węgiel aktywowany.
Do sorbentów syntetycznych zalicza się: pianki (poliuretanowe, mocznikowo-formaldehydo-
we, polieterowe) i włókna (nylonowe, polistyrenowe, polipropylenowe).
Działania ratownicze w wypadkach z substancjami chemicznymi wymagają prze-
strzegania bardzo rygorystycznych zasad bezpieczeństwa. Należy być świadomym nie tylko

15
możliwości wystąpienia kontaktu z substancją, która nawet w bardzo małych ilościach jest
niebezpieczna dla zdrowia i życia, ale także przenoszenia skażenia przez środowisko (wiatr,
rzeki) czy ludzi.
2.1. Neutralizacja substancji chemicznych w organizmie człowieka
Substancje chemiczne mogą przeniknąć do organizmu człowieka w wyniku połknięcia
(drogą pokarmową), inhalacji (drogą oddechową) lub przez skórę, wywołując niekorzystny
wpływ na jego zdrowie.
Neutralizacja substancji chemicznych w organizmie człowieka jest uzależniona od ich
charakteru, należy więc ściśle przestrzegać wytycznych dotyczących postępowania w przy-
padku zatrucia danym związkiem chemicznym.
Najprostszą metodą usuwania substancji chemicznych, które wniknęły do organizmu
drogą pokarmową, jest prowokowanie wymiotów albo płukanie żołądka. Metody te warto
rozważyć, jeśli połknięta substancja szkodliwa pozostaje w żołądku nie dłużej niż godzinę.
Jeśli od jej wniknięcia upłynęło więcej czasu, to w większości przypadków ani prowokowane
wymioty, ani płukanie żołądka nie przyniosą spodziewanych korzyści, a są obciążone
ryzykiem groźnych powikłań. Powyższych metod nie wolno stosować w przypadku zatruć
kwasami, zasadami i innymi silnie drażniącymi oraz żrącymi substancjami. Również przy
zatruciach rozpuszczalnikami organicznymi i detergentami procedury te mogą okazać się
niebezpieczne i dlatego są przeciwwskazane. Zachłyśnięcie się nimi może doprowadzić do
poważnego uszkodzenia płuc.
Jedną z procedur dekontaminacyjnych o dużych możliwościach w zakresie usuwania
trucizn z przewodu pokarmowego, zwłaszcza w zakresie zmniejszania stopnia ich wchła-
niania, jest doustne stosowanie węgla aktywowanego (tzw. węgla lekarskiego). Na jego po-
wierzchni może się w krótkim czasie zaadsorbować znaczna ilość połkniętej trucizny. Wę-
giel aktywowany podaje się doustnie w postaci gęstej zawiesiny wodnej, w dawce 1
2 g/kg
masy ciała, zawsze pod kontrolą, aby nie dopuścić do przedostania się jej do dróg od-
dechowych i uszkodzenia tkanki płucnej. Substancje, takie jak kwasy nieorganiczne, zasady,
sole kwasu cyjanowodorowego (cyjanki), sole żelaza oraz inne związki nieorganiczne,
niestety źle adsorbują się na węglu.
W celu neutralizacji związków żrących (stężonych kwasów, zasad) w przewodzie po-
karmowym człowieka nie można stosować węgla aktywowanego, prowokować wymiotów
mechanicznie lub farmakologicznie ani płukać żołądka. Pierwszym krokiem w takich przy-
padkach jest zobojętnienie kwasu lub zasady. Przykładowo przy zatruciach ługiem podaje się
najczęściej roztwór octu (łyżka octu na szklankę wody) czy soku z cytryny. W zatruciach
substancjami żrącymi zaleca się również ich rozcieńczanie, czyli zmniejszanie ich stężenia
w przewodzie pokarmowym (szczególnie w żołądku) przez podawanie do picia płynów,
przede wszystkim wody w ilości 5 cm
3
/kg masy ciała. Nie należy podawać związków zobo-
jętniających, które w reakcji z kwasem doprowadzają do powstania dwutlenku węgla, np.
sody oczyszczonej.

16
2.2. Wybrane przykłady neutralizacji substancji niebezpiecznych
i toksycznych
Kwas azotowy (V)
HNO
3
Jest cieczą żrącą i utleniającą, związkiem aktywnym chemicznie. Większość reakcji
z jego udziałem ma przebieg gwałtowny, a nawet wybuchowy. Gwałtownie rozpuszcza się
w wodzie z wydzieleniem ciepła. Jest związkiem nietrwałym, rozkładającym się pod wpły-
wem ogrzewania i światła, z wydzieleniem tlenku oraz dwutlenku azotu. Rozcieńczony
reaguje z wieloma metalami, wydzielając palny i wybuchowy wodór.
W przypadku pożaru w pobliżu otwartego zbiornika z kwasem azotowym do gaszenia
nie używa się wody. Do neutralizacji mniejszych ilości HNO
3
stosuje się wodorowęglan sodu
i spłukuje się dużą ilością wody. Następnie oczyszczoną powierzchnię pokrywa się środkami
wiążącymi (np. ziemią okrzemkową), po czym resztę produktów neutralizacji traktuje się jak
odpad specjalny.
Kwas siarkowy (VI)
H
2
SO
4
Kwas siarkowy działa żrąco na skórę i błony śluzowe. W postaci mgły i dymów wy-
wołuje ból i łzawienie oczu, oparzenia spojówek, rogówki, ból gardła, kaszel, duszność,
skurcz głośni, obrzęk krtani, skurcz oskrzeli, obrzęk płuc. Na skutek skurczu głośni może
nastąpić śmierć. Jego kontakt ze skórą może prowadzić do oparzeń termicznych (reakcja
egzotermiczna z wilgotną skórą) i chemicznych. Ich stopień zależy od stężenia i czasu
narażenia. Kontakt z oczami wywołuje poważne oparzenia powieki i gałki ocznej oraz jej
trwałe uszkodzenie (utratę wzroku lub trwałe zmętnienie rogówki). Spożycie tego kwasu
skutkuje oparzeniami jamy ustnej, gardła, przełyku i żołądka, objawiającymi się uczuciem
pragnienia, nudnościami, wymiotami, biegunką, krwawieniami z przewodu pokarmowego,
wreszcie wstrząsem. Dawka śmiertelna dla człowieka dorosłego wynosi 6
8 g.
Dekontaminacja stężonego kwasu polega na jego rozcieńczeniu wodą, a następnie
neutralizacji wodorowęglanem sodu. Produkt neutralizacji należy spłukać dużą ilością wody.
Bar (Ba)
W naturalnym środowisku bar występuje w bardzo niewielkich ilościach. Większe
ilości tego pierwiastka znaleźć można jedynie w glebie oraz takich produktach żywnościo-
wych, jak orzechy, wodorosty, ryby oraz niektóre rośliny.
Największe zagrożenie dla zdrowia występuje u osób, które pracują w przemyśle,
wykorzystującym ten pierwiastek. Dostaje się do organizmu drogą oddechową w postaci
siarczanów lub węglanów. Szkodliwość związków baru zależy od ich rozpuszczalności w wo-
dzie. Wszystkie rozpuszczalne w wodzie związki baru mają właściwości toksyczne, w prze-
ciwieństwie do trudno rozpuszczalnych. Na przykład rozpuszczalny w wodzie chlorek baru
(BaCl
2
) jest trucizną i przechowywany musi być pod ścisłą kontrolą, podczas gdy trudno-
rozpuszczalny siarczan baru (BaSO
4
), mało toksyczny, podaje się pacjentom jako kontrast
między innymi przy prześwietlaniu żołądka.

17
Długotrwałe narażenie na związki tego pierwiastka może wywoływać zaburzenia
równowagi, depresję, drżenie i skurcze mięśniowe, osłabienie, zmiany ciśnienia krwi, za-
kłócenia funkcji serca i porażenie ośrodka oddechowego. Pył baru jest szczególnie szkodliwy,
jeżeli przedostanie się do układu oddechowego człowieka. W kontakcie ze skórą metaliczny
bar powoduje oparzenia.
Do neutralizacji tych związków stosuje się siarczan sodu.
2.3. Ćwiczenia praktyczne
2.3.1. Neutralizacja substancji kwasowych za pomocą zasad i soli
Wykonanie ćwiczenia:
Do trzech probówek nalać po 1 cm
3
roztworu kwasu siarkowego (2 mol/dm
3
). Uniwer-
salnym papierkiem wskaźnikowym wstępnie zmierzyć pH roztworu, a następnie papierkiem
o zawężonej skali odczytać jego wartość dokładnie. Używając pipety z nasadką (nie
pipetować ustami!!!), do pierwszej probówki dodać 5 kropel roztworu wodorotlenku sodu
(2 mol/dm
3
, mocna zasada), wymieszać zawartość i zmierzyć pH roztworu. Czynność powta-
rzać aż do uzyskania pH=7. Sporządzić wykres zależności pH od liczby kropel dodanej
zasady. Identycznie postąpić z drugą i trzecią probówką, jednak zamiast roztworu wodo-
rotlenku sodu do drugiej probówki dodawać roztwór wodorotlenku amonu (2 mol/dm
3
, słaba
zasada), natomiast do trzeciej probówki
roztwór octanu sodu (2 mol/dm
3
, sól mocnej zasady
i słabego kwasu).
Z wykresów odczytać, ile kropel dodawanych substancji całkowicie neutralizuje bada-
ny roztwór.
2.3.2. Neutralizacja przez strącanie osadów
Jony Ba
+2
tworzą z anionami siarczanowymi (VI) trudnorozpuszczalny osad siarczanu
(VI) baru:
Ba(OH)
2
+ H
2
SO
4
BaSO
4
↓ + 2H
2
O
Wykonanie ćwiczenia:
Do zlewki o pojemności 150 cm
3
wlać 50 cm
3
wody destylowanej. Zanurzyć w nim
dwie blaszki żelazne lub miedziane znajdujące się w obwodzie elektrycznym z żarówką i ba-
terią kieszonkową 4,5 V. Dodać 3 krople kwasu siarkowego
(2 mol/dm
3
) obserwując jed-
nocześnie zachowanie się żarówki. Nieustannie mieszając, dodawać kroplami roztwór na-
syconego wodorotlenku baru (Ba(OH)
2
) (zachować ostrożność przy pracy z roztworami wo-
dorotlenku baru, ze względu na jego toksyczne właściwości!!!). O czym świadczy fakt, że
w pewnym momencie żarówka zgasła

18
2.3.3. Sorpcja jako metoda usuwania substancji chemicznych
Sorpcja na węglu aktywowanym
Węgiel aktywowany jest tak spreparowany, że powierzchnia jego cząstek jest silnie
rozwinięta. Oznacza to, że cząstki węgla aktywowanego mają na powierzchni wiele kanałów,
zagłębień i otworów nazywanych porami. Wiele barwników i substancji organicznych, ma-
jących podobnie jak węgiel własności hydrofobowe, może więc
w przeciwieństwie do wo-
dy i innych podobnych rozpuszczalników
osiadać w porach w sposób trwały. Dlatego,
jeśli do wodnego roztworu barwnika lub substancji organicznej, np. toksycznej, doda się
węgla aktywowanego, to zostanie ona zaadsorbowana na węglu, tworząc z nim trwałe, neu-
tralne połączenie i może być wraz z nim usunięta.
Wykonanie ćwiczenia:
Do pięciu probówek dodać po 2 krople niebieskiego atramentu i rozcieńczyć 5 cm
3
wody. Dodać małą porcję (ustaloną przez asystenta), węgla aktywowanego do pierwszej
probówki, 2 porcje do drugiej itd., a zawartość probówek dokładnie wymieszać. Po ok. 15
minutach roztwór można odsączyć lub zaczekać aż węgiel aktywowany ulegnie sedymentacji
(osiądzie na dnie). Ustalić, ile porcji węgla aktywowanego potrzebne jest do zaadsorbowania
substancji barwnej po 15 minutach.
Piśmiennictwo:
1. Bodzek D. (red.): Chemia i fizykochemia substancji toksycznych i niebezpiecznych. Skrypt dla stu-
dentów I roku studiów licencjackich specjalność: ratownictwo medyczne. Śląska Akademia Medyczna,
Katowice 2003.
2. Seńczuk W. (red.): Toksykologia współczesna. PZWL, Warszawa 2005, 2006.
3. http://www.ratownictwo.chem.pl/

19
3. TOKSYKOLOGIA ŚRODKÓW
PSYCHOAKTYWNYCH
Do tej grupy ksenobiotyków (czyli substancji egzogennych, obcych dla organizmu)
zalicza się m.in. substancje o działaniu narkotycznym, nasennym, uspokajającym, pobudza-
jącym i psychodysleptycznym (halucynogennym), które stosowane są zazwyczaj w celach
poprawienia nastroju. Zatrucia tymi związkami ściśle łączą się ze zjawiskiem toksykomanii
i uzależnienia od środków psychoaktywnych oraz alkoholu. Ponadto do grupy tej zalicza się
również leki przeciwdepresyjne i neuroleptyki, będące często przyczyną zatruć samobójczych
u chorych z zaburzeniami afektywnymi (depresją lub manią) i psychozami, które nie posia-
dają właściwości uzależniających. Na przebieg zatrucia ma wpływ wiele czynników, przede
wszystkim rodzaj użytego środka, droga podania, dawka, aktualny stan zdrowia i fakt przew-
lekłego kontaktu ze stosowaną substancją (zjawisko rozwoju tolerancji).
Do charakterystycznych objawów zatrucia substancjami działającymi depresyjnie na
ośrodkowy układ nerwowy (OUN), tj. opiatami, lekami uspokajającymi i nasennymi, należą
zaburzenia świadomości o różnym nasileniu oraz zaburzenia oddechowe i krążeniowe.
W przypadku zatrucia pochodnymi amfetaminy i innymi związkami działającymi podobnie
dominuje znaczne pobudzenie, zaczerwienienie skóry, wzrost ciśnienia tętniczego i częstości
akcji serca (tachykardia) oraz zaburzenia OUN (drgawki, urojenia, omamy). Wśród leków
przeciwdepresyjnych za najniebezpieczniejszą grupę uważane są trójpierścieniowe leki
przeciwdepresyjne (TLPD). W obrazie klinicznym, poza objawami ośrodkowymi (napady
drgawkowe, hipo- lub hipertermia, zaburzenia oddechowe, pobudzenie lub śpiączka),
dominują głównie zaburzenia krążeniowe, w tym szczególnie często komorowe zaburzenia
rytmu, z migotaniem komór włącznie. Dodatkowo może wystąpić tzw. zespół cholinolityczny
związany z działaniem atropinopodobnym TLPD (hipertermia, tachykardia, suchość błon
śluzowych i zaburzenia widzenia). Przebieg zatrucia środkami halucynogennymi ma
zazwyczaj łagodny, choć spektakularny charakter.
Substancje o działaniu psychoaktywnym mogą być wykrywane zarówno w materiale
konfiskowanym przez policję lub służby celne, resztkach trucizny znalezionych przy osobie
zatrutej (w obu przypadkach poszukuje się niezmetabolizowanej trucizny), jak i w materiale
biologicznym (mocz, krew, ślina, popłuczyny żołądkowe), w którym bada się obecność
substancji macierzystych oraz metabolitów trucizn.
Zatrucia lekami, w tym szczególnie środkami o działaniu psychoaktywnym, stanowią
obecnie w Polsce jedną z głównych przyczyn ostrych zatruć (procentowo plasują się na
drugim miejscu po zatruciach alkoholem i jego substytutami).

20
3.1. Ćwiczenia praktyczne
3.1.1. Wykrywanie środków psychotropowych z grupy pochodnych
fenotiazyny i trójpierścieniowych leków przeciwdepresyjnych (TLPD)
oraz ich metabolitów w moczu
Pod wpływem środków utleniających, np. kwasu azotowego (V) (HNO
3
), chlorowego
(VII) (HClO
4
) i chlorku żelaza (III) (FeCl
3
) (ich mieszaniną jest odczynnik Forresta), leki
z tych grup oraz ich metabolity zawarte w moczu tworzą charakterystycznie zabarwione
pochodne. Neuroleptyki fenotiazynowe zazwyczaj dają produkty o różnych odcieniach
czerwieni, natomiast TLPD
o zabarwieniu zielonym lub niebieskim. Reakcja może być
wykorzystywana do szybkiej kontroli przyjmowania leków przeciwpsychotycznych z grupy
pochodnych fenotiazyny przez pacjentów leczonych ambulatoryjnie lub w szybkiej diagno-
styce zatrucia nimi. Niestety, reakcja nie jest w pełni specyficzna dla omawianych grup
związków i jej dodatni wynik wymaga zawsze potwierdzenia innymi technikami analitycz-
nymi (immunochemicznymi lub chromatograficznymi)
zwłaszcza, jeśli próbka badana
pochodzi od osoby zatrutej.
Wykonanie ćwiczenia:
Do kilku cm
3
moczu dodać równą objętość odczynnika Forresta. Zaobserwować
pojawiające się zabarwienie. Jeżeli analizowana próbka moczu nie będzie pochodzić od osoby
narażonej na neuroleptyki fenotiazynowe lub TLPD, to zawartość probówki nie zmieni
zabarwienia.
3.1.2. Wykrywanie i identyfikacja najczęściej spotykanych środków
psychoaktywnych
Pod wpływem specyficznych odczynników, najczęściej o działaniu utleniającym,
w wyniku reakcji ze środkami uzależniającymi dochodzi do tworzenia charakterystycznie
zabarwionych produktów. Reakcje te stosowane są do szybkiego, przesiewowego identy-
fikowania substancji uzależniających, np. przez celników. Wstępna identyfikacja musi być
następnie potwierdzona inną metodą, np. badaniem chromatograficznym.
Do identyfikacji substancji uzależniających stosowane są:
stężony (96%) kwas siarkowy (VI) H
2
SO
4
,
stężony (65%) kwas azotowy (V) HNO
3
,
odczynnik Marquisa mieszanina 40% roztworu formaldehydu (formaliny) i stężonego
kwasu siarkowego (VI),
odczynnik Froehdego roztwór kwasu molibdenowego (lub molibdenianu sodu) w stę-
żonym kwasie siarkowym (VI),
odczynnik Mandelina roztwór metawanadynianu amonu w stężonym kwasie siarkowym
(VI).

21
Wykonanie ćwiczenia:
Do pięciu wgłębień porcelanowej płytki wprowadzić niewielkie ilości badanej sub-
stancji i zadać poszczególnymi odczynnikami (kilka kropel). Obserwować pojawiające się
zabarwienie (w niektórych przypadkach dochodzi do zmiany zabarwienia w czasie lub za-
barwienie nie powstaje) i porównać otrzymane wyniki z danymi w tabeli I.
3.1.3. Wykrywanie barbituranów
próba Zwikkera
Barbiturany i inne związki zawierające w cząsteczce ugrupowanie –CO-NH-CO-
tworzą z solami kobaltu w środowisku bezwodnym i w obecności zasad (amoniaku,
piperydyny lub dietyloaminy) fioletowe kompleksy. Reakcja może być wykorzystywana do
identyfikacji barbituranów, np. w skonfiskowanych środkach uzależniających. Do wykry-
wania pochodnych kwasu barbiturowego w materiale biologicznym stosowane są inne me-
tody analityczne (chromatograficzne lub immunochemiczne).
Wykonanie ćwiczenia:
W probówce umieścić kilka kryształków pochodnej kwasu barbiturowego (barbital,
fenobarbital lub inna pochodna kwasu barbiturowego), a następnie dodać około 2 cm
3
meta-
nolowego roztworu chlorku kobaltu (1%) i kilka kropli roztworu piperydyny lub dietyloaminy
(10%) w metanolu. W obecności pochodnych kwasu barbiturowego powstaje trwale fioletowe
zabarwienie.
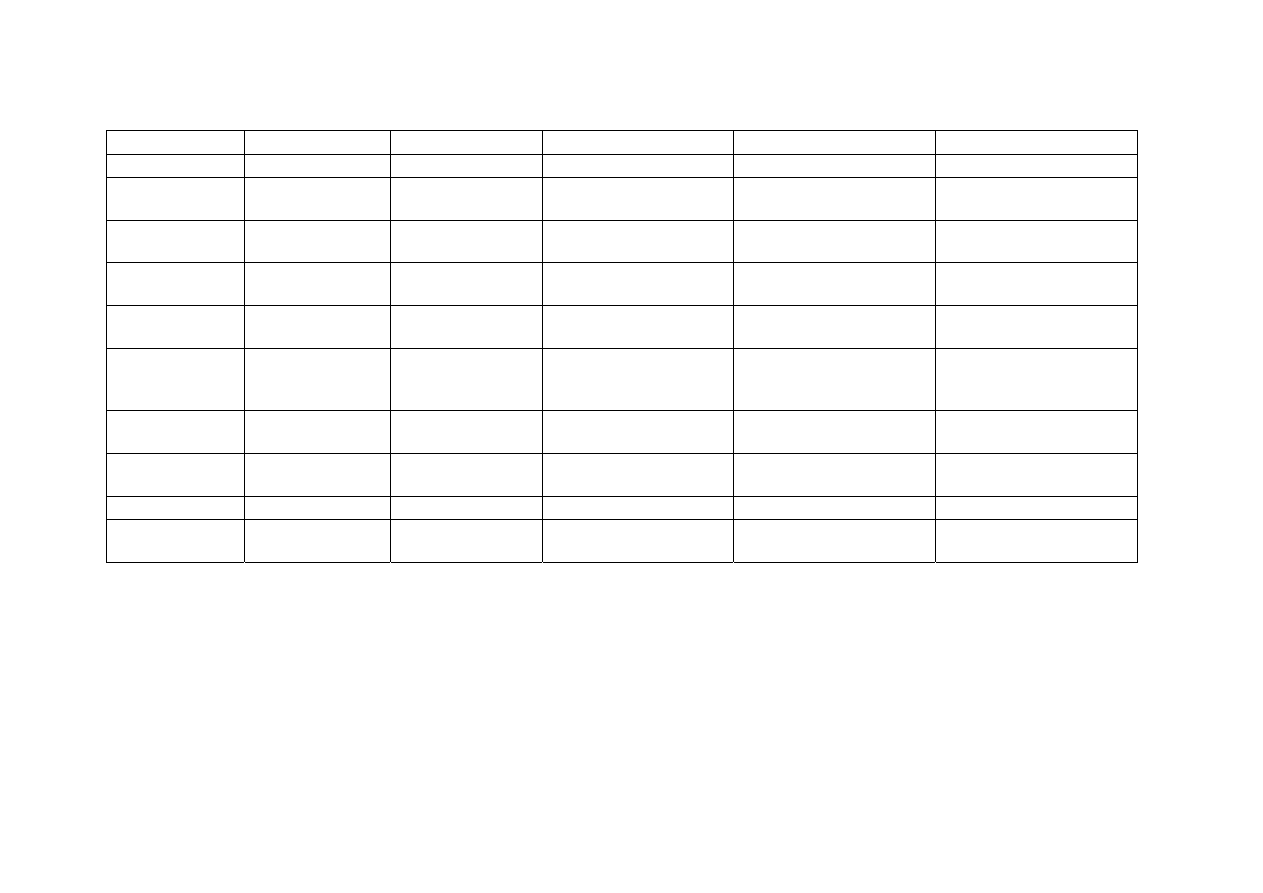
Tabela I. Wykrywanie środków psychoaktywnych za pomocą reakcji barwnych (przesiewowa analiza kroplowa)
Badany związek
Kwas siarkowy
Kwas azotowy
Odczynnik Marquisa Odczynnik
Froehdego Odczynnik
Mandelina
Amfetamina
pomarańczowe brązowe
Chlordiazepoksyd
(Elenium)
żółte
żółte cienmopomarańczowe
Chloropromazyna czerwono-
karminowe
brązowo-żółte czerwone niebieskofioletowe
czerwone
purpurowe
Imipramina jasnoniebieskie
po
½ min
granatowe zielone
jasnoniebieskie
jasnoniebieskie
żółte jasnobrązowe
niebieskie
Kodeina
pomarańczowe fioletowe żółte zielone
niebieskie
żółto-zielone
Morfina
czerwone
pomarańczowe
żółte
czerwone fioletowe
fioletowe zielone żółte
czerwono-fioletowe
brunatno-fioletowe
Papaweryna żółte niebiesko-różowe
żółte zielone
niebiesko-zielone
zielone
Pentazocyna
żółte ciemnoczerwone
zielone oliwkowe
niebieskie granatowe
oliwkowe
Petydyna
pomarańczowe po ½ min
pomarańczowe (znikające)
Promazyna
różowo-
pomarańczowe
żółte purpurowo-pomarańczowe czerwone
zielone
czerwone
zielone czerwone
22

23
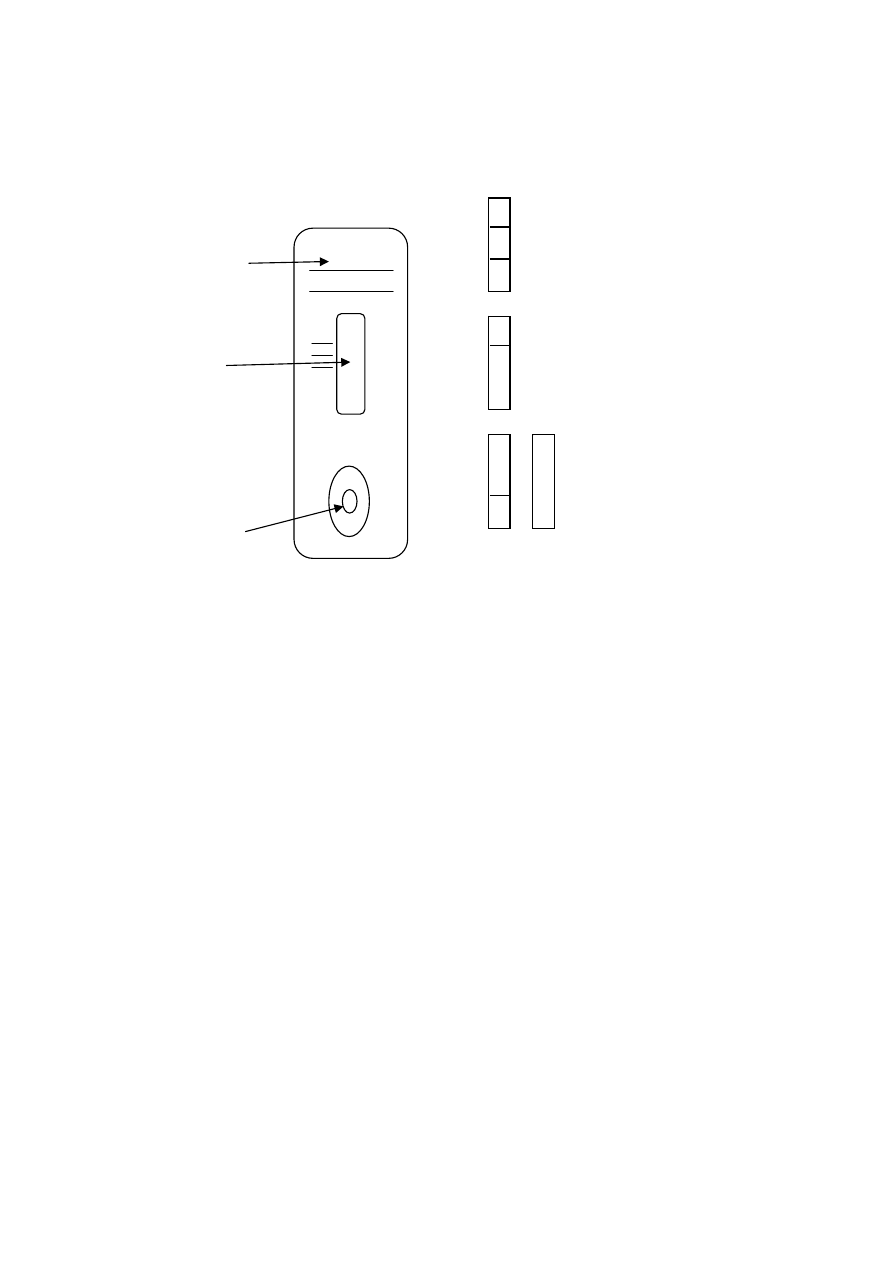
3.1.4. Immunochromatografia
przesiewowa analiza środków
psychoaktywnych i ich metabolitów w moczu za pomocą testu
kasetkowego
Test służy do wykrywania obecności w moczu wielu środków uzależniających i ich
metabolitów. W tabeli II zamieszczono listę substancji, które można oznaczyć, oraz podano
najniższe wykrywane stężenia. Jeśli stężenie danej substancji lub jej pochodnych, ewentualnie
metabolitów, przekracza wykrywalność testu, uzyskuje się wynik pozytywny (dodatni).
Podczas badania metodą immunochromatograficzną analizowane substancje uzależ-
niające (jeśli są obecne w badanej próbce moczu) wędrują w nośniku umieszczonym w ka-
setce wraz z tzw. koniugatem. Koniugat jest to przygotowane przez producenta testu i pier-
wotnie umieszczone w miejscu nanoszenia próbki moczu, kowalencyjne połączenie anali-
zowanej substancji z barwnym znacznikiem (np. złotem koloidalnym). Wędrując w nośniku,
badana substancja i koniugat jednocześnie docierają do linii testowej, na powierzchni której
unieruchomione są specyficzne dla wykrywanej substancji przeciwciała. Oznaczana sub-
stancja zawarta w próbce moczu konkuruje z koniugatem o związanie się ze swoistym prze-
ciwciałem. Jeśli w analizowanej próbce zawartość danej substancji jest niższa od wykry-
walności testu, to nie wszystkie miejsca wiążące swoistych przeciwciał zostaną przez nią
zajęte. Pozostałe wolne miejsca połączą się z koniugatem i w efekcie pojawi się zabarwienie
w obszarze linii testowej (na kasetce litera T), oznaczające ujemny wynik testu. Jeśli
zawartość środka psychoaktywnego w moczu będzie wyższa od wykrywalności testu i badana
substancja zajmie wszystkie miejsca wiążące na przeciwciele, wówczas nie pojawi się
zabarwienie w obrębie linii testowej (na kasetce litera T), co będzie oznaczać dodatni wynik
testu.
Właściwy przebieg testu oceniany jest w obszarze linii kontrolnej (na kasetce litera C).
Prawidłowo wykonane badanie powoduje pojawienie się barwnej linii w tym obszarze,
świadcząc o tym, że dodano odpowiednią objętość badanej próbki moczu do prawidłowego
wykonania testu.
Należy pamiętać, że testy kasetkowe znajdują zastosowanie tylko w badaniach
przesiewowych, a dodatni wynik (szczególnie u pacjenta w ciężkim stanie klinicznym)
wymaga potwierdzenia inną (często ilościową) metodą analityczną! W przypadku badania
obecności niektórych środków uzależniających (np. pochodnych amfetaminy) często zdarzają
się wyniki fałszywie dodatnie, wywołane obecnością w moczu innych niż amfetaminy
związków chemicznych (np. leków stosowanych w leczeniu przeziębienia).
Wykonanie ćwiczenia:
Do wykonania ćwiczenia potrzebne są:
płytka testowa
zakraplacz
badane próbki moczu
24
1. Przed analizą płytkę testową, próbki oraz/lub roztwory wzorcowe doprowadzić do tem-
peratury pokojowej.
2. Umieścić płytkę testową na płaskiej powierzchni. Trzymając zakraplacz pionowo, prze-
nieść 3 pełne krople tej samej próbki moczu do wgłębienia, a następnie włączyć stoper.
Nie dopuścić do utworzenia pęcherzyków powietrza we wgłębieniu.
3. Po 5 minutach odczytać wyniki:
Wynik negatywny: jedna barwna linia w obszarze kontrolnym (C) oraz druga barwna
w obszarze testowym (T) dla określonej substancji.
Wynik pozytywny: jedna barwna linia w obszarze kontrolnym (C) oraz brak barwnej
linii w obszarze linii testu (T) dla określonej substancji.
Wynik nieważny: nie pojawia się linia kontrolna. Badanie powtórzyć! Sprawdzić
termin ważności testu i warunki jego przechowywania.
C
T
C
T
C
T
wgłębienie, do którego
wkrapla się badany mocz
Negatywny
Pozytywny
Nieprawidłowy
Interpretacja wyników
Odczyt
C
linia kontrolna
T – linia testowa dla oznaczanej substancji
Płytka testowa
opis próbki moczu
pole testowe
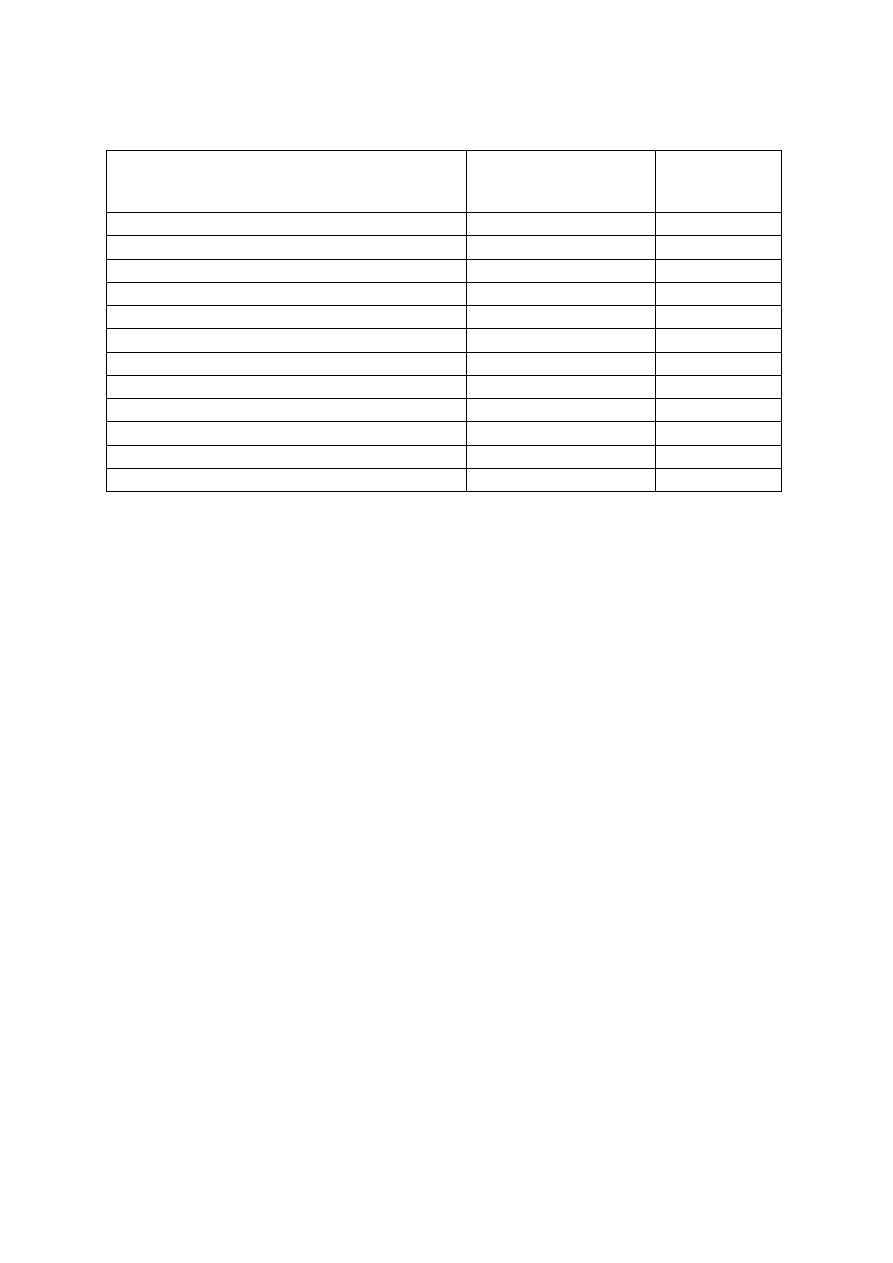
25
Tabela II. Lista substancji wykrywanych testem kasetkowym oraz najniższe wykrywane stężenie
(wykrywalność)
Test Substancja
wzorcowa
Granica
wykrywalności
testu (ng/cm
3
)
Amfetamina (AMP)
d-amfetamina
1000
Barbiturany (BAR)
sekobarbital
300
Benzodiazepiny (BZO)
oksazepam
300
Kokaina (COC)
benzoiloekgonina
300
Tetrahydrokanabinol (THC)
11-nor-
9-THC-9COOH 50
Metadon (MTD)
metadon
300
Opiaty (OPI)
morfina
2000
Fencyklidyna (PCP)
fencyklidyna
25
Trójpierścieniowe leki przeciwdepresyjne (TLPD)
nortryptylina
1000
3,4-metylenodioksymetamfetamina (MDMA)
MDMA
500
Metamfetamina (MET)
metamfetamina
1000
Morfina (MOP)
morfina
300
Piśmiennictwo:
1. Kała M.: Analiza toksykologiczna środków uzależniających. Wydawnictwo Instytutu Ekspertyz Sądowych,
Kraków 2000.
2. Kubalski J., Tobolska-Rydz H.: Środki uzależniające. PZWL, Warszawa 1984.
3. Szukalski B. (tłum.): Metody analizy środków uzależniających. Instytut Psychiatrii i Neurologii, Warszawa
1997.

26
4. TOKSYKOLOGIA ROZPUSZCZALNIKÓW
ORGANICZNYCH
Rozpuszczalnikami organicznymi nazywamy lotne w warunkach normalnych ciecze,
które rozpuszczają substancje organiczne, przede wszystkim te, które nie rozpuszczają się
w wodzie. Są zróżnicowane pod względem chemicznym, a najważniejsze z nich to: węglo-
wodory i ich chlorowcowe pochodne, ketony, alkohole, estry, etery i disiarczek węgla.
Rozpuszczalniki organiczne stosuje się przede wszystkim w przemyśle do roz-
puszczania i rozcieńczania substratów oraz produktów. Znajdują również zastosowanie jako
środki chłodzące w urządzeniach zamrażających, do gaszenia pożarów, do dezynfekcji, jako
materiały pędne itp. Drogami ich wnikania do organizmu są przewód pokarmowy, układ
oddechowy i skóra. Niektóre z rozpuszczalników ułatwiają wchłanianie innych związków do
ustroju. Działają drażniąco na skórę, a po wchłonięciu w większych stężeniach do krwiobiegu
wywierają działanie narkotyczne.
Do najczęściej stosowanych rozpuszczalników należą alkohole, a wśród nich etanol,
jeden z najbardziej popularnych środków uzależniających i psychoaktywnych. Oddziałuje on
na błonę śluzową jamy ustnej, przełyku, żołądka i górnej części jelita cienkiego. Naduży-
wanie alkoholu jest przyczyną zaburzeń w układach: nerwowym, dokrewnym, krążenia, po-
karmowym, moczowo-płciowym i mięśniowym. U osób nadużywających alkoholu, częściej
niż u niepijących, stwierdza się nowotwory złośliwe różnych narządów. Podobnie jak alkohol
etylowy, alkohol metylowy równie dobrze wchłania się przez drogi oddechowe oraz przez
skórę (główna przyczyna zatruć w przemyśle), a także przez przewód pokarmowy. Jest
bardzo silną trucizną, nieporównywalnie silniejszą od alkoholu etylowego. Tę dużą tok-
syczność potęguje fakt, że metanol kumuluje się w ustroju, osiągając w tkankach znacznie
wyższe stężenie, a jego eliminacja z krwi przebiega czterokrotnie wolniej niż etanolu. W pier-
wszym etapie metabolizmu metanol ulega przemianie do aldehydu mrówkowego pod
wpływem dehydrogenazy alkoholowej, następnie przechodzi w kwas mrówkowy, który dalej
zostaje utleniony do CO
2
i H
2
O. Aldehyd i kwas mrówkowy są odpowiedzialne za
uszkodzenie nerwu wzrokowego, co często prowadzi do ślepoty. Wystąpienie objawów
zatrucia metanolem może mieć miejsce nawet 24 godziny po jego spożyciu. Na początku są
to bóle głowy, nudności, wymioty, osłabienie. W dalszym przebiegu zatrucia pojawiają się
zaburzenia widzenia, potem sinica, śpiączka, zapaść i śmierć. Charakterystyczne są za-
burzenia gospodarki kwasowo-zasadowej pod postacią kwasicy metabolicznej. W takich
przypadkach bardzo ważne jest zapewnienie zatrutemu jak najszybciej specjalistycznej opieki
medycznej.
Glikol etylenowy jest bezbarwną, oleistą cieczą, o słodkawym smaku, mieszającą się
dobrze w każdym stosunku z wodą. Znajduje on zastosowanie jako rozpuszczalnik celulozy
i niektórych farb. Może wchodzić w skład preparatów przeciw zamarzaniu szyb, płynów do
chłodnic, tuszów do stempli oraz żywic syntetycznych. Glikol etylenowy najczęściej dostaje
się do ustroju po omyłkowym lub celowym wypiciu płynu zawierającego w składzie glikol,
27
np. płynu do chłodnic. Przemiany metaboliczne (głównie utlenianie) prowadzą do powstania
kwasu szczawiowego, odpowiedzialnego za obecne w ostrych zatruciach zmiany w nerkach
i występującą zawsze bardzo głęboką kwasicę metaboliczną. Część glikolu wydalana jest
z moczem w formie niezmienionej. Z powietrzem wydychanym wydalany jest w postaci
dwutlenku węgla w ilości 60% w ciągu 3 dni, a mniej niż 2% w postaci kwasu szczawiowego.
Wydalanie tego metabolitu przebiega bardzo wolno i trwa od 2 do 6 tygodni. Za działanie
toksyczne odpowiadają również kwasy glioksalowy i glikolowy oraz inne kwasy organiczne
(ryc. 1).
Ryc. 1. Metabolizm glikolu etylenowego.
Glikol etylenowy wywiera działanie narkotyczne, a gromadząc się w płynie mózgo-
wo-rdzeniowym, może wywołać ciężkie uszkodzenie ośrodkowego układu nerwowego. Ma
również dużą zdolność penetrowania innych tkanek i narządów. W ostrym zatruciu glikolem
można wyróżnić trzy okresy. Pierwszy rozpoczyna się 30 minut do 12 godzin od spożycia
i charakteryzuje się objawami narkotycznymi ze strony ośrodkowego układu nerwowego
(OUN), podobnymi do zatrucia alkoholem etylowym oraz stopniowo rozwijającą się kwasicą.
W drugim okresie pojawia się niewydolność układów krążenia i oddychania, a także objawy
obrzęku mózgu i napady padaczkowe. Powstają zmiany zwyrodnieniowe w siatkówce oka
i nerwie wzrokowym. W trzecim okresie nasilają się objawy niewydolności nerek i narasta
kwasica.
Do grupy rozpuszczalników aromatycznych należy benzen
najprostszy węglowodór
aromatyczny. Doprowadza do uszkodzenia układu nerwowego i szpiku kostnego (u osób
narażonych na częsty kontakt z benzenem może to być przyczyną białaczki). Homologami
benzenu są toluen, etylobenzen i ksyleny. Substancje te to lotne, palne ciecze o charakte-
rystycznym zapachu, niemieszające się z wodą. Stosowane są jako rozpuszczalniki lakierów,
farb drukarskich, klejów i gumy, jako środki ekstrahujące, odtłuszczające oraz czyszczące. Są
ważnymi surowcami w przemyśle chemicznym i farmaceutycznym. Objawami ostrego
zatrucia rozpuszczalnikami aromatycznymi mogą być podrażnienie błon śluzowych układu
oddechowego, bóle i zawroty głowy, pobudzenie, nudności, wymioty. W dużych stężeniach
związki te działają narkotycznie, uszkadzają wątrobę i nerki, powodują zaburzenia rytmu
serca z ryzykiem migotania komór, utraty przytomności i śmierci. Ciekłe ksyleny wywierają
CH
2
OH
CH
2
OH
CH
2
OH
CHO
CH
2
OH
COOH
CHO
COOH
COOH
COOH
HCOOH
CH
2
NH
2
CH
2
OH
CH
2
NHCOC
6
H
5
CH
2
OH
kwas aminooctowy
(glicyna)
kwas hipurowy
glikol
etylenowy
aldehyd
glikolowy
kwas
glikolowy
kwas
glioksalowy
kwas
mrówkowy
kwas
szczawiowy
CO
2 +
H
2
O

28
miejscowe działanie drażniące, wywołują podrażnienie spojówek i ich zaczerwienienie, mogą
uszkadzać rogówkę.
Omówione powyżej rozpuszczalniki organiczne należą do substancji łatwopalnych,
natomiast do rozpuszczalników niepalnych należą chlorowcowe pochodne węglowodorów
alifatycznych, jak chloroform, di- i tetrachlorometan. Efekt toksyczny tej grupy rozpusz-
czalników wiąże się z odszczepianiem chloru przy udziale enzymów mikrosomalnych i wy-
twarzaniem wolnych rodników, a końcowym produktem tych przemian jest tlenek węgla.
Większość z nich prawdopodobnie wykazuje własności kancerogenne. Wiadomo, że chlo-
rowcopochodne węglowodorów mają działanie hepatotoksyczne, które rośnie wraz ze wzro-
stem liczby atomów chloru w cząsteczce.
Disiarczek węgla łatwo ulega samozapłonowi, w temperaturze niższej niż 100°C,
z możliwością wybuchu par. W największych ilościach jest stosowany jako rozpuszczalnik do
wytwarzania włókien wiskozowych, ale także w syntezie organicznej i jako rozpuszczalnik do
flotacji minerałów. Należy do związków trujących o działaniu szkodliwym na ośrodkowy
układ nerwowy. Długotrwałe wchłanianie disiarczku węgla w niższych stężeniach powoduje
trwałe uszkodzenia mózgu. Związek ten wykazuje też działanie rakotwórcze i mutagenne.
4.1. Ćwiczenia praktyczne
4.1.1. Badanie właściwości fizycznych rozpuszczalników organicznych
Badanie właściwości fizycznych rozpuszczalników organicznych: acetonu, metanolu,
etanolu, izopropanolu, butanolu, eteru, chloroformu, heksanu, toluenu, ksylenu, octanu etylu,
disiarczku węgla oraz ocena zapachu i rozpuszczalności w wodzie:
Badanie zapachu należy zbliżyć wylot probówki, w której znajduje się badany roz-
puszczalnik, do nosa i wykonać szybki, delikatny wdech przez nos z jednoczesną
wentylacją dłonią.
Badanie rozpuszczalności w wodzie dodać 1 cm
3
badanego rozpuszczalnika do probówki
napełnionej w 1/3 wodą destylowaną, od czasu do czasu wstrząsając. Po upływie kilku
minut ocenić stopień rozpuszczenia badanego rozpuszczalnika w wodzie.
4.1.2. Oznaczanie etanolu w surowicy metodą enzymatyczną
Dehydrogenaza alkoholowa (ADH) katalizuje reakcję utleniania alkoholu. Towarzy-
szy jej redukcja dinukleotydu nikotynoamidoadeninowego (NAD
+
) do formy zredukowanej
o wyższym współczynniku absorpcji molowej:
C
2
H
5
OH + NAD
+
CH
3
CHO + NADH
Powstający aldehyd octowy usuwany jest w reakcji z hydrazyną:
CH
3
CHO + NH
2
-NH
2
H
2
O + CH
3
-CH=N- NH
2
Obniżenie stężenia jednego z produktów (CH
3
CHO) w środowisku reakcji przesuwa
jej równowagę w prawo i pozwala na ilościowe utlenienie etanolu obecnego w badanej
próbce.

29
Odczynniki:
1. Odczynnik enzymatyczny zawierający dehydrogenazę alkoholową, hydrazynę i dinukleo-
tyd nikotynoamidoadeninowy w buforze glicynowym o pH 9,0.
2. Roztwór etanolu (1 g/dm
3
= C
wzorca
).
Wykonanie ćwiczenia:
Przygotować trzy probówki i wprowadzić do nich po 3 cm
3
odczynnika enzyma-
tycznego. Do jednej (próbka badana) dodać 10
l badanej surowicy przepłukując końcówkę
pipety w odczynniku znajdującym się w probówce. Do drugiej probówki (próbka wzorcowa)
wprowadzić 10
l roztworu etanolu (również przepłukując końcówkę pipety zawartością
probówki). Zawartości obu probówek dobrze wymieszać i odstawić na 15 minut w tem-
peraturze pokojowej. Trzecia probówka zawierająca sam odczynnik enzymatyczny stanowić
będzie próbkę ślepą.
Zmierzyć absorbancję A próbki badanej i wzorcowej wobec ślepej przy długości fali
340 nm lub 360 nm. Wynik obliczyć ze wzoru:
stężenie etanolu [g/dm
3
] = (A
próbki badanej
x
C
wzorca
)/A
wzorca
)
Liniowość metody: do 3 g/dm
3
. Próbki o wyższym stężeniu etanolu należy rozcień-
czyć 5-krotnie wodą destylowaną i oznaczyć ponownie.
4.1.3. Wykrywanie etanolu w ślinie
Alkohol można też wykrywać czułymi i łatwymi do zastosowania testami, np.
ALCO-SCREEN firmy Chematics. Jest to nieinwazyjny test umożliwiający wykrywanie
alkoholu w ślinie, działający w taki sposób, że w wyniku kontaktu z alkoholem zawartym
w ślinie (proporcjonalnie do stężenia alkoholu w krwi) zachodzi reakcja z chromogennym
składnikiem testu. Pojawia się zabarwienie od jasnozielono-szarego do ciemnoniebiesko-
szarego w zależności od stężenia alkoholu w krwi (do 3 ‰). Jeśli wymagane jest dokładne
określenie stężenia alkoholu, pozytywny wynik uzyskany przy użyciu ALCO-SCREEN musi
być zweryfikowany za pomocą odpowiedniej procedury umożliwiającej dokładny pomiar.
Wykonanie ćwiczenia:
Nanieść próbkę śliny na próbnik testu o barwie jasnokremowej i odczekać 2 minuty.
Oszacować stężenie alkoholu w krwi, porównując kolor próbnika z kolorami na opakowaniu
testu.
4.1.4. Wykrywanie metanolu
próba kroplowa
Wykonanie ćwiczenia:
We wgłębieniu płytki porcelanowej umieścić kryształek fosforanu kodeiny, a następ-
nie zwilżyć 1 kroplą stężonego kwasu siarkowego
(96%). Do probówki odmierzyć 3 krople
roztworu metanolu (50%, v/v), a następnie 15 kropel stężonego kwasu siarkowego. Probówkę
ochłodzić w łaźni z zimną wodą. Odmierzyć 3 krople tak sporządzonej mieszaniny i umieścić

30
we wgłębieniu, gdzie znajdowała się kodeina. Powstająca po czasie barwa niebieska wskazuje
na obecność metanolu.
4.1.5. Wykrywanie glikolu etylenowego
Wykonanie ćwiczenia:
Do około 1 cm
3
glikolu etylenowego dodać 1 cm
3
roztworu wodorotlenku sodu (10%)
i kroplami roztwór siarczanu miedzi (10%). Powstający wodorotlenek miedzi (II) tworzy
z glikolem związek rozpuszczalny w wodzie o zabarwieniu niebieskim.
2 NaOH + CuSO
4
Na
2
SO
4
+ Cu(OH)
2
Piśmiennictwo:
1. Brandys J.: Toksykologia
wybrane zagadnienia. Wydawnictwo Uniwersytetu Jagiellońskiego, Kraków
1999.
2. Seńczuk W. (red.): Toksykologia współczesna. PZWL, Warszawa 2005, 2006.
3. Timbrell J.: Paradoks trucizn. Wydawnictwo Naukowo-Techniczne, Warszawa 2008.
C
C H
H
H
OH
H
OH
+
Cu(OH)
2
H C C H
H H
O O
Cu
+
2H
2
O
niebieski

31
5. TOKSYKOLOGIA ZWIĄZKÓW
NIEORGANICZNYCH I GAZÓW
Toksykologia związków nieorganicznych dotyczy zatruć ostrych i chorób będących
wynikiem narażenia człowieka na zanieczyszczenia środowiska naturalnego oraz środowiska
pracy toksycznymi metalami i niemetalami bądź ich związkami.
Prawidłowe funkcjonowanie organizmu człowieka zależy m.in. od pierwiastków
niezbędnych do życia, tzw. makroelementów: wapń, fosfor, sód, potas, siarka. Do mikro-
elementów, tj. pierwiastków, których stężenie nie powinno przekraczać określonej, bezpiecz-
nej dla człowieka wartości, należą m.in. cynk, miedź, mangan, selen. Inne pierwiastki, które
nie są niezbędne dla organizmu, w tym metale: rtęć, glin, kadm, ołów, chrom (VI), mogą
stanowić przyczynę zatruć.
Szkodliwość pierwiastków chemicznych i ich związków zależy od dawki, drogi wpro-
wadzenia do organizmu, od podatności na biokumulację ze środowiska, łatwości resorpcji
z przewodu pokarmowego, zdolności do przenikania przez barierę krew-mózg i łożysko,
a także od tendencji do uszkadzania DNA i RNA. Jony metali wiążą się w organizmie
człowieka z grupami sulfhydrylowymi (–SH) enzymów i białek oraz z grupami karboksy-
lowymi aminokwasów. Silniejsze działanie toksyczne wykazują związki dobrze rozpusz-
czalne w wodzie lub płynach ustrojowych. Metale wprowadzane do organizmu w formie
związków organicznych (połączenia alkilowe), ze względu na właściwości lipofilowe, mogą
łatwo przenikać przez błony biologiczne, w tym przez ściany komórkowe. Pierwiastki
podlegające kumulacji w narządach miąższowych wykazują wyższy stopień toksyczności niż
gromadzone w tkankach twardych i skórze. Nawet minimalne stężenie metali toksycznych
może być powodem zaburzeń metabolicznych, zmian prawidłowego funkcjonowania enzy-
mów oraz osłabienia procesów immunologicznych, prowadzących chorób, a nawet śmierci.
Ostre lub przewlekłe zatrucia związkami nieorganicznymi mogą stanowić przyczynę uszko-
dzeń różnych narządów i układów.
Do najbardziej niebezpiecznych dla człowieka gazów należą: amoniak, tlenek węgla,
cyjanowodór, siarkowodór, chlor, tlenki azotu, dwutlenek siarki, a także niektóre gazy
organiczne. Dla ludzi największe zagrożenie stanowią gazy o gęstości większej od powietrza,
ponieważ w przypadku awarii koncentrują się blisko powierzchni ziemi.

32
5.1. Ćwiczenia praktyczne
Charakterystyka i wykrywanie wybranych metali toksycznych i ich
związków oraz toksycznych gazów
5.1.1. Nikiel (Ni)
W wodzie dobrze rozpuszczalne są chlorki, siarczany i azotany tego metalu. Uwod-
nione sole niklu mają barwę zieloną. Najbardziej toksycznym związkiem jest karbonylek
Ni(CO)
4,
który jest bezbarwną, lotną cieczą.
Na kontakt z niklem narażone są głównie osoby wydobywające jego rudy, pracujące
przy rafinowaniu, produkcji stopów i przy niklowaniu. Pierwiastek ten może zostać wpro-
wadzony do organizmu człowieka drogą pokarmową, inhalacyjną lub przez skórę. Narażenie
inhalacyjne na słabo rozpuszczalne związki niklu (pył metaliczny, siarczek, tlenek) powoduje
ich odkładanie się w płucach. Wdychany karbonylek niklu rozkłada się, uwalniając metal,
który gromadzi się w nabłonku pęcherzykowym. Uwalniające się jony niklu ulegają szybkiej
resorpcji i uszkadzają tkankę płuc oraz mózgu. Przy stężeniu powyżej 30 mg/m
3
karbonylek
może doprowadzić do zatruć ostrych i śmierci. U osób inhalacyjnie narażonych na ten metal
stwierdzono częste występowanie nowotworów układu oddechowego (zatok przynosowych
i płuc). Przewlekłe narażenie na nikiel i jego sole może skutkować podrażnieniem spojówek,
błony śluzowej górnych dróg oddechowych oraz owrzodzeniem przegrody nosa, a także wy-
wołać pylicę płuc i astmę oskrzelową.
W wyniku kontaktu skóry z metalicznym niklem może wystąpić alergia typu
kontaktowego, która objawia się swędzącym wypryskiem. Szacuje się, że około 5 do 10%
ludzi jest podatnych na wystąpienie alergii na nikiel.
Wykonanie ćwiczenia:
Do 1 cm
3
roztworu chlorku niklu (1%) dodać kroplami etanolowy roztwór dimety-
loglioksymu (1%) oraz 1
2 krople roztworu amoniaku. Pojawienie się czerwonego zabar-
wienia świadczy o obecności niklu w roztworze.
5.1.2. Chrom (Cr)
Chrom na stopniu utlenienia +3 jest niezbędnym pierwiastkiem śladowym potrzebnym
do metabolizmu glukozy i lipidów u ssaków, natomiast na +6 stopniu utlenienia okazuje się
toksyczny. Sole chromu (VI), np. chromian i dichromian potasu (K
2
CrO
4
i K
2
Cr
2
O
7
), są
stosunkowo dobrze rozpuszczalne w wodzie i łatwo przenikają do krwioobiegu poprzez płuca
i przewód pokarmowy. Działanie toksyczne tego pierwiastka związane jest z utleniającymi
właściwościami chromu (VI). Jego redukcja do chromu (III), zachodząca wewnątrz komórek,
powoduje modyfikację DNA. Związki chromu (VI), zwłaszcza te o słabej rozpuszczalności,
mogą wywoływać raka płuc (okres utajenia wynosi od 10 do 15 lat).
Zatrucia ostre, spowodowane spożyciem związków chromu w ilości kilku gramów,
objawiają się silnymi bólami brzucha, wymiotami, krwistą biegunką, owrzodzeniami
śluzówki przewodu pokarmowego i uszkodzeniem nerek, prowadzącym do mocznicy.

33
Zatrucia przewlekłe powstają u osób narażonych zawodowo na chrom, m.in. u pracowników
garbarni, galwanizerni, zakładów produkujących chromiany i barwniki chromowe, a także
u malarzy stosujących farby antykorozyjne. Objawiają się one zaburzeniami funkcji układów
oddechowego i pokarmowego (zapalenie wątroby z żółtaczką) oraz alergicznymi zmianami
skórnymi.
Wykonanie ćwiczenia:
Do probówki zawierającej 1 cm
3
roztworu dichromianu (VI) potasu (0,2 mol/dm
3
),
dodać kilka kropel roztworu difenyloaminy (0,1%) w stężonym kwasie siarkowym. Poja-
wienie się niebieskiego zabarwienia świadczy o obecności chromu (VI). W reakcji tej
przeszkadza obecność jonów azotanowych (V) (NO
3
-
).
5.1.3. Cyjanki
Cyjanki
(np. cyjanek potasu
KCN) są solami kwasu cyjanowodorowego, nazywa-
nego też cyjanowodorem (HCN). Cyjanowodór (kwas pruski) jest bezbarwną, łatwo lotną
(temp. wrzenia wynosi 26
o
C) cieczą o zapachu gorzkich migdałów. Zarówno cyjanowodór,
jak i cyjanki są substancjami bardzo toksycznymi; śmiertelna dawka doustna KCN dla
dorosłego człowieka wynosi 2
3,5 mg/kg masy ciała. Narażenie na duże stężenie par
cyjanowodoru w powietrzu (rzędu 300 mg/m
3
) powoduje prawie natychmiastową utratę
przytomności i śmierć. Najwyższe dopuszczalne stężenie pułapowe (NDSP) par cyjano-
wodoru w powietrzu wynosi 5 mg/m
3
. NDSP określa stężenie w środowisku przebywania
człowieka, które ze względu na zagrożenie zdrowia lub życia nie może w żadnym momencie
zostać przekroczone.
Cyjanowodór jest wykorzystywany jako substancja odymiająca (fumigant) do
zabijania szkodników (np. gryzoni) w magazynach, silosach ziarna, szklarniach i ładowniach
statków. Roztwory cyjanków są używane do czyszczenia rud złota i srebra, hartowania i ra-
finacji metali, a także w galwanoplastyce oraz do odzyskiwania srebra z naświetlonych błon
fotograficznych i rentgenowskich. Z powodu tych wielorakich zastosowań istnieje prawdo-
podobieństwo ekspozycji człowieka na ich działanie. Cyjanowodór zawarty jest też w dymie
tytoniowym.
Cyjanowodór i większość jego soli wchłania się szybko przez skórę, płuca i z prze-
wodu pokarmowego. Cyjanki „odbierają” organizmowi tlen, działając jak chemiczny środek
duszący (w przeciwieństwie do prostych środków duszących, które zastępują tlen we wdy-
chanym powietrzu). Jony cyjankowe łączą się z jonami żelazowymi (Fe
+3
) krwi, hamując
działanie enzymu oksydazy cytochromowej i uniemożliwiając wykorzystanie tlenu przez
komórki. Zmniejszone wykorzystanie tlenu w tkankach objawia się gromadzeniem oksy-
hemoglobiny w krwi żylnej (krew staje się jasnoczerwona), co powoduje, że skóra i błony
śluzowe osób, które uległy zatruciu, przybierają charakterystyczne czerwone zabarwienie.
Cyjanowodór działa na układ nerwowy oraz zaburza rytm serca. Spadek ciśnienia tętniczego
krwi może doprowadzić do wstrząsu kardiogennego.
Metabolizm i detoksykacja cyjanku związana jest z przekształceniem go (przy udziale
enzymu siarkotransferazy tiosiarczanowej) w znacznie mniej toksyczny tiocyjanian, zwany
też rodankiem (np. rodanek potasu KNCS).

34
Wykonanie ćwiczenia:
Jony rodankowe można wykryć w ślinie oraz moczu osób palących papierosy. Jony te
w obecności jonów żelazowych Fe
3+
tworzą rozpuszczalny w wodzie rodanek żelazowy
o charakterystycznym krwistoczerwonym zabarwieniu.
3 NCS
-
+ Fe
3+
→ Fe(NCS)
3
Zakwasić ok. 5 cm
3
śliny kwasem octowym (10%) aż do wystąpienia zmętnienia.
Zagotować i przesączyć w celu oddzielenia białka. 1 cm
3
przesączu śliny zakwasić kroplą
roztworu kwasu solnego (2 mol/dm
3
) i dodać kroplę roztworu chlorku żelaza (III)
(5%).
Zaobserwować zmianę zabarwienia.
5.1.4. Chlor (Cl
2
)
Chlor jest żółto-zielonym gazem, będącym w stanie skroplonym żółtą cieczą. Znajduje
zastosowanie w przemyśle chemicznym, włókienniczym i papierniczym. Używany jest do
dezynfekcji wody oraz ścieków. Chlor jest silnym utleniaczem. Reaguje z metalami i nie-
metalami, dobrze rozpuszcza się w wodzie, tworząc między innymi żrący kwas chlorowo-
dorowy (solny)
HCl. Chlor ma silne właściwości drażniące. Kontakt z tkanką układu
oddechowego lub ze skórą doprowadza do całkowitego ich zniszczenia. Zawartość chloru
gazowego w powietrzu od 10 do 20 mg/dm
3
powoduje umiarkowane podrażnienie układu
oddechowego oraz spojówek. Przy zwiększonym stężeniu nasila się kaszel, łzawienie,
pojawia się podrażnienie tchawicy i oskrzeli, a następnie duszność, zaburzenia krążenia
i obrzęk płuc. Krótka ekspozycja na chlor w stężeniu 1000 mg/dm
3
może okazać się
śmiertelna. Ostry zapach chloru, wyczuwalny nawet przy dużym rozcieńczeniu, pozwala
szybko reagować na zaistniałe zagrożenie zatrucia tym gazem.
Wykonanie ćwiczenia:
Uwaga! Ćwiczenie to należy wykonać pod wyciągiem.
Wlać do probówki 0,5 cm
3
roztworu podchlorynu sodu (10%), a następnie dodać
0,5 cm
3
roztworu kwasu solnego (2 mol/dm
3
). U wylotu probówki umieścić zwilżony wodą
papierek jodoskrobiowy. Zaobserwować pojawiające się ciemne zabarwienie, świadczące
o wydzielaniu się chloru.
NaClO + 2 HCl → NaCl
+ Cl
2
↑
+ H
2
O
5.1.5. Tlenek azotu (IV)
NO
2
(ditlenek azotu)
Wydzielanie tlenków azotu NO
x
, w tym tlenku azotu (IV), towarzyszy przemysłowej
produkcji kwasu azotowego. Podstawowym źródłem tlenku azotu (II) są procesy spalania
paliw kopalnych (przede wszystkim węgla i ciężkiego oleju napędowego) oraz oleju silni-
kowego, co przedstawiają reakcje:
2 N
(paliwo kopalne)
+ O
2
→ 2 NO
N
2
+ O
2
2 NO
spalanie
w silniku

35
Tlenek azotu (II) łatwo ulega utlenieniu do ditlenku azotu. W warunkach powstawania
smogu fotochemicznego tlenek azotu (II) przekształca się w ditlenek zgodnie z reakcją:
2 NO + O
2
2 NO
2
Ditlenek azotu powstaje również w wyniku szybkiego rozkładu materiału roślinnego,
zachodzącego np. w silosach. NO
2
jest uważany za najbardziej toksyczny z tlenków azotu,
chociaż inne tlenki oraz potencjalne źródła ich wydzielania (np. kwas azotowy w obecności
mogącej się utlenić materii organicznej) powinny być traktowane z taką samą ostrożnością.
W temperaturze pokojowej ditlenek azotu jest brunatnym gazem, dobrze rozpuszczalnym
w wodzie z utworzeniem kwasu azotowego. Wyczuwalne przez człowieka stężenie ditlenku
azotu wynosi 200
g/m
3
. Podstawowym objawem zatrucia jest duszność. Wdychanie NO
2
powoduje obrzęk i poważne podrażnienie płuc oraz ostre zarostowo-włókniste zapalenie
oskrzelików. Obrzęk płuc może pojawić się nawet kilka godzin od ekspozycji. Zatruciom
przewlekłym towarzyszą zapalenie spojówek, owrzodzenia jamy ustnej i uszkodzenie szkliwa
zębów. Objawem narażenia na tlenki azotu może być również żółte zabarwienie skóry,
będące wynikiem reakcji ksantoproteinowej, tj. reakcji kwasu azotowego (V) – HNO
3
z zawartymi w naskórku aminokwasami aromatycznymi (tryptofanem, fenyloalaniną i ty-
rozyną).
Wykonanie ćwiczeń:
1. Wydzielanie ditlenku azotu
Uwaga! Ćwiczenie to należy wykonać pod wyciągiem.
Do probówki zawierającej drut miedziany dodać stężony kwas azotowy (V) (65%).
Obserwować wydzielający się produkt gazowy.
3 Cu + 8 HNO
3
→ 2 NO↑ + 3 Cu(NO
3
)
2
+ 4 H
2
O
Wydzielający się tlenek azotu (II) ulega utlenieniu do brunatnego ditlenku azotu pod
wpływem tlenu zawartego w powietrzu, według następującego równania reakcji:
2 NO + O
2
→ 2 NO
2
2. Reakcja ksantoproteinowa aminokwasów
Reakcja ta zachodzi dla aminokwasów aromatycznych pod wpływem stężonego
kwasu azotowego (V). Rodnik fenylowy aminokwasów ulega nitrowaniu, dając nitropo-
chodne o żółtym zabarwieniu.
Do 1 cm
3
roztworu tyrozyny (1%) dodać 0,5 cm
3
stężonego kwasu azotowego
(65%)
.
Podgrzać i zaobserwować zmianę zabarwienia roztworu aminokwasu.
5.1.6. Siarkowodór
H
2
S
Siarkowodór jest bezbarwnym, palnym, dobrze rozpuszczalnym w wodzie gazem
o przykrym zapachu zgniłych jaj. Powstaje jako produkt uboczny przemysłu petroche-
micznego i metalurgicznego. Tworzy się również w wyniku procesów gnilnego rozkładu
związków organicznych. Jego ciężar właściwy jest większy od powietrza, dlatego może
związki organiczne
procesy fotochemiczne

36
zalegać w niżej położonych miejscach terenu oraz w kanałach ściekowych. Próg wykry-
walności zapachowej tego gazu jest niski i wynosi od 0,8 do 200
g/m³. Przy wyższych
stężeniach, przekraczających 225 mg/m³, gaz ten staje się niewyczuwalny z powodu natych-
miastowego porażenia nerwu węchowego.
Siarkowodór jest jedną z najbardziej niebezpiecznych trucizn gazowych. Wchłania się
głównie przez płuca. Niższe stężenia tego gazu mogą spowodować podrażnienie błon
śluzowych dróg oddechowych, przyspieszenie tętna, wzrost ciśnienia krwi, nudności, bóle
głowy. Przy dużym stężeniu dochodzi do nagłego zatrzymania oddechu i utraty przytomności.
Przy ekspozycji na powietrze zawierające H
2
S w stężeniu powyżej 1 g/m³ następuje nagły
zgon. Ekspozycja na niższe stężenia tego gazu przez okres około 30 min może również
okazać się śmiertelna. Śmierć następuje w wyniku uduszenia i jest konsekwencją porażenia
układu oddechowego. Działanie toksyczne siarkowodoru polega (podobnie jak w przypad-
ku cyjanków) na blokowaniu oddychania wewnątrzkomórkowego poprzez zatrzymanie żelaza
w oksydazie cytochromowej.
Wykonanie ćwiczenia:
Uwaga! Ćwiczenie to należy wykonać pod wyciągiem.
Do 0,5 cm
3
roztworu siarczku sodu (10%) dodać podobną objętość roztworu kwasu
solnego (2 mol/dm
3
). Do wylotu probówki przyłożyć pasek bibuły nasączony roztworem
octanu ołowiu (20%). Pojawienie się zaczernienia na bibule świadczy o obecności siarko-
wodoru. Zachodzą następujące reakcje:
Na
2
S + 2 HCl → H
2
S + 2 NaCl
H
2
S + (CH
3
COO)
2
Pb → PbS ↓ + 2 CH
3
COOH
5.1.7. Amoniak (NH
3
)
Amoniak jest bezbarwnym gazem o ostrym, drażniącym, nieprzyjemnym, charakte-
rystycznym zapachu moczu. Dobrze rozpuszcza się w wodzie, a jego roztwór ma właściwości
zasadowe:
NH
3
+ H
2
O → NH
4
OH
Powstaje w koksowniach jako produkt uboczny suchej destylacji węgla. Wydziela się
przy produkcji klejów, nawozów sztucznych i kwasu azotowego. Naturalnym źródłem
amoniaku są procesy rozkładu substancji białkowych i związków organicznych zawierających
azot. Amoniak jest wyczuwalny przez człowieka przy stężeniu 3 mg/m
3
. Charakterystyczna
woń działa ostrzegawczo, jednak w czasie ekspozycji obserwuje się szybkie zmniejszenie
wrażliwości na zapach, spowodowane podrażnieniem zakończeń nerwów węchowych.
Amoniak wchłania się głównie przez błony śluzowe dróg oddechowych i skórę. Jego
toksyczne działanie polega na powstawaniu żrącego wodorotlenku amonowego (NH
4
OH) w
kontakcie z wilgotnymi błonami śluzowymi. Spożycie roztworu amoniaku powoduje podraż-
nienie, a nawet perforację błon śluzowych przełyku i żołądka, wywołuje kaszel, wymioty
i wstrząs.
czarny osad

37
Narażenie na pary amoniaku może być przyczyną bezgłosu, nieżytu oskrzeli, pod-
rażnienia (oparzenia) oczu, a w zatruciach ostrych
duszności, sinicy i obrzęku płuc.
Przebywanie w atmosferze zawierającej duże stężenie amoniaku (powyżej 1000 mg/m
3
) może
spowodować w ciągu pół godziny śmierć w wyniku porażenia ośrodka oddechowego i nie-
wydolności krążenia.
Wykrywanie jonu amonowego NH
4
+
w reakcji z odczynnikiem Nesslera:
Sporządzanie odczynnika Nesslera:
Odczynnik Nesslera powstaje w reakcji chlorku rtęci z nadmiarem jodku potasu,
według schematu:
HgCl
2
+ 2 KI → HgI
2
↓ + 2 KCl
HgI
2
↓ + 2 KI → K
2
[HgI
4
]
Odczynnik Nesslera (alkaliczny roztwór jodortęcianu (II) potasu) w reakcji z jonami
NH
4
+
wytrąca żółtobrunatny osad jodku tlenoaminortęci (II):
NH
4
Cl + 2 K
2
[HgI
4
] + 4 NaOH → OHg
2
NH
2
I↓ + KCl + 7 KJ + 3 H
2
O
Wykonanie ćwiczenia:
Do probówki zawierającej około 0,5 cm
3
roztworu chlorku rtęci (0,25 mol/dm
3
)
wlewać kroplami roztwór jodku potasu (0,5 mol/dm
3
). Po wytrąceniu się różowego osadu
jodku rtęci (II), dodawać kroplami roztwór jodku potasu, aż do rozpuszczenia tego osadu
i utworzenia rozpuszczalnego związku kompleksowego
jodortęcianu (II) potasu. Następnie
dodać ok. 5 cm
3
roztworu wodorotlenku sodu (2 mol/dm
3
).
Do drugiej probówki wlać 1 cm
3
roztworu chlorku amonu (1 mol/dm
3
) oraz kilka
kropli odczynnika Nesslera. Zaobserwować zmianę zabarwienia roztworu.
Reakcja ta ma zastosowanie do wykrywania śladowych ilości NH
4
+
w wodzie pitnej.
Piśmiennictwo:
1. Bodzek D., Luks-Betlej K., Tyrpień K. (red.): Skrypt do ćwiczeń z chemii i chemii ogólnej dla studentów
I roku Wydziału Lekarskiego z Oddziałem Lekarsko-Dentystycznym w Zabrzu, Wydanie IV. Śląski
Uniwersytet Medyczny, Katowice 2007.
2. Brandys J.: Toksykologia
wybrane zagadnienia. Wydawnictwo Uniwersytetu Jagiellońskiego, Kraków
1999.
3. Dreisbach R.H., Robertson W.O.: Vademecum zatruć. PZWL, Warszawa 1995.
4. Seńczuk W. (red.): Toksykologia współczesna. PZWL, Warszawa 2005, 2006.
5. Timbrell J.: Paradoks trucizn. Wydawnictwo Naukowo-Techniczne, Warszawa 2008.
różowy
żółtobrunatny

38
6. TOKSYKOLOGIA LEKÓW I ŚRODKÓW
POCHODZENIA ROŚLINNEGO
Leki, oprócz działania terapeutycznego, mogą również wywierać skutek niekorzystny
niepożądany i toksyczny. Działania niepożądane występują po podaniu dawek terapeu-
tycznych, natomiast toksyczne
po podaniu dawek przekraczających terapeutyczne lub przy
stosowaniu ich w niewłaściwy sposób (zbyt często lub zbyt długo). Każdy lek w odpo-
wiednio dużej dawce może stać się trucizną, a granica między działaniem niepożądanym
a toksycznym jest często trudna do sprecyzowania. Do najczęstszych przyczyn zatruć lekami
należą: świadome przyjęcie dużych dawek leków w celach samobójczych, spożycie leku
omyłkowo lub przypadkowo (zwłaszcza przez dzieci), przedawkowanie w wyniku niewłaści-
wego stosowania i lekomania. Występowanie i nasilenie objawów toksycznych może być
modyfikowane przez wiele czynników, m.in. wiek, płeć, stopień odżywienia, stan zdrowia,
uwarunkowania genetyczne, interakcje z innymi lekami lub czynnikami toksycznymi (np.
alkoholem, narkotykami), skażenie środowiska itp.
6.1. Ćwiczenia praktyczne
6.1.1. Ilościowe oznaczanie stężenia salicylanów w surowicy
Pochodne kwasu salicylowego (salicylany) mają silne działanie przeciwzapalne,
przeciwbólowe i przeciwgorączkowe, a w niewielkich dawkach również przeciwkrzepliwe
i antyagregacyjne. Do najczęściej stosowanych pochodnych należą: kwas acetylosalicylowy,
salicylamid oraz salicylany sodu i metylu. Salicylany dobrze wchłaniają się z przewodu
pokarmowego i po zmetabolizowaniu w wątrobie wydalane są głównie przez nerki. Łatwa
dostępność tych leków sprawia, że mogą być przyczyną wielu ostrych zatruć (samobójczych
lub przypadkowych). Dawkę śmiertelną ocenia się na 0,2
0,5 g/kg mc., co oznacza 2535 g
dla człowieka dorosłego i powyżej 10 g dla dziecka. Ciężkość zatrucia i rokowanie zależą od
stężenia salicylanów w surowicy. Pierwsze objawy toksyczności występują przy stężeniach
powyżej 0,3 g/dm
3
. Są to: pieczenie w jamie ustnej i przełyku, brak łaknienia, znużenie, bóle
i zawroty głowy, szum w uszach, zaburzenie ostrości widzenia i przyspieszenie oddechu. Przy
stężeniach powyżej 0,7 g/dm
3
obserwuje się
niepokój, majaczenie, zaburzenia równowagi
i senność. Wyraźnemu przyspieszeniu ulegają oddech i akcja serca. Mogą pojawić się krwa-
wienia z nosa i przewodu pokarmowego. W zatruciach ciężkich (stężenia powyżej 0,9 g/dm
3
),
obok znacznego nasilenia opisanych wcześniej objawów, po przejściowym okresie pobu-
dzenia psychoruchowego rozwija się śpiączka z zaburzeniami oddychania (do porażenia
czynności oddechowej włącznie) i sinicą. Zatrucia ze stężeniami przekraczającymi 1,2 g/dm
3
zwykle kończą się zejściem śmiertelnym. Od objawów toksyczności salicylanów związanej
z dawką, należy odróżnić nadwrażliwość (alergię) na tę grupę leków. Objawy o charakterze
napadu astmatycznego i pokrzywkowo-obrzękowe zmiany skórne występują wówczas już
przy dawkach terapeutycznych. Salicylanów nie należy również podawać dzieciom do 12 rż.,

39
z uwagi na ich domniemaną rolę w powstawaniu ostrego uszkodzenia wątroby z encefalo-
patią, znanego pod nazwą zespołu Reye’a.
Zasada metody oznaczania stężenia salicylanów
Kwas salicylowy i jego sole w obecności soli Fe
3+
tworzą barwny (czerwono-fiole-
towy) kompleks. Dodatek chlorku rtęci powoduje odbiałczenie próbki badanej surowicy
i uwolnienie salicylanów z połączeń białkowych. Metoda charakteryzuje się małą czułością
i specyficznością, jednak może być wykorzystywana do ilościowego oznaczania salicylanów
u osób nimi zatrutych lub do monitorowania stężeń podczas leczniczego stosowania dużych
dawek kwasu acetylosalicylowego (np. w leczeniu gorączki reumatycznej).
Wykonanie ćwiczenia:
Do 3 probówek wirówkowych wprowadzić po 5 cm
3
odczynnika barwnego (zawie-
rającego chlorek rtęci i sole Fe
3+
). Do pierwszej dodać 1 cm
3
wody destylowanej (próbka
kontrolna), do drugiej
1 cm
3
wzorca salicylanów o stężeniu 0,1
g/dm
3
(C
wzorca
), do trzeciej
1 cm
3
badanej surowicy lub osocza. Zawartość probówek wymieszać. Odwirować osad białka
wytrąconego w trzeciej probówce. Zmierzyć absorbancję (A) roztworu wzorcowego i próbki
badanej wobec próbki kontrolnej przy długości fali 540 nm. Wynik obliczyć ze wzoru:
stężenie salicylanów
[g/dm
3
] = (A
próbki badanej
x
C
wzorca
)/A
wzorca
Stężenia terapeutyczne salicylanów wynoszą:
0,1–0,2 g/dm
3
(działanie przeciwbólowe i przeciwgorączkowe)
0,2–0,3 g/dm
3
(działanie przeciwzapalne)
0,0002–0,0013 g/dm
3
(działanie antyagregacyjne).
Stężenia powyżej 0,3 g/dm
3
mogą świadczyć o zatruciu salicylanami.
6.1.2. Wykrywanie paracetamolu
Paracetamol (acetaminofen) jest lekiem przeciwbólowym i przeciwgorączkowym,
czasem stosowanym również w skojarzeniu z innymi lekami w preparatach złożonych. Lek
ten jest bezpieczny jedynie w dawkach terapeutycznych, natomiast po ich przekroczeniu
wywiera silne działanie hepatotoksyczne. Z uwagi na bardzo łatwą dostępność bywa coraz
częściej przyczyną ostrych zatruć, zarówno samobójczych, jak i przypadkowych. W wielu
krajach, m.in. w Stanach Zjednoczonych, paracetamol zajmuje pierwsze miejsce na listach
leków najczęściej powodujących zatrucia. Przykładowo w Wielkiej Brytanii rocznie hospi-
talizowanych jest ponad 5000 osób zatrutych tym lekiem, z czego 50
100 umiera. Zgony
dotyczą przeważnie dorosłych, którzy zażyli lek w dawce powyżej 10
15 g.
Paracetamol dobrze i szybko wchłania się z przewodu pokarmowego. Uważa się, że za
hepatotoksyczność odpowiada jego pochodna powstająca pod wpływem cytochromu P-450
z pewnej części wchłoniętej dawki. Objawy zatrucia rozwijają się po pewnym okresie
utajenia, dlatego ma ono bardzo podstępny charakter. U dorosłych zatrucie ostre może
wystąpić już po przyjęciu dawki 4 g w czasie krótszym niż 8 godzin. Toksyczność para-
cetamolu zwiększa się dodatkowo u ludzi starszych i małych dzieci, u osób nadużywających
alkoholu, niedożywionych, odwodnionych, osób z chorobami wątroby i nerek oraz stosują-

40
cych jednocześnie inne leki przeciwbólowe. Wczesne objawy przedawkowania, występujące
w pierwszej dobie zatrucia, to: brak łaknienia, nudności, wymioty i bóle brzucha. W kolejnej
dobie dołączają się żółtaczka, świąd skóry, objawy pseudogrypowe, zaburzenia orientacji,
senność. W 4
6 dobie rozwija się pełnoobjawowa niewydolność wątroby z encefalopatią,
niewydolnością krążeniowo-oddechową i niewydolnością nerek. Zgony z powodu martwicy
wątroby notowano do 2 tygodni od przyjęcia śmiertelnej dawki leku.
Wykonanie ćwiczenia:
A. Około 0,1 g paracetamolu rozpuścić w 2 cm
3
gorącej wody i dodać 0,1 cm
3
świeżo
przygotowanego roztworu chlorku żelaza (III) (1%) (nie mieszać). Powstanie niebiesko-
-fioletowego zabarwienia świadczy o obecności paracetamolu w badanej próbce.
B. Około 0,1 g paracetamolu ogrzewać przez 2 minuty z 2 cm
3
stężonego kwasu solnego
(36%). Następnie wlać 10 cm
3
wody i ochłodzić, po czym dodać 1
2 krople roztworu
dichromianu potasu (0,5%). Powoli powstaje fioletowe zabarwienie.
6.1.3. Wykrywanie sulfonamidów
Sulfonamidy są pochodnymi kwasu sulfanilowego o działaniu przeciwbakteryjnym.
Toksyczne działanie sulfonamidów rozpoczyna się od stężeń powyżej 0,1 g/dm
3
. Bardzo
często powodem zatrucia jest nieprawidłowe dawkowanie. Dotyczy to przede wszystkim
preparatów o przedłużonym działaniu, które omyłkowo podaje się w dużych ilościach, tak jak
preparaty krótko działające. Sulfonamidy mają działanie nefrotoksyczne
mogą krystalizo-
wać w kanalikach nerkowych, powodując ich uszkodzenie manifestujące się krwiomoczem,
a następnie bezmoczem. W zatruciach sulfonamidami często występują również zapalenia
nerwów obwodowych, niezborność ruchów, porażenia mięśniowe i bóle stawów, zaburzenia
widzenia, hipertermia i zaburzenia psychiczne (halucynacje, stany depresyjne, psychozy).
W bardzo ciężkich zatruciach dochodzi do uszkodzenia wątroby i szpiku oraz rozwoju
niedokrwistości hemolitycznej. Często występujące podczas leczenia sulfonamidami zmiany
skórne (osutki, pokrzywki, rumień wielopostaciowy itp.) są zwykle objawem alergii
polekowej i mogą pojawiać się już przy typowych dawkach terapeutycznych.
Wykonanie ćwiczenia:
A. 50 mg sulfanilamidu rozpuścić w 1 cm
3
kwasu solnego (2 mol/dm
3
) i dodać 1 cm
3
odczynnika Ehrlicha (4-dimetyloaminobenzaldehyd w etanolu z dodatkiem stężonego
kwasu solnego)
powstaje pomarańczowy osad.
B. Do 0,1 g sulfanilamidu dodać 1 cm
3
kwasu solnego (2 mol/dm
3
), ogrzać do rozpuszczenia,
oziębić, a następnie dodać 1 cm
3
roztworu azotanu (III) sodu (1%) i 2 cm
3
roztworu
2-naftolu (5%)
powstaje czerwono-pomarańczowy osad.
6.1.4. Wykrywanie chininy
Chinina
alkaloid pochodzący z kory drzewa chinowego była jednym z pierwszych
leków przeciwmalarycznych. Izomer chininy
chinidyna stosowana jest nadal jako lek
przeciwarytmiczny. Leki te wchłaniają się dobrze w jelitach. Są metabolizowane w wątrobie
i wydalane z moczem. W zatruciu ostrym jednym z pierwszych objawów są zaburzenia

41
widzenia oraz szum w uszach. Obserwować można senność, bóle głowy oraz zaburzenia
żołądkowo-jelitowe. Najważniejsze objawy toksyczne są związane z wpływem chinidyny na
układ bodźcoprzewodzący serca
obserwuje się ciężkie arytmie pochodzenia komorowego,
z migotaniem komór i zatrzymaniem akcji serca włącznie. W bardzo ciężkich zatruciach
dochodzi do utraty przytomności, znacznego obniżenia ciśnienia tętniczego krwi, zaburzeń
oddychania, skąpomoczu i narastającej kwasicy metabolicznej. W przypadku przeżycia może
pozostać trwała ślepota i głuchota. W zatruciach przewlekłych występują zmiany skórne oraz
niedokrwistość wskutek hemolizy krwinek czerwonych. Stężenie terapeutyczne chinidyny
w surowicy wynosi 3
5 mg/dm
3
, natomiast toksyczne 6
8 mg/dm
3
.
Wykonanie ćwiczenia:
A. Szczyptę chininy rozpuścić w 1 cm
3
wody, dodać 0,5 cm
3
kwasu siarkowego (1 mol/dm
3
)
powstaje niebieska fluorescencja.
B. Szczyptę chininy rozpuścić w 1 cm
3
wody, dodać 0,5 cm
3
wody bromowej i po upływie
1 min 0,5 cm
3
roztworu wodorotlenku amonu (2 mol/dm
3
)
powstaje zielone zabar-
wienie.
6.1.5. Wykrywanie alkaloidów pochodnych metyloksantyny (kofeina,
teofilina)
Kofeina (1,3,7-trimetyloksantyna) występuje w nasionach kawy i liściach herbaty,
wchodząc w skład popularnych napojów. Stosowana jest również w lecznictwie jako składnik
złożonych preparatów przeciwbólowych. Dawka toksyczna kofeiny wynosi ok. 1 g, dawka
śmiertelna
ok. 10 g. Objawami zatrucia są: światłowstręt (wskutek rozszerzenia źrenic),
bóle głowy, pobudzenie, bezsenność, stany lękowe, przyspieszenie akcji serca i zaburzenia
rytmu, spadek ciśnienia krwi i narastająca kwasica. Bezpośrednią przyczyną zgonu jest
najczęściej porażenie ośrodka oddechowego. Nadmierne używanie kofeiny może również
prowadzić do zatrucia przewlekłego z pobudzeniem psychoruchowym, bezsennością,
tachykardią, biegunką i wzmożoną diurezą.
Teofilina (1,3-dimetyloksantyna) i jej pochodne
diprofilina, aminofilina i pentoksy-
filina są stosowane w leczeniu astmy oskrzelowej, chorób układu krążenia oraz jako leki
moczopędne. Dawka toksyczna teofiliny to ok. 50 mg/kg mc. Głównym objawem zatrucia
lekami tej grupy jest spadek ciśnienia tętniczego krwi. W zatruciu ostrym, w czasie od 1 do
2 minut, po dożylnym wstrzyknięciu toksycznej dawki aminofiliny, występuje nagła zapaść
ze zgonem włącznie. Doustne podanie zbyt dużej dawki teofiliny może spowodować nud-
ności i nawracające wymioty, pobudzenie psychoruchowe, bóle głowy, stany lękowe i objawy
psychotyczne, zaburzenia rytmu pochodzenia komorowego aż do migotania komór włącznie,
spadek ciśnienia, narastające zaburzenia elektrolitowe i kwasowo-zasadowe, drgawki i zatrzy-
manie oddechu. Wielokrotne doodbytnicze podanie aminofiliny niemowlętom może powo-
dować gwałtowne wymioty, zapaść i zgon. Leki tej grupy charakteryzują się małą roz-
piętością między dawką terapeutyczną a toksyczną, stąd wskazane jest monitorowanie
stężenia leku w trakcie leczenia.

42
Wykonanie ćwiczenia:
A. Do parowniczki porcelanowej wlać 2 krople roztworu kofeiny, 2 krople roztworu kwasu
solnego (6 mol/dm
3
) oraz 2 krople wody utlenionej (3%). Odparować do sucha w suszarce
laboratoryjnej. Czerwono-żółta pozostałość, po dodaniu 2
3 kropel roztworu wodoro-
tlenku amonu (2 mol/dm
3
), zabarwia się na czerwono-fioletowo.
B. Do parowniczki porcelanowej wlać 2 krople roztworu teofiliny, 2 krople roztworu kwasu
solnego (6 mol/dm
3
) oraz 2 krople wody utlenionej (3%). Odparować do sucha w suszarce
laboratoryjnej. Czerwono-żółta pozostałość, po dodaniu 2
3 kropel roztworu wodoro-
tlenku amonu (2 mol/dm
3
), zabarwia się na ciemnoczerwono.
6.1.6. Wykrywanie efedryny
Efedryna jest alkaloidem występującym w roślinie o nazwie Ephedra, której właści-
wości znane były już w czasach prehistorycznych, a w tradycyjnej medycynie chińskiej
stosuje się ją od 4 tysięcy lat. Substancja ta wpływa na układ sercowo-naczyniowy, odde-
chowy i ośrodkowy układ nerwowy. Podawana jest w niedociśnieniu, w stanach zapalnych
śluzówki nosa i zatok oraz wspomagająco w leczeniu astmy i stanów zapalnych oskrzeli
(rozszerza oskrzela, zmniejsza wydzielanie śluzu). Przy dłuższym stosowaniu może
powodować uzależnienie psychiczne. U ludzi uzależnionych występują psychozy paranoi-
dalne, napady agresji oraz halucynacje wzrokowe i słuchowe. Jednorazowe przedawkowanie
objawia się wzrostem ciśnienia, przyspieszeniem tętna i zaburzeniami rytmu serca, bólami
i zawrotami głowy, dusznością, drżeniami kończyn, suchością w ustach. Narastające zabu-
rzenia krążeniowo-oddechowe mogą doprowadzić do zgonu.
Wykonanie ćwiczenia:
Do 1 cm
3
roztworu chlorowodorku efedryny (1%) dodać 0,1 cm
3
roztworu siarczanu
miedzi (II) (0,5%) i 1 cm
3
roztworu wodorotlenku sodu (2 mol/dm
3
)
powstaje fioletowe
zabarwienie. Do barwnego roztworu dodać 1 cm
3
eteru tert-butylowego i wytrząsnąć.
Warstwa eterowa przyjmuje zabarwienie ciemnofiołkowe, a wodna
niebieskie.
6.1.7. Wykrywanie glikozydów naparstnicy
Do najczęściej stosowanych glikozydów nasercowych należą digoksyna i digitoksyna
glikozydy naparstnicy wełnistej. Podawane są jako leki w niewydolności serca i niektórych
typach zaburzeń rytmu serca. Cechują się szczególnie wąskim przedziałem pomiędzy dawką
terapeutyczną a toksyczną (tzw. indeks terapeutyczny). Najczęstszą przyczyną zatruć
glikozydami naparstnicy są: stosowanie zbyt dużych dawek, niedobór potasu lub magnezu,
zwiększone stężenie jonów wapnia we krwi, niedoczynność tarczycy. Pierwsze objawy
zatrucia to zaburzenia ze strony przewodu pokarmowego (brak apetytu, nudności, wymioty,
bóle brzucha, biegunka) oraz bóle głowy, zmęczenie, senność, uczucie rozbicia. W ciężkich
zatruciach, zwłaszcza u ludzi starszych, pojawiają się objawy psychotyczne (omamy) i cha-
rakterystyczne zaburzenia widzenia oraz percepcji kolorów (widzenie na żółto lub zielono).
Najbardziej niebezpiecznymi objawami zatrucia są różnego rodzaju zaburzenia rytmu serca:
znaczny rzadkoskurcz, blok przedsionkowo-komorowy, dodatkowe skurcze komorowe,
częstoskurcz i migotanie komór. Dawka 5 mg digoksyny wywołuje poważne objawy zatrucia,

43
a dawka 10 mg jest zwykle śmiertelna (stężenie digoksyny w surowicy niebezpieczne dla
życia to zaledwie 3
g/dm
3
, digitoksyny
40 g/dm
3
), stąd należy monitorować stężenia
u osób leczonych glikozydami, zwłaszcza będących w podeszłym wieku.
Wykonanie ćwiczenia:
Do 0,5 cm
3
roztworu zawierającego digitoksynę wlewać kroplami, po ściankach
probówki stężony kwas siarkowy (96%) (ostrożnie!). Powstaje brunatny pierścień, a górna
warstwa zabarwia się na niebiesko.
6.1.8. Wykrywanie karbamazepiny
Karbamazepinę (w preparatach Amizepin, Neurotrop, Tegretol) stosuje się w leczeniu
padaczek, stanów maniakalnych i w terapii detoksykacyjnej alkoholików. Działa również
przeciwbólowo, co wykorzystywane jest m.in. w leczeniu nerwobólu nerwu trójdzielnego
i zapaleń nerwów obwodowych. Szerokie zastosowanie powoduje, że jest coraz częściej
przyczyną ostrych zatruć. Cechuje ją mały współczynnik terapeutyczny, a wiele działań
niepożądanych może się pojawić już przy dawkach leczniczych. Do najczęstszych należą
oczopląs, niezborność ruchów, bóle i zawroty głowy, senność. Dawka toksyczna to 3
5 g. Po
opisanych powyżej objawach wstępnych rozwijają się objawy obrzęku mózgu i zahamowania
ośrodka oddechowego oraz zaburzenia rytmu serca (często groźne dla życia). Karbamazepina
jest również toksyczna dla płodu.
Wykonanie ćwiczenia:
Do kilku mg karbamazepiny dodać 1 cm
3
stężonego kwasu siarkowego (96%) i ogrze-
wać 3 min w łaźni wodnej. Po tym czasie pojawia się jasnożółte zabarwienie, a w nadfiolecie
jasnozielona fluorescencja.
6.1.9. Wykrywanie dihydroergotaminy
Głównymi alkaloidami sporyszu (przetrwalniki pasożytniczego grzyba o nazwie buła-
winka czerwona, który atakuje kłosy zbóż) są ergometryna, ergotamina, (dihydroergotamina
jest jej uwodornioną pochodną) ergotoksyna, ergokryptyna i ergokornina. Powodują skurcze
macicy i mięśniówki naczyń krwionośnych. Ich długotrwałe działanie może doprowadzić do
przewlekłego uszkodzenia naczyń, zwłaszcza kończyn i objawów zgorzeli (dawniej powodem
wystąpienia takich objawów, zwanych też ogniem św. Antoniego, było znaczne zanieczysz-
czenie ziarna zbóż, a w następstwie mąki sporyszem). Obecnie takie zagrożenie nie występu-
je, dzięki właściwym systemom kontroli ziarna. Zatrucia mogą się natomiast zdarzyć w przy-
padku przedawkowania leków zawierających alkaloidy sporyszu (stosowanych między inny-
mi w leczeniu migreny oraz w położnictwie) lub przypadkowego spożycia przetrwalników
grzyba. Objawami zatrucia są kolkowe bóle brzucha, wymioty, biegunki, wzmożone pragnie-
nie. Następnie pojawiają się bóle głowy, niepokój, oszołomienie, halucynacje, wzrost ciśnie-
nia i tętna, sinica kończyn.

44
Wykonanie ćwiczenia:
Do 0,5 cm
3
roztworu dihydroergotaminy dodać 1 cm
3
odczynnika Allporta (4-dime-
tyloaminobenzaldehyd w kwasie siarkowym z dodatkiem chlorku żelaza (III). Powstaje
niebieskie zabarwienie.
6.1.10. Wykrywanie metamizolu
Metamizol sodowy (w preparatach Analgin, Dipyron, Novalgina, Pyralgina) to
pochodna pirazolonu o najsilniejszym wśród niesterydowych leków przeciwzapalnych
działaniu przeciwbólowym. Wywiera także działanie przeciwgorączkowe. Stosowana jest
w bólach różnego pochodzenia, również w przebiegu choroby nowotworowej i stanach
gorączkowych nieustępujących po innych lekach przeciwgorączkowych. Wśród objawów
toksyczności do najpoważniejszych należą: niedokrwistość aplastyczna, leukopenia i agranu-
locytoza (na skutek uszkodzenia szpiku kostnego), zaburzenia żołądkowo-jelitowe (nudności,
wymioty, krwotoczne zapalenie błony śluzowej żołądka), zapalenie wątroby, odczyny skórne
(wysypki, rumień guzowaty i wielopostaciowy, zespół Lyella, zespół Stevens-Johnsona),
zaburzenia sercowo-naczyniowe (obrzęki, zastoinowa niewydolność serca), objawy ze strony
nerek (białkomocz, krwinkomocz, zespół nerczycowy, ostra martwica cewek nerkowych,
śródmiąższowe zapalenie nerek) i układu nerwowego (bóle głowy, pobudzenie, zaburzenia
świadomości, zapalenie nerwu wzrokowego). Pochodne pirazolonu mogą też powodować
uszkodzenie szpiku o charakterze alergicznym. Reakcja ta jest niezależna od dawki. Ponieważ
występuje najczęściej u osób, u których w wywiadzie stwierdza się długotrwałe stosowanie
tych leków w przeszłości, obecnie nie zaleca się przyjmowania leku dłużej niż 5
6 dni.
Dawki śmiertelne pochodnych pirazolonu zaczynają się od 5 g.
Wykonanie ćwiczenia:
Do 1 cm
3
wodnego roztworu pyralginy (10%) dodać 0,5 cm
3
kwasu azotowego (V)
(2 mol/dm
3
) i 1 kroplę roztworu azotanu (III) sodu (5%). Powstaje szybko zanikające
niebieskie zabarwienie. Do bezbarwnego roztworu dodać 4 krople roztworu azotanu srebra
(5%). Powstaje zmętnienie i ponownie niebieskie zabarwienie, przechodzące w zielone
i żółte, a następnie wydziela się metaliczne srebro.
6.1.11. Wykrywanie papaweryny
Papaweryna to alkaloid izochinolinowy opium niewykazujący działania narkotycz-
nego. Zmniejsza napięcie mięśni gładkich i rozszerza naczynia krwionośne. Działanie
przeciwskurczowe występuje w obrębie dróg żółciowych, moczowych, przewodu pokarmo-
wego i oskrzeli. Papaweryna stosowana jest w stanach skurczowych przewodu pokarmowego,
stanach zapalnych i kamicy pęcherzyka żółciowego, zaparciach spastycznych, kamicy ner-
kowej i stanach zapalno-spastycznych dróg moczowych. Przedawkowanie objawia się
zaburzeniami żołądkowo-jelitowymi, jadłowstrętem, bólami i zawrotami głowy, sennością,
zaczerwienieniem skóry (zwłaszcza twarzy), nadmierną potliwością oraz spadkiem ciśnienia
tętniczego (przy podaniu dożylnym). Papaweryna przyjęta w dużych dawkach może
powodować porażenie mięśni poprzecznie prążkowanych i mięśnia sercowego.

45
Wykonanie ćwiczenia:
We wgłębieniu płytki porcelanowej umieścić kilka mg chlorowodorku papaweryny.
Następnie dodać 2
3 krople odczynnika Froehdego (molibdenian amonu w stężonym kwasie
siarkowym). Powstające zielone zabarwienie roztworu identyfikuje badaną substancję.
Piśmiennictwo:
1. Dreisbach R.H., Robertson W.O.: Vademecum zatruć. PZWL, Warszawa 1995.
2. Farmakopea Polska VI z suplementem. Wydawnictwo Polskiego Towarzystwa Farmaceutycznego,
Warszawa 2005.
3. Seńczuk W. (red.): Toksykologia współczesna. PZWL, Warszawa 2005, 2006.
4. Timbrell J.: Paradoks trucizn. Wydawnictwo Naukowo-Techniczne, Warszawa 2008.

46
7. TOKSYKOLOGIA WYBRANYCH ŚRODKÓW
CHEMII GOSPODARCZEJ
Niektóre preparaty stosowane w gospodarstwie domowym mogą stanowić znaczne
zagrożenie dla zdrowia i życia ludzi, ze względu na posiadane właściwości toksyczne,
a nawet doprowadzić do śmierci poszkodowanej osoby. Szkodliwość tych preparatów zależy
od składu chemicznego i sposobu działania. Niebezpieczne środki chemii gospodarczej
zawierają aktywne składniki czynne. Do grupy tej należą środki czyszczące, czyszcząco-
-dezynfekujące i dezynfekująco-wybielające. Wiele z nich to preparaty o działaniu draż-
niącym, niektóre żrącym i dlatego też ich opakowania zostały odpowiednio oznakowane,
ostrzegając przed niebezpieczeństwem.
Substancje żrące mogą być silnymi kwasami lub zasadami (ługami). Przede wszy-
stkim wywołują zmiany struktury tkanek, z którymi mają kontakt (oparzenie chemiczne).
Efektem działania substancji żrącej na organizm ludzki mogą być również zaburzenia
ogólnoustrojowe.
W kontakcie z tkanką silne kwasy wywołują martwicę skrzepową (powstają
struktury o zagęszczonej konsystencji w wyniku procesu denaturacji białka), a zasady
martwicę rozpływną (obumarcie tkanek z ich szybkim upłynnieniem przez enzymy uwalniane
z uszkodzonych komórek).
Skład chemiczny preparatów stosowanych w gospodarstwie domowym jest bardzo
różnorodny. Cillit, popularny środek do czyszczenia urządzeń sanitarnych, jest mieszaniną
zawierającą między innymi 15% kwas fosforowy. W ACE substancją czynną w ilości 5
15%
jest chloran (I) sodu (NaClO) nazywany też podchlorynem sodu. Kret to silnie zasadowa
mieszanina podchlorynu sodu, wodorotlenku sodu i krzemianu sodu.
Stosując środki chemiczne zawierające chloran (I) sodu, należy unikać ich kontaktu
z kwasami, gdyż zgodnie z poniższą reakcją chemiczną wydzielał się będzie niebezpieczny
dla zdrowia gazowy chlor:
NaOCl + 2 HCl → NaCl
+ Cl
2
↑
+ H
2
O
W tabeli III zestawiono składniki i działanie niektórych preparatów chemii gospodar-
czej.

47
Tabela III. Skład wybranych środków używanych w gospodarstwie domowym i ich działanie
Nazwa preparatu
Skład Działanie na organizm
Kret
udrażniacz do
kanalizacji
(różna postać fizyczna
różni
producenci)
20% chloran (I) sodu,
7% wodorotlenek sodu,
1% krzemian sodu
żrący
ACE
wybielacz w płynie 515% chloran (I) sodu
żrący
ACE
wybielacz w płynie
łagodny
6
8% nadtlenek wodoru,
detergenty
drażniący
Domestos Professional Citrus
Fresh
preparat czyszcząco-
-dezynfekujący
<5% chloran (I) sodu,
<5% alkilodimetylo-amina, N-tlenki,
<1% wodorotlenek sodu,
niejonowe detergenty
drażniący
Cillit
płyn do czyszczenia
urządzeń sanitarnych
15% kwas fosforowy,
detergenty
drażniący
CILLIT® BANG
czyszcząco-odkamieniający
1
5% kwas sulfamidowy,
1
3% kwas szczawiowy,
1
5% kwas mrówkowy,
1% oksyetylenowane alkohole C
9
C
11
(polimer)
drażniący
Vizir
proszek do prania
<5% oksyetylenowane alkohole
C9
C11
(polimer)
<20% kwas benzenosulfonowy
<5% kwas cytrynowy
<10% węglan sodu
<10% krzemian sodu
drażniący
Benzyna ekstrakcyjna
rozpuszczalnik (odplamiacz)
produkt naftowy
szkodliwy, łatwopalny
7.1. Ćwiczenia praktyczne
7.1.1. Chemiczne środki udrażniające
Wykonanie ćwiczenia:
1. Badanie odczynu preparatu Kret
W probówce należy umieścić kilka granulek preparatu i rozpuścić w 2 cm
3
wody
destylowanej. Rozdzielić roztwór na dwie części. Do jednej z probówek z roztworem
badanym dodać 2 krople roztworu fenoloftaleiny. Do drugiej
dwie krople roztworu
oranżu metylowego. Obserwować pojawiające się barwy roztworów w probówkach.
W tabeli II podano charakterystykę wskaźników alkacymetrycznych, którą należy wyko-
rzystać w celu określenia odczynu roztworu.
2. Badanie wpływu preparatu Kret na tkankę mięśniową
Na porcji mięsa (1 g) znajdującym się na szkiełku zegarkowym umieścić kilka granulek
preparatu Kret. Po 30 minutach zaobserwować zachodzące zmiany na powierzchni próbki
mięsa.
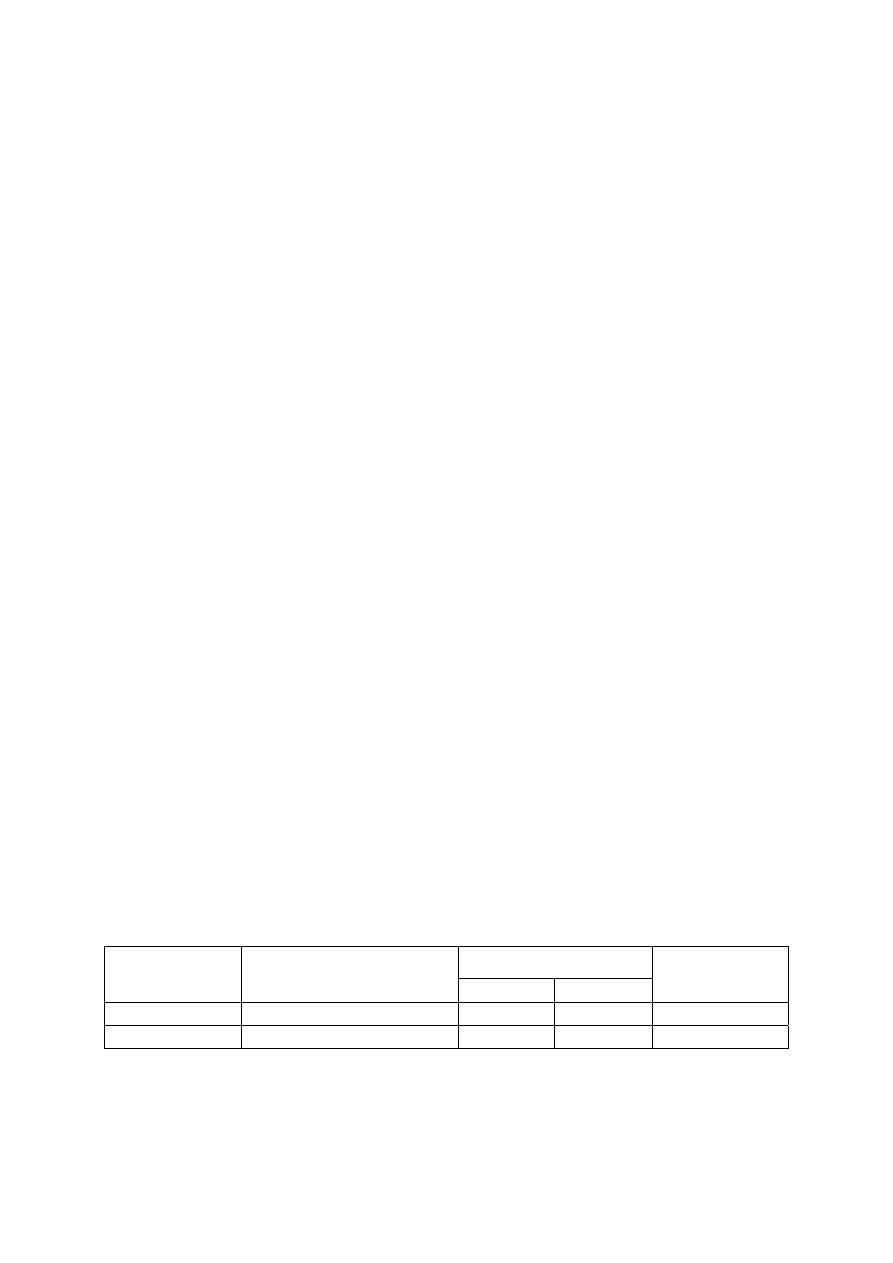
48
7.1.2. Chemiczne środki wybielające
Wykonanie ćwiczenia:
1. Badanie odczynu preparatu ACE
Do probówki nalać 2
3 krople preparatu ACE oraz 2 cm
3
wody destylowanej. Rozdzielić
otrzymany roztwór na dwie części. Do jednej dodać 2 krople roztworu fenoloftaleiny, do
drugiej
dwie krople roztworu oranżu metylowego. Obserwować pojawiające się barwy
roztworów w probówkach.
2. Badanie wpływu preparatu ACE na tkankę mięśniową
Na porcję mięsa (1 g) znajdującego się na szkiełku zegarkowym nalać kilka kropel
preparatu ACE. Po 30 minutach zaobserwować zachodzące zmiany na powierzchni mięsa.
7.1.3. Środki myjąco-dezynfekujące i odkamieniające
Wykonanie ćwiczenia:
1. Badanie odczynu preparatów Domestos i Cillit
Do probówki nalać 2
3 krople preparatu Domestos lub Cillit oraz 2 cm
3
wody desty-
lowanej. Rozdzielić roztwór na dwie części. Do jednej z probówek z roztworem dodać
2 krople roztworu fenoloftaleiny, do drugiej
dwie krople roztworu oranżu metylowego.
Obserwować pojawiające się barwy roztworów w probówkach.
2. Badanie wpływu preparatów Domestos i Cillit na tkankę mięśniową
Na porcję mięsa (1 g) znajdującego się na szkiełku zegarkowym nalać kilka kropel
preparatu Domestos lub Cillit. Po 30 minutach zaobserwować zmiany zachodzące na
powierzchni mięsa.
7.1.4. Środki piorąco-myjące
proszki do prania, szampon
Wykonanie ćwiczenia:
Do probówki zawierającej proszek do prania dodać 2 cm
3
wody destylowanej. Po
rozpuszczeniu się proszku otrzymany roztwór rozdzielić na dwie części. Do jednej z pro-
bówek dodać 2 krople roztworu fenoloftaleiny, do drugiej
dwie krople oranżu metylowego.
Obserwować pojawiające się barwy i na podstawie danych w tabeli IV ustalić odczyn
roztworu proszku do prania. W podobny sposób zbadać odczyn szamponu.
Tabela IV. Barwa wskaźników alkacymetrycznych w różnych zakresach pH
Wskaźnik
Zakres pH, w którym
wskaźnik zmienia barwę
Barwa w środowisku:
Roztwór
kwaśnym zasadowym
Oranż metylowy
3,1
4,4 czerwona
żółta 0,1%
wodny
Fenoloftaleina 8,3
10,0 bezbarwna
malinowa
0,5%
etanolowy
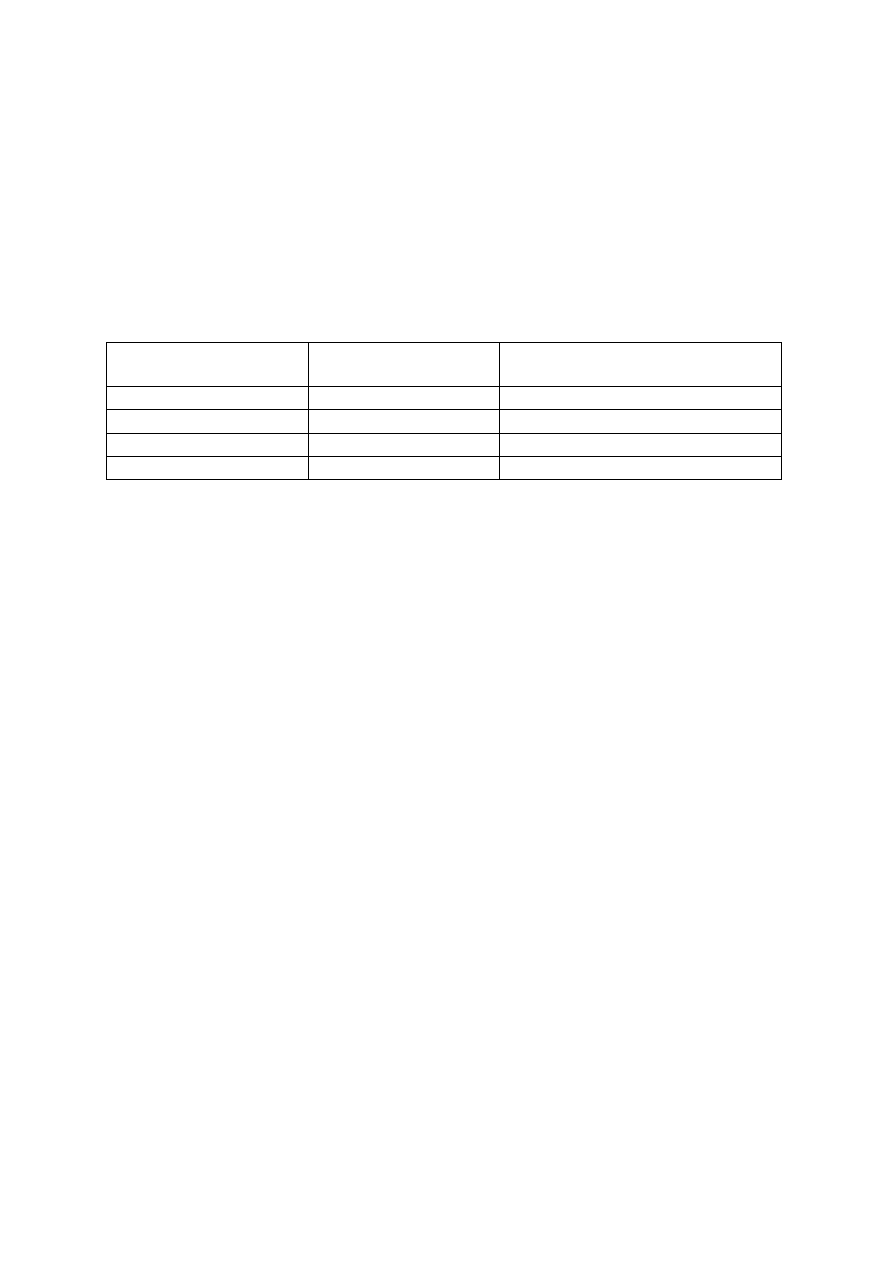
49
7.1.5. Benzyna ekstrakcyjna
Wykonanie ćwiczenia:
Badanie rozpuszczalności wody i tłuszczów w benzynie.
Do probówki zawierającej 0,5 cm
3
benzyny dodać 1 cm
3
wody. Wstrząsnąć zawartość
probówki. Zaobserwować rozpuszczalność obu faz. Do probówki zawierającej 0,5 cm
3
benzyny dodać grudkę tłuszczu stałego. Obserwować rozpuszczalność tłuszczu w powyższym
rozpuszczalniku. Wyniki doświadczeń wpisać do tabeli, której wzór znajduje się poniżej.
Nazwa preparatu
Odczyn
(K-kwaśny/Z-zasadowy)
Obserwacje (barwa i/lub
rozpuszczalność i/lub opis zmian)
Piśmiennictwo:
1. Dreisbach R., Robertson W.: Vademecum zatruć. PZWL, Warszawa 1995.
2. Timbrell J.: Paradoks trucizn. Wydawnictwo Naukowo-Techniczne, Warszawa 2008.
3. Wąsowska-Królikowska K., Toporowska-Kowalska E., Kołaciński Z. et al.: Pediatria Współczesna.
Gastroenterologia, Hepatologia i Żywienie Dziecka 2002, 4 (2): s. 141
146.

50
ZALECANA LITERATURA
1. Bodzek D. (red): Chemia i fizykochemia substancji toksycznych i niebezpiecznych. Skrypt dla studentów
I roku studiów licencjackich specjalność: ratownictwo medyczne. Śląska Akademia Medyczna, Katowice
2003.
2. Bodzek D., Luks-Betlej K., Tyrpień K. (red.): Skrypt do ćwiczeń z chemii i chemii ogólnej dla studentów
I roku Wydziału Lekarskiego z Oddziałem Lekarsko-Dentystycznym w Zabrzu, Wydanie IV. Śląski
Uniwersytet Medyczny, Katowice 2007.
3. Brandys J.: Toksykologia
wybrane zagadnienia. Wydawnictwo Uniwersytetu Jagiellońskiego, Kraków
1999.
4. Dreisbach R.H., Robertson W.O.: Vademecum zatruć. PZWL, Warszawa 1995.
5. Seńczuk W. (red.): Toksykologia współczesna. PZWL, Warszawa 2005, 2006.
6. Timbrell J.: Paradoks trucizn. Wydawnictwo Naukowo-Techniczne, Warszawa 2008.
Wyszukiwarka
Podobne podstrony:
Higiena Przewodnik do cwiczen
parazytologia lekarska przewodnik do ćwiczeń UM Poznań
Przewodnik do ćwiczeń z hokeja na trawie
przewodnik do cwiczeń z immunologii
PPI przewodnik do cwiczen id 381349
przewodnik do cwiczen z geograf Nieznany
PPI - przewodnik do ćwiczeń, Zarządzanie i inżynieria produkcji, Semestr 6, Podstawy projektowania i
Przewodnik do ćwiczeń z geologii inżynierskiej i petrografii
Instrukcja do ćwiczeń laboratoryjnych Określanie wielkości kinematycznych chodu człowieka
Przewodnik do cwiczen-Prawo miedzynarodowe publiczne ADMINISTRACJA , Administracja - studia, III sem
przewodnik do ćwiczeń z logiki dla prawników
Higiena Przewodnik do cwiczen
parazytologia lekarska przewodnik do ćwiczeń UM Poznań
Przewodnik do ćwiczeń z hokeja na trawie
więcej podobnych podstron