WODÓR
Najbardziej rozpowszechniony pierwiastek we wszechświecie 89 %.
Na ziemi około 1 %, ale około 15 % wszystkich atomów. Występuje przede wszystkim w stanie związanym. Woda i minerały typu hydraty. W atmosferze tylko ślady wodoru w stanie wolnym.
Właściwości fizyczne.
Bezbarwny gaz bez smaku i zapachu, słabo rozpuszczalny we wodzie. W normalnych warunkach cząsteczki H2. Tw = 20.4 K, łatwo dyfunduje. Dobre przewodnictwo cieplne. Inne izotopy:
2H = D (deuter 0,016 %), ciężka woda D2O, deuterowane odczynniki.
3H = T, tryt, promieniotwórczy, znakowanie odczynników. t½ = 12.4 lata, emiter β (elektronów) 31T = 32He + -10β-
Otrzymywanie wodoru (metody laboratoryjne)
Reakcja reaktywnych metali z kwasami nieutleniającymi
Zn + 2HCl = ZnCl2 + H2
Reakcja niektórych metali mających właściwości amfoteryczne z zasadami 2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2↑
Napisz podobną reakcję Zn z NaOH, powstaje Na2[Zn(OH)4].
Reakcja metalu z wodą 2Na + 2H2O = 2NaOH + H2↑
Sr + 2H2O = Sr(OH)2 + H2↑
Reakcje jonowych wodorków z wodą
CaH2 + 2H2O = Ca(OH)2 + 2H2↑
jonowo H- + H2O = OH- + H2↑
Otrzymywanie wodoru (metody przemysłowe)
1a) Otrzymywanie gazu wodnego
C + H2O CO + H2 (1500 K) ΔH = 132 kJ · mol-1
1b) Konwersja gazu wodnego, katalizator tlenki (Fe + Cr), zupełnie inne warunki (reguła Le Chateliera-Brauna)
CO(g) + H2O(g) CO2(g) + H2(g) ΔH = -42 kJ · mol-1 600K
i dalej wymywanie CO2,
2a) Otrzymywanie gazu syntezowego
CH4(g) + H2O(g) CO(g) + 3H2(g) ΔH = 205 kJ · mol-1
katalizator niklowy na Al2O3)
2b) Konwersja gazu syntezowego, tak jak konwersja gazu wodnego.
3) Podczas krakingu węglowodorów w rafineriach
4) Elektroliza wody:
a) z dodatkiem H2SO4
katoda 2H+(aq) + 2e = H2(g)
anoda H2O(l) =½O2(g) + 2H+(aq) + 2e
b) z dodatkiem NaOH
katoda: H2O(l) + 2e = H2(g) + 2OH-(aq)
anoda: 2OH-(aq) = ½O2(g) + H2O(l) + 2e
Właściwości chemiczne.
Trwałe cząsteczki H2. H2 → H + H ΔH = 436,0 kJ · mol-1 .
Jest to jedno z najsilniejszych wiązań pojedynczych. Dlatego w normalnych warunkach stosunkowo mało reaktywny. Podgrzany reaguje znacznie szybciej, w obecności katalizatorów reaguje szybko.
Reakcje H2
właściwości redukujące
a) mieszanina piorunująca 2H2 + O2 = 2H2O
b) redukcja tlenku miedzi (II) 2CuO + H2 = Cu2O + H2O
Cu2O + H2 = 2Cu + H2O
c) redukcja wodorem „in statu nascendi”- w chwili powstawania
KMnO4 w środowisku kwaśnym Mn(+7) + 5e = Mn(+2)
Zn + H2SO4 (rozcieńczony) = ZnSO4 + 2H (H2*)
2 KMnO4 + 3H2SO4 + 10H (5H2*) = K2SO4 + 2MnSO4 + 8H2O
KMnO4 w środowisku zasadowym Mn(+7) + e = Mn(+6)
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 6H (3H2*)
2 KMnO4 + 2KOH + 2H (H2*) = 2K2MnO4 + 2H2O
Napisz równanie tej reakcji w wersji jonowej.
Reakcje H2 + 2e = 2H- (-1) właściwości utleniające 2K + H2 = 2KH
H-. Bardzo silna zasada, bardzo silny reduktor.

Reakcje H2 - tworzenie nowych wiązań kowalencyjnych.
Zastosowanie wodoru.
a) Synteza amoniaku
N2(g) + 3H2(g) 2NH3(g) (katalizator żelazny)
ΔH = -92.4 kJ · mol-1 (50% produkcji) (Fe3O4 + K2O + Al2O3) + H2
b) Produkcja metanolu CO(g) + 2H2(g) → CH3OH(c) (katalizator kobaltowy, proces „oxo”)
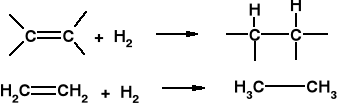
c) Uwodornianie tłuszczów (katalizator niklowy) - produkcja margaryny. H2(g) + ·····C==C····· (c) ·····CH—-CH····· (c)
d) Rafinerie, usuwanie związków S, N i O. przyłączanie do wiązań wielokrotnych.
e) Hydrometalurgia np. Cu2+(H2O) + 2H2(g) = Cu(s) + 2H+( H2O)
f) Redukcja związków metali, tlenki Mo i W do metali w fazie stałej.
g) Synteza chlorowodoru Cl2(g) + H2(g) → 2HCl(g)
h) Paliwo rakietowe (ciekły wodór).
i) Spawanie - palniki tlenowodorowe.
Wodorki
Wodorki typu soli. Metale bloku s - wodorki typu soli, nielotne substancje, nie przewodzące prądu w stanie stałym. Mają charakter wodorkowy, czyli są donorem jonu H- (d = 154 pm). Kationy M+ (litowce) lub M2+ (berylowce oprócz Be i Mg). Wodorki BeH2, MgH2 i AlH3 nie mają typowego charakteru soli. Mają właściwości pośrednie między charakterem soli a charakterem wodorków cząsteczkowych (kowalencyjnych).
Synteza 2Li + H2 = 2LiH
Właściwości CaH2 + 2H2O = Ca(OH)2 + 2H2
Donor H- 4LiH + AlCl3 = Li[AlH4] + 3LiCl
Wodorki metaliczne. Przewodzą prąd elektryczny w stanie stałym. Zmienny skład stechiometryczny np. ZrHx (x = 1,30 - 1,75). łatwo oddają wodór przy nieco podniesionej temperaturze. Potrafią gromadzić wodór (szczególnie Pd, tworząc PdHx, x > 1). Oczyszczanie wodoru przez przepuszczanie przez folię Ag-Pd
Wodorki kowalencyjne. Wszystkie pozostałe. EH4 (gazy), EH3 (gazy), H2E (woda - ciecz, pozostałe gazy), HE (fluorowodór - ciecz, t.w. 19oC, pozostałe gazy). HE - wyraźne właściwości kwasowe we wodzie.
NH3 i H2O wyraźne właściwości zasadowe Lewisa.
H2S, H2Se, H2Te wzrost właściwości kwasowych.
Napisz reakcję NH3 z wodą. Napisz reakcję NH3 z HBr.
reaktywne metale reagujące z kwasami, Mg, Al, Mn, Zn,
reaktywne metale reagujące z zasadami, Al, Sn, Zn,
3
Wyszukiwarka
Podobne podstrony:
07-makroukłady TECH, Materiały PG, Nieorgana
12-helowceTECH, Materiały PG, Nieorgana
13-fluorowceTECH, Materiały PG, Nieorgana
08-tlen, Materiały PG, Nieorgana
TCh1-stud1, Materiały PG, Nieorgana
11-dysocjacjaTECH, Materiały PG, Nieorgana
IR, Materiały PG, Nieorgana
05-OrbitalemolekTECH, Materiały PG, Nieorgana
Egzamin pisemny TChem 2010-tematy-1, Materiały PG, Nieorgana
4-Wodór TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
cwiczenia 7 25.04.2008, Prawoznawstwo, Materialy e-learning, mgr M. Zalewska
04 Dynamika punktu materialnego I
Akustyka materiały pg gda
04 dynamika punktu materialnego
MATERIAŁY IZOLACYJNE NIEORGANICNE, MATERIAŁY IZOLACYJNE NIEORGANICNE
cwiczenia 5 4.04.2008, Prawoznawstwo, Materialy e-learning, mgr M. Zalewska
USTRÓJ-RP-18.04, bezpieczeństwo wewnętrzne materiały
więcej podobnych podstron