TEORIA ORBITALI MOLEKULARNYCH
Teoria Lewisa oraz teoria wiązań walencyjnych nie tłumaczyły takich faktów jak np. paramagnetyczne właściwości tlenu oraz trwałość niektórych związków z deficytem elektronów. Fakty te tłumaczy dobrze teoria orbitali molekularnych. Przy zbliżaniu się dwóch atomów do siebie orbitale atomowe oddziaływają ze sobą. Nakładanie może być dodatnie-dodawanie, wartości funkcji falowej mają w danym punkcie przestrzeni ten sam znak, ujemne (mają znak przeciwny) lub zerowe, inna symetria orbitali atomowych. Teoria ta konstruuje orbitale molekularne z orbitali atomowych atomów tworzących cząsteczkę. Do tworzenia rozpatrujemy oddziaływanie na siebie orbitali atomowych z powłok walencyjnych.
Teoria ta przewiduje, że elektrony w cząsteczce obsadzają orbitale molekularne w miarę wzrostu energii tych orbitali. Orbitale molekularne obejmują całą cząsteczkę. Zgodnie z zakazem Pauliego orbital molekularny może być obsadzony najwyżej przez dwa elektrony różniące się spinem. Zgodnie z regułą Hunda jeżeli dostępnych jest więcej orbitali o tej samej energii to elektrony obsadzają je pojedynczo i mają równoległe spiny.
Konstruowanie orbitali molekularnych
Przyjmuje się, ze orbitale molekularne tworzone z udziałem orbitali rdzenia, zbliżone są do odpowiednich orbitali atomowych z powodu słabego nakładania się (zbyt oddalone od siebie). Zakładamy, że elektrony rdzenia będą opisywane przez orbitale atomowe.
Będziemy zatem konstruowali orbitale cząsteczkowe tylko z orbitali elektronów walencyjnych.
Orbital molekularny (MO) tworzy się przez liniową kombinację orbitali atomowych (LCAO). Z dwóch orbitali atomowych otrzymujemy
dwa orbitale molekularne, czyli dwie nowe funkcje falowe opisujące stan elektronu w układzie złożonym z obydwu jąder.
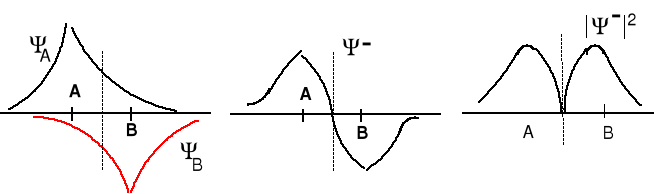
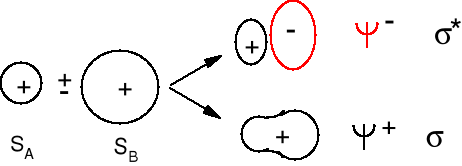
Ψ+ = cA ΨA + cB ΨB (orbital wiążący)
Ψ- = dA ΨA - dB ΨB (orbital antywiążący)
Dla tych samych atomów cA = cB, dla uproszczenia możemy przyjąć
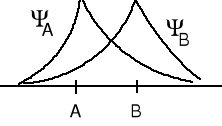
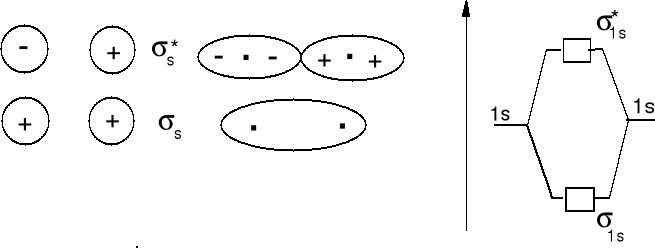
cA = cB = 1. Rozpatrzmy cząsteczkę wodoru H2 - nakładanie czołowe dwóch orbitali 1s - wiązania σ.
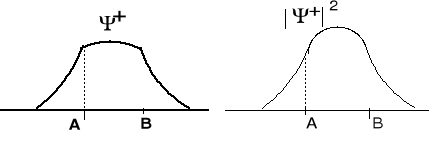
Ψ+ = ΨA + ΨB - orbital wiążący, amplitudy funkcji falowych się dodają
Elektron na tym orbitalu
silnie oddziałuje z dwoma
jądrami i jego energia jest
niższa niż na każdym z orbitali
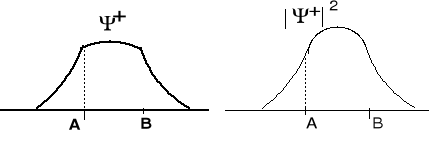
atomowych. Prawdopodobieństwo znalezienia się elektronów między jądrami jest duże. Elektrony na tym orbitalu stabilizują cząsteczkę.
Po prostu tworzą wiązanie chemiczne.
Ψ- = ΨA - ΨB orbital antywiążący, amplitudy funkcji falowych się odejmują. Elektron na tym orbitalu słabo oddziałuje z dwoma jądrami i jego energia jest wyższa niż na każdym z orbitali atomowych.
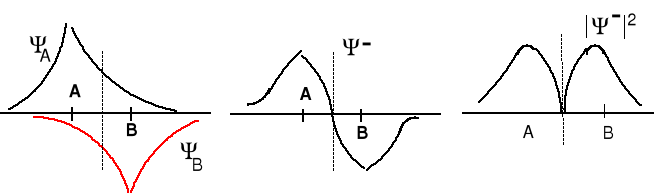
Prawdopodobieństwo znalezienia się elektronów między jądrami jest małe. W połowie odległości między jądrami A i B (A = B) wynosi zero.
Jest to płaszczyzna węzłowa. Obsadzenie tego orbitalu elektronami destabilizuje cząsteczkę.
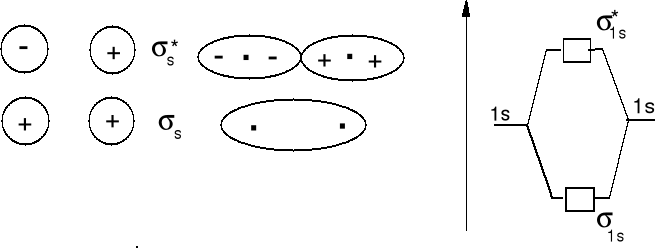
Cząsteczki i jony homojądrowe pierwiastków pierwszego okresu.
Jon H2+ obsadzenie (σ1s1), cząsteczka H2 obsadzenie (σ1s2), jon He22+ obsadzenie (σ1s2) - istnieje , jon He2+ obsadzenie (σ1s2), (σ*1s1) - istnieje, hipotetyczna cząsteczka He2 obsadzenie (σ1s2), (σ*1s2) - efekt destabilizujący obsadzenia σ*1s2 jest większy niż stabilizujący obsadzenia σ1s2 - cząsteczka nie istnieje.
Cząsteczki i jony homojądrowe pierwiastków drugiego okresu.
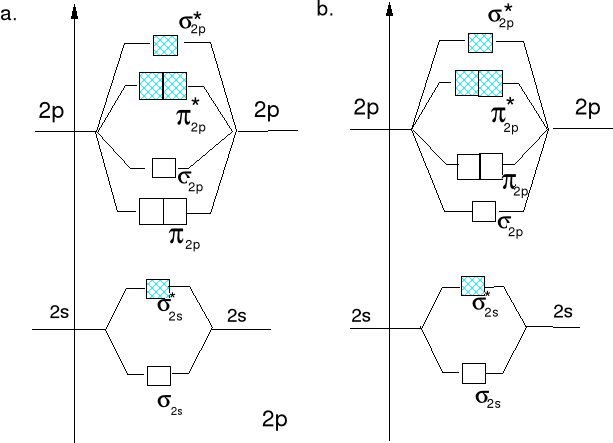
Oddziaływanie orbitali atomowych typu 2s prowadzi do wytworzenia orbitali molekularnych typu σ2s i σ*2s (podobnie jak pokazano dla 1s).
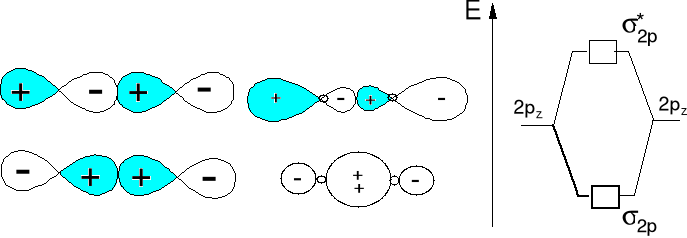
Wzajemne oddziaływanie orbitali atomowych typu 2pz prowadzi do wytworzenia orbitali molekularnych typu σ2p i σ*2p.
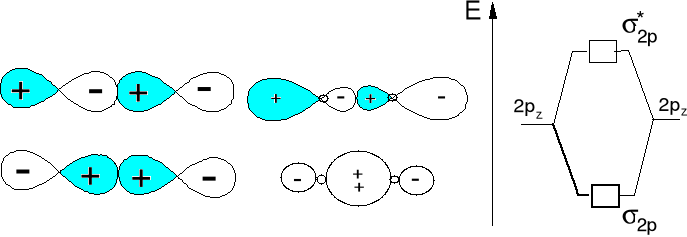
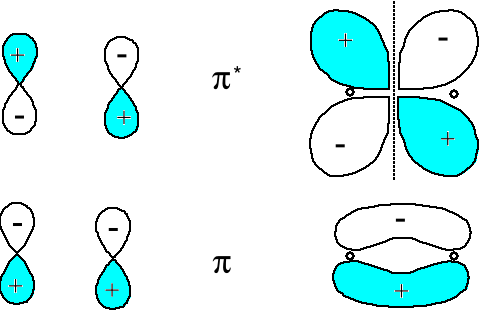
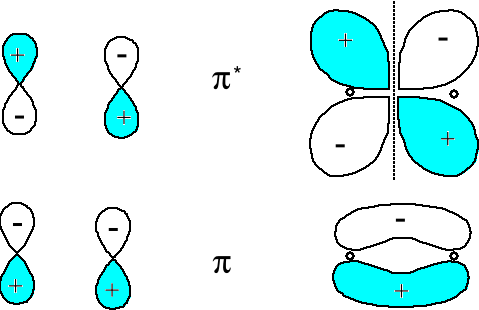
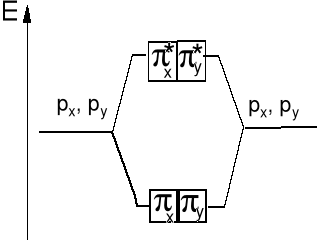
Wzajemne oddziaływanie orbitali atomowych typu 2px obydwu atomów prowadzi do wytworzenia orbitali molekularnych typu π2px i π*2px a 2py do π2py i π*2py.
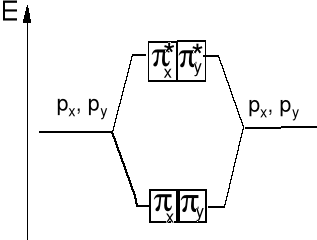
Orbital antywiążący π*2p ma płaszczyznę węzłową w poprzek wiązania A-B
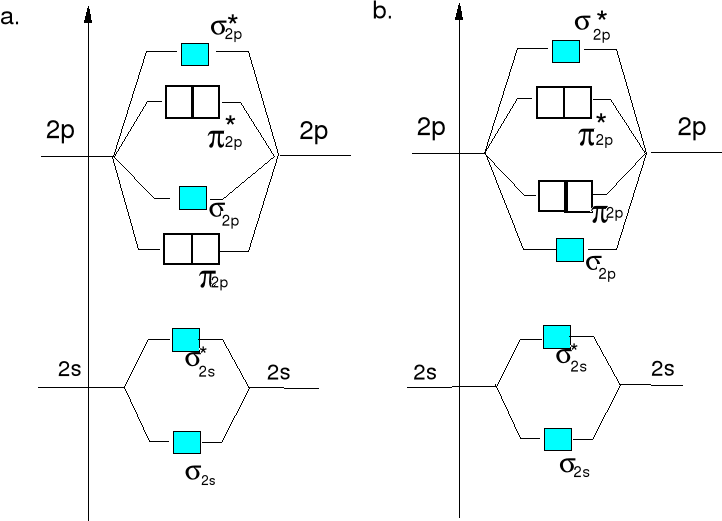
Diagramy energii orbitali molekularnych dla cząsteczek lub jonów homojądrowych X2a drugiego okresu.
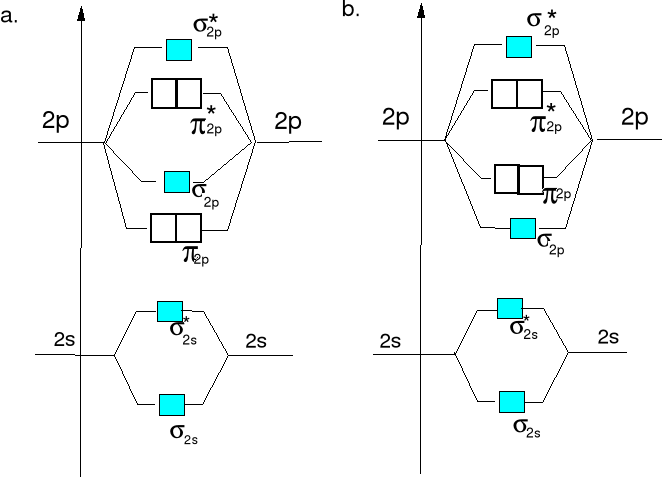
Diagram energii orbitali mol. Diagram energii orbitali mol.
dla Li2, Be2,B2, C2 i N2. dla O2 i F2.
W diagramach tych uwzględniono tylko orbitale ostatniej warstwy elektronowej. Elektrony walencyjne umieszczamy na orbitalach molekularnych zgodnie z wzrastającą ich energią
Diagram a)
Li2 (σ2s)2
Be2 (σ2s)2, (σ*2s)2 nie istnieje, Be2+ (σ2s)2, (σ*2s)1
B2 (σ2s)2, (σ*2s)2, (π2px)1, (π2py)1 - paramagnetyczny
C2 (σ2s)2, (σ*2s)2, (π2px)2, (π2py)2 C2-2 (σ2s)2, (σ*2s)2, (π2px)2, (π2py)2, (σ2p)2
N2 (σ2s)2, (σ*2s)2, (π2px)2, (π2py)2, (σ2p)2
Diagram b)
O2 (σ2s)2, (σ*2s)2, (σ2p)2, (π2px)2, (π2py)2, (π*2px)1, (π*2py)1 - paramagnetyczny
O2- (σ2s)2, (σ*2s)2, (σ2p)2, (π2px)2, (π2py)2, (π*2px)2, (π*2py)1 - paramagnetyczny
O22- (σ2s)2, (σ*2s)2, (σ2p)2, (π2px)2, (π2py)2, (π*2px)2, (π*2py)2
F2 (σ2s)2, (σ*2s)2, (σ2p)2, (π2px)2, (π2py)2, (π*2px)2, (π*2py)2
Rząd wiązania jest to w rozumieniu teorii orbitali molekularnych
½ (liczba elektronów na orbitalach wiążących - liczba elektronów na orbitalach antywiążących).
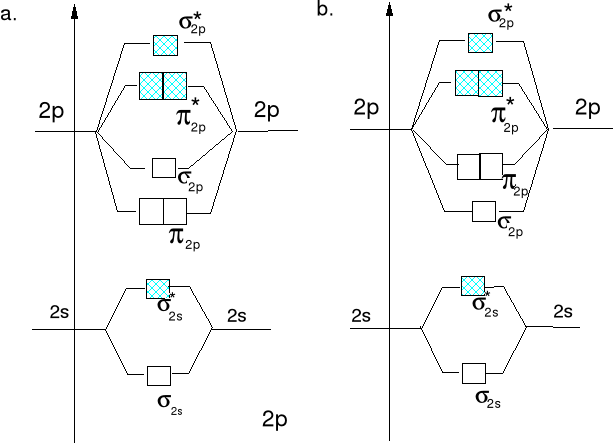
posłużymy się diagramem energii orbitali molekularnych dla A2
N2 (σ2s)2, (σ*2s)2, (π2px)2, (π2py)2, (σ2p)2 - razem 10e.
2 -2 2 2 2 = 6 Rząd wiązania (r.w.) = 3
O2 (σ2s)2, (σ*2s)2, (σ2p)2, (π2px)2, (π2py)2, (π*2px)1, (π*2py)1 - razem 12e.
2 -2 2 2 2 -1 -1 = 4 r.w. = 2
O2- (σ2s)2, (σ*2s)2, (σ2p)2, (π2px)2, (π2py)2, (π*2px)2, (π*2py)1 - razem 13e.
2 -2 2 2 2 -2 -1 = 3 r.w. = 1,5
O22- (σ2s)2, (σ*2s)2, (σ2p)2, (π2px)2, (π2py)2, (π*2px)2, (π*2py)2 - razem 14e.
2 -2 2 2 2 -2 -2 = 2 r.w. = 1
Ne2 (σ2s)2, (σ*2s)2, (σ2p)2, (π2px)2, (π2py)2, (π*2px)2, (π*2py)2, (σ*2p)2 razem 16e
2 -2 2 2 2 -2 -2 -2 = 0 r.w. = 0
Dwuatomowe cząsteczki heterojądrowe AB.
Ψ+ = cA ΨA + cB ΨB (orbital wiążący)
Ψ- = dA ΨA - dB ΨB (orbital antywiążący)
Orbitale molekularne możemy tworzyć tylko z takich orbitali atomowych, które wykazują taką samą symetrię wobec osi wiązania (z), zatem sA i sB, sA i pzB oraz pzA i pzB, a także pxA i pxB oraz pyA i pyB.
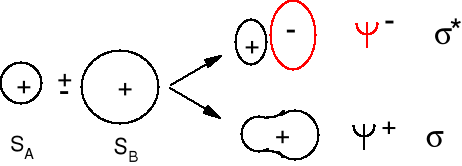
Powstawanie orbitali wiążących σ i antywiążących σ* z orbitali atomowych sA i sB
Powstawanie orbitali wiążących σ i antywiążących σ* z orbitali atomowych sA i pzB.
powstawanie orbitali wiążących π i antywiążących π* z orbitali atomowych pxA i pxB lub pyA i pxB.
Poziomy energetyczne orbitali Poziomy energetyczne orbitali
molekularnych Ψ+ i Ψ- dla ma- molekularnych Ψ+ i Ψ- dla dużej
łej różnicy energii ΨA i ΨB. różnicy energii ΨA i ΨB.
Atom A jest atomem bardziej elektroujemnym. Energia orbitalu ΨA leży niżej niż ΨB. Orbital wiążący Ψ+ cząsteczki A-B przypomina orbital atomowy ΨA a orbital antywiążący Ψ- przypomina orbital atomowy ΨB.
9
Wyszukiwarka
Podobne podstrony:
12-helowceTECH, Materiały PG, Nieorgana
04-Wodór TECH, Materiały PG, Nieorgana
07-makroukłady TECH, Materiały PG, Nieorgana
13-fluorowceTECH, Materiały PG, Nieorgana
08-tlen, Materiały PG, Nieorgana
TCh1-stud1, Materiały PG, Nieorgana
11-dysocjacjaTECH, Materiały PG, Nieorgana
IR, Materiały PG, Nieorgana
Egzamin pisemny TChem 2010-tematy-1, Materiały PG, Nieorgana
wzm oper 05, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, Układy Elektronicz
Akustyka materiały pg gda
miernictwo wyklad 05, INNE MATERIAŁY
MATERIAŁY IZOLACYJNE NIEORGANICNE, MATERIAŁY IZOLACYJNE NIEORGANICNE
materiałożnawstwo 9 - 08.05.2007, Materiałoznawstwo - wykłady
STATYSTYKA-wykład z 13-05-2000, Materiały z zajęć, statystyka
wzm mocy 05, Inzynieria Materiałowa, I semestr, Elektrotechnika, elektrotechnika, Układy Elektronicz
Rozdział 05, S. Rudnik - materiałoznawstwo
więcej podobnych podstron