FLUOROWCE
Blok p grupa 17-ta FLUOROWCE elektrony walencyjne ns2np5. Pierwiastki bardzo reaktywne. Wysoki potencjał jonizacji, zatem mała tendencja do tworzenia jonów X+ i bardzo duże powinowactwo elektronowe, łatwo powstają jony X-. Występują jako cząsteczki dwuatomowe X2.
Fluorowiec |
F2(g) |
Cl2(g) |
Br2(l) |
I2(s) |
At(s) |
Elektrony walencyjne |
2s22p5 |
3s23p5 |
4s24p5 |
5s25p5 |
6s26p5 |
E.I. [kJ·mol-1] |
1680 |
1256 |
1143 |
1009 |
[926] |
Pow. elektr. [kJ·mol-1] |
332,6 |
348,5 |
324,7 |
295,5 |
[270] |
Promień v.d.Waals [pm] |
135 |
180 |
195 |
215 |
— |
Promień jon. X- [pm] |
133 |
184 |
196 |
220 |
— |
Elektroujemność. (Pauling) |
4,0 |
3,16 |
2,96 |
2,66 |
— |
ΔHo(dys. X2) [kJ·mol-1] |
158,8 |
242,6 |
192,8 |
151,1 |
— |
Temp. wrzenia [oC] |
-188,1 |
-34,0 |
59,5 |
185,2a |
— |
Eo dla ½E2(g) + e = E-(aq) |
+2.85 |
+1,36 |
+1,09 |
+0.54 |
— |
FLUOR Moissan (1886).
Dość rozpowszechniony w przyrodzie. Główne minerały:
CaF2 - fluoryt, Na3[AlF6] - kriolit, Ca5(PO4)3F - fluoroapatyt.
Jasno żółty gaz. Niezwykle reaktywny chemicznie. Najsilniejszy znany utleniacz. Stopień utlenienia tylko -1. Najbardziej elektroujemny.
Mała standardowa. entalpia dysocjacji F2 +158,8 kJ ∙ mol-1 - duża reaktywność.
Standardowy potencjał reakcji redukcji:
½F2(g) + e = F-(aq) Eo = 2,85 V
½F2(g) + H+(aq) + e = HF(aq) Eo = 3,03 V
są to najwyższe znane wartości. Nie ma utleniacza chemicznego mogącego bezpośrednio utlenić związki fluoru (-1) do F2.
Otrzymywanie fluoru - elektroliza KF.3HF. Warunki ściśle bezwodne). Aparatura Ni-Cu (stop Monela), Cu, Pt lub stal. Katoda jest miedziana lub stalowa, anoda węglowa (koks bezgrafitowy). Napisz reakcje elektrodowe dla tej reakcji, na katodzie wydziela się gazowy wodór, na anodzie F2. Anoda jest dość szybko niszczona. Jest to praktycznie elektroliza HF. Podobnie jest n. p. przy elektrolizie wodnego roztworu KOH, gdzie jest praktycznie redukcja i utlenianie wody.
Związki fluoru:
Reaguje bezpośrednio z wszystkimi pierwiastkami oprócz O2, N2, He, Ne i Ar. Wzbudzony reaguje bezpośrednio z O2, N2 i Ar.
Difluorek tlenu OF2, bladożółty gaz, nie jest bezwodnikiem kwasowym
NaOH + F2 = OF2 + …… uzupełnij reakcje i podaj stopnie utlenienia. Podaj wzór Lewisa OF2 i podaj kształt jego cząsteczki
FLUOROWODÓR HF I FLUORKI
(HF)n ciecz o temperaturze wrzenia 19 ºC. Wyjaśnij dlaczego. Przypomnij warunki występowania silnego wiązania wodorowego. Roztwór wodny to słaby kwas. Handlowy kwas fluorowodorowy to z reguły azeotrop 38 - 39 %.
CaF2 + 2H2SO4 = Ca(HSO4)2 + (HF)2 (70 - 120 oC)
Ca(HSO4)2 + CaF2 = 2CaSO4 + 2HF (200 - 250 oC)
KHF2 = KF + HF (500 - 600 oC) aparatura miedziana.
Fluorki jonowe: jon F- (136 pm), podobny do rozmiaru jonu tlenkowego O2- (140 pm). Jest to bardzo twarda zasada w rozumieniu Pearsona.
Bezpośrednia synteza: metal + fluor prowadzi z reguły do najwyższych możliwych stopni utlenienia:
Ag + F2 → AgF2 a nie AgF
2Bi + 5F2 → 2BiF5 a nie BiF3
2Co + 3F2 → 2CoF3 a nie CoF2
Pt + 3F2 = PtF6 W + 3F2 = WF6
i bardzo ważna reakcja U + 3F2 = UF6
Fluorki na niższych stopniach utlenienia - można je otrzymać przez reakcje metali, tlenków lub węglanów metali z kwasem fluorowodorowym.
Bi2O3 + 6HF(aq) = 2BiF3 + 3H2O na niższym „normalnym” stopniu utlenienia.
Ag2O + 2HF(aq) = 2AgF + H2O na niższym „normalnym” stopniu utlenienia.
Sn + 2HF = SnF2 + H2
Kilka doświadczeń pokaże różnice w rozpuszczalności fluorków w odniesieniu do chlorków (także bromków i jodków).
AgNO3 + NaF — brak osadu
CuSO4 + 2NaF = Na2SO4 + CuF2↓ (niebieski) podobnie związki Ni(II).
BaCl2 + 2NaF = biały osad uzupełnij i napisz w formie jonowej.
Podobnie reagują sole ołowiu, magnezu.

CaCl2 + 2NaF = biały galaretowaty osad
F- jako ligand, tworzenie jonów kompleksowych
Odbarwianie siarkocyjankowego kompleksu Fe(III)
FeCl3 + 3NaSCN = [Fe(SCN)3] - sól słabo zdysocjowana
[Fe(SCN)3] + 3NaSCN = Na3[Fe(SCN)6]
Na3[Fe(SCN)6] + 6NaF = Na3[FeF6] + 6 NaSCN
Zapisz te reakcje w formie jonowej. Podaj reakcję dysocjacji elektrolitycznej sześciofluorożelazianu (III) sodu, zapisz te reakcje w formie jonowej.
Gazowy HF atakuje i powoduje matowienie szkła. Trawienie szkła kwasem fluorowodorowym daje natomiast powierzchnie gładkie.
SiO2 + 4HF → SiF4 + 2H2O SiF4 - gaz
SiF4 + 2HF(aq) → H2[SiF6] (aq) dodatkowo w roztworze wodnym HF.
SiO2 + 6HF (aq) → H2[SiF6] (aq) + 2H2O
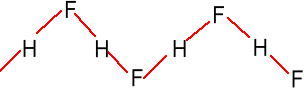
Chętnie tworzy aniony pochodzące od (HF)n - H+, np. H3F4-, H2F3-, HF2-. HF + KF = KHF2
![]()
KHF2 → K+ + [HF2]-
Ogrzewanie: KHF2 → HF + KF
Powstający gazowy HF barwi papierek uniwersalny na czerwono, także reaguje ze szkłem.
Podobnie ogrzewanie NH4HF2 → NH3 + 2 HF
papierek uniwersalny barwi się na niebiesko, dlaczego?
KWAS FLUOROKRZEMOWY I FLUOROKRZEMIANY
Kwas fluorokrzemowy H2SiF6 jest znany tylko w roztworach wodnych.
Jest to mocny kwas sprzedawany jako 40 % roztwór.
2HF(aq) + SiF4 = H2SiF6
SiF4 + H2O = H2SiF6 + SiO2.H2O dobierz współczynniki tej reakcji.
Na2[SiF6] dość słabo rozpuszczalny. K2[SiF6] jeszcze słabiej.
H2[SiF6] + 2 KCl = K2[SiF6]↓ + 2HCl odróżnienie od F-
Ba2+ + [SiF6]2- = Ba[SiF6]↓ podaj zapis cząsteczkowy.
Brak osadu z solami ołowiu (II). Odróżnienie od F- (PbF2).
Brak osadu z solami srebra (I).
Reakcja z NaOH H2[SiF6] + 2NaOH = Na2[SiF6] + 2H2O
Na2[SiF6] + 4NaOH = 6NaF + SiO2.H2O + H2O
Na2[SiF6] + 2H2SO4(stężony) = 2NaHSO4 + (HF)2 + SiF4
Termiczny rozkład fluorokrzemianów. Na2[SiF6] = 2NaF + SiF4
Fizjologiczne działanie związków fluoru, zasadniczo trujące, małe ilości fluorków dodawane są do past do zębów. Kwas fluorowodorowy silnie toksyczny i niebezpiecznie uszkadzający tkanki.
Zastosowanie związków fluoru - olbrzymie.
NH4HF2 - zabezpieczanie powierzchni cementu przed kwaśnymi zanieczyszczeniami atmosfery.
SF6 - gazowy środek izolujący termicznie, dielektryk.
Na3AlF6 - topnik w elektrolitycznym otrzymywaniu glinu.
UF6 - wzbogacanie uranu w izotop 235U.
Organiczne monomeryczne związki fluoru (freon - CCl2F2) lodówki, spray - ostatnio ograniczane (niszczenie ozonu w stratosferze).
Organiczne polimeryczne związki fluoru, olbrzymie znaczenie.
Przez polimeryzację F2C=CF2 otrzymujemy teflon
Doskonała odporność termiczna i chemiczna, powłoki antyadhezyjne.
Częściowo fluorowane polimery i smary.
CHLOR
Żółtozielony gaz, silnie trujący. Znakomicie rozpuszcza się w CCl4.
Minerały chloru, złoża powstały podczas wysychania wody morskiej:
halit NaCl karnalit KCl∙MgCl2∙6H2O,
sylwin KCl kainit KCl∙MgSO4∙3H2O.
Otrzymywanie techniczne: elektroliza stopionej bezwodnej mieszaniny
NaCl + CaCl2 (dlaczego) lub elektroliza wodnego roztworu NaCl.
a) stopiony bezwodny NaCl K: 2 Na+ + 2e → 2Na
+ CaCl2 pokazano tylko dla NaCl A: 2Cl- → Cl2 + 2e
Produktem bardzo cennym jest metaliczny sód.
b) wodny roztwór NaCl K: 2H2O + 2e → 2OH- + H2
A: 2Cl- → Cl2 + 2e
Produktem bardzo cennym jest NaOH (proces anodowy).
Otrzymywanie laboratoryjne: utleniamy Cl-.
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2↑ (metoda Scheele'go):
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 8H2O + 5Cl2↑
CaCl(OCl) + 2HCl → CaCl2 + H2O + Cl2↑
Chlor jest bardzo reaktywnym pierwiastkiem, lecz zdecydowanie mniej reaktywnym od F2. Chlor jest silnym utleniaczem, jednak słabszym od fluoru.
Potencjał standardowy reakcji redukcji:
½Cl2(g) + e = Cl-(aq) Eo = 1,36 V
Spalanie w atmosferze chloru: 2As + 3Cl2 → 2AsCl3 dymy, iskry
P4 + 10 Cl2 → 4 PCl5 samozapłon i białe dymy stałego PCl5
Sn + 2Cl2 → SnCl4 pył cynowy w tyglu kwarcowym
Parafina przy spalaniu w chlorze wydziela sadzę.
C22H46 + 23Cl2 → 22C + 46HCl świeczka kopci paląc się w chlorze.
Reakcja Cl2 + H2 → 2HCl na świetle wybuchowa reakcja łańcuchowa
Cl2 + hυ → Cl∙ + Cl∙ homolityczne rozerwanie wiązania Cl-Cl, inicjacja
Cl∙ + H2 → HCl + H∙
H∙ + Cl2 → HCl + Cl∙ wielokrotnie powtórzone, propagacja
Cl∙ + Cl∙ → Cl2
Cl∙ + H∙ → HCl rekombinacja rodników, terminacja
H∙ + H∙ → H2
Właściwości bielące chloru (utlenianie): środowisko wilgotne, utlenianie barwników takich jak fuksyna, lakmus, barwniki kwiatka.
Roztwór chloru we wodzie, woda chlorowa. Co to jest chemicznie?
W 1 dm3 wody rozpuszcza się 2,26 dm3 chloru. Fizyczny proces solwatacji oraz reakcja chemiczna : Cl2 + H2O ![]()
HCl + HClO
Można udowodnić obecność jonów Cl- (reakcja z AgNO3)
Pod wpływem światła nieodwracalnie: 2HClO → 2HCl + O2
Reakcje z wodą chlorową: ma ona właściwości utleniające.
2KBr + Cl2 → 2KCl + Br2 chloroform brązowy
Cl2 + Br2 → 2BrCl żółto-winny
2KI + Cl2 → 2KCl + I2 chloroform fioletowy
Cl2 + I2 + H2O → HIO3 + ............uzupełnij bezbarwny
H2S + Cl2 → 2HCl + S
Chlorowodór: bardzo ważny technicznie związek. Gaz o tw. - 85 ºC.
Związek kowalencyjny, udział struktury jonowej około 18 %.
H2 + Cl2 → 2HCl ΔH = -542 kJ. metoda techniczna spalanie wodoru w chlorze
NaCl + H2SO4 → NaHSO4 + HCl ↑ reakcja wymuszana przez lotność HCl
NaCl + NaHSO4 → Na2SO4 + HCl ↑ ogrzewanie
Znakomicie rozpuszcza się we wodzie 400 objętości w 1 objętości wody.
gęstość takiego roztworu d = 1,19 g·cm-3 (25 ºC). Stężenie procentowe
nasyconego roztworu około 38 %. Roztwór to silny kwas solny.
Na podstawie tych danych oblicz jaka będzie całkowita objętość roztworu, jeżeli
nasycimy 0,5 dm3 wody gazowym HCl.
Metale nieszlachetne takie jak:
cynk (E0 = -0,76 V), glin (E0 = -1,66 V), żelazo (E0 = -0,44 V, dla reakcji
Fe2+(aq) + 2e = Fe(s))
łatwo roztwarzają się w kwasie solnym z wydzieleniem wodoru. .
Zn + 2HCl → ZnCl2 + H2↑
Fe + HCl → ................ Uzupełnij równanie reakcji, powstaje FeCl2 a nie FeCl3
Cr + HCl → ................ Uzupełnij równanie reakcji, powstaje CrCl2 a nie CrCl3
Natomiast metale szlachetne:
Au (E0 = +1,36 V), Pt (E0 = +1,18 V)
i inne o dodatnim potencjale normalnym, np.
Cu (E0 = +0,32 V), Ag (E0 = +0,80 V), Hg (E0 = +0,80 V)
nie roztwarzają się w kwasie solnym.
Cu + HCl brak reakcji.
Reakcje analityczne jonów chlorkowych:
AgNO3 + HCl → HNO3 + AgCl↓ fioletowieje na słońcu
AgCl + 2NH3 → [Ag(NH3)2]Cl zapisz tą reakcję jonowo.
Hg2(NO3)2 + 2NaCl → 2NaNO3 + Hg2Cl2↓ czernieje pod wpływem amoniaku
Hg2Cl2 + 2NH3 → NH4Cl + Hg(NH2)Cl + Hg
Pb(CH3COO)2 + 2KCl → 2CH3COOK + PbCl2↓ nieco rozpuszczalny
PbCl2 + 2KI → 2KCl + PbI2↓
Chlorki kowalencyjne: chlorki niemetali i metali na wysokich stopniach
utlenienia. Gazy (HCl), ciecze (CCl4, SiCl4, SnCl4, BCl3, AsCl3, PCl3,
NCl3, SbCl5) i łatwo lotne ciała stałe (PCl5). Większość tych chlorków
ulega łatwo hydrolizie do odpowiednich kwasów tlenowych, stosunkowo
trwały jest natomiast CCl4. Tlenochlorki, POCl3, SOCl2, SO2Cl2.
SiCl4 + nH2O → SiO2·(n-2)H2O + 4HCl mgła, dymy, kwaśny odczyn
PCl5 + 4H2O → H3PO4 + 5HCl można wykryć H3PO4 w reakcji z (NH4)2MoO4
TLENKI CHLORU I KWASY TLENOWE CHLORU
Tlenek chloru (I), nietrwały żółtobrązowy gaz, silny utleniacz,
bezwodnik kwasu chlorowego (I) Cl2O. Atom centralny, tlen, budowa
kątowa (kształt trójkąta). Podaj wzór Lewisa tlenku chloru (I).
Kwas chlorowy (I), podchlorawy, HOCl, słaby kwas K = 2,9.10-8
Cl2 + H2O HCl + HOCl
2 HOCl 2HCl + O2 - światło
kwas 2HOCl(aq) jest w równowadze z Cl2O
2HOCl(aq) Cl2O(aq) + H2O
silne działanie utleniające
HOCl(aq) + H+(aq) + 2e = H2O + Cl- (śr. kwaśne) Eo = + 1,47V
Sole chlorany (I), podchloryny. Reakcja dysproporcjonowania
2 NaOH + Cl2 = NaCl + NaOCl + H2O (woda Javelle)
Zastosowanie: bielenie tkanin, dezynfekcja.
Ważny produkt techniczny - wapno chlorowane (wapno bielące)
CaCl(OCl). Podaj reakcję roztworu Ca(OH)2 z gazowym chlorem. Podaj
dysocjację elektrolityczną CaCl(OCl).
Podchloryny są silnymi utleniaczami zarówno w roztworze kwaśnym
jak i zasadowym.
Utlenianie KI:
2KI + NaOCl + H2SO4 = I2 + K2SO4 + NaCl + H2O (śr. kwaśne)
Nadmiar NaOCl utlenia I2 w środowisku kwaśnym między innymi do
kwasu jodowego (V) HIO3. Napisz te reakcje.
Utlenienie Pb(OH)2 w warunkach alkalicznych:
Pb(CH3COO)2 + 2NaOH = Pb(OH)2 + 2CH3COONa
Pb(OH)2 + NaOCl = PbO2 + NaCl + H2O (osad brunatny)
Zbilansuj następujące reakcje:
NaOCl z Cr(OH)3 w środowisku zasadowym. Powstaje chromian(VI)
soduNaOCl z PbS w środ. obojętnym. Powstaje siarczan(VI) ołowiu(II).
NaOCl z HCl w środowisku kwaśnym. Powstaje chlor.
NaOCl z azotanem (III) sodu w środowisku obojętnym. Powstaje
azotan (V) sodu.
Trwałość termiczna jonu OCl- i HOCl jest niewysoka.
3HOCl = 2HCl + HClO3 reakcje
3KOCl = 2KCl + KClO3 dyspropocjonowania
Zapisz tę reakcję w formie jonowej. Wskaż utleniacz i reduktor.
Kwas chlorowy (III) HClO2 (chlorawy) i jego sole. Jest bardzo
nietrwałym, średniej mocy (K = 1,7.10-2) kwasem.
Dwutlenek chloru ClO2, tlenek chloru (IV), żółty, wybuchowy gaz o przenikliwym zapachu, silny utleniacz. Kąt O-Cl-O wynosi 117,2º. Zatem geometria centralnego atomu chloru jest bliska trygonalnej.
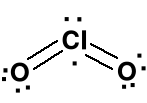
Rozszerzony oktet przy
atomie chloru
Dwutlenek chloru można otrzymać działając na stały chloran potasu stężonym H2SO4. Odkażanie wody.
KClO3 + H2SO4 → KHSO4 + HClO3
dysproporcjonowanie 3 HClO3 → HClO4 + H2O + 2ClO2↑
Jest to związek endotermiczny, bardzo łatwo, często wybuchowo zachodzi reakcja: ClO2 → O2 + ½Cl2 ΔH = - 106,6 kJ.
Dość dobrze rozpuszcza się we wodzie. Należy go traktować jako bezwodnik kwasu chlorowego (III) i chlorowego (V).
2 KOH + 2 ClO2 → KClO2 + KClO3 + H2O
Kwas chlorowy (V) HClO3 (chlorowy) i jego sole.
Jest stosunkowo trwałym silnym kwasem.
Ba(ClO3)2 + H2SO4 = 2HClO3 + BaSO4↓
W stężeniach ponad 40 % rozpada się (dysproporcjonuje)
Jest energicznym środkiem utleniającym.
HClO3 + 5H+(aq) + 6e = 3H2O + Cl- (śr. kwaśne) Eo = + 1,47V
ClO3- + 3H2O + 6e = Cl- + 6OH- (śr. zasadowe) Eo = + 0,69V
Otrzymywanie chloranów (V), stosunkowo trwałe sole:
Elektroliza lekko kwaśnego NaCl w temp. około 80 oC.
Na anodzie wydziela się Cl2, na katodzie NaOH, mieszamy produkty elektrodowe.
2NaOH + Cl2 → NaCl + NaOCl + H2O
3NaOCl → 2NaCl + NaClO3
NaClO3 - doskonale rozpuszczalny, higroskopijny. Środek chwastobój- czy. Najważniejszy związek KClO3 (sól Bertholeta), znacznie gorzej rozpuszczalny, nie jest higroskopijny. Otrzymywanie:
KCl + NaClO3 = KClO3↓ + NaCl trzeba dobrać warunki do strącenia KClO3
Zastosowanie: Pirotechnika, materiały wybuchowe, zapałki.
Właściwości utleniające chloranów: mocne utleniacze zasadniczo w środowisku kwaśnym, w obojętnym są słabymi utleniaczami:
KClO3 + 6KI + 3H2SO4 = 3I2 + 3K2SO4 + KCl + 3H2O
Wykrywanie jonu ClO3- . (V grupa anionów).
Redukujemy do jonu Cl- i wykrywamy w postaci AgCl.
KClO3 + 3Zn + 3H2SO4 = KCl + 3ZnSO4 + 3H2O (śr. kwaśne)
KClO3 + Al + KOH + H2O = uzupełnij reakcję K[Al(OH)4] (śr. zasadowe)
KClO3 + Zn + KOH+ H2O = uzupełnij reakcję K2[Zn(OH)4] (śr. zasadowe)
Kwas chlorowy (VII) HClO4 (nadchlorowy) i jego sole.
Jest stosunkowo trwałym bardzo silnym kwasem. W stężeniach ponad 70 % rozpada się, może samorzutnie eksplodować.
Jest dość energicznym środkiem utleniającym.
HClO4 + 7H+(aq) + 8e = 4H2O + Cl- (śr. kwaśne) Eo = + 1,38V
Mimo wysokiego potencjału oksydacyjnego rozcieńczony HClO4 jest stosunkowo stabilny i mało reaktywny. Nie odbarwia indyga, nie utlenia HNO2, HI, H2SO3. Metale jak magnez, cynk - H2 w reakcji z bardzo rozcieńczonym HClO4.
Otrzymywanie chloranów (VII):
Dysproporcjonowanie chloranów (V) w temp. około 400 oC.
2 KClO3 → KClO4 + KCl + O2
ClO3-(aq) + 2 OH- = ClO4-(aq) + H2O + 2e anodowe utlenianie chloranów (V)
Wolny kwas: NaClO4 + HCl → NaCl ↓ + HClO4 dobieramy
warunki do strącenia NaCl i zatężamy HClO4 przez destylację próżniową.
Zastosowanie:
HClO4 do ilościowego oznaczania K+, Rb+ i Cs+. Także NH4ClO4 rozpuszcza się dość słabo we wodzie.
NaClO4 do otrzymywania wszystkich innych nadchloranów.
KClO4 pirotechnika, najczęściej w rakietach sygnałowych.
NH4ClO4 w silnikach rakietowych (75 %), 25 % stanowi palny polimer lub pył glinowy.
BROM
BROM Ciemnobrązowa ciecz. T.w. = 59 oC.
Rozpowszechniony w przyrodzie. Rzadki jako minerał w skorupie ziemskiej n. p. AgBr. Główne zasoby w oceanach 6,5.10-3 % (65 ppm) jako NaBr. Odkryty przez Balarda 1826.
Otrzymywanie bromu w technice. Z wody morskiej przez działanie chlorem, przedmuchiwanie powietrzem i oziębianie tego powietrza.
2NaBr + Cl2 Ⴎ 2NaCl + Br2
Otrzymywanie bromu w laboratorium, utlenianie HBr i bromków:
MnO2 + 2KBr + 2H2SO4 = Br2 + K2SO4 + MnSO4 + 2H2O
Napisz tę reakcję w formie jonowej.
KBr + KMnO4 + H2SO4 = Br2 + K2SO4 + MnSO4 + H2O Ekstrakcja Dobierz współczynniki, napisz tę reakcję w formie jonowej.
Brom jest reaktywny ale mniej niż chlor. Br2 jest utleniaczem słabszym od Cl2. Potencjał standardowy reakcji redukcji:
½Br(c) + e = Br-(aq) Eo = 1,09 V
![]()
Pn + 3Br2 → 2PBr3 2PBr3 + 2Br2 Ⴎ 2PBr5
Zn(s) + Br2(aq) Ⴎ ZnBr2(aq) (Zn2+ + 2Br-)
3Zn2+ + 2[Fe(CN)6]3- Ⴎ Zn3[Fe(CN)6]2 żółtobrązowy osad
2AgNO3 + ZnBr2 Ⴎ 2AgBr + Zn(NO3)2
2NaI + Br2 Ⴎ 2NaBr + I2 (jod-chloroform - fiolet)
We wodzie rozpuszcza się słabo (cząsteczka niepolarna), dużo lepiej w rozpuszczalnikach organiczych.
W środowisku alkalicznym utlenia np. sole Mn (II) lub sole Cr (III).
2NaOH + Br2(aq) Ⴎ NaBr + NaOBr
Mn(OH)2 + OBr- Ⴎ MnO2(aq) + Br- + H2O
Utlenienie wodorotlenku chromu (III)
Cr(OH)3 + KOH + Br2 Ⴎ uzupełnij, zapisz także w formie jonowej.
Związki bromu:
Bromowodór, HBr. Gaz doskonale we wodzie rozpuszczalny, daje silny kwas bromowodorowy (66 %, d = 1,78 g.cm-3). Ile dm3 gazowego HBr należy rozpuścić w 1 dm3 wody aby otrzymać nasycony kwas bromowodorowy. Jaka będzie objętość tego roztworu?
Reakcja stężonego H2SO4 z bromkami daje mieszaninę HBr i Br2
KBr + H2SO4 Br2 + uzupełnij reakcje i podaj stopnie utlenienia.
Jeżeli użyjemy H3PO4 to uzyskamy HBr bez Br2. Napisz reakcję.
Bezpośrednia synteza(katalizator Pt/azbest) , zapis termochemiczny.
½H2(g) + ½Br2(c) = HBr(g) ΔHotw = -36 kJ.mol-1 (st. entalpia tw.).
Synteza laboratoryjna:
P4 + 6Br2 = 4PBr3 przez PBr3 i jego hydrolizę
4PBr3 + 12H2O = 12HBr + 4H3PO3 hydroliza halogenków niemetali
P4 + 12H2O + 6Br2 = 12HBr + 4H3PO3
HBr i bromki są słabymi reduktorami.
Redukcja manganianu (VII) potasu: napisać jonowo
Redukcja dichromianu (VI) potasu: zapisz tę reakcję w formie jonowej.
K2Cr2O7 + 14HBr 3Br2 + 2KBr + 2CrBr3 + 7H2O
Tlenowe kwasy bromu.
kwas HBrO3 nietrwały, silny utleniacz
Utlenienie bromków przez bromian.
KBrO3 + KBr + H2SO4 Ⴎ uzupełnij reakcję i zapisz w formie jonowej.
Znany jest jeszcze silny kwas bromowy (VII) HBrO4 i jego sole. Podaj wzór Lewisa tego kwasu i podaj kształt geometryczny jego anionu, taki jak kwas chlorowy (VII).
JOD
Stalowo czarne kryształki. Temperatura topnienia 113,6 oC. Wysoka prężność par w stosunkowo niskich temperaturach, dlatego łatwo sublimuje. Courtois 1811, destylacja popiołu z roślin morskich z dodatkiem st. H2SO4.
Słabo rozpowszechniony w przyrodzie. Główne minerały: AgI oraz przede wszystkim Ca(IO3)2 w saletrze chilijskiej. W tej chwili otrzymuje się go z niektórych solanek w Japonii i USA. W oceanach jest go niewiele (0,05 ppm). Niektóre rośliny morskie potrafią go akumulować.
Otrzymywanie jodu w technice. Z jodanów (V) saletry chilijskiej
2HIO3 + 5HSO3- → I2 + 5HSO4- + H2O
Otrzymywanie jodu w technice (z solanek):
2NaI + Cl2 2NaCl + I2 (ekstrakcja)
i w laboratorium: Napisz tę reakcję w formie jonowej.
MnO2 + 2KI + 2H2SO4 = I2 + K2SO4 + MnSO4 + 2H2O
Jod słabo rozpuszcza się we wodzie, lepiej w rozpuszczalnikach organicznych. Roztwór w alkoholu i w KI - jodyna.
Alkohol etylowy, eter dietylowy, KI, woda (KI + I2 Ⴎ KI3) brązowe
kompleksy C(harge)T(ransfer) Et2O Ⴎ I2 Et = C2H5
chloroform, CS2, CCl4 - fioletowe (cząsteczki I2)
Niezbędny dla życia. Tarczyca zawiera hormon tyroksynę
Brak jodu - przerost tarczycy (wole). Jodowanie soli kuchennej
(główne zużycie), KI - odczynnik (jodometria).
Jod jest dość reaktywny. Jest miernym utleniaczem, słabszym od Br2.
Potencjał standardowy reakcji redukcji: ½I2(s) + e = I-(aq) Eo = 0,54 V
Związki jodu:
Jodowodór, HI. Gaz doskonale we wodzie rozpuszczalny, daje bardzo silny kwas jodowodorowy (maks. 70 %, azeotrop 57 %).
% HI azeotrop
——————————————l————— - - - - - - - - - - -
0 57 70 100
Bezpośrednia synteza(katalizator Pt/azbest), t > 300 oC.
2HI(g ½H2(g) + ½I2(s) HI(g) ΔHotw = +26 kJ.mol-1 (st. entalpia tw.).
2KI + H3PO4 Ⴎ K2HPO4 + 2HI
2I2 + N2H4 Ⴎ 4HI + N2 hydrazyna
H2S + I2 Ⴎ 2HI + S
Hydroliza jodków niemetali 2PI3 + 6H2O Ⴎ 2H3PO3 + 6HI
HI i jodki są reduktorami. Reakcja stężonego H2SO4 z jodkami daje mieszaninę HI i I2.
2KI + 3 H2SO4 SO2 + 2KHSO4 + I2
KI + H2SO4 Ⴎ S + .…….
KI + H2SO4 H2S + ……..
Redukcja H2SO4 może iść przez SO2 i S aż do H2S. Uzupełnij odpowiednie reakcje.
Wykrywanie H2S: H2S + Pb(CH3COO)2 2CH3COOH + PbS
Podaj reakcję KI z KNO2 (redukcja)w środowisku kwaśnym.
2FeCl3 + 2HI 2FeCl2 + 2HCl + I2 (chloroform)
Pb2+ + 2I- Ⴎ PbI2 (żółty)
Hg2+ + 2I- HgI2 (czerwony) HgI2 + 2I- [HgI4]2-
Napisać te trzy reakcje w formie cząsteczkowej.
Reakcje z solami Cu(II) 2CuSO4 + 4KI 2K2SO4 + 2CuI + I2
Usunięcie I2: I2 + 2Na2S2O3 2NaI + Na2S4O6
Roztwarzanie CuI CuI + 2Na2S2O3 NaI + Na3[Cu(S2O3)2]
Napisać te trzy reakcje w formie jonowej.
Reakcje z solami Bi(III): Bi3+ + 3I- Ⴎ BiI3 BiI3 + I- Ⴎ [BiI4]-
Czarny jodek bizmutu (III) i pomarańczowy tetrajodobizmutan (III)
Tlenowe kwasy jodu. Najważniejszy jest kwas jodowy (V) HIO3.
Utlenienie jodu przez chlor
I2(aq) + 6H2O + 5Cl2 2HIO3 + 10HCl (usunąć HCl)
Daje się izolować jako bezbarwne kryształy. Jest to dość silny kwas.
Daje się odwodnić 2HIO3 Ⴎ I2O5 + H2O ΔHotw (I2O5) = -158,2 kJ
I2O5 + 5CO I2 + 5CO2 oznaczanie i usuwanie CO.
HIO3 jest silnym utleniaczem.
5KI + KIO3 + 3H2SO4 Ⴎ 3I2 + 3K2SO4 + 3H2O (fiksonal)
2NaIO3 + H2SO4 + 5H2S I2 + 5S + 6H2O + Na2SO4
Termiczny rozkład jodanu: 2KIO3 Ⴎ 2KI + 3O2
Reakcje analityczne dopowiadają III grupie anionów (biały AgIO3 rozpuszczalny w HNO3, biały Ba(IO3)2 rozpuszczalny w HNO3).
21

![]()
Wyszukiwarka
Podobne podstrony:
12-helowceTECH, Materiały PG, Nieorgana
04-Wodór TECH, Materiały PG, Nieorgana
07-makroukłady TECH, Materiały PG, Nieorgana
08-tlen, Materiały PG, Nieorgana
TCh1-stud1, Materiały PG, Nieorgana
11-dysocjacjaTECH, Materiały PG, Nieorgana
IR, Materiały PG, Nieorgana
05-OrbitalemolekTECH, Materiały PG, Nieorgana
Egzamin pisemny TChem 2010-tematy-1, Materiały PG, Nieorgana
13-fluorowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
Akustyka materiały pg gda
MATERIAŁY IZOLACYJNE NIEORGANICNE, MATERIAŁY IZOLACYJNE NIEORGANICNE
Ćwiczenie 13 Badanie materiałów i elementów półp
Ćwiczenie 13 Badanie materiałów i elementów półp
sprawko 13, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyc
Fluorowce(1), Chemia, Chemia nieorganiczna
więcej podobnych podstron