Pierwiastek chemiczny - zbiór atomów o identycznej liczbie atomowej, identycznych właściwościach chemicznych.
Liczba atomowa - [Z] jest równa liczbie protonów jądrze atomowym i jest równa liczbie porządkowej pierwiastka w układzie okresowym, jest także równa liczbie elektronów w atomie obojętnym.
Liczba masowa - [A] jest to suma protonów i neutronów w jądrze atomowym. [A=Z+N]
Izotopy - atomy tego samego pierwiastka, posiadające taką samą liczbę protonów różnią się liczbą neutronów [N] w jądrze, np. wodór 1 proton, 0 neutronów), Deuter (1 proton, 1 neutron), Tryd (1 proton, 2 neutrony). Izotopy tlenu (8 protonów, 8 neutronów) lub (8 protonów, 7 neutronów).
Atomowa jednostka masy - [u] 1u = 1/12 masy atomu węgla 12C.
1u = 1,66 * 1027 kg
Masa atomowa - masa atomu wyrażona w unitach [Atomowych jednostkach masy]
Masa cząsteczkowa - masa cząsteczki wyrażona w [u], jest to suma mas atomowych atomów wchodzących w skład cząsteczki.
Mol - jest jednostką liczności materii w układzie SI. Zbiór N elementów materii. N = 6,02 * 1023 cząsteczek materii.
Masa molowa - jest to masa 1 mola substancji wyrażona w gramach, a liczbowo równa się masie atomowej.
Wartościowość pierwiastka - W = masa atomowa / równoważnik.
Prawo zachwania masy - łączna masa wszystkich substratów reakcji chemicznej równa jest łącznej masie wszystkich produktów powstałych w wyniku tej reakcji.
Prawo stałości składu (stałych stosunków wagowych) - pierwiastki łączą się w określony związek w ściśle określonym stosunku wagowym.
Stopień utlenienia pierwiastka - jest to umowny ładunek, którym byłby obdarzony 1 atom danego pierwiastka w cząsteczce lub jonie, gdyby elektrony tworzące wiązanie zostały przydzielone atomowi bardziej elektroujemnemu.
Elektroujemność - zdolność atomu do przyciągania elektronów.
Reakcje utleniania - proces związany z utratą elektronów, redukcja - przyłączaniem. Utleniacz ulega procesowi redukcji (przyjmuje elektron).
Falowo korpuskularny charakter elektronów - elektron ma charakter dualistyczny, jest jednocześnie falą i cząsteczką. Stan elektronu w atomie określają Liczby Kwantowe: {n - gł.l.kw. (1,2,3…),l - poboczna l.kw. (0,1,2,…,n), m - magnetyczna l.kw. (-l,…,+l), s - spinowa l.kw. (1/2), ms - magnetyczna spinowa l.kw. (1/2, -1/2), liczby kwantowe przymują ściśle określone wartości.
Orbital atomowy - określa funkcja falowa Ψ. Która zależy od liczb n, l, m (kwantowych).
|Ψ|2 = gęstość prawdopodobieństwa znalezienia elektronu.
Powłokę elektronową stanowią elektrony opisane tą samą liczbą kwantową n (powłoka el. - poziom energetyczny).
Podpowłokę elektronową tworzą elektrony opisane tą samą poboczną liczbą kwantową l.
Liczby n, l, m związane są z ruchem wokół jądra, a s i ms związane są z ruchem wewnętrznym elektronu.
Zakaz Pauliego - nie mogą istnieć w atomie dwa elektrony w identycznym stanie, nie może być dwóch elektronów mających identyczne wszystkie liczby kwantowe.
Maksymalne zapełnienie elektronami podpowłok - [s] - 2 el, [p] - 6el, [d] - 10el, [f] - 14el.
Powłok - [K] - 2, [L] - 8, [M] - 18, [N] - 32.
Zgodnie ze wzorem 2n2
Konfiguracja elektronowa - jest to przyporządkowanie każdemu elektronowi 4 liczb kwantowych zgodnie z zakazem Pauliego.
Reguła Hunda - podpowłoka zapełnia się najpierw elektronami niesparpwanymi, dopiero potem mogą tworzyć się pary. Elektrony niesmarowane mają taką samą orientację spinu.
Energia elektronu zależy od [n] i [l] podpowłoki zapełniane są w kolejności wzrastającej energii.
Elektrony walencyjne - elektrony ostatnie w zapisie kolejności energetycznej orbitali oraz inne elektrony powłoki najbardziej zewnętrznej.
Potencjał jonizacyjny - minimalna energia potrzebna do oderwania elektronu od atomu.
Powinowactwo elektronowe - energia uwalniana lub pobierana podczas przyłączania elektronu przez atom.
15.Wiązanie jonowe polega na elektrostatycznym przyciąganiu się jonów różnych znaków( wiązanie występuje, jeżeli różnica elektroujemności >1,7) występuje w kryształach jonowych.
Wiązanie kowalencyjne - wspólna para elektronowa utworzona z elektronów niesmarowanych występujących w dwóch atomach, róznica elektroujemn.<0,5.
Wiązanie kowalencyjne spolaryzowane - wspólna para elektronowa przesunięta w kierunku pierwiastka bardziej elektroujemnego, 0,5<różnica elektrouj.<1,7.
Wiązanie koordynacyjne inaczej donorowo-akceptorowe (1 atom jest donorem, a drugi akceptorem pary elektronowej).
16. Orbitale molekularne (cząsteczkowe) powstają z nałożenia się orbitali atomowych.
Z nałożenia się dwóch orbitali atomowych powstają dwa orbitalne molekularne, jeden wiążący, a drugi antywiążący.
Orbitalne molekularne typu σ powstają w wyniku czołowego nałożenia się orbitali atomowych (wiązanie znajduje się na osi łączącej jądra atomowe.
Orbitalne molekularne typu π powstaje w wyniku bocznego nałożenia się orbitali atomowych (wiążąca para elektronowa znajduje się nad i pod osią łączącą jądra atomowe.
Hybrydyzacja jest to ujednolicenie orbitali atomowych. Orbitale hybrydyzowane są symetrycznie ułożone w przestrzeni i równocenne pod wzgl. energetycznym.
21. Wiązania metaliczne w metalach i stopach Sieć kryształu metalicznego jest zbudowana z dodatnich rdzeni atomowych (atomy pozbawione elektronów walencyjnych) walencyjnych i gazu elektronowego, czyli zdelokalizowanej chmury elektronów. Zdolność przewodzenia prądu związana jest z przemieszczaniem chmury elektronowej pod wpływem napięcia.
42. Reakcja odwracalna - produkty reagują ze sobą i odtwarzają się w substraty.
Stała równowagi - nie zależy od stężenia początkowego, od temp, ani od ciśnienia. Jest równa stosunkowi iloczynu stężeń produktów do iloczynu stężeń substratów w stanie równowagi chemicznej.
Stopień dysocjacji - jest to stosunek liczby cząstek zdysocjowanych do liczby cząstek wprowadzonych do roztworu. Zależy od stężenia roztworu, rodzaju elektrolitu i rozpuszczalnika.
Prawo rozcieńczeń Oswalda - 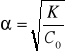
Dla słabych elektrolitów.
44. Autodysocjacja wody - 2H2O <=> H3O+ + OH-
Stała dysocjacji (iloczyn jonowy wody) -
KH2O = [H3O+][OH-] = 10-14
45. Teoria Arrheniusa - kwasy odszczepiają kation H+, a zasady OH-. Teoria Bró'nsteda - kwasy odszczepiają H+, a zasady przyjmują jony H+.
46. Hydroliza soli - jest to reakcja jonów zdysocjowanych soli z wodą.
Stała hydrolizy K = KH2O/Kkw jeżeli sól słabego kw.
K = KH2O/Kzas jeżeli sól słabej zas.
K = KH2O/Kzas*Kkw jeżeli sól słabego kwasu i słabej zasady.
47. Roztwory buforowe - dodanie mocnego kwasu lub zasady nie zmienia znacznie Ph roztworu. Bufory
- słaby kwas oraz sól tego słabego kwasu z mocną zasadą
- słaba zasada i sól tej słabej zasady z mocnym kwasem.
48. Iloczyn rozpuszczalności jest to iloczyn stężeń molowych (w odpowiedniej potędze wynikających z reakcji równowagi) jonów trudno rozpuszczalnej soli w roztworze nasyconym, w roztworze będącym w równowadze z fazą stałą. Jest wielkością stałą, charakterystyczną dla określonej temperatury.
49. Wodorotlenki amfoteryczne - w środowisku zasadowym wykazują właściwości kwasowe, a w środowisku kwaśnym właściwości zasadowe.
51. Elektroliza roztworów wodnych - całokształt procesów zachodzących pod wpływem prądu elektrycznego.
Reguła przekory - jeżeli na układ znajdujący się w stanie równowagi działa bodziec zewnętrzny (temp, ciśnienie, zmiana stężenia reagentów) to równowaga przesuwa się w takim kierunku aby zmniejszyć skutki działania bodźca.
Wyszukiwarka
Podobne podstrony:
elektro otwarte, Mechanika i Budowa Maszyn PWR MiBM, Semestr III, elektronika, Egzamin - pytania, op
egzamin pytania opracowanie, PODSTAWY IMMUNOLOGII
egzamin pytania opracowanie, immunologia
PP EGZAMIN PYTANIA opracowane
Egzamin pytania opracowane(1)
egzamin pytania opracowanie, Immunologia(1)
elektro moja dodatkowe informacje, Materiały do nauki PWR MBM (zaoczne), Semestr IV, Elekronika, koł
egzamin pytania opracowanie
TRB 2 egzamin pytania opracowane 13 2014
kozlowski egzamin pytania opracowane
Egzamin licencjacki Opracowane pytania finanse i rachunkowość collegium mazowia
Pytania na egzamin do opracowania
egzamin z NOMu opracowane pytania
Zapis konstrukcji pytania, WWNiG INiG
Edukacja wczesnoszkolna pytania opracowanie pytań na egzamin
Fizjologia - przypuszczalne pytania na Egzamin - Fizjoterapia, Opracowane
więcej podobnych podstron