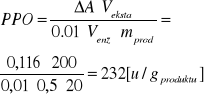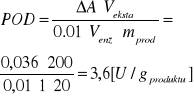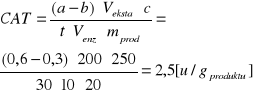22.05.2012r.
Laboratorium z Biochemii
Oksydoreduktazy
Prowadzący: dr inż. M. Krzepkowska
Proszę dopisać w każdym doświadczeniu podstawy oznaczeń oraz wzory reakcji chemicznych[Author ID1: at Wed May 30 22:12:00 2012 ]
Marta Wujek
Przemysław Woiński
Wstęp teoretyczny:
Enzymy są substancjami wytwarzanymi przez organizmy i odgrywającymi podstawową rolę jako katalizatory przemian chemicznych zachodzących zarówno wewnątrz organizmów, jak i po za nimi.
Enzymy można podzielić na 6 klas:
oksydoreduktazy - odpowiedzialne za przeniesienie wodoru lub elektronu z jednego substratu na inny,
transferazy - odpowiedzialne za przenoszenie grup funkcyjnych
hydrolazy - powodują hydrolityczne rozczepienie wiązań
liazy - rozczepiają wiązania w sposób niehydrolityczny
izomerazy - katalizują przemiany wewnątrzcząsteczkowe
ligazy - powodują powstawanie różnorodnych wiązań chemicznych
Komitet nazewnictwa Międzynarodowej Unii Biochemii i Biologii Molekularnej w 1984 roku opracował system zasad klasyfikacji enzymów według, którego każdemu z tych związków przypisany jest odpowiedni numer EC (ang. Enzyme Catalogue). I tak oksydoreduktazy, jako pierwsza klasa enzymów dostały oznaczenie EC 1, a poszczególne enzymy wchodzące w skład tej grupy posiadają osobne numery, na przykład:
Katalaza EC 1.11.1.6
Peroksydaza EC 1.11.1.7
Oksydaza o-difenolowa EC 1.10.3.1
W utlenianiu biologicznym zachodzą różne typy reakcji redoks: przenoszenie elektronów i protonów, lub wyłącznie elektronów oraz przenoszenie tlenu. Istotą utleniania biologicznego jest przenoszenie elektronów i protonów z substancji pokarmowych, w tym przede wszystkim z sacharydów, białek i lipidów na tlen, za pośrednictwem enzymów, zintegrowanych w wewnętrznej błonie mitochondrialnej jako tzw. łańcuch oddechowy. O kierunku przenoszenia elektronów decyduje większość potencjału oksydoredukcyjnego poszczególnych przenośników. Procesowi biologicznego odłączenia elektronów zazwyczaj towarzyszy odłączenie protonów, stąd większość reakcji biologicznego utlenienia rozumiemy jako przenoszenie atomów wodoru. Odwodorowanie jest zatem równoznaczne z ich utlenianiem.
Źródła:
„Nowoczesne kompendium chemii” K.H. Lautenschlager, W. Schroter, A. Wanninger
katalog ExPASy http://enzyme.expasy.org
Część doświadczalna:
10 kropel 1% roztworu wodnego katecholu
10 kropel 1% roztworu wodnego pirogalolu
10 kropel 1% roztworu wodnego H2O2
5 cm3 ekstraktu[Author ID1: at Wed May 30 06:43:00 2012 ] enzymatyczn
y[Author ID1: at Wed May 30 06:43:00 2012 ]e[Author ID1: at Wed May 30 06:43:00 2012 ]go[Author ID1: at Wed May 30 06:43:00 2012 ] otrzymany[Author ID1: at Wed May 30 06:43:00 2012 ]ego[Author ID1: at Wed May 30 06:43:00 2012 ] z kapusty pekińskiej10 cm3 ekstraktu enzymatycznego z kapusty pekińskiej
3 cm3 1% H2O2
5 cm3 10% H2SO4
1 cm3 ekstraktu enzymatycznego z kapusty pekińskiej
2 krople 1% H2O2
5 cm3 0,1M buforu fosforanowego o pH 7
1 cm3 2mM gwajakolu
0,5 cm3 ekstraktu enzymatycznego z kapusty pekińskiej
2 cm3 (1,5 w próbie właściwej) 0,1M buforu fosforanowego
4 cm3 10mM roztworu katecholu
|
Analiza jakościowa |
Cel |
Oznaczenie oksydoreduktaz (oksydazy o-difenolowej, peroksydazy i katalazy) w badanym ekstrakcie z kapusty pekińskiej czy tylko ten substrat był użyty w ćwiczeniu?[Author ID1: at Wed May 30 06:42:00 2012 ] Czy tylko to było celem??[Author ID1: at Wed May 30 06:44:00 2012 ] |
Użyte odczynniki |
Powyższe elementy nie powinny być w tabeli, ale jeśli tak pan zrobił to powinna być nazwana tabela [Author ID0: at Thu Nov 30 00:00:00 1899 ]
Opis przeprowadzonego doświadzczenia[Author ID1: at Wed May 30 06:47:00 2012 ][Author ID1: at Wed May 30 06:47:00 2012 ]
Tabela [Author ID1: at Wed May 30 06:48:00 2012 ]. [Author ID1: at Wed May 30 06:49:00 2012 ]Wyniki analizy jakościowej aktywności oksydazy o-difenolowej, peroksydazy i katalazy w kapuście pekińskiej
Nr probówki |
Próba |
Oznaczany enzym |
Wynik analizy |
Opis próby |
1 |
Ekstrakt |
Próba odniesienia |
- |
- |
2 |
Ekstrakt + katechol |
Oksydaza o-difenolowa |
+/- |
lekkie zmętnienie; delikatnie żółta barwa |
3 |
Ekstrakt + pirogalol |
|
+ |
żółta barwa |
4 |
Ekstrakt + katechol + H2O2 |
Peroksydaza |
+++ |
barwa - brudny róż |
5 |
Ekstrakt + pirogalol + H2O2 |
|
+++ |
herbaciany kolor |
6 |
Ekstrakt + H2O2 |
Katalaza |
+++ |
pęcherzyki gazu, lekkie zmętnienie |
7 |
Woda + katechol |
Próby odczynnikowe |
- |
- |
8 |
Woda + pirogalol |
|
- |
lekko żółta barwa |
Co oznaczają u pana [Author ID1: at Wed May 30 06:50:00 2012 ]zaznaczone[Author ID1: at Wed May 30 22:12:00 2012 ] symbole??[Author ID1: at Wed May 30 06:50:00 2012 ][Author ID1: at Wed May 30 06:50:00 2012 ]
Tabela . [Author ID1: at Wed May 30 06:50:00 2012 ]Wyniki analizy jakościowej aktywności oksydazy o-difenolowej, peroksydazy i katalazy w różnych próbkach??[Author ID1: at Wed May 30 06:50:00 2012 ]:
Produkt |
Oksydaza o-difenolowa |
Peroksydaza |
Katalaza |
Kapusta pekińska |
+ delikatna żółta barwa |
+++ kolor herbaciany |
+++ pęcherzyki gazu CO2 |
Banan |
+ pęcherzyki gazu CO2 |
++ jasno-brunatny kolor |
++ jasno-brunatny kolor |
Jabłko |
- |
++ barwa żółta |
+ kolor jasno-żółty |
Rzodkiewka |
+ kolor żółty |
+/- barwa brunatno-żółta |
+++ kolor brązowy, pęcherzyki gazu CO2 |
Proszę podać co oznaczają + i -[Author ID1: at Wed May 30 06:51:00 2012 ]
Wnioski:
W badanych przez nas surowcach wykryliśmy obecność wszystkich oznaczanych enzymów, za wyjątkiem oksydazy o-difenolowej w jabłku. Największą aktywnością wykazały się katalaza (najbardziej w kapuście pekińskiej i rzodkiewce) oraz peroksydaza (kapusta). Najmniej aktywna we wszystkich badanych przez nas surowcach była oksydaza o-difenolowa. Na jakiej podstawie można było to stwierdzić??[Author ID1: at Wed May 30 06:52:00 2012 ]
|
Analiza ilościowa |
Cel |
Doświadczalne wyznaczenie aktywności oksydoreduktaz (oksydazy o-difenolowej, peroksydazy i katalazy) w badanym ekstrakcie z kapusty pekińskiej |
Użyte odczynniki |
w oznaczeniu aktywności katalazy: |
|
w oznaczeniu aktywności peroksydazy: |
|
w oznaczeniu aktywności oksydazy o-difenolowej: o pH 7 |
Opis doświadczenia[Author ID1: at Wed May 30 07:04:00 2012 ][Author ID1: at Wed May 30 07:04:00 2012 ]
Zasada oznaczenia[Author ID1: at Wed May 30 07:09:00 2012 ] wzory reakcji [Author ID1: at Wed May 30 22:12:00 2012 ][Author ID1: at Wed May 30 07:09:00 2012 ]
Wyniki analizy ilościowej aktywności oksydazy o-difenolowej, peroksydazy i katalazy w kapuście pekińskiej
Nr próby |
Próba |
Oznaczany enzym |
Długość fali |
ΔA |
Aktywność |
1 próba kontrolna |
katechol + bufor fosforanowy |
Oksydaza o-difenolowa |
420 nm |
0,116 |
|
2 próba właściwa |
Ekstrakt + katechol + bufor fosforanowy |
|
|
|
|
3 próba kontrolna |
Ekstrakt + gwajakol + bufor fosforanowy |
Peroksydaza |
436 nm |
0,036 |
|
4 próba właściwa |
Ekstrakt + gwajakol + bufor fosforanowy + H2O2 |
|
|
|
|
Nr próby |
Próba |
Oznaczany enzym |
Ilość zużytego KMnO4 |
Aktywność |
|
5 próba kontrolna |
Ekstrakt + H2SO4 + H2O2 |
Katalaza |
0,6 cm3 |
|
|
6 próba właściwa* |
Ekstrakt + H2O2 + H2SO4 |
|
0,3 cm3 |
|
|
* przed dodaniem kwasu siarkowego do roztworu należało, przez 30 minut, w temperaturze pokojowej, prowadzić reakcje rozkładu nadtlenku wodoru pod wpływem katalazy.
Wyniki analizy ilościowej aktywności oksydazy o-difenolowej, peroksydazy i katalazy w różnych próbkach:
Produkt |
Aktywność enzymatyczna |
|||||
|
Katalaza [u/g] |
Oksydaza o-difenolowa [u/g] |
Peroksydaza [U/g] |
|||
Kapusta pekińska |
2,5 |
2,5 |
284 |
232 |
3,2 |
3,6 |
Banan |
4,58 |
4,58 |
794 |
764 |
2,0 |
1,5 |
Jabłko |
0 |
0 |
86 |
130 |
1,5 |
0 |
Rzodkiewka |
4,2 |
5 |
182 |
272 |
14,9 |
16,4 |
Wnioski:
W peroksydazę najbardziej (z badanych produktów) obfituje rzodkiewka, natomiast najmniej jest jej w jabłku. Oksydaza o-difenolowa obecna jest w największych ilościach w bananie, trochę mniej jest jej w kapuście pekińskiej i rzodkiewce, najmniej w jabłku. W badanych przez nas produktach spożywczych najmniej jest katalazy, szczególnie w jabłku gdzie ilości te są tak małe, że nie zdołaliśmy ich wykryć.
Wyszukiwarka
Podobne podstrony:
Zadanie koncowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwiczenie nr2, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Zadanie końcowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprEnzymyII, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
bialka spr(1), Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprKwasy nukleinowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
LABORATORIUM 4(1), Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
LABORATORIUM Z BIOCHEMII 3(1), Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
sprAminokwasy, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
enzymy - sprawozdanie, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwieczenie nr8, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwiczenie nr5, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
SPRAWOZDANIE 1 AMINOKWASY, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
kwasy nukleinowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Zadanie koncowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Ćwiczenie nr2, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
tabEnzymy, Studia PŁ, Ochrona Środowiska, Biochemia, laborki
GRUBOŚĆ STRUNY, Studia PŁ, Ochrona Środowiska, Fizyka, Laborki, sprawka
tabKinetykaEnzymów, Studia PŁ, Ochrona Środowiska, Biochemia, laborki
więcej podobnych podstron