BUDOWA ATOMU I UKŁAD OKRESOWY
Przy omawianiu wymienionych w tytule zagadnień posłużymy się animacjami znajdującymi się na płycie I podręcznika multimedialnego pt. ”Chemia w gimnazjum” w dziale „Atom i cząsteczka”. Pojęcie atomu ulegało ewolucji od terminu o znaczeniu czysto filozoficznym, interpretującym punkt widzenia na budowę świata, po pojęcie naukowe, którego zadaniem jest określenie budowy materii, umożliwiające wyprowadzenie uogólnień opisujących otaczający nas świat. Budowa atomu jest domeną fizyki, dlatego opis atomu w aspekcie chemicznym jest z natury uproszczony i sprowadza się do cech istotnych z chemicznego punktu widzenia. Z tego też względu warto znać pewne aspekty dawnych teorii, które zwykło się określać jako herezje w sensie fizycznym, a które swego czasu wniosły znaczący wkład w rozwój chemii. Do takich niewątpliwie należy teoria atomistyczna Daltona. Uczony ten postrzega atom jako niepodzielną cząstkę materialną o takich cechach fizycznych jak rozmiar czy masa, które zgodnie z tą teorią, są określone i specyficzne dla danego pierwiastka. Podkreślając prymitywizm tej teorii z punktu widzenia fizyki, dla której od dawna wiadomym jest, że atom zbudowany jest z mniejszych cząstek materialnych, zapomina się o jej znaczącej roli historycznej w rozwoju podstaw stechiometrii i innych działów chemii. Zakładając bowiem taką uproszczoną wizję atomu można było wyprowadzić podstawy stechiometrii oraz fundamentalne prawa chemii - prawo stałości składu i prawo zachowania masy. Prawa te, stosowane są w chemii na co dzień, są tak oczywiste, że się o nich wręcz zapomina. Pierwsze z nich jest stosowane przy ustalaniu wzorów chemicznych a drugie przy pisaniu równań reakcji a ściślej ich uzgadnianiu. Przykłady obliczeń związanych z tymi prawami znajdują się w części „Atom i cząsteczka” na płycie nr 1. Do naszych rozważań wystarczająca jest teoria budowy atomu Rutheforda czyli tzw. planetarny model atomu, opisany szczegółowo w animacji komputerowej z niewielkim uzupełnieniami. Zapamiętać należy oznaczenia literowe powłok elektronowych, poczynając od jądra atomowego - K, L, M, N, O, P, Q oraz zależności między ilością poszczególnych cząstek elementarnych: protonów (p), neutronów (n) i elektronów (e) wchodzących w skład atomu (X) a opisanych liczbą atomową (A) i masową (Z) ![]()
co stanowi zapis nuklidu danego pierwiastka. Nuklidu czyli atomu o ściśle określonej ilości cząstek elementarnych budujących atom, czyli:
Proton cząstka o masie równej 1u (unit ≡ atomowa jednostka masy) i ładunku dodatnim równym elementarnemu ładunkowi elektrostatycznemu. Symbolicznie zapisuje się to następująco:
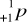
Neutron to cząstka o masie zbliżonej (prawie identycznej) do masy protonu, pozbawiona ładunku czyli jest ona neutralna. Zapis symboliczny:
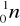
Elektron, cząstka o masie w przybliżeniu równa dwutysięcznej części atomowej jednostki masy. W praktyce więc przyjmuje się, że jest pozbawiona masy. Ładunek elektronu jest równy ładunkowi elementarnemu i posiada najczęściej znak ujemny. Zdarzają się jednak również takie cząstki posiadające znak dodatni. Noszą one nazwę elektronów dodatnich lub krócej pozytonów. Oto symboliczny zapis elektronu
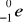
i pozytonu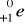
Znając wartości liczby atomowej (A) i masowe (Z) danego atomu można z łatwością określić ilość budujących go cząstek elementarnych. Liczba atomowa czyli porządkowa określa ilość elektronów w atomie i tym samym ilości protonów znajdujących się w atomie, bowiem atom jest cząsteczką elektrycznie obojętną. Na masę atomu składa się ilość protonów oraz ilość neutronów, które tworzą jądro atomu i dlatego określa się je mianem nukleony. Rozważmy więc przykład nuklidu (czyli atomu o określonej liczbie atomowej i masowej) chloru ![]()
. Liczba atomowa 17 określa ilość elektronów oraz tym samym ilość protonów (tak aby suma ładunków w atomie była równa zero). Na liczbę masową 35, równą ilości nukleonów, składa się więc 17 protonów oraz (35 - 17) = 18 neutronów.
Omawianie budowy atomu rozpoczniemy od stwierdzenia, że w atomie wyróżnić się dwa elementy: jądro atomowe (złożone z nukleonów czyli protonów i neutronów) oraz sferę elektronową. O ile jądro określa głównie właściwości fizyczne pierwiastka (atomu) o tyle sfera elektronowa, jej struktura, pozwala przewidzieć niektóre cechy chemiczne pierwiastków.
Nasze rozważanie rozpoczniemy od budowy jądra atomu. Mówiąc o jądrze atomu ma się na uwadze zasadniczo trzy zagadnienia:
1/ Obliczanie masy atomowej pierwiastka na podstawie jego składu izotopowego w przyrodzie - przykład takiego obliczenia podano w filmiku oraz w załączonych przykładach zadań.
2/ Pisanie równań reakcji jądrowych
3/ Obliczenia związane z tzw. okresem półtrwania izotopów
Obliczenia związane z wyznaczaniem masy atomowej pierwiastka pozwalają wyjaśnić dlaczego, mimo że ilości nukleonów podaje się w liczbach całkowitych jako wielokrotności unitów, masy atomowe mają wartości ułamkowe. Dzieje się tak dlatego, że tabelaryczne wartości mas atomowych pierwiastków są średnią udziałów izotopów danego pierwiastka występujących w przyrodzie. Istnieje również drugi czynnik tzw. defekt masy, który ma miejsce wówczas gdy fuzji (łączeniu) ulegają cząstki tworzące jądra atomowe. Ilość emitowanej przy tym energii jest tak znaczna, że zgodnie z równaniem Einsteina E = mּc2 następuje częściowy, równoważny ilości emitowanej energii (E), ubytek masy (m). Świadczy to również o niezwykłej trwałości jądra i wyjaśnia fenomen polegający na tym, że element stanowiący masę atomu zajmuje wielkość o pięć rzędów (105) mniejszą od sfery elektronowej czyli całego atomu. Nadaje to materii niezwykle ażurową strukturę czyniąc ją przenikliwą przykładowo dla strumienia elektronów.
Przemiany, którym podlega jądro atomowe bardzo często są pomijane na lekcjach chemii do ewentualnego przerobienia w ramach fizyki, dlatego często tak bywa, że nie mówi się o nich w ogóle. W związku z powyższym zagadnieniom związanym z jądrem atomowym poświęcimy nieco więcej uwagi.
Reakcją jądrową nazywa się reakcję w wyniku której tworzą się jądra atomów innych pierwiastków (jednego lub kilku) lub zmienia się stan energetyczny jądra wyjściowego. Reakcje jądrowe przedstawia się za pomocą równań podobnie jak reakcje konwencjonalne, przy czym należy uwzględnić że:
Podawane w tych równaniach symbole chemiczne oznaczają nie atomy pierwiastków lecz ich jądra atomowe (jednak znając ładunek i masę jądra łatwo określić jakiemu odpowiada pierwiastkowi)
Cząstki bombardujące jak i powstające zapisuje się w formie podanej wcześniej to znaczy uwzględniając ich ładunek i masę. Poniżej będą podane sposoby zapisu dla charakterystycznych rodzajów promieniowania.
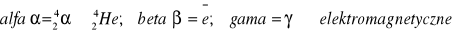
Przypomnijmy, że indeks górny przy zapisie nuklidu oznacza tzw. liczbę masową i odpowiada łącznej ilości neutronów i protonów (stanowiących masę atomu)
Indeks dolny to liczba atomowa zwana również liczbą porządkową i odpowiada ilości elektronów w atomie. Liczba ta określa więc jednoznacznie o który pierwiastek chodzi.
Równania reakcji jądrowych muszą spełniać następujące warunki (reguła równości sum indeksów):
suma liczb masowych składników po lewej i prawej stronie równania (indeksy górne) muszą być sobie równe; nie uwzględnia się przy tym mas elektronów, pozytonów i fotonów
sumy ładunków cząstek (indeksy dolne) po obu stronach równania muszą być sobie równe. Ładunek elektronów ma znak minus, protonu i pozytonu - znak plus. Neutrony i fotony (rodzaj promieniowania elektromagnetycznego) nie mają ładunku.
Przykład 1. Cząstką bombardującą jest jądro atomu helu (cząstka α) cząstką wtórną jądro izotopu wodoru - deuteru.
![]()
Suma górnych indeksów po lewej i prawej stronie równania: 32 + 4 = 34 + 2. Suma indeksów dolnych: 16 + 2 = 17 + 1 = 18
Przykład 2. Nuklid manganu - 56 ulega samorzutnemu rozpadowi promieniotwórczemu β. Pisząc równanie reakcji określ powstały produkt:
![]()
Parametry powstałego nuklidu żelaza wyliczono właśnie z równości parametrów. Obliczona wartość parametru dolnego 26 w sposób jednoznaczny określa, że powstały nuklid odpowiada pierwiastkowi o liczbie porządkowej 26 czyli żelazu.
Rodzaj zachodzącej przemiany jądrowej zwykło się określać nazwą cząstki biorącej w niej udział i tak:
Przemiana α biegnie z udziałem tzw. cząstki α składającej się z dwóch protonów i dwóch neutronów, czyli stosując indeksy opisujące nuklidy można zapisać
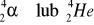
Przemiana β biegnie z udziałem cząstki β czyli elektronu lub pozytonu i wtedy mówi się o emisji pozytonowej
Przemiana γ to emisja elektromagnetyczną i nie wiąże się z przemianą nuklidów a jedynie wyemitowaniem kwantu energii. Praktycznie towarzyszy każdej przeminie jądrowej
Kolejne zagadnienie to obliczenia związane z tak zwanym okresem półtrwania τ½ - (tau) lub inaczej połowicznego zaniku. Tak określa się cechę izotopów polegającą na tym, że w określonym, typowym dla danego izotopu czasie, ulega rozpadowi połowa jego dawki. Znajomość tej wielkości i możliwość oznaczenia ilości nierozłożonego izotopu są podstawą tak zwanych zegarów izotopowych, wykorzystywanych do określenia wieku dawnych przedmiotów. Najbardziej znanym przykładem jest niewątpliwie tzw. zegar węglowy.
Przykład. W laboratorium w czasie 34 h przechowywano izotop Sr-81 o okresie półtrwania τ½ = 8,5 h. Początkowa ilość izotopu wynosiła 10 mg. Ile izotopu pozostało po upływie czasu przechowywania?
34 godziny przechowywania oznacza czterokrotny czas półtrwania. Następuje więc czterokrotny (34 : 8,5 = 4) połówkowanie próbki strontu czyli kolejno - 10:2=5; 5:2=2,5; 2,5:2=1,25; 1,25:2=0,625 mg Sr. Po okresie przechowywania pozostało 0,625 mg Sr
Przykłady zadań związanych z jądrem atomowym
Odkrycia neutronu dokonano w wyniku napromieniowania tarczy z Be - 9 cząstkami α. Napisać równania reakcji jądrowych. Podać symbol powstałego jądra.
Jak zmieni się masa i ładunek jądra izotopu:
W wyniku emisji jednaj cząstki α i dwóch cząstek β
W wyniku absorpcji dwóch protonów i emisji dwóch neutronów
W wyniku absorpcji jednaj cząstki α i dwóch neutronów
Oznaczając Jądro wyjściowe X, a końcowe przez Y, napisać pełne równanie reakcji jądrowych dla powyższych przemian.
Izotop potasu K-40 ulega rozpadowi β W jaki pierwiastek przekształci się potas w wyniku tej przemiany. Napisz odpowiednie równanie reakcji.
Jaki był typ rozpadu w następujących przemianach jąder promieniotwórczych. Napisz odpowiednie równania reakcji jądrowych:
Napisać pełne i uproszczone równania przemiany promieniotwórczej Th-226 w Po-216
Ile cząstek α i β powinno utracić jądro Bi-209 aby przekształcić się w jądro o masie 201 (pierwiastka grupy III). Napisać odpowiednie równanie reakcji jądrowej.
Jak zmieniłby się stosunek liczby neutronów do liczby protonów w jądrze Cu-65 gdyby uległo ono rozpadowi α, β+, β-.
W wyniku przemiany promieniotwórczej jądro izotopu U- 238 przekształca się w Ra-226. Ile cząstek i jakiego rodzaju emituje jądro wyjściowe? Napisać równania reakcji.
Sumaryczne, uproszczone równania reakcji rozpadu dwóch z trzech naturalnych szeregów promieniotwórczych przedstawiają się następująco: U-238 (8 α; 6β) Pb-206; U-235(7α;4β)Pb-207. Napisz równania reakcji jądrowych.
Jaki był typ rozpadu w następujących przykładach reakcji jądrowych: Os-185 →Ir-185; Rn-222 → Po-218; Pd -111 →Ag-111
Podać jakie pierwiastki posiadają jądra o następującym składzie: (9p, 10n); (34n, 30p); (84p, 126n); (124n, 82p)
Znając następujące izotopy wodoru: 1H, 2H (D), 3H(T) oraz tlenu 16O, 17O, 18O, napisać wszystkie możliwe wzory wody (18 wzorów) Spośród nich wybrać wodę „najlżejszą” i „najcięższą”, a następnie obliczyć ich masy molowe.
Wśród podanych nuklidów wybrać izotopy oraz izobary:
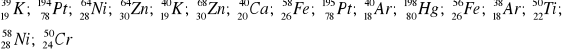
Na jeden atom izotopu 37Cl przypadają, w przybliżeniu, 3 atomy izotopu 35Cl . Jakiej średniej masie atomowej odpowiada ten skład?
Stosunek liczb nuklidów 65Cu i 63Cu w miedzi, występujących w związkach chemicznych, wynosi 31:69. Obliczyć średnią masę atomową miedzi. Wynik obliczeń porównaj z wartością tabelaryczną masy atomowej.
Skład izotopowy talu jest następujący: 203Tl : 205Tl = 3 : 7. Obliczyć średnią masę atomową talu.
Brom zawiera 40,52% atomowych izotopu 79Br. Pozostałą część stanowi izotop 81Br. Obliczyć średnią masę atomową bromu.
Skład izotopowy magnezu (w procentach atomowych) jest następujący: 78,60% 24Mg; 10,11% 25Mg; 11,29% 26Mg. Ile wynosi średnia masa atomowa magnezu ?
Skład izotopowy antymonu jest następujący: x121Sb + y123Sb. Wyznaczyć wartości x i y, jeśli masa atomowa antymonu, znaleziona doświadczalnie, wynosi 121,75 u.
Średnia masa atomowa rubidu wynosi 85,45 u. Rubid składa się z izotopów 85Rb oraz 87Rb. Podać skład izotopowy pierwiastka w procentach atomowych.
Po upływie 55 minut z 400 mg izotopu promieniotwórczego 13N pozostało 12,5 mg. Ile wynosił okres półtrwania tego izotopu ?
Okres półtrwania izotopu 24Na ulegającego rozpadowi β, wynosi 14,8 godziny. Napisz równanie reakcji jądrowej. Jaka ilość 24Mg powstanie z 12 g 24Na: a/ po upływie 10 h; b/ po całkowitym rozpadzie promieniotwórczym tej ilości izotopu sodu.
Rozwiązanie zadań
Zad. 1
Równanie reakcji jądrowej : ![]()
można sprawdzić równość indeksów górnych i dolnych nuklidów
Zad. 2
1/ ![]()
2/ ![]()
![]()
3/ ![]()
Zad.3
Równanie reakcji jądrowej: ![]()
Zad.4
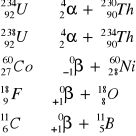
Przy zapisie równań proszę pamiętać o zgodności indeksów górnych i dolnych nuklidów oraz cząstek
Zad. 5
Oto zapis uzgodnionego równania
![]()
Porównując indeksy liczb masowych widzimy ich nadmiar po stronie lewej, czyli wśród produktów muszą się znajdować również cząstki α.
Zad.6
Oto pełny zapis równania reakcji przemiany jądrowej: ![]()
Zad. 7
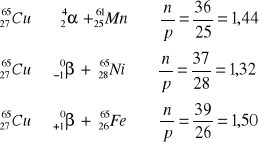
Wartość ułamka po przemianie zapisanej równaniem trzecim jest największa, ponieważ w wyniku przemiany pozytonowej jeden proton przekształcił się w neutron, czyli mianownik ułamka zmniejszył się o jeden przy jednoczesnym wzroście o jednostkę licznika ułamka.
Zad. 8
Poniżej zapisano równanie reakcji uwzględniając równość parametrów opisujących cząstki i nuklidy ![]()
Zad. 9
Poniżej podano zapis równań reakcji jądrowych z uwzględnieniem równości parametrów opisujących cząstki i nuklidy po stronie substratów i produktów:
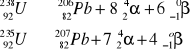
Zad. 10
![]()
przemiana, lub inaczej, rozpad beta
![]()
przemiana, lub inaczej, rozpad alfa
![]()
przemiana, lub inaczej, rozpad beta
Zad. 11
Przy rozwiązywaniu tego zadania można się posłużyć przykładowo następującym rozumowaniem:
9p + 10n = 19 nukleonów (liczba masowa), zaś 9 protonów oznacza jednocześnie 9 elektronów, czyli liczbę atomową odpowiadającą fluorowi -
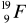
30p + 34n = 64 nukleony (Z) oraz 30 elektronów czyli (A) -
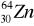
84p + 126n = 210 nukleonów (Z) oraz 84 elektrony (A) -
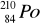
124 n + 82 p = 206 nukleonów (Z) oraz 82 elektrony (A) -
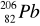
Zad. 12
Zgodnie z sugestią autorów zadania napisać dwanaście kombinacji podanych izotopów wodoru i tlenu. Dla uproszczenia przyjęto następujące symbole izotopów wodoru: 1H = H; 2H = D; 3H = T. Oto sześć możliwych kombinacji dla każdego izotopu tlenu przy zmiennej kombinacji izotopów wodoru:
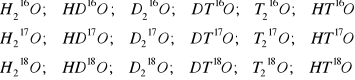
„Najlżejsza” woda ma wzór ![]()
M = 18 g/mol
„Najcięższa” woda ma wzór ![]()
M = 24 g/mol
Zad. 13
Izotopy - to nuklidy tego samego pierwiastka różniące się masą atomową. Można więc powiedzieć inaczej, że izotopy to nuklidy o identycznej liczbie atomowej a różnej liczbie masowej. W przytoczonych przykładach izotopami są następujące pary nuklidów:![]()
Izobary - to nuklidy o identycznej liczbie masowej lecz różnych liczbach atomowych. Można więc powiedzieć, że są to izotopy różnych pierwiastków posiadające identyczną masę atomową. Poniżej podano trzy grupy izobarów:
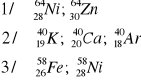
Zad. 14
Z informacji zawartej w zadaniu wynika, że skład procentowy izotopów chloru wynosi: 25% Cl-37 oraz 75% Cl-35. Średnia masa atomowa chloru będzie więc wynosiła:
MCl= 37uּ25%+35uּ75% = 9,25u + 24,0 = 33,25 u
Dla podanego składu izotopowego masa atomowa chloru wynosi więc 33,25 u
Zad. 15
Cu-65 : Cu-63 = 31 : 69 więc skład procentowy nuklidów wynosi 31% : 69%
MCu = 65u ּ 31% + 63u ּ 69% = 20,15 u + 43,47 u = 63,62 u
Dla podanego składu masa atomowa miedzi wynosi 63,62 u
Zad. 16
Tl-203 : Tl-205 = 3 : 7 co w przeliczeniu na skład procentowy daje: 30% Tl-203 oraz 70%Tl - 205. Następnie stosuje się znany wzór na obliczenie średniej masy atomowej:
M = 203 u ּ30% + 205u ּ 70% = 60,9 u + 143,5 u = 204,4 u
Dla podanego składu izotopowego masa atomowa talu wyniesie 204,4 u.
Zad. 17
Znając skład procentowy nuklidów bromu w znany sposób obliczamy średnią masę atomową: M = 79 u ּ 40,52% + 81 u ּ59,48% = 32,01 u + 48,18 u = 80,19 u
Zad. 18
Skład izotopowy magnezu: Mg - 24 = 78,6%; Mg - 25 = 10,11%; Mg - 26 = 11,29%
Masę atomową obliczamy w znany z poprzednich zadań sposób:
M = 24 u ּ78,6% + 25 u ּ 10,11% + 26 u ּ 11,2% = 24,33 u
Zad. 19
Współczynniki przy symbolach nuklidów oznaczają ich skład procentowy dlatego można go wyrazić w postaci tzw. ułamków procentowych, tak więc dla nuklidu Sb - 121 przyjmujemy x, zaś dla nuklidu Sb - 123 będzie (1-x). Znając masę atomową antymonu można zapisać: 121 x + 123 (1 - x) = 121,75. Po rozwiązaniu równania otrzymujemy wartość x = 0,625 co określa udział procentowy nuklidu Sb - 121 = 62,5 % zaś dla nuklidu Sb - 123 = 37,5%
Zad. 20
Zadanie podobne do poprzedniego czyli nr 19. Jednak tego typu obliczenia występują bardzo często dlatego proponuję jeszcze jedno ćwiczenie.
85 x + 87 (1-x) = 85,45 po wyliczeniu x = 0,775 czyli mieszanina zawiera 77,5% Rb - 85 oraz 22,5% Rb - 87
Zad. 21
t = 55 minut ; m1= 400 mg; m2 = 12,5 mg
Do obliczenia τ czas połowicznego rozpadu
Ustalamy ilość cykli połówkowania:
I okres 400 : 2 = 200
II okres 200 : 2 = 100
III okres 100 : 2 = 50
IV okres 50 : 2 = 25
V okres 25 : 2 = 12,5
Tak więc, w podanym w zadaniu, czasie 55 minut nastąpiło pięciokrotne połówkowanie czyli czas połowicznego rozpadu będzie wynosił: τ = 55 minut : 5 okresów = 11 minut. Okres połowicznego rozpadu izotopu azotu wynosi 11 minut.
Zad.22
τ = 14,8 godzin mNa = 12 g t1= 10 h
![]()
jako, że rozpad beta nie wiąże się ze zmianą masy, z rozpadu 12g sodu powstanie 12 g magnezu. Uwzględniając wartość czasu połowicznego rozpadu, przy założeniu liniowej zależności ilości powstałego sodu z czasem, można obliczyć ilość powstałego magnezu:
po upływie 14,8 h powstaje 0,5 · 12g = 6 g Mg
po upływie 10 h powstaje x g Mg
x = 4,05 g magnezu
Po upływie 10 godzin powstanie 4,05 g magnezu
Sfera elektronowa to druga wyróżniana część atomu. O ile omówione już jądro atomowe, a ściślej jego budowa, umożliwiała przewidywanie cech fizycznych pierwiastków takich jak masa atomowa, możliwość zachodzenia i zapis rozpadu promieniotwórczego, o tyle budowa sfery elektronowej pozwala na przewidywanie właściwości chemicznych pierwiastków. Ogólny zarys budowy sfery elektronowej przedstawiono na filmie. Pokazane tu powłoki elektronowe stanowią zbyt małą ilość informacji dla dalszych rozważań na temat wiązań czy też hybrydyzacji orbitalowej. Przypomnijmy podstawowe informacje. Elektrony są zlokalizowane na powłokach, które w kolejności od jądra oznaczono dużymi literami w porządku alfabetycznym: K, L, M, N, O, P, Q. Maksymalną, możliwą ilość elektronów na powłoce można obliczyć z zależności 2n2, gdzie przez n oznaczono kolejny numer powłoki liczonej w kolejności od jądra atomowego. Przykładowo na powłoce K, gdzie n=1 mogą być 2·12= 2 elektrony, na L, 2·22 = 8, na M może być maksymalnie 2·32 = 18 elektronów i tak dalej. Jednak na zewnętrznej powłoce nigdy nie może być więcej elektronów jak 8 (oktet) i to powoduje pewne komplikacje, które łatwo wyjaśnić wprowadzając zapis elektronowy z wykorzystaniem tzw. liczb kwantowych. Możliwość, a właściwie konieczność, modyfikacji poglądu na budowę atomu spowodowała tzw. teoria nieoznaczoności Heisenberga oraz teoria kwantowa Plancka. Najogólniej teorie te dowiodły, że cząstki materii w określonych warunkach, mogą występować w formie fali elektromagnetycznej o określonej amplitudzie o częstotliwości. Tak więc tor kołowy modelu planetarnego zastąpiono pojęciem powłoki, w której z pewną gęstością prawdopodobieństwa, może wystąpić elektron, lub pewna ich ilość. To pociąga za sobą dalsze konsekwencje. Oscylujący elektron, nośnik ładunku ujemnego indukuje wokół siebie pole elektromagnetyczne, oddziaływujące na pozostałe elektrony sfery. Jak więc widzimy w świetle tych teorii atom jawi się jako niezwykle złożony układ w którym następuje oddziaływanie wielu czynników tzw. parametrów stanu. Aby móc w sposób możliwie prosty określić budowę sfery elektronowej, ilość parametrów stanu należy sprowadzić do rozsądnej, niezbędnej ilości.
W rozważaniach chemicznych konieczne będzie rozróżnienie dwóch najbliżej siebie położonych elektronów. Można to osiągnąć stosując cztery parametry stanu, które nazywa się liczbami kwantowymi.
Liczby kwantowe są obliczane jedna z drugich dlatego istotne jest określenie ich kolejności. Z tego względu mówi się kolejno o pierwszej, drugiej, trzeciej i czwartej liczbie kwantowe. Pokrótce poznamy ich znaczenie i wzajemne zależności matematyczne.
Pierwsza liczba kwantowa -n, zwana również główną liczbą kwantową. Określa energię całkowitą elektronu. Liczba ta przyjmuje wartości kolejnych liczb naturalnych od 1 do 7 (licząc od jądra). Jest to tyle wartości ile jest okresów w układzie okresowym. Właśnie najwyższa wartość liczby kwantowej atomu pierwiastka określa jego położenie w odpowiednim okresie. Główną liczbę kwantową zapisuje się w formie odpowiedniej liczby arabskiej.
Druga liczba kwantowa, zwana również poboczną lub orbitalną. Oznacza się małą literą -l. Przyjmuje wartości od 0 do (l-1). W ten sposób powłoka K, której odpowiada wartość matematyczna 1, przyjmuje jedną wartość „0” a więc powłoka pierwsza posiada jeden orbital „0”. Powłoka druga posiada orbitale 0, 1 czyli dwa orbitale. Kolejna powłoka, której odpowiada wartość głównej liczby kwantowej 3 przyjmuje wartości 0, 1, oraz 2. Tak więc trzecia powłoka posiada trzy orbitale Czwarta powłoka posiada cztery orbitale odpowiadające wartościom 0, 1, 2 oraz 3. W kolejnej powłoce należałoby się więc spodziewać pięciu podpowłok. Jest to ważne w rozważaniach fizycznych, jednak w rozważaniach chemicznych wskutek przenikania energetycznego powłok nie stosuje się dalszego rozróżniania orbitali poprzestając na orbitalu odpowiadającym wartości 4. Warto sobie uzmysłowić, że do powłoki czwartej istnieje zależność następująca - nr powłoki określa ilość orbitali (podpowłok). W celu uniknięcia identycznego znakowania liczbami arabskimi numerów powłok oraz orbitali przyjęto zwyczaj literowego znakowania orbitali i tak: orbital 1 to s, orbital 2 to p, orbital 3 to d wreszcie orbital 4 to f. Zrekapitulujmy więc:
powłoka K odpowiadająca głównej liczbie kwantowej n = 1,posiada jeden orbital - s
powłoka L odpowiadająca głównej liczbie kwantowe n = 2 posiada dwa orbitale - s, p
powłoka M odpowiadająca głównej liczbie kwantowej n = 3, posiada trzy orbitale -s, p, d
powłoka N odpowiadająca głównej liczbie kwantowej n = 4, posiada cztery orbitale - s, p, d, f
powłoka O odpowiadająca głównej liczbie kwantowej n = 5, teoretycznie posiada pięć orbitali jednak dla potrzeb chemicznych wyróżnia się tylko cztery - s, p, d, f
Wielokrotnie zastosowano termin orbital, pod tym pojęciem rozumie się funkcję matematyczną opisującą obszar wokół jądra atomowego o największej gęstości prawdopodobieństwa wystąpienia elektronu. W ten sposób orbital s posiada kształt sferyczny, kulisty, której powłoka stanowi obszar największej gęstości prawdopodobieństwa znalezienia elektronu. Orbitale s kolejnych powłok mają odpowiednie większe promienie. Orbital p ma kształt symetrycznej ósemki obrotowej opisywany również jako kształt schodzących się łezek (od łzy). Dalsze orbitale, których kształty są bardziej złożone nie będą nam potrzebne w dalszych rozważaniach.
Trzecia liczba kwantowa - m. Nosi nazwę liczby magnetycznej i opisuje efekt oddziaływania na elektrony pól magnetycznych indukowanych przez poruszające się elektrony. Indukowane w wyniku ruchu wirowego elektronów, tzw. spinu elektronowego, pola magnetyczne powodują odpowiednią orientację przestrzenną orbitali, którą można wyliczyć z następującej zależności: m (liczba magnetyczna) przyjmuje wartości od -l(el) do +l(el) łącznie z zerem. W ten sposób można określić ilość możliwych stanów orbitalnych dla poszczególnych podpowłok:
podpowłoce s odpowiadała wartość liczbowa 0. Tak więc liczba magnetyczna może przyjąć jedynie wartość zero. Podpowłoka s posiada tylko jeden orbital
podpowłoce p odpowiadała wartość matematyczna 1, liczba magnetyczna może więc przyjąć wartości -1, 0, +1. Podpowłoka p składa się więc z trzech orbita li, trzech ósemek symetrycznych leżących w osiach x, y, z przestrzennego układu współrzędnych.
podpowłoce d ma wartość 2, liczby magnetyczne przyjmą wartości -2, -1, 0, +1, +2 czyli łącznie pięć wartości. Podpowłoka d składa się więc pięciu orbita- li.
Analogicznie podpowłoka f o wartości 3, będzie miała 7 orbitali.
Łatwo zorientować się, że ilość orbitali można obliczyć z wzoru, ilość orbitali m= 2 · l + 1. Reasumując: podpowłoka s składa się z jednego orbitalu, p trzech, d pięciu zaś f z siedmiu orbitali.
Po omówieniu trzech kolejnych liczb kwantowych czas na pewne ograniczenia. Pierwszym z nich jest tzw. zakaz Pauliego. Zgodnie z nim w atomie mogą występować dwa elektrony posiadające trzy identyczne liczby kwantowe, różnić zaś muszą się co najmniej jedną tzw. liczbą spinową.
To stwierdzenie jest podstawą wprowadzenia czwartej liczby kwantowej s tzw. liczby spinowej. Jak już wspomniano wcześniej pod pojęciem spin rozumie się kręt elektronu, czyli jego ruch wirowy wokół osi. Możliwe są oczywiście jedynie dwa kierunki wirowania dlatego też liczba kwantowa spinowa może przyjmować dwie wartości mianowicie +½ oraz -½. Oznacza się to też dwiema, przeciwnie skierowanymi strzałkami ↑ lub ↓. Z zakazu Pauliego wynika więc, że dwa elektrony opisane trzema identycznymi liczbami kwantowymi, a więc posiadające identyczny poziom orbitalny, muszą się różnić liczbami spinowymi. Tak więc każdy orbital może być obsadzony przez dwa elektrony. To stwierdzenie pozwala na obliczenie ilości elektronów, które mogą wystąpić na danym orbitalu (na danej podpowłoce). Tak więc na podpowłoce s (jeden stan orbitalny) znajdą się dwa elektrony. Na podpowłoce p (trzy stany orbitalne) sześć elektronów. Podpowłoce d (pięć stanów orbitalnych) dziesięć elektronów i wreszcie na podpowłoce f może być maksymalnie 14 elektronów. Tę zależność warto sobie utrwalić gdyż omawiając budowę układu okresowego a konkretnie jego bloki energetyczne nawiążemy do tych ilości elektronów aby wykazać, że blok energetyczny s stanowią dwie grupy, blok p sześć grup, blok d 10 grup zaś blok f to 14 po czternaście pierwiastków grup lantanowców i aktynowców.
W dalszych rozważaniach dotyczących budowy układu okresowego jak również tworzenia wiązań chemicznych ważna jest umiejętność określania ilości elektronów na poszczególnych podpowłokach jak również zapis klatkowy struktur elektronowych. Tego typu polecenia są dosyć częste w testach maturalnych i można je spotkać w zadaniach rozwiązanych w rozdziale pt. Właściwości chemiczne pierwiastków. Nim omówimy przykłady należy przytoczyć drugą, obok zakazu Pauliego, regułę ważną dla zapisu klatkowego struktur elektronowych. Jest to tzw. reguła Hunda zwana również regułą maksymalnego rozspinowania.
Elektrony znajdujące się na danej podpowłoce zajmują możliwie największą ilość orbitali, przyjmując spiny równoległe i dopiero po ich zapełnieniu następuje ich sparowanie pozostałymi do dyspozycji elektronami.
W celu przybliżenia omawianego zagadnienia dla przykładu podano zapis klatkowy atomów pierwiastków pierwszego i drugiego okresu układu okresowego. W pierwszej kolumnie podano symbole kolejno pierwiastków pierwszego okresu czyli wodoru i helu a następnie drugiego okresu. Warto zapamiętać nazwy tych pierwiastków, bowiem zgodnie z przyjętą zasadą, od nich wywodzą się nazwy tzw. grup głównych. Wyjątek stanowi wodór, bowiem grupa pierwsza to litowce a więc nazwa pochodzi od drugiego pierwiastka w grupie jednak bardziej pasującego pod względem właściwości chemicznych. Kolumny tabeli oznaczają orbitale kolejno: 1s, 2s i trzy orbitale p.
Rozmieszczenie elektronów pierwiastków okresu pierwszego i drugiego w stanie podstawowym atomów.
H |
↑ |
|
|
|
|
He |
↑↓ |
|
|
|
|
Li |
↑↓ |
↑ |
|
|
|
Be |
|
|
|
|
|
B |
↑↓ |
↑↓ |
↑ |
|
|
C |
↑↓ |
↑↓ |
↑ |
↑ |
|
N |
↑↓ |
↑↓ |
↑ |
↑ |
↑ |
O |
↑↓ |
↑↓ |
↑↓ |
↑ |
↑ |
F |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑ |
Ne |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
1s 2s 2p
W celu graficznego przedstawienia konfiguracji elektronowej atomu uwzględniającej spin elektronów, zaleca się wyprowadzić najpierw konfigurację elektronową pierwiastka a następnie kolejno przedstawić konfigurację każdego poziomu. Poziomy energetyczne przedstawia się jeden nad drugim, jak to przykładowo przedstawiono na przykładzie atomu chloru. Cl (A = 17) 1s22s22p63s23p5
| s | p | d |
(M)3 |
↑↓ |
↑↓ |
↑↓ |
↑ |
|
|
|
|
|
(L) 2 |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|
|
d |
|
|
(K)1 |
↑↓ |
|
p6 |
|
|
|
|
|
|
s2
Można również zastosować zapis w jednym rzędzie:
1s2 |
2s2 |
|
2p6 |
|
3s2 |
|
3p6 |
|
|
|
3d10 |
|
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑ |
|
|
|
|
|
Najistotniejsze dla dalszych rozważań jest usytuowanie elektronów na powłokach zewnętrznych są to tzw. elektrony walencyjne, czyli te, które mogą tworzyć wiązania chemiczne. W związku z powyższym często stosuje się tzw. zapis skrócony, to znaczy rozpoczynający się od poprzedzającego gazu szlachetnego. Dla przytoczonego powyżej przykładu chloru elektronami walencyjnymi będą te, które znajdują się na powłoce zewnętrznej czyli te, które posiadają najwyższą wartość głównej liczby kwantowej. W omawianym przykładzie będzie to liczba 3, czyli atom chloru posiada siedem elektronów walencyjnych - 3s23p5 a zapis skrócony będzie miał formę: [Ne]3s23p5. Pewne utrudnienie rozpoczyna się od okresu czwartego to znaczy z pojawieniem się podpowłoki d. Jako, że na powłoce zewnętrznej nie może być więcej jak 8 elektronów po podpowłoce 3p nie może się zapełnić 3d. Tworzy się więc nowa powłoka a ściślej podpowłoka 4s, która zapełnia się dwoma elektronami i dopiero wówczas, jako przedostatnia zapełnia się podpowłoka 3d. Ta prawidłowość będzie się powtarzała w następnych powłokach. Więcej na ten temat zawiera informacja o budowie układu okresowego.
Przykłady zadań testowych związanych z budową atomu jak również i z układem okresowym zajmują stosunkowo niewiele miejsca w testach maturalnych. Można je znaleźć przy okazji zadań w dziale pt. „Właściwości chemiczne pierwiastków”. Poniżej podano więc kilka przykładów, które umożliwią ugruntowanie najistotniejszych informacji o budowie sfery elektronowe atomów.
Przykłady zadań na temat „Budowa sfery elektronowe”
Przeczytać i objaśnić następujące zapisy: 1s2, 5s1, 3p2, 6d8, 4f5
Na podstawie podanej konfiguracji elektronowej wskazać, które podpowłoki są całkowicie zapełnione elektronami a które nie: 5s1; 1s2; 2p6; 6p2; 4p4; 5d10; 6d2
W podanych niżej konfiguracjach wskazać, i uzasadnić, które z nich są możliwe a które nie: 3s2; 2s3; 2d5; 5d2; 3f12; 6f3; 1p3; 3p1; 4p4; 4d4; 3f6.
Powłoka elektronowa odpowiadająca głównej liczbie kwantowe n = 3 jest całkowicie zapełniona. Ile elektronów i jak rozmieszczonych znajduje się na tej powłoce.
Czy dana powłoka może zawierać elektrony d, jeżeli kończy się ona jedną z następujących konfiguracji: 5f11; 3s1; 4p6Przedstawić konfiguracje elektronowe odpowiednich powłok.
Powłoka elektronowa atomów miedzi zawiera na kolejnych poziomach energetycznych odpowiednio następujące ilości elektronów: 2, 8, 18, 1. Przedstawić pełną konfigurację elektronową. Wskazać poziomy zapełnione i niezapełnione. Podać zapis klatkowy elektronów walencyjnych tego atomu.
Zewnętrzna powłoka elektronowa pewnego atomu ma zapis 4s24p3. Napis konfigurację pełną i skróconą struktury elektronowej tego pierwiastka.
Przedstaw graficznie (klatkowo) konfiguracje elektronowe: atomu sodu oraz jonu sodu; atomu glinu oraz jonu glinu Al3+; atomu siarki oraz jonów S2-, S+IV; S+VI.
Na podstawie konfiguracji elektronowej wytłumaczyć dlaczego chlor może a fluor nie może występować na różnych stopniach utlenienia.
Rozwiązania zadań związanych z budową sfery elektronowej
Zad. 1
W zadaniu zgodnie z poleceniem chodzi o uwzględnienie dwóch zagadnień:
Prawidłowe odczytanie zapisu struktur elektronowych
Właściwą interpretację zapisu struktury elektronowej
Oto interpretacja kolejnych zapisów:
1s2 - czyta się - jeden s dwa; oznacza to dwa elektrony podpowłoki s powłoki pierwszej
5s1 - pięć - s - jeden; jeden elektron podpowłoki s powłoki piątej
3p2 - trzy - s - dwa; dwa elektrony podpowłoki p powłoki trzeciej
6d8 - sześć - d - osiem; osiem elektronów podpowłoki d powłoki szóstej
4f5 - cztery - f - pięć; pięć elektronów podpowłoki f powłoki czwartej
Zad. 2
W zadaniu chodzi o utrwalenie informacji o ilości elektronów, które mogą się znajdować w danej podpowłoce (orbitalu): s - dwa elektrony; p - sześć elektronów; d - dziesięć elektronów; f - czternaście elektronów, tak więc całkowicie zapełnione są orbitale: 1s2, 2p6, 5d10.
UWAGA - wartość głównej liczby kwantowej nie ma wpływu na ilość elektronów występujących na danej podpowłoce.
Zad. 3
Zadanie ma na celu utrwalenie informacji na temat współzależności poszczególnych liczb kwantowych, i tak:
3s2 - możliwe
2s3 - błędne, ponieważ na orbitalu s mogą się znajdować najwyżej dwa elektrony
2d5 - błędne, ponieważ powłoka druga nie zawiera podpowłoki d
5d2 - możliwe
3f12 - błędne, ponieważ powłoka trzecia nie posiada podpowłoki f a jedynie s, p, d.
6f3 - możliwe
1p3 - błędne, ponieważ powłoka 1 nie zawiera podpowłoki p
3p1 - możliwe
4p4 - możliwe
4d4 - możliwe
3f6 - błędne, ponieważ powłoka 3 zawiera jedynie podpowłoki s, p oraz d
Zad. 4
Głównej liczbie kwantowej n = 3 odpowiadają podpowłoki odpowiadające wartościom od 0 do (n -1) czyli 0, 1, 2 to znaczy s, p, d
Podpowłoka s 1 stan orbitalny czyli 2 elektrony
Podpowłoka p 3 stany orbitalne czyli 8 elektronów
Podpowłoka d 5 stanów orbitalnych czyli 10 elektronów
Łączna ilość elektronów na powłoce n=3 18 elektronów
Zad. 5
5f11 - tak, gdyż wcześniej zapełni się 3d oraz 4d
3s1 - nie, gdyż powłoka 2 zawiera jedynie podpowłoki s,p. Zapis elektronowy: 1s2, 2s2, 2p6, 3s1
4p6 - tak, gdyż powłoka 3 posiada podpowłoki s, p oraz d. Pełny zapis ma więc postać: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6
Zad. 6
K2L8M18N1 co w postaci liczb kwantowych zapisuje się następująco: 1s22s22p63s23p64s13d10
UWAGA - konfiguracja elektronowa atomu miedzi jest nietypowa. Jeden elektron z orbitalu 4s zostaje przeniesiony do orbitalu 3d aby ten mógł w ten sposób osiągnąć optymalną postać zapełnienia wszystkich orbita li d parami elektronów, czyli łącznie orbital ten zawiera 10 elektronów a na podpowłoce 4s pozostaje tylko jeden elektron. Tak więc w wersji skróconej strukturę elektronową atomu miedzi można zapisać: [Ar] 4s13d10. W niektórych podręcznikach stosuje się zapis zgodnie z wartością głównej liczby kwantowej czyli [Ar] 3d104s1
Zad, 7
Al o![]()
1s2 2s2 2p6 3s2 3p1
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
|
↑ |
|
|
Al 3+ 1s2 2s2 2p6
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
S0 1s2 2s2 2p6 3s2 3p4
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
|
↑↓ |
↑ |
↑ |
S+IV 1s2 2s2 2p6 3s2
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
S+VI 1s2 2s2 2p6
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
S2- 1s2 2s2 2p6 3s2 3p6
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
|
↑↓ |
|
↑↓ |
↑↓ |
↑↓ |
UWAGA -proszę zwrócić uwagę na odmienny sposób zapisu stopni utlenienia. Cyfrę arabską i znak stosuje się w jonach prostych, takich jak właśnie S2- czy też Fe3+. Cyfry rzymskie stosuje się dla określenia stopnia utlenienia atomów w jonach złożonych takich jak przykładowo atomy siarki w jonach siarczanowych(IV) oraz siarczanowych(VI)
Zad. 9
Obydwa pierwiastki mają po siedem elektronów walencyjnych. Odmienne zachowanie wynika z różnic w promieniach atomów. Atom fluoru ma elektrony walencyjne na drugiej powłoce, która jest położona blisko jądra atomowego i dlatego elektrony walencyjne są silnie przyciągane przez jądro atomowe. Z tego powodu atomy innych pierwiastków nie potrafią odłączyć elektronu od atomu fluoru. Pozostałe fluorowce, mając większe wartości promieni atomowych, łatwiej mogą odłączyć elektrony przyjmując elektrowartościowości dodatnie. Podobnie jak fluor zachowuje się atom tlenu, który również wyłącznie przyjmuje elektronu a co za tym idzie posiada wyłączcie elektrowartościowość -II. Atomy pierwiastków drugiego okresu zachowują się specyficznie. W związku z małą odległością elektronów walencyjnych od jądra, w miarę wzrostu ładunku, elektrony są coraz silniej przyciągane i w efekcie w drugim okresie w miarę wzrostu wartości liczby atomowej promienie atomowe maleją
Przykłady zadań z zestawów maturalnych
Określ jaki pierwiastek powstanie z radu o liczbie masowej 226, jeżeli jądro atomowe tego izotopu ulega pięciu przemianom α i czterem przemianom β-.
Określ wiek szczątków włóczni wydobytych w czasie wykopalisk jeżeli w pobranej z niej próbie oznaczona zawartość izotopu 14C stanowi 25% zawartości tego izotopu w drewnie w chwili wykonywanie z niego włóczni. Okres półtrwania tego izotopu węgla wynosi 5568 lat.
Dany jest ciąg przemian promieniotwórczych polonu - 216 w ołów - 208
![]()
Zapisz każdą przemianę odpowiednim równaniem oraz nazwij rodzaj promieniowania w każdej reakcji.
4. Okres półtrwania radonu - 222 wynosi 4 dni. Oblicz ile radonu - 222 pozostanie z próbki o masie 10 g po upływie 12 dni. Narysuj wykres półtrwania radonu-222.
Pierwiastek E jest mieszaniną nuklidów o liczbach masowych 54, 56, 57 oraz 58 w ilościach odpowiednio 5,84%, 91,68%, 2,17% oraz 0,31%. Oblicz masę atomową tego pierwiastka oraz podaj jego nazwę. Podaj czym różnią się jego nuklidy.
Podczas badania kawałka drewna znalezionego w egipskich grobowcach stwierdzono, że intensywność rozpadu promieniotwórczego izotopu C-14 jest ośmiokrotnie mniejsza niż w świeżo ściętym drewnie. Określ wiek znaleziska wiedząc, że okres połowicznego rozpadu tego izotopu wynosi 5730 lat.
Oblicz zawartość procentową dwóch izotopów w węglu, wiedząc, że jego średnia masa atomowa wynosi 12,011u. Jeden z izotopów ma w jądrze 6 a drugi 7 neutronów. W obliczeniach pominąć śladowe ilości izotopu C-14
Cez-137 był jednym ze składników chmury radioaktywnej po katastrofie w Czarnobylu. Przenika on do gleby i może być kumulowany np. w grzybach. Czas połowicznego rozpadu tego izotopu wynosi 30 lat. Po ilu latach zawartość promieniotwórczego cezu zmaleje do około 1,5% zawartości początkowej.
Rozwiązania zadań z zestawów maturalnych
Zad.1
Zapisujemy w formie równania przemiany podane w treści zadania a następnie bilansujemy wartości liczb masowych i atomowych:
![]()
Zad.2
Na podstawie informacji o pozostałej ilości izotopu węgla obliczamy ile okresów połowicznego rozpadu minęło: po I pozostaje 50%, po kolejnym 25% ilości pierwotnej. Uwzględniając czas połowicznego rozpadu wynoszący 5568 lat należy szacować, że włócznia powstała przed 11136 laty.
Zad. 3
Kolejne przemiany można zapisać następującymi równaniami:
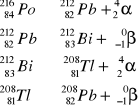
Kolejno są to przemiany (1) alfa, (2) beta minus, (3) alfa, (4) beta minus
Zad.4
Dwanaście dni, to trzy okresy połowicznego rozkładu. Po pierwszym okresie pozostaje 5 g, po kolejnym 2,5g i po trzecim 1,25g
Zad. 5
W pierwszej kolejności należy, w znany sposób, obliczyć średnią masę atomową: M = 54 ∙ 0,0584 + 56 ∙ 0,9168 + 57 ∙ 0,0217 + 58 ∙ 0,0031 = 55,91 u. Pierwiastkiem tym może być żelazo
Zad. 6
Na podstawie informacji ustalamy ilość okresów połowicznego rozpadu. Po pierwszy okresie ½, po kolejnym ¼ i po trzecim pozostaje ⅛. Tak więc wiek znaleziska można wyliczyć z iloczynu okresu połowicznego rozpadu i czasu trwania połowicznego rozpady, czyli 3٠5730 = 17190 lat.
Zad.7
Obliczamy liczby masowe nuklidów węgla:
1/ 6 neutronów + 6 protonów = 12 u; zawartość x % lub jako ułamek procentowy x
2/ 6 neutronów+7protonów =13 u; zawartość (100-x)%, jako ułamek procentowy (1-x)
Masa atomowa wynosi M => 12x + 13(1-x) = 12,011. Po rozwiązaniu równania otrzymujemy x = 0,989, co odpowiada 98,9%. Tak więc skład procentowy nuklidów przedstawia się następująco: 98,9% nuklidu C-12 oraz 1,1% nuklidu C-13
Zad.8
W pierwszej kolejności wyliczamy ilość okresów półtrwania, po których pozostaje około 1,5% radionuklidu. Po pierwszym 50%, po drugim 25%, po trzecim 12,5%, po czwartym 6,25%, po piątym około 3,12%, po szóstym pozostaje około 1,5%. Jako, że okres połowicznego rozpadu tego nuklidu trwa 30 lat, tak więc czas osiągnięcia oczekiwanego poziomy wyniesie 6 razy 30 lat, a więc 180 lat
25
Wyszukiwarka
Podobne podstrony:
Budowa atomu testy chemia liceum, chemia liceum
Budowa atomu 2, CHEMIA, semestr 1, chemia ogólna, wykłady
Budowa atomu 1, CHEMIA, semestr 1, chemia ogólna
chemia budowa atomu
Chemia II Budowa atomu
1. Budowa atomu...., chemia(2)
Budowa atomu, Chemia
ściąga na chemie [Jasiorski], Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Chemia materiałów
budowa materii i wiazania chem, Chemia, Gimnazjum, kl1, Budowa atomu
na koło z chemii trzeba umieć [Jasiorski], Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Chemia mat
8. budowa atomu pow+éoki i elektrony zadania maturalne, Chemia
scen. - budowa atomu a układ okresowy pierwiastków, chemia, scenariusze lekcji
pods. - budowa atomu a układ okresowy 2, chemia, podsumowanie wiadomości
WYKŁAD (budowa atomu, CHEMIA
Budowa Atomu, Zarządzanie i inżynieria produkcji, Semestr 2, Materiałoznawstwo
Chemia - Budowa atomu i wiązania chemiczne(1), EDUKACJA 35 000 TYS. plików z każdej branży
budowa atomu ukl okresowy, Chemia, Gimnazjum, kl1, Budowa atomu
4. Budowa ciala stałego, pwr biotechnologia(I stopień), II semestr, Chemia nieorganiczna, Wykłady Ap
Budowa atomu, Chemia, Korki chemia
więcej podobnych podstron