Ćwiczenie:9
Rozdzial kinetyczny racematów:
- jeżeli mamy reakcje chem - związek A reaguje szybciej nadklasami jednym enancjomerem niż z drugim
A + R ---Kr------> P
A + S ----Ks-----> Q
K - stala szybkości
Kr >> Ks
Przykład enzymatyczny:
![]()
--------> (L)-RCHCOOH + (D)-RCHCOOH
| | |
NHAc NH2 NHAc
L- amylaza zdejmuje grupe ochronna przy asymetrycznym at. C nadklasami konfiguracji L, nie zdejmuje grupy ochronnej ze zw. Nadklasami konfiguracji D. Enzym rozroznia konfiguracje i substraty.
Przykład chemiczny:
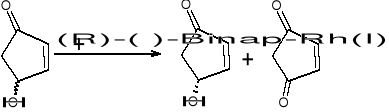
(R) w=27%
cz=91%
Gr OH może być na gorze lub na dole, jest to mieszanina racemiczna. Enzymy są bardzo wrażliwe na warunki (pH, temp)
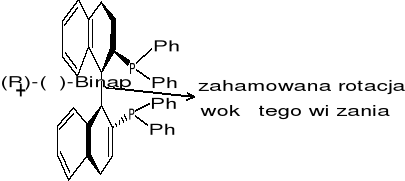
(R)-(+)-Binap - ma czynność optyczna (związana nadklasami tym, ze wiazanie nie umozliwia obrotu; ma nieslasciwa os symetrii); dodajemy go do jakiegos związku - rozroznia on enancjomery jeden od drugiego (9%-produkt redukcji; 91% - I wszy enancjomer OH)
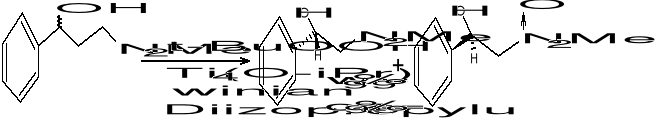
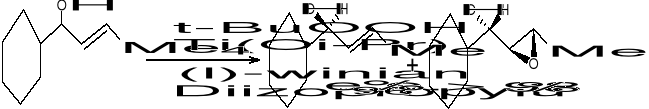
Asymetryczne epoksydowanie alkoholi alkilowych:
t-BuOOH - wodoronadtlenek ter-butylowy; jest donorem O2 - umozliwia tworzenie zw. epoksydowego.
L-(+)-winian dietylu - decyduje o asymetrycznym epoksydowaniu; jest związkiem optycznie czynnym (roznicuje on przestrzen)
Ti - metal przejściowy; zbiera wszystkie substraty i rozmieszcza je w scisle geometryczny sposób
Związki epoksydowe sluza do otrzymywania związków aktywnych biologicznie. W ten sposób otrzymujemy: bromycyne, rifamycyne S, jonomycyne, werrukaryne A itd.
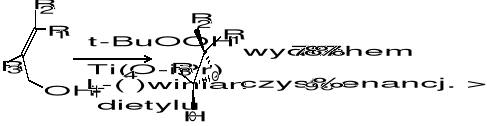
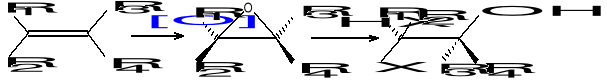
Kinetyczne rozszczepienie racemicznych alkoholi allilowych:
Związki stosowane do przeprowadzania procesów chemicznych:
1. Utlenianie związkami chromu i manganu:
Cr+6 (K2Cr2O7, Na2CrO4, CrO3)
Mn+7 (KMnO4)
Mn+4 (MnO2)
2CrO3 + R2CHOH + 6H+ 3R2C=O + 2Cr+3 + 6H2O
2MnO4- + 5R2CHOH + 6H+ 5R2C=O + Mn+2 + 8H20
2MnO4- + 3R2CHOH 3R2C=O + 2MnO2 + 2H2O + 2OH-
Rozpuszczalniki: wodne, t-butanol, kwas octowy, rzadziej aceton, pirydyna, CrO3/pirydyna(rop nadklasami pirydynie), CH2Cl2
Zastosowanie:
- utlenianie alkoholi (utlenianie alkoholi allilowych nadklasami benzylowych - MnO2)
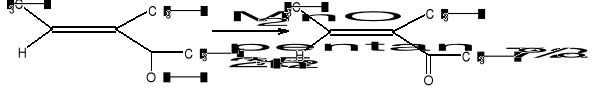
- utlenianie aldehydów
- utlenianie wiązań podwójnych
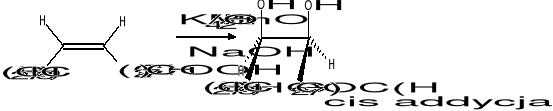
- utlenianie łańcucha bocznego pochodnych benzenu
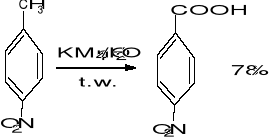
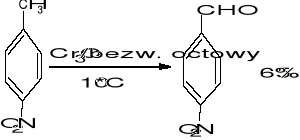
2. Utlenianie przy udziale HNO3
- rozrywanie wiązań węgiel - węgiel
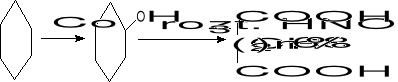
- utlenianie alkoholi i aldehydów
![]()
65%
- utlenianie łańcucha bocznego pochodnych benzenu
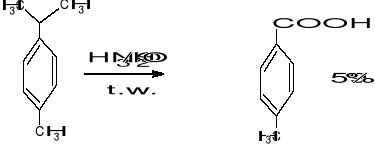
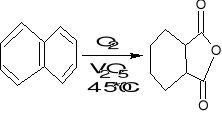
3. Utlenianie O2
- katalizatory (metale szlachetne) - Pt, Pd, Ag - duża selektywność, drogie, wrażliwe na temp. i trucizny; tlenki wanadu, żelaza, miedzi, kobaltu, molibdenu.
Zastosowanie:
- utlenianie węglowodorów
![]()
![]()
![]()
![]()
![]()
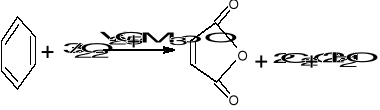
Utlenianie nadkwasami i nadtlenkami - nadkwasy są słabsze od kwasów zwykłych; zw. standardowe: 30% H2O2; nadtlenek kw. octowego, trifluorooctowego, benzoesowego,(CH3)3COOH, zw. siarki: Na2S2O8, Na2SO5
zastos.
a) utlenianie wiąz podw. C=C
C6H5CHCH2 + C6H5COOOH C6H5CHOCH2 /0°C CHCl3/ W=75%
CH3CHCH2 +(CH3)3COOH CH3CHOCH2 +(CH3)3COH
kw. benzoesowy - łagodne warunki, niska temp. niedopuszcza do gwałtownego przebiegu r-cji
b) utlenianie zw. karbonylowych
p-NO2-C6H4COC6H5 p-NO2-C6H4COOC6H5 /CH3COOOH;CH3OOH;H2SO4;25°C/ W=95%-keton- insercja tlenu w wiąz. C-C, łag. war.katalityczna ilość kwasu
cykloheksanon lakton kw. kapronowego / C6H5COOOH,CHCl3, 25°C/ W=71%
c) utlenianie amin i siarczków
- pirydyna- zablokowanie aktywnego azotu- brak zastosowania; można wprowadzać różne grupy do pierścienia
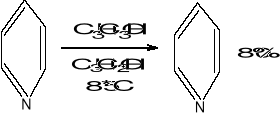
5. Utlenianie zw. chloru na dodatnim stopniu utlenienia- NaOCl, Ca(OCl)2, NaClO3tanie do otrzymywania
chloran sodu- przepuszczanie chloru przez zasadę sodową
CH3-C6H4-NO2 COOH-C6H4-NO2 /NaOCl/-delokalizacja elektronów, możliwe inne utleniacze; metoda hist.
Utlenianie metodą Oppenauera
dotyczy szczególnie steroidów
w zależności od temperatury stosujemy jeden z dwóch układów:
aceton/alkohol izopropylowy- w temp. wrzenia jednego z substratów np.: acetonu selektywna
cykloheksanon/cykloheksanol- wzrost temp. wrzenia znacznie wyżej do otrzymywania zmodyfikowanych hormonów
jako katalizatorów używamy:
*izopropanolan glinu
*t-butolan glinu
R1R2CH-OH+ CH3COCH3R1COR2+ (CH3)2CHOH
- katalizator o charakterze kwasu Levisa
- przenoszenie anionu wodorkowego do ketonu ( aceton)
- r-cja obustronna- przebieg kontrolowany przez usuwanie produktu
benzoesan androstendionu benzoesan testosteronu / cykloheksanon,
(t-C4H9O)Al., C6H5CH3/ W=85%
- wiązanie podwójne nienaruszone- ulega przesunięciu, stałe grupy CH3
- r-cja w środowisku obojętnym- toluen
- wada: r-cja czasochłonna, ogrzewanie pod chłodnicą zwrotną.
- następuje wymiana grupy OH na gr. karbonylową
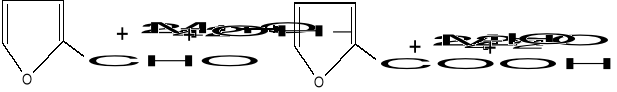
6) Utlenianie kwasem nadjodowym i jego solami (NaJO4, KJO4)
rozpuszczalniki: H2O, MeOH, EtOH, dioksan - rozszczepienie 1-2- dioli α- hydroksykwasów , różnica- aktywność w różnym środowisku
7) Utlenianie tetraoctanem ołowiu ( niepolarny- rozp. w benzenie, toluenie, kw. octowym)
rozpuszczalniki: C6H6, C6H5CH3, CH3COOH- polarne
Zastosowanie:
- rozszczepienie 1,2- dioli i zw. pokrewnych
CH3(CH2)7CHOHCHOH(CH2)7COOH CH3(CH2)7CHO+COOH(CH2)7CHO
/ KJO4/ H2O/ EtOH, H2SO4/ 400C
- duża wydajność- 80%
- proces kilkugodzinny
- etanol rozp. substrat, śr. kwaśne- wzrost szybkości
COOCH3-(CHOH)2COOCH3COH-COOCH3 / Pb(CH3COO)4, C6H6, 25oC
- tleny wchodzą w str. katalit. ołowiuaktywność ; W=80%
- niska temp.- niższa od temp. benzenu
- rozcięcie wiązania C-C
CH2OH-(CHOH)4CH2OH(CH3)2CO-(CHOH)4CH2OC(CH3)2CHO-CH2OH-CH2OH 1. CH3COCH3, H+; 2. Pb(OAc)4
-otrzymano w ten sposób dużo zw. z licznymi centrami asymetrycznymi
-związki o dużej ilości C (cukry)blokada grup OH przez tworzenie wiązania acetalowego;
Redukcja metalami (Fe, Zn, Sn, Na)
1. Fe/H2O ( aktywator- HCl, FeSO4)- metoda Beschampa; stara; układ 2- fazowy, konieczność intensywnego mieszania, trudności usunięcia osadu, mało ekologiczna
Fe/CH3COOH, Fe/HCl
4 ArNO2+ 9Fe+ 4 H2O 4 ArNH2+ 3Fe3O4
2. Zn/HCl, Zn/NaOH, Zn/CH3COOH, Zn-Hg
5 Zn+ 10NaOH+2ArNO2ArNH-NH-Ar+5Na2ZnO2+2H2O
- najszybciej przebiega w środowisku kwaśnym, wolniej w zasadowym
- pochodne hydrazyny- duża wydajność
Ph-CO-CH2-COOEt Ph-(CH2)2-COOEt W=ok. 100%
3. Sn/HCl, SnCl2, Sn/CH3COOH
- ArNO2+ 2SnCl2+7HClArNH3+Cl-+3 SnCl4+2H2O
- szybsza, łatwiej oddzielić produkt od substratu
4. Na/C6H6 lub C6H5CH3, Na/C2H5OH, Na/ciekły NH3
n-C11H23CO2C2H5n-C11H23CH2OH /Na, C2H5OH, C6H5CH3/ temp
6) Redukcja katalityczna
przy pomocy wodoru
w postaci czerni palladowej
przy udziale Pt, PtO2, Pd, Rh, Ni, Ru, Co, Ni
na nośnikach
Cakt. Al2O3 SiO2 Na2CO3 Sr2CO3 BaSO4
Aktywność rośnie
Hamują aktywność katalizatorów
*Otrzymywanie czerni palladowej
a)
PdCl2 HCl, 40% HCOH Pd (czerń palladowa- przechowywana pod
NaOH warstwą płynu, zapala się w bezpośrednim
kontakcie z powietrzem,
b) PdCl2 H2 Pd/C
C
c) H2PtCl6 + NaBH4 + Cpył C2H5OH Pt/C
25oC
*rozpuszczalniki:
woda, etanol, kwas octowy, octan etylu
*trucizny katalityczne: siarczan baru oraz aminy trzecio-rzędowe
7) Redukcja wodorkami metali (ma tu miejsce kataliza heterogenna)
Zastosowanie: selektywna redukcja grup: C=O, C=N, N=O

8) Redukcja hydrazyną i przy pomocy związków siarki
Stosujemy Na2S, Na2SO3, Na2S2O4
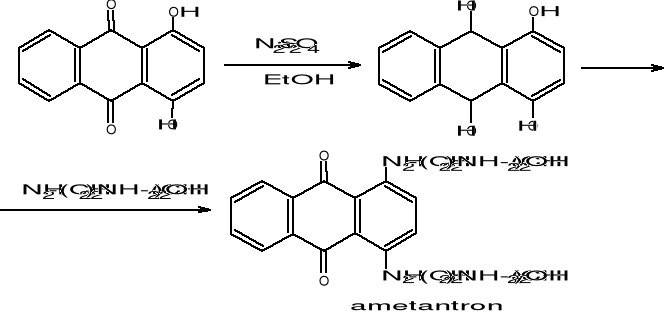
Redukcja hydrazyną i jej pochodnymi (r. wolffa-Kiznera)
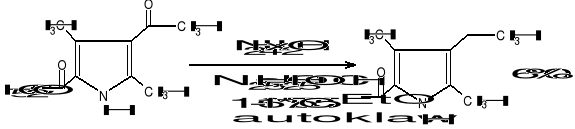
Kataliza homogenia
Stosujemy rozpuszczalne związki Rh+1
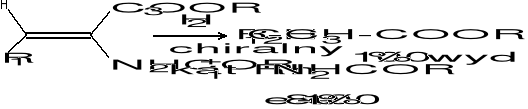
Zastosowanie:
- synteza aminokwasów i peptydów niepochodzących z białek (L-DOPA, aspartam)
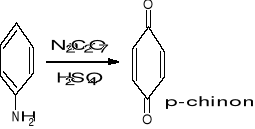
Uzyskiwanie hydrochinonu:
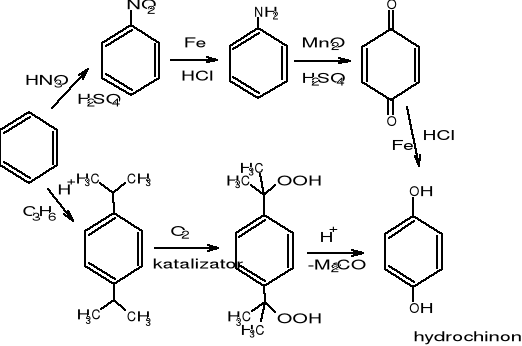
Metoda klasyczna > 10 kg soli na kg produktu
Metoda katalityczna < 1 kg soli na kg produktu
9) Otrzymywanie kwasu salicylowego i kwasu acetylosalicylowego.
KWAS SALICYLOWY
Kwas salicylowy otrzymuje się przez karboksylowanie fenolanu sodowego. O wydajności kwasu salicylowego decydują odpowiednio dobrane parametry temperatury, ciśnienia oraz stopień rozwinięcia powierzchni fenolanu sodowego. Autoklawy, w których przeprowadza się karboksylowanie, zaopatrzone są w mieszadła, które przez ucieranie, rozdrabnianie i mieszanie stwarzają odpowiednie warunki reakcji między stałym fenolanem sodowym a gazowym CO2.
Zwykle stosuje się ciśninie w granicach 2-8 atm, temp. 135oC, do całkowitego przereagowania fenolanu na fenylowęglan sodowy. Całkowite przereagowanie fenolanu sodowego poznajemy po utrzymywaniu się ciśnienia w autoklawie, mimo wyłączenia dopływu dwutlenku węgla. Następnie temp. procesu zwiększa się stopniowo od 135 do 175oC w celu przegrupowania powstałego fenylowęglanu sodowego na salicylan sodowy.
Aby otrzymać fenolan sodowy, wprowadza się do reaktora czysty fenol oraz 40% roztwór NaOH w ilościach stechiometrycznych.
Reaktor powinien być zaopatrzony w płaszczowe urządzenie grzejne oraz w wolnoobrotowe mieszadło. Również zbiornik z fenolem zaopatrzony jest w urządzenie grzejne ze względu na konieczność stapiania fenolu przed przetłaczaniem do reaktora. Przepisy produkcyjne uwzględniają jeszcze dodatek siarczynu sodowego, który zabezpiecza fenolan sodowy przed utlenieniem.
Po sprawdzeniu, że żaden z substratów nie jest w nadmiarze, roztwór fenolanu sodowego przetłacza się do autoklawu, który ogrzewa się systemem Frederkinga lub Samka. Wodę odparowuje się początkowo pod zwykłym ciśnieniem, potem pod zmniejszonym w temp. 130oC, przy końcu w temperaturze160oC. Wodę skrapla się w chłodnicy, skąd spływa do odbieralnika. W okresie odparowania pod zmniejszonym ciśnieniem załącza się pompę próżniową. Równocześnie, podczas odparowywania i suszenia, wolnoobrotowe mieszadło początkowo miesza, potem uciera i rozdrabnia fenolan sodowy. Po wysuszeniu i rozdrobnieniu fenolanu soduschładza się autoklaw do 90oC. Karboksylowanie fenolanu sodu wykonuje się początkowo w temp. 100oC przy ciśnieniu 2 atm., potem w 130oC-135oC przy ciśninieniu 4-6 atm. Ukończenie procesu karboksylowania kontroluje się manometrycznie. Gdy mimo zamknięcia przewodów z CO2 nie następuje spadek ciśnienia w autoklawie; karboksylowanie jest ukończone.
W celu przegrupowania fenylowęglanu sodowego na salicylan sodowy, autoklaw ogrzewa się do temp. 175oC. Po przegrupowaniu otwiera się zawór łączący autoklaw z chłodnicą i osobnym odbieralnikie i wypuszczaCO2 wraz z pewną ilością nie przereagowanego fenolu. Następnie techniczny produkt karboksylowania rozpuszcza się w gorącej wodzie i przetłacza do kotła, gdzie salicylan sodowy oczyszcza się za pomocąwęgla odbarwiającego. Do roztworu technicznego salicylanu sodowego dodaje się węgla w ilości 1% w stosunku do salicylanu, gotuje się przez wiele godzin pod chłodnicą zwrotną, filtruje i z oczyszczonego roztworuwytrąca kwas salicylowy za pomocą kwasu solnego. Wytrącony kwas salicylowy po odwirowaniu i wysuszeniu oczyszcza się przez sublimację.
Skrócony schemat otrzymywania kwasu acetylosalicylowego
Kwas salicylowy (CH3CO)2O kwas acetylosalicylowy
C6H6 bezw. 80oC
80OC- temp. wrzenia benzenu
krystalizacja 5OC
odwirowanie
przemycie benzenem,
krystalizacja i odwirowanie 3 lub4 razy
suszenie 40oC- niska temp. by nie uległ rozpyleniu
10)Otrzymywanie kwasu izonikotynowego (izoniazydu)
B-pikolina (3-metylopirydyna), i gama-pikolina (4-metylopirydyna), obok 2,6-dwumetylopirydyny, występują w tzw. Frakcji zasad pikolinowych w smole węgla kamiennego.
Zasady pikolinowe poddaje się zemulgowaniu i utlenia nadmanganianem potasowym, dzięki czemu otrzymuje się mieszaninę soli potasowych kwasu nikotynowego i izonikotynowego. Następnie wydziela się obydwa kwasy z mieszaniny poreakcyjnej, filtrując je na gorąco (oddzielenie powstałego w reakcji utleniania MnO2), dokładnie przemywa, potem do filtratu dodaje kwasu solnego (reakcją słabo alkaliczna) i zagęszcza w wyparkach. Po zagęszczeniu roztwór powtórnie zadaje się kwasem solnym i poddaje frakcyjnej krystalizacji. Wykorzystuje się różną rozpuszczalność kwasu nikotynowego i izonikotynowego w wodzie i etanolu.
Hydrazyd kwasu izonikotynowego otrzymuje się przez estryfikacje kwasu izonikotynowego i kolejne hydrazowanie. Wcelu otrzymania estru kwasu izonikotynowego ogrzewa się z chlorkiem tionylu, nadmiar odczynnika oddestylowuje, do pozostałości w reaktorze dodaje alkoholu i ogrzewa w temperaturze wrzenia przez godzinę. Następnie mieszaninę schładza się, zadaje wodą, alkalizuje NaOH i ekstrahuje benzenem. Ester etylowy kwasu izonikotynowego otrzymuje się przez oddestylowanie benzenu pod zwykłym ciśnieniem, a następnie przez destylację przy ciśnieniu15 mm w temp. 105-107oC.
Otrzymany ester rozpuszcza się w etanolu, dodaje wodzianu hydrazyny(80%) i ogrzewa, mieszając przez godzinę. Przez krystalizację z etanolu otrzymuje się preparat.
Wyszukiwarka
Podobne podstrony:
SYNTEZA ĆW.5, Ćwiczenia
SYNTEZA- ĆW. 4, Ćwiczenia
ściąga- ĆW.3, Ćwiczenia
KOZ (Cw) Cwiczenie 10 Przyk A3 id 249078
mikro ćw 6, Ćwiczenie 6: Metabolizm bakterii - odżywianie
Epidemiologia Weterynaryjna Ćw ćwiczenie 2 Występowanie chorób w populacji
FiR ćw 1, Ćwiczenia 1 (11.10.09)
Ćw. 1, ĆWICZENIA z Hydrologii st. niestacj. p.rozsz
SYNTEZA ĆW2, Ćwiczenia
konspekt ćw 2, Ćwiczenia
Synteza do ćwiczenia z chemii metaloorganicznej, Chemia
zejscie cw 1, cwiczenie 1
zejscie cw 4, cwiczenie 4
konspekt ćw 4, Ćwiczenia
Ćw. 2, ĆWICZENIA z Hydrologii st. niestacj. p.rozsz
Cw 4, Ćwiczenie nr 1
cw 6, Ćwiczenie 6, Politechnika Koszalińska
cw 1 z, Ćwiczenia 1
więcej podobnych podstron