LABOLATORIUM Z BIOTECHNOLOGII
KINETYKA PROCESÓW FERMENTACYJNYCH
Prowadzący:
dr inż. Celina Kubik
Wykonała:
Karolina Sędkowska
Data wykonania: 14 kwietnia 2008 r.
Ochrona Środowiska
Grupa dziekańska I
Poniedziałek 8.15-12.00
WSTĘP TEORETYCZNY
Kinetyka wzrostu drobnoustrojów jest uwarunkowana zarówno rodzajem drobnoustrojów, dostępnością substratów oraz ilością tlenu, jak i rodzajem procesu. Inaczej przebiega rozwój drobnoustrojów w klasycznym procesie biosyntezy (hodowle okresowe), a inaczej w procesach ciągłych czy półciągłych.
Według klasyfikacji Gadena produkty fermentacyjne podzielono na trzy grupy. Do pierwszej z nich zalicza się produkty syntezowanie podczas wzrostu drobnoustrojów i zanikające w fazie stacjonarnej hodowli. Druga grupa to taka, gdzie gromadzenie produktu jest pośrednio związane ze wzrostem - zachodzi zarówno w komórkach rosnących jak i nierosnących. W trzeciej grupie tworzenie produktu nie jest związane ze wzrostem komórek drobnoustrojów, ma miejsce tylko w komórkach nierozwijających się.
Aby móc wydajnie kierować procesem biosyntez mikrobiologicznej, ważne jest, aby poznać zależność pomiędzy wzrostem szczepu a tworzeniem produktu, fizjologie drobnoustrojów, a także fazowości procesów mikrobiologicznych.
Do badań użyto kwasu cytrynowego wytworzonego przez szczep Aspergillus niger oraz dekstranazy powstałej w wyniku hodowli szczepu Penicillium funiculosum.
Kwas cytrynowy występuje w niewielkich ilościach w większości organizmów żywych, gdyż spełnia ważną rolę w ich metabolizmie - jest ważnym produktem przejściowym w cyklu Krebsa. W większych ilościach występuje w niektórych owocach, np. w cytrynach, w których stanowi nawet do 8% suchej masy. Kwas cytrynowy jest używany jako regulator kwasowości i przeciwutleniacz w przemyśle spożywczym. Sole kwasu cytrynowego - cytryniany - są stosowane jako leki przy niedoborze określonego metalu w organizmie.
Dekstran to polimer glukozy połączonej głównie wiązaniami α-1,6-D-glikozydowymi. Wytwarzany jest przez bakterie kwasu mlekowego. Ma wysoki ciężar cząsteczkowy i jest rozpuszczalny w wodzie. Stosuje się go jako płyn krwiozastępczy. W technologii żywności można by stosować go jako zagęstnik, dzięki któremu można uzyskać półstałą konsystencję produktów. Dekstran nie jest jednak dopuszczony przez FAO/WHO jako dodatek do żywności. Stanowi surowiec do produkcji materiałów chromatograficznych, tzw. żeli dekstranowych. Bakterie zasilające przewód pokarmowy człowieka i zwierząt są zdolne do rozkładu dekstranu, co powoduje szybki wzrost zawartości cukru we krwi oraz glikogenu w wątrobie.
CEL ĆWICZENIA
Celem ćwiczenia jest poznanie relacji między wzrostem drobnoustrojów a tworzeniem produktów na przykładzie dwóch procesów biotechnologicznych: biosyntezy kwasu cytrynowego przez Aspergillus Niger oraz dekstranazy przez Penicillium funiculosum.
WYKONANIE ĆWICZENIA
Oznaczenie suchej masy grzybni (Aspergillus Niger i Penicillium funiculosum).
25 ml wyrośniętej, wgłębnej grzybni oddzielono od podłoża na lejku Büchnera, używając do tego celu bibuły filtracyjnej. Następnie pozostałość na lejku przemyto acetonem i wysuszono w suszarce. Suchą masę grzybni zważono przy pomocy wagi analitycznej. Ilość biomasy podano w gramach na 1000 ml płynu pohodowlanego. W tym celu masę odczytaną z wagi pomnożono razy 40. Wyniki przedstawia tabela 1.
Tabela 1. Ilość biomasy w zależności od czasu hodowli.
Doba |
Biomasa [g/l] |
|
|
Aspergillus Niger |
Penicillium funiculosum |
2 |
4,7 |
4,5 |
3 |
4,1 |
7,8 |
4 |
5,5 |
4,0 |
5 |
- |
2,7 |
6 |
5,9 |
3,1 |
7 |
5,1 |
- |
Oznaczenie kwasowości ogólnej przesączu (Aspergillus Niger)
Pobrano po 2 ml przesączu po oddzieleniu grzybni Aspergillus Niger i miareczkowano 0,1 n roztworem wodorotlenku sodu w obecności fenoloftaleiny. 1 cm3 0,1 n NaOH użytego do miareczkowania przesączu odpowiada 0,0064 g kwasu cytrynowego.
Przykładowe obliczenie dla przesączu po 2 godzinach hodowli:
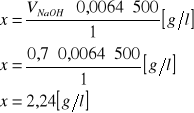
gdzie:
x - masa wytworzonego kwasu cytrynowego, [g / l];
VNaOH - objętość 0,1 n NaOH użytego do miareczkowania 2 ml przesączu, [ml];
500 - przeliczenie na masę kwasu cytrynowego w 1000 ml płynu po hodowli.
Pozostałe obliczenia dla kwasu cytrynowego wykonano w analogiczny sposób. Wyniki zestawiono w tabeli 2.
Tabela 2. Ilość otrzymanego kwasu cytrynowego z hodowli Aspergillus niger zależnie od czasu hodowli.
Doba |
Kwas cytrynowy [g / l] |
||||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
Średnia |
2 |
2,2 |
2,1 |
2,2 |
1,6 |
1,9 |
2,6 |
1,9 |
2,2 |
2,1 |
3 |
8,6 |
- |
8,3 |
8,3 |
8,3 |
6,4 |
7,7 |
8,6 |
8,0 |
4 |
10,9 |
8,8 |
9,0 |
11,2 |
9,3 |
10,2 |
10,0 |
9,2 |
9,8 |
5 |
18,2 |
15,3 |
16,6 |
18,2 |
16,3 |
16,0 |
18,6 |
15,7 |
16,9 |
6 |
33,0 |
30,6 |
30,7 |
31,7 |
30,4 |
33,6 |
31,0 |
29,9 |
31,4 |
7 |
35,2 |
32,2 |
36,5 |
34,9 |
33,6 |
33,9 |
33,6 |
32,5 |
34,1 |
Rysunek 1. Zmiany stężenia biomasy Aspergillus niger oraz zmiany stężenia kwasu cytrynowego w ciągu 7 dni hodowli.
Rysunek 2. Zmiany stężenia biomasy Aspergillus niger oraz zmiany stężenia kwasu cytrynowego w kolejnych dobach hodowli.
Oznaczenie aktywności dekstranazy (Penicillium funiculosum).
Oznaczenie aktywności dekstranazy rozpoczęto od wykonania rozcieńczeń przesączu po oddzieleniu biomasy Penicillium funiculosum.
Tabela 3. Wartości rozcieńczeń cieczy pohodowlanej w zależności od czasu hodowli szczepu Penicillium funiculosum.
Doba |
Rozcieńczenie |
2 |
200 |
3 |
400 |
4 |
400 |
5 |
600 |
6 |
600 |
Do probówek wprowadzono po 0,5 ml roztworu dekstranu 110 oraz 0,5 ml odpowiednio rozcieńczonej cieczy pohodowlanej. Reakcję prowadzono w temperaturze 45 0C przez dokładni 10 minut. Po upływie tego czasu do mieszaniny reakcyjnej wprowadzono 1 ml odczynnika miedziowego i umieszczono całość na kolejne 10 minut we wrzącej łaźni wodnej. Następnie roztwory schłodzono i dodano po 1 ml odczynnika Nelsona. Barwne mieszaniny rozcieńczono zależnie od intensywności barwy (dopełniano do 10 ml, 25 ml lub 50 ml objętości). W między czasie wykonano próbę kontrolną, analogicznie jak próby właściwe, lecz zamiast cieczy pohodowlanej w probówce umieszczono 0,5 ml wody destylowanej. Absorbancję zmierzono przy długości fali 520 nm wobec próby kontrolnej.
Na podstawie krzywej wzorcowej obliczono ilość μg izomaltozy w 1 ml badanego roztworu. Przykładowe obliczenie dla roztworu, który zawierał ciecz po 2 dobach hodowli szczepu Penicillium funiculosum:
0,1 - 325 [μg/ml]
0,01 - A [μg/ml]
A = 32,5 [μg/ml]
Dalej obliczono aktywność dekstranazy korzystając ze wzoru:
![]()
gdzie:
X - aktywność dekstranazy, [J/ml];
A - ilość μg izomaltozy w 1 ml badanego roztworu, odczytana z krzywej wzorcowej, [μg/ml];
2 - rozcieńczenie enzymu w mieszaninie reakcyjnej;
R - rozcieńczenie cieczy pohodowlanej;
342 - mikromol izomaltozy;
10 - czas trwania reakcji enzymatycznej, [min].
Za 1 jednostkę dekstranazy (1 J) przyjmuje się ilość enzymu, która z dekstranu 110 uwalnia cukry redukujące w ilości równoważnej jednemu mikromolowi izomaltozy w ciągu 1 minuty, w temperaturze 50 0C, w pH 5,4.
Przykładowo:
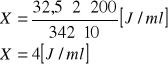
Pozostałe obliczenia wykonano w analogiczny sposób. Wyniki zestawiono w tabeli 4.
Tabela 4. Aktywność dekstranazy w zależności od czasu hodowli szczepu Penicillium funiculosum.
Doba |
Aktywność dekstranazy [J/ml] |
||||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
Średnia |
2 |
- |
- |
- |
3,8 |
58,9 |
- |
- |
11,4 |
24,7 |
3 |
- |
- |
- |
136,8 |
87,4 |
- |
- |
159,6 |
127,9 |
4 |
- |
- |
- |
129,2 |
106,4 |
- |
- |
136,8 |
124,1 |
5 |
- |
- |
- |
171,1 |
125,4 |
- |
- |
199,6 |
165,4 |
6 |
- |
- |
- |
205,3 |
193,7 |
- |
- |
153,9 |
184,3 |
Rysunek 3.Zmiany stężenia biomasy Penicillium funiculosum oraz zmiany stężenia kwasu cytrynowego w ciągu 7 dni hodowli.
Rysunek 4.Zmiany stężenia biomasy Penicillium funiculosum oraz zmiany stężenia kwasu cytrynowego w kolejnych dobach hodowli.
WNIOSKI
Patrząc na Rysunek 1 oraz Rysunek 3 zauważyć można, że tworzenie produktu ma miejsce zarówno podczas namnażania się komórek drobnoustrojów jak i wówczas, kiedy wzrost biomasy ustabilizuje się. Dotyczy to zarówno hodowli szczepu Aspergillus niger jak i Penicillium funiculosum. Zgodnie z tym stwierdzeniem badane procesy biosyntezy zaliczyć należy do drugiej grupy według klasyfikacji Gadena. Porównując te obserwacje z danymi literaturowymi obserwuje się błędną analizę w stosunku do produkcji dekstranazy - powszechnie zaliczana jest ona do trzeciej grupy Gadena.
W hodowli Penicillium funiculosum obserwuje się maksymalne stężenie biomasy w trzeciej dobie trwania procesu (Rysunek 3). Patrząc na dynamikę wzrostu biomasy Aspergillus niger (Rysunek 1) nie dostrzega się takiego maksimum - stężenie biomasy wzrasta w tym przypadku podczas trwania całego procesu.
Obserwując Rysunek 2 i Rysunek 4 wnioskuje się, że maksymalny przyrost biomasy Aspergillus niger oraz Penicillium funiculosum ma miejsce od początku trwania hodowli do drugiej doby, a następnie przyrost ten maleje. Produkcja kwasu cytrynowego jest najbardziej wydajna w szóstej dobie biosyntezy, a produkcja dekstranazy w trzeciej.
9
Wyszukiwarka
Podobne podstrony:
Otrzymywanie i analiza brzeczki laboratoryjnej, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, PROCESY FERMENTA
Wykonanie wiczenia, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, PROCESY FERMENTACYJNE
moj spirytus, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, PROCESY FERMENTACYJNE
Data, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, PROCESY FERMENTACYJNE
Wino kozub, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, PROCESY FERMENTACYJNE
szpirytus, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, PROCESY FERMENTACYJNE
tabelka, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, PROCESY FERMENTACYJNE
Zad 4 (Biosynteza proteinaz bakteryjnych w fermentorach), BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, BIOTEC
sprawko- biosynteza proteinaz bakteryjnych w fermentatorach, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, BIO
FermentacjaBeztlenowa, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, BIOTECHNOLOGIA ŚRODOWISKA
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
obliczenia i wnioski, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
enzymologia 11-15, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, ENZYMOLOGIA
konsp15, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
konspekt 53, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
wykład4 Systemowe zarządanie wg. PN-18001, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, ZARZĄDZANIE BEZPIECZE
więcej podobnych podstron