0000004 7

e) asymetrii kompleksu E-S w przypadku symetrycznych substratów.
Większość enzymów wykazuje tzw. specyficzność grupową, tzn. że mogą one wykorzystywać w charakterze substratu pewną grupę podobnych do siebie substancji. Na przykład oksydaza aminokwasowa katalizuje oksydacyjną deaminację wielu aminokwasów, a heksokinaza katalizuje z udziałem ATP fosforylację wielu aldoheksoz, np. glukozy i mannozy. Są jednak znane enzymy zdolne do przyspieszania reakcji wyłącznie jednego substratu. Na przykład oksydaza glukozowa katalizuje utlenienie jedynie /1-D-glukopiranozy, a ureaza — tylko hydrolizę mocznika. Te enzymy są określane jako enzymy mające absolutną specyficzność substratową.
Grupa enzymów wykazujących specyficzność względem określonego typu reakcji ma najmniejsze wymagania odnośnie charakteru substratu. Są znane np. esterazy, czyli enzymy katalizujące rozkład wiązania estrowego, do działania których jest istotna wyłącznie obecność tego wiązania w cząsteczce, natomiast nie odgrywa większej roli rodzaj kwasu i alkoholu. Do takich enzymów należą lipazy, które katalizują hydrolizę wiązania estrowego w dowolnych tłuszczach, ale mogą rozkładać również estry innych alkoholi niż glicerol. Nieco bardziej zawężona jest specyficzność niektórych fosfomonoesteraz (fosfataz), które katalizują rozpad estrów fosforanowych, bez względu na rodzaj związanego z kwasem fosforowym alkoholu. Do tej grupy należy również specyficzność wielu peptydaz, które katalizują hydrolizę określonego rodzaju wiązań peptydowych w dowolnym białku (np. rozkład wiązania między grupą NH2 lizyny lub argininy i COOH tyrozyny, przy udziale trypsyny, str. 202).
Enzymy wykazują również specyficzność przestrzen-n ą, czyli stereospecyficzność. Właściwość stereospecyficzności polega na tym, że substrat musi mieć odpowiednią konfigurację przestrzenną, pasującą do układu przestrzennego tzw. punktów zaczepienia, czyli miejsc przyłączenia substratu do centrum aktywnego enzymu. Tylko w tym przypadku może nastąpić wytworzenie kompleksu enzym-sub-strat, który będzie zdolny do dalszego przekształceni^ według reakcji 5-3. Na przykład oksydaza L-aminokwasowa nie katalizuje przemian D-aminokwasów i odwrotnie, a wspomniana oksydaza glukozowa katalizuje utlenianie tylko /5-D-glukopiranozy. Znane są również enzymy, wykazujące specyficzność w stosunku do jednej z form geometrycznych. Na przykład hydroliaza jabłczanu przyspiesza reakcję przyłączenia cząsteczki wody tylko do fumaranu, a więc formy trans, a jest nieaktywna w stosunku do formy cis, czyli maleinianu
H C00~
V/
\ ~000/ XH
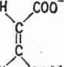
H C00'
mleinian
XIX
fumaran
105
Wyszukiwarka
Podobne podstrony:
0000003 3 jakim może podlegać substrat wchodzący z nim w kompleks. W przypadku, gdy jeden substrat m
Koenzymy Większość enzymów katalizuje przemiany substratów jedynie w obecności niebiałkowych
IMAG0353 (6) Specyficzność substratowa absolutna - enzym może utworzyć kompleks wyłącznie z jednym s
CCF20110129�018 ~x) imiirin ouczynmk kompleksujjjcy, w przypadku gdy o/nm .nmy kationy meiu w posta
Podział na klasy równoważności (8) projektowanie przypadków testowych dla większej liczby podziałów
m16 jn Mcłąfbry w naszym życiu Tak jak w przypadku metafor orientacyjnych, w większości tych wyrażeń
Zdjęcie0160 Reakcje większości enzymów opisuje równanie Michaellsa-Menten: szybkość maksymalna szybk
Zdjęcie0181 Temperatura wpływa na aktywność enzymów Dla większości enzymów można określić tzw optimu
Zdjęcie0184 Dla każdego enzymu istnieje optymalne pH Dla większości enzymów można określić pewne opt
DSC04150 W zależności od symetrii nukleokapsydu większość wirusów podzielono na dwie grupy: wirusy o
DSC00469 (10) »plrl 5,0-8,0) j iS*i ramii i substratów • spienia enzymów •temperatury
DSCF5295 Z. Jasińska i rzeczywiste. We wszystkich tych przypadkach wartość potencjalna w większym ^
1$5 W przypadku pryzmatu im większa jest energia fotonów tworzących wiązkę (krótsza długość fali)&nb
86111 WYKŁAD 2 enzymy cz 1 (29) WPŁYW pH NA SZYBKOSC REAKCJI ENZYMATYCZNEJ Większość enzymów funk
więcej podobnych podstron