19264 skanuj0066 (14)

128 8. Równownąl Jonowo w rozcieńczonych roztworach wodnych
pH--log3,420-IO-'-3,47
c
HCO
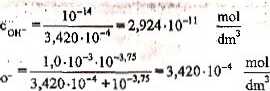
mol
CHOOOH
dm3
WERYFIKACJA ZAŁOŻENIA UPRASZCZAJĄCEGO
Należy sprawdzić wartość stosunku jonów oksoniowych do wodorotlenkowych:

coh- 2.924-10"
Jak widać, założenie upraszczające (2.8) jest słuszne.
Obliczone wartości stężeń cHj(),, cncoo" coir P°<ls,*wia do równania bilansu ładunków (2.5):
lewa strona bilansu L=3,420-10"4 + 2,924-10"11 = 3,420-MT4,
prawa strona bilansu* P*= 3,420-10^.----------------------
Stężenie jonów wodorotlenkowych jest znacznie niniejsze od stężeń pozostałych składników (L - P). Założenie (2.9) nie wpływa na dokładność wyników.
Odpowiedź
W roztworze kwasu mrówkowego o stężeniu formalnym c = l*l(T* mol/dm3 stężenia poszczególnych składników wynoszą: " 55,34 mol/dm1, c,IC00H ■
6,578-lff4 mol/dm’, cHC0O. = 3>420-l(T‘'SoVdmV ^H- = 2,924-HT" mol/dm’, c - 3,420' 10- mol/dm5, pH =■ 3,47.
tljO
Przykład 3
Obliczyć stężenia równowagowe wszystkich składników wodnego roztworu .amoniaku (NHj) o stężeniu c = 0,06 mol/dm3.
Kw-1.010^, K*=l,81<r5.
MODEL STBCHIOMETRYCZNY
Amoniak w roztworze wodnym ulega reakcji protolizy. Ponieważ jest słabym elektrolitem, proces ten przebiega niecałkowicie i w roztworze ustala się równowaga:
NHa+HjO NHj* + OH- (3.1)
Równocześnie ustala się stan równowagi reakcji autoprotolizy wody:
2H2O ** HjO* + OH" (3.2)
Składniki roztworu: jony NH|*» HjOł, OH", cząsteczki nkzdysocj cwanego NHj iHjO.
MODEL MATEMATYCZNY Opis równowagi
Równowagę reakcji protolizy amoniaku opisuje stała protolizy K* wyrażona wzorem (patrz równanie (18)):
Kb=*Cwt C°H~ , (33) '
°W|
natomiast równowagę reakcji autoprotolizy wody - iloczyn jonowy wody Kw równanie (9):
_____________ _____________ (3.4)
Bilans materiałowy. Amoniak występuje w roztworze w postaci niezdysocjo-wanej NHj 1 zdysocjowanej NH4*. Stężenie formalne amoniaku można wyrazić jako sumę stężeć :
C”CNK, +Cn„J OS)
Przyjęto, że stężenie wody jest stałe i wynosi cHj0 “ 5534 mol/dm\
-Bilans ładunków. Zgodnie z równaniem (1): -»■*
CH« +cH^“°c»r M
Ostatecznie model matematyczny stanowi układ równań (3.3) + (3.6).
Ocena kompletności modela matematycznego. Model matematyczny wiąże w czterech niezależnych liniowo równaniach siedem wielkości: K* Kw, c, c^.,
chh| » 6oh* * cmh, » z których trzy pierwsze stanowią dane, a dalsze cztery niewiadome. Model matematyczny jest kompletny.
Wyszukiwarka
Podobne podstrony:
19264 skanuj0066 (14) 128 8. Równownąl Jonowo w rozcieńczonych roztworach
skanuj0066 (14) 128 8. Równownąl Jonowo w rozcieńczonych roztworach
50054 skanuj0082 (12) 160 5. Równowagi Jonowo yy rozcieńczonych roztworach wodnych Odpowiedź . Skład
skanuj0064 (16) 5. Równowagi jonowe w rozcieńczonych roztworach wodnych prawa strona bilansu P = cHj
skanuj0058 2 114 S. Równowagi joiwre w rozcieńczonych roztworach wodnych znanych jest kilka innych,
skanuj0060 2 118 5. Równowagi .tonowe w rozcieńczonych roztworach wodnychK, SOL Iloczyn
skanuj0061 2 na 5. Równowiigl jonowe w rozcieńczonych roztworach wodnych Ml* <V Bocływ
skanuj0073 142 5. Równowagi Jonowe w rozcieńczonych roztworach wodnjcŁ Stąd stężenie formalne roztwo
skanuj0083 162 5. Równowag jonowe w rozcieńczonych roztwoiii^ wodnych 162 5. Równowag jonowe w rozci
skanuj0091 178 5. Równowagi jonowy w rozcieńczonych roztworach wodnych Bilans materiałowy W rozpatry
skanuj0093 - 182 5. Równowagi jonowe w rozcieńczonych roztworach wodnych - 182 5. Równowagi jonowe w
skanuj0095 186 S. Równowagi jonowe w rozcieńczonych roztworach wodnych Ks = cscs(cs+c)
skanuj0102 2 200 5. Równowag jonowe w rozcieńczonych roztworach wodnych 22. Oblicz
skanuj0062 (16) 120 5. Równowagi Jonowe w rozclortesonych roztworach wodnych5.1. Roztwory mocnych kw
66962 skanuj0071 (15) 138 5. Równowagi jonowe w rozcieńczonych rortworath wpfrffŁ UPROSZCZONY MODEL
więcej podobnych podstron