10670189x5432704831476U05956075151962700 n

VII. Reakcje w roztworach wodnych
Rozwiązanie
Należy pamiętać, ie do grupy elektrolitów należą rozpuszczalne w wodzie zwlątit w organiczne o charakterze kwasu, wodorotlenku lub soli.
/.wiązki organiczne to nicclektrolity za wyjątkiem kwasów kat boksytowych 1 !*♦»
HjS - nieorganiczny kwas, elektrolit
N: - substancja nic należy do kwasów, wodorotlenków lub soli. niecicktmlll
CH,-związek organiczny, mcelrktrolit
CH,COOH - organiczny kwas. elektrolit
AJCJ(- nieorganiczna, rozpuszczalna w wodzie sól. elektrolit
KOH - wodorotlenek rozpuszczalny w wodzie, elektrolit
C6H, - związek organiczny, nicclcktiolit
ZnCO( - nierozpuszczalna w wodzie sól. nieelekrrolit
Zadanie 2
Zapisz równania trakcji dysocjacji elektrolitycznej następujących substancji: lNII(N(i H.SO,. Mg(OII)., FcCIj, H;CO,, Na,S.AlJ(SOł)1, K.CO,
Rozwiązanie:
I II
(NIIł),S04 2NH/ + SO.”
H,SO,—► 2H* + SO,*
MgCOH),--^- ► Mg” » 20H FeCl, "**-» Fe” + 2CI 2H* t CO,*
Na.S 2Na‘ + Sł
AIjCSOj),—51^—► 2Al” ł 3S04*
KsCO ► 2K+CO”
Zadanie 3
Zapisz równania dysocjacji stopniowej oraz równanie sumaryczne dysocjacji dla k*« su H,PO,.
. ■l^ianln
trapie dysocjacji odrywa się jeden kation wodorowy.
IU'nł~iL-* H* + H,POł H,h>. H' + hpo;
h* + po4
»-
stronami tr/.y równania (substraty + substracy, produkty ♦ produkty |P pliHiimtjąc identyczne jony po obu stronach równania) otrzymujemy równanie Ipar «nne
4
II |*o, 3H* + PO.
3. Moc elektrolitu
Ifcfal) ołKtnośd jonów, roztwory elektrolitów mają zdolność przewodzenia prądu dek-Hkttr^o Między innymi od rodzaju elektrolitu zaleź)', czy pr/cwodnktwo jego roztwo-■ hądrk' lepsze lub gorsze. Przewodnictwo roztworu jest tym wyższe, im więcej nośni-h-lnl miku, w tym przypadku jonów znajduje się w roztworze. To oznacza, że nic za-■p wszystkie wprowadzone do wody cząsteczki elektrolitu rozpadają się na jony. część ń uli |i może pozostać w formie niezdysocjonowanej. Elektrolity ulegające w dużym stop f|| i ni jacji elektrolitycznej, to znaczy ich roztwory nic zawierają cząsteczek niczdyso-aiUllow anych lub zawierają ich bardzo niewiele, nazywamy elektrolitami mocnymi. Na-i, i.li. nich niektóre kwasy: HCl.(. HBr , HNOy H,SO„. 1 lCIOt. wodorotlenki litow-I liny łowców z wyjątkiem Ba(OI Mg(OH), oraz sole. Elektrolity, które ulegają J,.... j.t> n elektrolitycznej w niewielkim stopniu, to znaczy ich roztwory oprócz jonów ||płr'.iią dużą ilość cząsteczek niezdysocjonowanych nazywamy elektrolitami słaby-m.I Należą do nich między innymi kwasy, na przykład: H.S^. H;SOs. HNO,. HjCO,. |ł W), oraz wiele kwasów organicznych.

Murą mocy elekt ml nów jat ttopień dyvocj»cji u Jcu to «to*unck lii /hy cząsteczek. l.iiWc uległy dysocjzep elektrolitycznej do ogólnc| liczby crąucoek elektrolitu wprowa-ibunych do roztworu.
Można gD przedstawić wrotem.
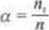
gdzie
a - Mopteń dysocjacji
169
Wyszukiwarka
Podobne podstrony:
10670189x5432704831476U05956075151962700 n VII. Reakcje w roztworach wodnych Rozwiązanie: Należy pam
10606602x5432691498144e13786858984941424 n VII. Reakcje w roztworach wodnych2. Dysocjacja kwasów, za
10606602x5432691498144e13786858984941424 n VII. Reakcje w roztworach wodnych2. Dysocjacja kwasów, za
0000012 Kopia Reakcje w roztworach wodnych Zadanie 567 (2pkt) Jakiej objętości roztworu kwasu soln
skanowanie0026 2 4.1.4. Wodne roztwory kwasów, zasad i soli. Reakcje w roztworach wodnych. Arkusz
IMAG0387 (3) IS]+KU Zaproponowany mechanizm reakcji (w roztworach wodnych) ki
Chemia0023 Reakcje w roztworach wodnych Zadanie nr 1 W t dm,3 wodnego roztworu wodorotlenku wapnia s
1 Reakcje w roztworach wodnych Woda jako środowisko reakcji jest tak powszechna, ze właściwie zapomi
0000001 Kopia Reakcje w roztworach wodnychStała i stopień dysocjacji; odczyny wodnych roztworów Za
Reakcje w roztworach wodnych wartość iloczynu stężeń jonów w tych układach zmieniła się i wynosiła:
Reakcje w roztworach wodnych Zadanie 745 (3 pkL) Iloczyn rozpuszczalności CaS04: Ir CaS04 = [Ca2+] [
więcej podobnych podstron