316 [1024x768]

325
WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW
Kation H+ po zaadsorbowaniu na powierzchni elektrody, zostaje zobojętniony (zredukowany) przez elektron z powierzchni metalicznej katody (Pt). Zaadsorbowany na powierzchni anody anion Cl- zostaje pozbawiony elektronu (utleniony): elektron ten obwodem zewnętrznym (rys. 5.2), pod postacią prądu elektrycznego, płynie do katody, aby tam wziąć udział w redukcji następnego kationu H+. Siłą napędową tej „pompy elektronowej” jest oczywiście napięcie zewnętrzne z akumulatora.
Gdyby gromadzić produkty elektrolizy (H2 i Cl2), to wydzielone na elektrodach masy tych pierwiastków, potwierdziłyby stosowalność znanych praw Faradaya:
I. Masa substancji wydzielonej na elektrodzie jest proporcjonalna do natę- Prawa żenią prądu I (A) i do czasu elektrolizy t (s): Faraday^
m = k- /• / = k- q (5.11)
II. Masy substancji wydzielonych na elektrodach przez ten sam ładunek mają się do siebie jak ich gramorównowaźniki:
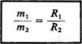
Z praw elektrolizy Faradaya wynika, że do wydzielenia jednego gramorówno-ważnika dowolnej substancji potrzeba takiego samego ładunku. Ładunek ten nosi nazwę stałej Faradaya i wynosi:
Stała
Faradaya
F = 96 500 kulombów
Wstawiając tę wartość do równania (5.11) w miejsce ładunku q, a w miejsce masy m, masę 1 gramorównoważnika m — ~ , otrzymujemy
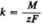
a stąd
M
zF
U
(5.13)
W równaniu tym M oznacza masę atomową wydzielanej substancji, zaś z — jej wartościowość.
Wyszukiwarka
Podobne podstrony:
314 [1024x768] 323 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW po rozpuszczeniu kryształu w wodzie mogłoby do
308 [1024x768] 317 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Tabela 5.1 Przewodnictwa równoważnikowe wodnyc
310 [1024x768] 31* WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓWTeoria dysocjacji elektrolitycznej Początki wsp
312 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 321 Zatem współczynnik izotermiczny van’t Hoffa wy
320 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 329 przestrzeni środkowej, a stąd do przestrzeni k
322 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW W równaniu tym liczby przenoszenia /J i /£ są wart
324 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 333 zakrcskowaną płaszczyznę na rys. 5.4. W ciągu
402 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW (OH-)-
272 [1024x768] 281 WŁAŚCIWOŚCI ROZTWORÓW W roztworze określa potencjał chemiczny d
278 [1024x768] 287 WŁAŚCIWOŚCI ROZTWORÓW Tabela 4.2 Slałe kriometryczne kjekfórych
80525 skan0262 6. Elektrochemia Właściwości roztworów elektrolitów różnią się od właściwości roztwor
342 [1024x768] Teoria przewodnictwa roztworów elektrolitów Debye’a-Hiickela-Onsagera opracowana
344 [1024x768] TEORIA PRZEWODNICTWA ROZTWORÓW ELEKTROLITÓW 353 (5.68) Elok =» £ł,.J+£Ml Występujące
346 [1024x768] TEORIA PRZEWODNICTWA ROZTWORÓW ELEKTROLITÓW 355 wykonuje tylko bardzo niewielkie drga
395 [1024x768] Niektóre równowagi w roztworach elektrolitówRównowagi dysocjacji Dysocjację prostych
396 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW 405 « 10" 5. W tym przypadku można
406 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW 41$ Tabela 5.8 Skład typowych roztworów
więcej podobnych podstron