322 [1024x768]
WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW
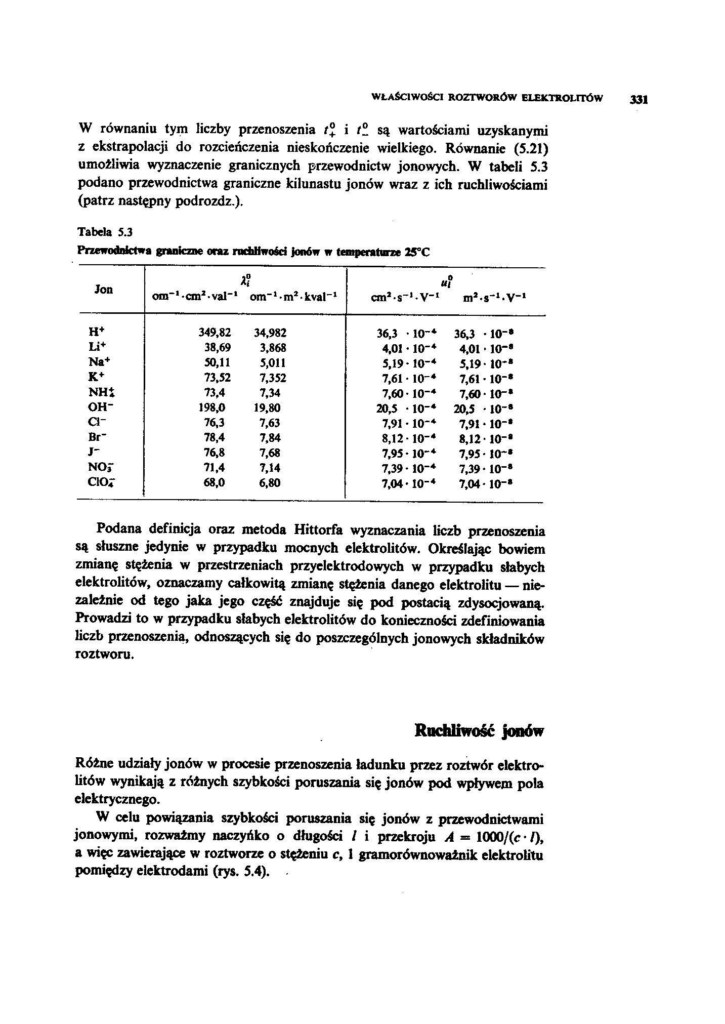
W równaniu tym liczby przenoszenia /J i /£ są wartościami uzyskanymi z ekstrapolacji do rozcieńczenia nieskończenie wielkiego. Równanie (5.21) umożliwia wyznaczenie granicznych przewodnictw jonowych. W tabeli 5.3 podano przewodnictwa graniczne kilunastu jonów wraz z ich ruchliwościami (patrz następny podrozdz.).
Tabel* 53
Przewodnictwa graniczne onu rochHwośd Jonów w temperaturze 2S°C
|
Jon |
om"' ■anł-val-ł |
i? om“>młkval_ł |
»v- |
Ul 1 mJ- | ||
|
H* |
349,82 |
34,982 |
36.3 |
10- |
36.3 |
io-• |
|
Li* |
38,69 |
3,868 |
4.01 |
10" |
4,01 |
10-* |
|
Na* |
30,11 |
5,011 |
5.19 |
io- |
5.19 |
io*' |
|
K* |
73,52 |
7,352 |
7,61 |
io- |
7,61 |
10-* |
|
NH1 |
73.4 |
7.34 |
7,60 |
io- |
7,60 |
10-* |
|
OH- |
198,0 |
19,80 |
20,5 |
10- |
20.5 |
10-» |
|
ci- |
76,3 |
7,63 |
7,91 |
10- |
7,91 |
10-* |
|
Br- |
78,4 |
7,84 |
8.12 |
10- |
8,12 |
10-• |
|
J" |
76,8 |
7,68 |
7.95 |
10- |
7,95 |
10-« |
|
NO," |
71.4 |
7.14 |
7.39 |
10- |
7.39 |
10-• |
|
ao; |
68,0 |
6,80 |
7,04 |
10- |
7,04 |
10-* |
|
Podana definicja oraz |
metoda Hittorfa |
wyznaczania |
liczb przenoszenia | |||
są słuszne jedynie w przypadku mocnych elektrolitów. Określając bowiem zmianę stężenia w przestrzeniach przyelektrodowych w przypadku słabych elektrolitów, oznaczamy całkowitą zmianę stężenia danego elektrolitu — niezależnie od tego jaka jego część znajduje się pod postacią zdysocjowaną. Prowadzi to w przypadku słabych elektrolitów do konieczności zdefiniowania liczb przenoszenia, odnoszących się do poszczególnych jonowych składników roztworu.
Ruchliwość jonów
Różne udziały jonów w procesie przenoszenia ładunku przez roztwór elektrolitów wynikają z różnych szybkości poruszania się jonów pod wpływem pola elektrycznego.
W celu powiązania szybkości poruszania się jonów z przewodnictwami jonowymi, rozważmy naczyńko o długości / i przekroju A « 1000/(c • /), a więc zawierające w roztworze o stężeniu c, 1 gramorównoważnik elektrolitu pomiędzy elektrodami (rys. 5.4).
Wyszukiwarka
Podobne podstrony:
312 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 321 Zatem współczynnik izotermiczny van’t Hoffa wy
320 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 329 przestrzeni środkowej, a stąd do przestrzeni k
324 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW 333 zakrcskowaną płaszczyznę na rys. 5.4. W ciągu
308 [1024x768] 317 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Tabela 5.1 Przewodnictwa równoważnikowe wodnyc
310 [1024x768] 31* WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓWTeoria dysocjacji elektrolitycznej Początki wsp
314 [1024x768] 323 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW po rozpuszczeniu kryształu w wodzie mogłoby do
316 [1024x768] 325 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Kation H+ po zaadsorbowaniu na powierzchni ele
318 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW E1ZJLTR0UTÓW 327 Elektroliza wodnego roztworu NaCi jest przykła
404 [1024x768] 413 NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW Z równań tych wynika, ic przy długoś
274 [1024x768] WŁAŚCIWOSO ROZTWORÓW 283 mm Hg. Obliczyć masę cząsteczkową benzaldehydu. Zakładamy, ż
276 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 285 przy czym m2 — masa substancji rozpuszczonej, m, — masa
280 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 289 Obliczmy bracę maksymalną dla procesu przeniesienia I mola
281 [1024x768] 290 ROZTWORY J RÓWNOWAGI FAZOWE W tym przypadku nie ma znaczenia, czy para nad roztwo
282 [1024x768] WŁAŚCIWOŚCI ROZTWORÓW 291 rtijRT ^ m2RT Mty ’ * " /IV 3
80525 skan0262 6. Elektrochemia Właściwości roztworów elektrolitów różnią się od właściwości roztwor
270 [1024x768] Właściwości roztworówTermodynamiczna charakterystyka roztworów Zgodnie z definicją (p
Wektor Poyntinga Jedną z ważnych właściwości fali elektromagnetycznej jest zdolność do przenoszenia
więcej podobnych podstron