Grupa: 23 Zespół: 8 |
Ćwiczenie: 11 |
Data: 10.4.2000. |
1.Kmieć Radosław 2.Trelińska Agnieszka 3.Orzeł Krystyna 4.Prokurat Michał |
Współczynnik podziału Nersta |
Ocena:
|
WSTĘP
Równanie
lub
możemy uważać za wyraz matematycznego sformułowania prawa podziału Nersta. Prawo to można również wyprowadzić na drodze prostych rozważań termodynamicznych, opierając się na twierdzeniu ,że w stanie równowagi potencjały chemiczne substancji rozpuszczonej, w dwóch cieczach praktycznie nie mieszających się ze sobą , muszą być sobie równe. Wyrażając potencjały te w poszczególnych fazach za pomocą aktywności (a) otrzymamy:
oraz
gdzie:
- standardowy potencjał chemiczny,
-potencjał chemiczny substancji rozpuszczonej.
Po porównaniu równań (2) i (3) otrzymamy:
stąd
Biorąc pod uwagę, że w stałej temperaturze = const. możemy opisać, że = const. W przypadku gdy rozważane roztwory są rozcieńczone, aktywność (a) możemy zastąpić stężeniem (c), wówczas = const.
Ponieważ stosunek ten jest jednocześnie równy stosunkowi roztworów nasyconych substancji rozpuszczonej w poszczególnych rozpuszczalnikach , stąd możemy napisać również , że:
=const.
Prawo podziału Nersta jest słuszne nie tylko w odniesieniu do gazów, lecz również w odniesieniu do rozpuszczonych cieczy i ciał stałych.
Jeżeli w rozpuszczalnikach rozpuszczamy równocześnie kilka różnych substancji, wówczas prawo podziału Nersta stosuje się do każdej z nich, niezależnie od obecności innych.
2.CEL ĆWICZENIA.
Celem ćwiczenia jest wyznaczenie współczynnika podziału kwasu benzoesowego między warstwę wodną, a ksylenową .
3.METODA POMIARU.
Dokonujemy odważenia trzech naważek kwasu benzoesowego. Wsypujemy je do kolbek Erlenmayera i do każdej wlewamy 25 cm3 ksylenu. Po rozpuszczeniu do każdej kolbki wlewamy 35 cm wody. Wytrząsamy około 20 minut. Z każdej fazy ksylenowej pobieramy 2 cm3 roztworu, dodajemy 25 cm3 wody, odparowujemy ksylen w czaszy i miareczkujemy na gorąco NaOH wobec fenoloftaleiny. Identycznie postępujemy z fazą wodną z tą różnicą, że pobieramy 5 cm3 roztworu wodnego i miareczkujemy na gorąco.
4.STOSOWANE WZORY.
Jeżeli układ izotermiczno-izobaryczny złożony jest z dwóch nie mieszających się cieczy 1 i 2 to jest on układem dwufazowym, w którym fazę pierwszą stanowi roztwór składnika 2 w 1, a faza druga jest nasyconym roztworem składnika 1 w 2. Jeżeli do jednej z faz wprowadzimy składnik trzeci, to rozpocznie się proces przenoszenia tego składnika przez granicę faz, aż do ustalenia się równowagi termodynamicznej. Stan równowagi zostanie osiągnięty, gdy potencjały chemiczne składnika trzeciego w obu fazach będą jednakowe:
, - aktywności składnika trzeciego w fazach I i II.
Dla realnych stężeń określa się tzw. współczynnik podziału Nersta wyrażony za pomocą stężeń:
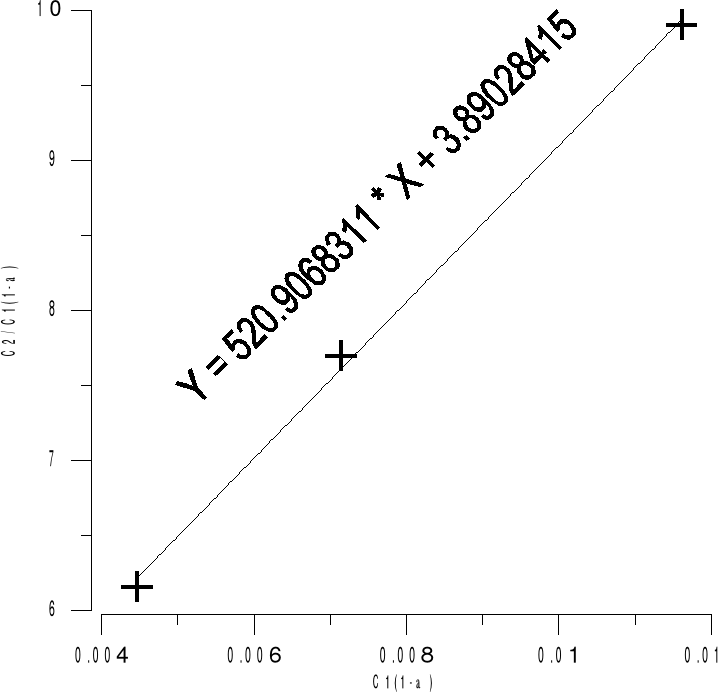
5. WYNIKI POMIARÓW .
Lp. |
C1 |
C2 |
C2/C1 |
C1(1-a) |
C2/ C1(1-a) |
1 |
0.005 |
0.0275 |
5.5 |
0.00446 |
6.1583 |
2 |
0.008 |
0.055 |
6.875 |
0.00714 |
7.6979 |
3 |
0.013 |
0.115 |
8.849 |
0.01161 |
9.9049 |
C1-stężenie kwasu benzoesowego w warstwie wodnej.
C2-stężenie kwasu benzoesowego w warstwie ksylenowej.
A) faza wodna
![]()
K=6,04*10-5
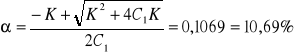
a-stopień dysocjacj
i
B) faza organiczna
2AH=AH2
Z tego wynika:
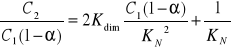
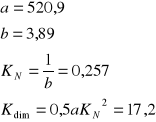
6. WNIOSK
W wyniku doświadczenia otrzymaliśmy KNr=0,257.Świadczy to o tym że kwas benzoesowy rozpuszcza się lepiej w warstwie ksylenowej niż w wodnej.Błąd w przeprowadzonym ćwiczeniu może być spowodowany złym odczytem z biurety , czyli błędem paralaksy oraz nie dokładnym przygotowaniem naważek kwasu benzoesowego.
Poza tym błąd wynika z trudności uchwycenia końcowego punktu miareczkowania.
![]()
Wyszukiwarka
Podobne podstrony:
Wzór sprawozdania analiza ilościowa WSTEP, Imir imim, Semestr 1, Chemia
Wstęp mój druk, UWr Sprawozdania - Pracownie, Pracownia, Pracownia Jądrowa, pj(1), Ćwiczenie 7
Strona tytułowa sprawozdanie, UTP Elektrotechnika, 1 sesmetr, Wstęp do elektrotechniki, Laborki
Wstęp teoretyczny, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i anality
WSTEP, SPRAWOZDANIA czyjeś
Wstęp i dane o nauczycielu, MATERIAŁY DLA NAUCZYCIELI, Dyplomowanie -sprawozdanie
wstęp do sprawozdania(1), AWANS ZAWODOWY(1)
Sprawozdanie Krzysztof Filipek 3D6, Informatyka WEEIA 2010-2015, Semestr III, Wstęp do Techniki Cyfr
wstęp cz 1, UWr Sprawozdania - Pracownie, Pracownia, Pracownia Jądrowa, pj(2), pj, ĆWICZENIE NR 1
Wstęp do systemów SDH(1), SPRAWOZDANIA czyjeś
sprawozdanie 35 wstep, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i ana
Wyznaczanie widma promieniowania g wstep, Sprawozdania - Fizyka
wstęp 29, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizykii, fi
Sprawozdanie 1b, UTP, Semestr I, Labolatorium wstęp do elektrotechniki
Wyznaczanie współ. załamania światła, Pollub MiBM, fizyka sprawozdania
Wstęp pojecia sprawozdanko 4
Wstep 0, Akademia Górniczo - Hutnicza, Technologia Chemiczna, Studia stacjonarne I stopnia, SEMESTR
Wstęp do systemów SDH, SPRAWOZDANIA czyjeś
więcej podobnych podstron