Sprawozdanie z ćwiczenia nr 23
Sprawdzanie praw elektrolizy Faradaya
W cieczach prąd płynie dzięki istnieniu w nich anionów i kationów. Jony te powstają na skutek procesu dysocjacji występującego przy rozpuszczaniu się związków chemicznych. Cieczami przewodzącymi, czyli elektrolitami są na przykład roztwory wodne kwasów, zasad, soli. Nie wszystkie cząsteczki substancji rozpadają się na jony. Wielkością charakteryzującą tan proces jest tzw. Stopień dysocjacji, pod którym kryje się stosunek liczby jonów do liczby wszystkich cząsteczek, które mogą dysocjować.
Większość cieczy zawiera jony i w związku z tym jest przewodnikami. Zjawisko to można obserwować w wannie elektrolitycznej zwanej woltametrem. Do cieczy zanurza się dwie elektrody dołączając je do źródła napięcia. Mierząc prąd przepływający przez elektrolit w funkcji przyłożonego napięcia, można stwierdzić proporcjonalność tych wielkości, a w związku z tym do elektrolitów stosuje się prawo Ohma.
Elektrody woltametru dołączone do zacisków źródła nazywają się odpowiednio dodatnia anodą, ujemna anodą. Nośniki prądu - jony dodatnie - kationy, ujemne aniony.
Linie sił pola elektrycznego, które tworzy się między elektrodami po doprowadzeniu do nich napięcia skierowane są od anody do katody. Po dojściu do elektrod jony się neutralizują, stąd na elektrodach gromadzą się czyste pod względem chemicznym pierwiastki i na tym zjawisku oparte są praktyczne zastosowania elektrolizy np. do pokrywania metalu warstwą innego metalu.
Pierwsze prawo Faradaya:
Masa wydzielonej substancji jest proporcjonalne do ładunku, jaki przepływa przez elektrolit.
![]()
Drugie prawo Faradaya:
Równoważniki elektrochemiczne pierwiastków są proporcjonalne do ich równoważników chemicznych.
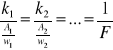
k - równoważnik elektrochemiczny
A - masa atomowa
w - wartościowość pierwiastka
Obliczenia i rachunek błędów:
ACu=63,546
![]()
![]()
![]()
![]()
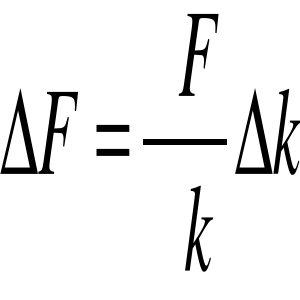
![]()
Imię i nazwisko
I TD, gr. Lab.
Data
Wyszukiwarka
Podobne podstrony:
SPRAWOZDANIE Z CWICZENIA NR 4, Technologia zywnosci, semestr III, chemia zywnosci
Sprawozdanie z ćwiczenia nr 2(transformator), Studia, AAAASEMIII, 3. semestr, Elektrotechnika II, Pa
Sprawozdanie z cwiczenia nr 1 justa
Sprawozdanie z ćwiczenia nr 1
Sprawozdanie z cwiczenia nr 1
Sprawozdanie z cwiczenia nr 9, Część ćwiczeniowa:
maszyny5, SPRAWOZDANIE Z ĆWICZENIA NR
Sprawozdanie ćwiczenie nr 14, Tż, Analiza żywności II, Sprawozdania
Sprawozdanie z ćwiczenia nr 7, PW MEiL, Elektrotechnika 2
maszyny3, SPRAWOZDANIE Z ĆWICZENIA NR
Sprawozdania z fizycznej 1, Refraktometria - nasze, Sprawozdanie z ćwiczenia nr
cwiczenie2, Sprawozdanie z ćwiczenia nr 2
Sprawozdanie z ćwiczenia nr 2
SPRAWOZDANIE Z CWICZENIA NR 2, Technologia zywnosci, semestr III, chemia zywnosci
SPRAWOZDANIE Z CWICZENIA NR 6, Technologia zywnosci, semestr III, chemia zywnosci
wzor-sprawozdania-cwiczenia-nr-4-analiza-tworzyw, Chemia
SPRAWOZDANIE Z ĆWICZENIA NR 2, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania
Sprawozdanie z ćwiczenia nr 4, Studia, AAAASEMIII, 3. semestr, Elektrotechnika II, Pack, Pack
więcej podobnych podstron