1. CZĘŚĆ TEORETYCZNA.
Analizę widmową możemy zdefiniować jako określanie ilościowe i jakościowe składu chemicznego ciał na podstawie widm ich promieniowania (widzialnego, nadfioletowego lub podczerwonego). Widma te powstają na skutek rozszczepienia światła pochodzącego od pobudzonych do świecenia gazów i par metali. Rozszczepienie widma na poszczególne linie widmowe następuje w pryzmacie, dzięki zjawisku dyspersji. Zjawisko to polega na zmianie współczynnika załamania w zależności od długości fali (im mniejsza długość fali, tym większy kąt załamania).
Powstawanie linii widmowych związane jest ze wzbudzeniem elektronów pojedynczych atomów. Jeżeli elektron na skutek wzbudzenia przechodzi ze stanu stacjonarnego na wyższy, to wracając wypromieniuje energię w postaci kwantu (fotonu).
Widma dzielimy ze względu na pochodzenie na widma:
- emisyjne,
- absorpcyjne,
- luminescencyjne.
Ze względu na obraz powstały po rozszczepieniu, widma dzielimy na:
- liniowe,
- pasmowe,
- ciągłe.
1. Widma liniowe zwane też seryjnymi, wysyłane przez pojedyncze atomy danego pierwiastka w stanie gazowym. Układają się one w charakterystyczne serie, które można wyodrębnić w poszczególnych przeplatających się liniach widmowych.
2. Widma pasmowe, charakteryzujące cząsteczki związków chemicznych, a nie pojedyncze atomy. Widma pasowe rozczepione przez przyrząd o szczególnie dużej zdolności rozdzielczej rozpadają się na dużą ilość bardzo bliskich linii widmowych, ułożonych według innych praw niż linie w atomowych widmach seryjnych.
3. Widma ciągłe, obejmujące wszystkie barwy światła od czerwieni do fioletu, charakteryzują rozżarzone ciała stałe i ciekłe oraz gazy pod dużym ciśnieniem. Rozkład natężeń zależy od rodzaju ciała i jego temperatury; im ona jest wyższa, tym bardziej maksimum natężenia w widmie przesuwa się w stronę fal krótkich.
Widmo absorpcyjne możemy zaobserwować gdy na drodze światła o ciągłym rozkładzie umieścimy warstwę gazu lub par metali o temperaturze niższej od temperatury źródła. Na tle widma ciągłego można wtedy zauważyć czarne linie odpowiadające liniom widma emisyjnego danego gazu lub par metalu. Najbardziej znanym widmem absorpcyjnym jest widmo światła słonecznego. Ciemne linie na tle tego widma (linie Fraunhofera) powstają na skutek pochłonięcia promieniowania o pewnych długościach przez czynnik znajdujący się na drodze promieni.
Trzeci rodzaj widma to widmo luminescencyjne które można uzyskać np. przez: bombardowanie ciała elektronami, przepływ prądu elektrycznego, napromieniowanie.
Widmem optycznym ciała nazywamy rozkład natężenia świetlnego promieniowania elektromagnetycznego w zależności od długości fali __OJ__QJ_częstotliwości v).Widmo optyczne otrzymuje się rozkładając wielobarwną wiązkę światła za pomocą spektroskopów, na wiązki jednobarwne, którym odpowiadają określone częstotliwości fal. Ściślej mówiąc, rozdzielone wiązki światła nigdy nie są dokładnie jednobarwne, czyli nie mają jednakowej wartości wiązkę świępujących powodów:
- przyrządy spektralne mają ograniczoną zdolność rozszczepiającą; jest to cecha aparaturowa.
- z samej istoty zjawisk atomowych wzbudzony poziom energetyczny. ście elektronu i towarzyszące temu wysłanie fotonu, nigdy nie jest dokładnie określony; ma pewną wprawdzie niewielką szerokość związaną z ogólną zasadą nieoznaczoności Heisenberga obowiązującą w mikroświecie.
Gdybyśmy nawet mieli idealny (nieosiągalny) przyrząd do analizy widmowej i badali widmo jednego wzbudzonego atomu odosobnionego, wówczas poszczególne rozszczepione wiązki światła byłyby prawie jednobarwne z dokładnością do owej naturalnej szerokości linii. Ponadto w warunkach rzeczywistych na poszerzenie linii widmowej gazu lub pary wpływają zjawiska związane z oddziaływaniem międzyatomowym oraz efekt Dopplera. Metoda analizy widmowej substancji jest bardzo czuła, pozwala wykryć już np. 5⋅10-7 mg sodu zawartego w określonym związku. Z natężenia linii w widmie substancji badanej możemy wnioskować o ilości danego pierwiastka. Zatem analiza widmowa może dawać również wyniki ilościowe.
Klasyfikacja widma. Wszystkie ciała pobudzone do świecenia wysyłają promieniowanie elektromagnetyczne w zakresie widzialnym lub w podczerwieni i nadfiolecie. Widma takie nazywamy emisyjnymi. Prócz widem emisyjnych znamy jeszcze inny ich rodzaj, tzw. widma absorpcyjne.
Widma takie obserwujemy, gdy na drodze światła znajduje się ciało, np. gaz, ciecz, które pochłania promieniowanie elektromagnetyczne o długościach fal światła znajduje sięźródła światła zostają wycięte charakterystyczne linie (lub całe pasma) absorpcyjne. Przykładem linii absorpcyjnych mogą być prążki Fraunhofera występujące na tle ciągłego widma Słońca. Światło słoneczne powstające w głębszych warstwach gazowych fotosfery Słońca o temperaturze 6000 C, przechodzi przez położone wyżej chłodniejsze warstwy, gdzie jest selektywnie (wybiórczo) pochłaniane. Związek między widmem emisyjnym i absorpcyjnym jest uwarunkowany samą budową atomów lub cząsteczek danej substancji. Atom (a uogólniając i cząsteczka) może przechodzić do wyższych stanów energetycznych pochłaniając foton o energii dopasowanej do dozwolonych przejść energetycznych w tym atomie (lub cząsteczce). Następnie przechodząc na poziom niższy lub inaczej do stanu energetycznie niższego wysyła foton (lub kilka fotonów,jeśli stan podstawowy osiąga przez kolejne przechodzenie przez kilka coraz niższych poziomów). Dlatego widmo absorpcyjne jest jakby odwróceniem widma emisyjnego. Na przykład, ciemne absorpcyjne prążki Fraunhofera pozwoliły na wykrycie w zewnętrznych warstwach Słońca gazowego wodoru, helu.
Do analizy widmowej stosuje się spektrografy
- pryzmatyczne,
- siatkowe,
- interferencyjne.
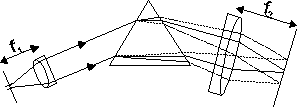
Rys.1. Schemat spektrografu pryzmatycznego.
W spektrografie obraz widma powstaje na matówce lub na kliszy fotograficznej. Do obserwacji widma służą znacznie prostsze spektroskopy.
Spektroskopy posiadają skalę liniową i wymagają każdorazowo cechowania. W tym celu stosując wzorcowe źródła światła o znanych długościach linii widmowych określamy ich położenie na tle skali i sporządzamy tzw. krzywą dyspersji. W naszej pracowni jako wzorca używamy lampę rtęciową (żarową) oraz rurkę Geislera (lub Plückera) wypełnioną neonem (której widmo z liniami czerwonymi uzupełnia widmo rtęci).
Optyczna analiza widmowa, obejmująca również nadfiolet i podczerwień oraz analiza widmowa charakterystycznego promieniowania rentgenowskiego znalazły liczne zastosowania. Na przykład, pozwala ona określić rodzaj badanego materiału. Jeśli stanowi on mieszaninę kilku pierwiastków, przez pomiar natężenia i długości fal można określić procentową zawartość poszczególnych pierwiastków.
Badania widm emisyjnych i absorpcyjnych są ważnym źródłem wiedzy o budowie gwiazd i materii międzygwiezdnej oraz międzygalaktycznej. Doprowadziły one np. do sklasyfikowania gwiazd według typów widmowych, grupujących gwiazdy wysyłające promieniowanie o zbliżonym wyglądzie widma.
Analiza widmowa umożliwiła odkrycie wielu nowych pierwiastków. Umożliwia też szybką analizę składu chemicznego bardzo małych ilości substancji. Największą wykrywalnością spektralną odznaczają się pierwiastki metaliczne choć i pozostałe można badać stosując tą metodę.
2. OPIS STANOWISKA.
Włączamy zasilacz spektrofotometru oraz lampę rtęciową (ustawiając ją na osi przyrządu). Regulujemy przyrząd (ostrość, intensywność, zbieżność wiązek). Do nastawienia przyrządu wybieramy zieloną linię rtęci.
Kręcąc pokrętłem sterującym (z prawej strony, z oświetloną skalą) notujemy położenia linii widmowych. Linie ustawiamy na brzegu (lewym lub prawym) wyróżnionej ramki pola widzenia. Stosujemy subiektywną skalę intensywności linii np. bardzo jasna, jasna, średnia, słaba, bardzo słaba (odpowiednio od 5 do 1).
Podobne pomiary wykonujemy z dwoma rurkami Plückera wypełnionymi nieznanymi gazami. Rurki zmieniamy przy wyłączonym zasilaczu. Po wykonaniu pomiarów na podstawie odczytu dla rtęci rysujemy krzywą dyspersji (skalowania) spektrofotometru. Z wykresu określamy długości fal linii widmowych badanych substancji i przy pomocy tablic linii spektralnych identyfikujemy je.
3. PRZEBIEG ĆWICZENIA.
1. Włączamy zasilacz oświetlenia skali spektrometru oraz lampę rtęciową.
2. Regulujemy przyrząd (ostrość okularu, ustawienie podziałek skali oraz szerokość szczeliny kolimatora).
3. Przesuwając lunetą notujemy położenia linii widmowych.
Tabela 1 - rtęć.
Skala |
Barwa |
Intensywność |
Długość fali [nm ] |
|
|
|
|
Tablicowa |
Z wykresu |
1,02 |
niebieski |
4 |
434,7 |
- |
1,27 |
niebieski |
4 |
433,9 |
- |
1,59 |
czerwony |
4 |
670,9 |
- |
1,61 |
czerwony |
5 |
650,1 |
- |
1,64 |
czerwony |
5 |
641,9 |
- |
1,66 |
pomarańczowy |
5 |
614,9 |
- |
1,67 |
czerwony |
5 |
641,9 |
- |
1,7 |
pomarańczowy |
5 |
579,1 |
- |
1,92 |
żółty |
3 |
579,0 |
- |
1,94 |
żółty |
3 |
577,0 |
- |
2,24 |
zielony |
5 |
546,1 |
- |
4,19 |
fioletowy |
2 |
435,8 |
- |
4,21 |
fioletowy |
4 |
434,7 |
- |
4,23 |
fioletowy |
5 |
433,9 |
- |
4. Podobne pomiary wykonujemy z rurkami Plückera wypełnionych neonem i gazem nieznanym oraz z badaną lampą spektralną.
Tbela 2 - neon.
Skala |
Barwa |
Intensywność |
Długość fali [nm ] |
|
|
|
|
Tablicowa |
Z wykresu |
1,43 |
czerwony |
5 |
692,9 |
- |
1,48 |
czerwony |
4 |
667,8 |
- |
1,5 |
czerwony |
4 |
659,9 |
- |
1,53 |
czerwony |
4 |
650,6 |
- |
1,54 |
czerwony |
5 |
640,2 |
- |
1,57 |
czerwony |
4 |
638,3 |
- |
1,6 |
czerwony |
5 |
633,4 |
- |
1,63 |
czerwony |
5 |
640,2 |
- |
1,65 |
czerwony |
4 |
633,4 |
- |
1,68 |
pomarańczowy |
4 |
626,6 |
- |
1,7 |
pomarańczowy |
4 |
621,7 |
- |
1,73 |
pomarańczowy |
5 |
616,4 |
- |
1,78 |
pomarańczowy |
5 |
614,3 |
- |
1,79 |
żółty |
4 |
576,4 |
- |
1,84 |
żółty |
5 |
574,8 |
- |
1,87 |
żółty |
3 |
571,9 |
- |
Tabela 3 - gaz nieznany.
Skala |
Barwa |
Intensywność |
Długość fali [nm ] |
|
|
|
|
Tablicowa |
Z wykresu |
1,33 |
czerwony |
5 |
- |
671 |
1,4 |
czerwony |
4 |
- |
665 |
1,84 |
pomarańczowy |
3 |
- |
587 |
2,75 |
niebieski |
5 |
- |
500 |
2,8 |
niebieski |
4 |
- |
497 |
2,94 |
indygo |
5 |
- |
487 |
3,05 |
indygo |
4 |
- |
480 |
3,33 |
fioletowy |
5 |
- |
465 |
3,86 |
fioletowy |
4 |
- |
440 |
Tabela 4 - gaz nieznany
Skala |
Barwa |
Intensywność |
Długość fali [nm ] |
|
|
|
|
Tablicowa |
Z wykresu |
1,46 |
czerwony |
2 |
- |
655 |
1,53 |
czerwony |
5 |
- |
633 |
2,6 |
zielony |
4 |
- |
513 |
2,7 |
zielony |
1 |
- |
507 |
3,16 |
niebieski |
1 |
- |
475 |
3,4 |
niebieski |
2 |
- |
460 |
4,01 |
fioletowy |
5 |
- |
432 |
4,04 |
fioletowy |
5 |
- |
421 |
5. Rysujemy krzywą dyspersji spektrometru.
6. Z wykresu określamy długość linii widmowych badanego gazu i za pomocą tablic linii spektralnych identyfikujemy go.
Za pomocą krzywej dyspersji zidentyfikowano obydwa gazy jako HEL i KADM.
4. WNIOSKI.
Przeprowadzone ćwiczenie wykazało , że źródłem widma są atomy co można stwierdzić po charakterystyce odczytywanego widma , które jest widmem liniowym.
Ocena tej metody jest subiektywna , dlatego że każdy człowiek widzi inaczej tę samą odczytywaną barwę jak i jej natężenie. Dokładść charakterystyki dla znanych substancji (rtęć i neon), oraz prawidłowe wyskalowanie przyrządu decyduje dokładnym zidentyfikowaniu badanych gazów. Ewentualne niedokładności przy skalowaniu utrudniają, a nawet uniemożliwiają prawidłową identyfikację nieznanych próbek.
Wyszukiwarka
Podobne podstrony:
C3 4 Analiza widmowa sygnalow czasowych
15-2, MIBM WIP PW, fizyka 2, laborki fiza(2), 29-Optyczna analiza widmowa
LabA Analiza Widmowa
Lab.Fiz II-21, MIBM WIP PW, fizyka 2, laborki fiza(2), 29-Optyczna analiza widmowa
Ćwiczenie 15, MIBM WIP PW, fizyka 2, laborki fiza(2), 29-Optyczna analiza widmowa
psfiz3, Mechatronika, Fizyka techniczna, Fizyka, analiza widmowa
Analiza widmowa prądów?zowych silnika klatkowego w stanie niesymetrycznym
ANALIZA WIDMOWA
LabA Analiza Widmowa
lab 05 analiza widmowa
cw8 analiza widmowa metoda szybkiej transformaty fouriera (FFT)
ćw 15 - badanie wiązki świetlnej, MIBM WIP PW, fizyka 2, laborki fiza(2), 29-Optyczna analiza widmow
4 aws, aws p, Analiza widmowa sygnałów
Analiza widmowa 6, ANALIZA WIDMOWA-wst˙p teoretyczny
6 Analiza widmowa id 43570 Nieznany (2)
psfiz4, Mechatronika, Fizyka techniczna, Fizyka, analiza widmowa
21 - Ciek-e kryszta-y, MIBM WIP PW, fizyka 2, laborki fiza(2), 29-Optyczna analiza widmowa
Analiza widmowa 7, Wydzia˙ AEiI , kierunek AiR
więcej podobnych podstron