
0
Otrzymywanie szkieł i warstw na szkle płaskim
przy zastosowaniu metody zol-żel
1
Metoda zol-żel
Metoda zol-żel jest znana już od ponad 40-tu lat. Jednak wyjątkowo szybki rozwój prac
badawczych nad otrzymaniem materiałów amorficznych metodą zol-żel zaczyna się od lat 70-tych,
a w latach 80-tych obserwuje się ich szczególny rozkwit. Metodę zol-żel można zaliczyć do
nowych, niekonwencjonalnych metod syntezy szkieł nieorganicznych. Jest to proces
niskotemperaturowy, pomijający całkowicie etap ogniowy i opiera się głównie na reakcjach
zachodzących w fazie ciekłej. Podstawowymi surowcami są, zwykle alkoholany metali oraz inne
związki, np. chelaty, estry lub kombinacje związków organicznych i nieorganicznych (azotany,
chlorki, tlenochlorki).
W najbardziej popularnej metodzie żelowej -alkoholanowej podstawowe składniki szkła
wprowadzane są w postaci odpowiednich alkoholanów lub estrów. Obok nich w skład roztworu
wyjściowego wchodzi: alkohol, spełniający rolę rozpuszczalnika, woda oraz katalizator reakcji.
Podstawowe procesy –reakcje hydrolizy i polikondensacji -warunkują przemianę roztworu
wyjściowego w żel, który w wyniku odpowiedniej obróbki termicznej może przejść w
nieorganiczne szkło tlenkowe. Po zmieszaniu składników, estry i alkoholany pierwiastków
szkłotwórczych i modyfikujących reagują z wodą w rozpuszczalniku organicznym i ulegają
częściowej hydrolizie i polikondensacji. Te dwa procesy przebiegają równolegle i nie można ich
rozdzielić w czasie. Zależą one od wielu czynników: temperatury i pH roztworu, ilości
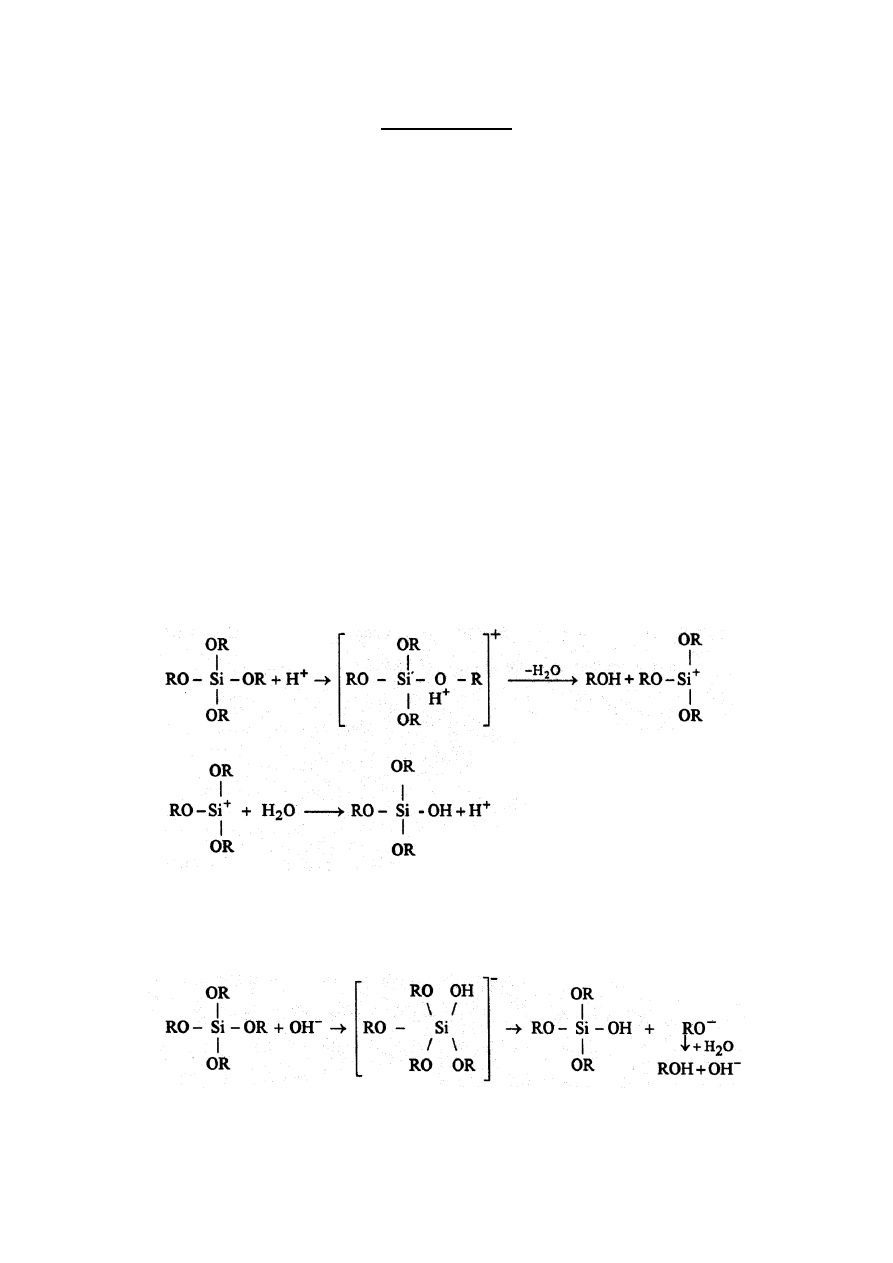
rozpuszczalnika i wody. pH regulowane jest ilości dodawanego katalizatora w postaci HCI lub
NH4OH. Optymalnym jest dobór takich warunków procesu, żeby żelowanie następowało w okresie
dwóch do pięciu dni a materiał końcowy miał postać monolitu. Na mechanizm przebiegu reakcji
hydrolizy ma wpływ rodzaj katalizatora. W przypadku stosowania kwasów (HCI, HNO
3
) hydroliza
polega na elektrofilowym ataku skierowanym na atom tlenu jednej z grup alkoksylowych.
Gdy katalizatorem jest zasada (ŃH
4
OH, NaOH) następuje nukleofilowy atak na atom krzemu:
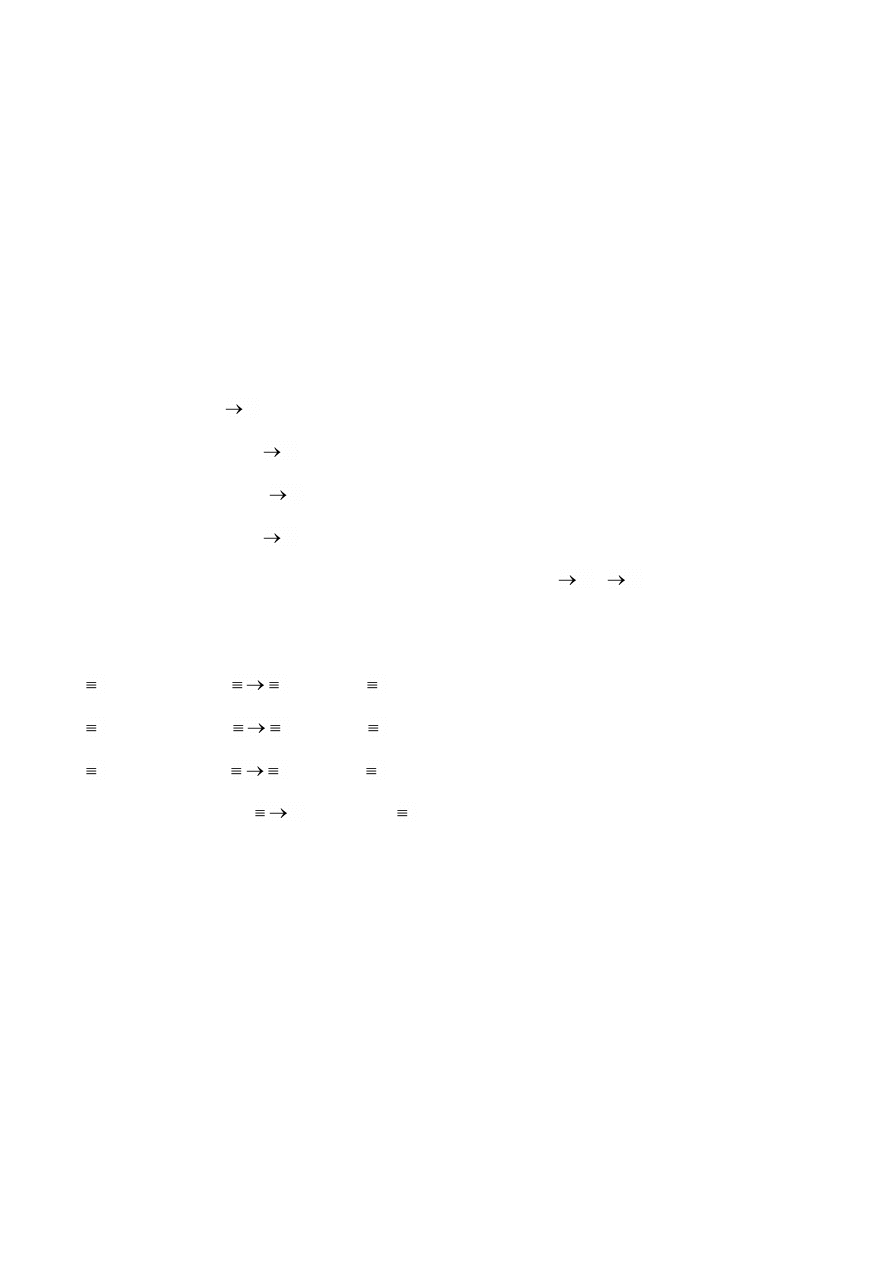
2
Podczas hydrolizy alkoholanów mogą zaistnieć dwa przypadki: hydroliza kompletna i hydroliza
częściowa. Pierwszy proces zachodzi w przypadku szybko hydrolizujących alkoholanów i etapem
końcowym jest wytrącenie nierozpuszczalnych w alkoholu wodorotlenków. Jest to
niedopuszczalne, gdy celem jest otrzymanie amorficznych materiałów żelowych. W związku z tym,
że alkoholany wielu pierwiastków użytecznych przy wytwarzaniu szkieł wieloskładnikowych
zwykle hydrolizuje dość szybko, należy je dodawać stopniowo do najwolniej hydrolizującego
alkoholanu, w momencie, gdy jest on zhydrolizowany częściowo. Do tego znakomicie się nadają
przede wszystkim związki krzemu -tetraetyloortokrzemian (TEOS) i tetrametyloortokrzemian
(TMOS). Wolny przebieg reakcji hydrolizy i polikondensacji jest niezbędny, aby w warunkach
niskotemperaturowej syntezy utworzyła się więźba tlenkowa.
W przypadku pierwiastków wielowartościowych hydroliza jest wielostopniowa i każdy
stopień reakcji odbywa się z różną szybkością.
W przypadku stosowania TEOS-u przebieg reakcji hydrolizy jest następujący:
Si(OC
2
H
5
)
4
+ H
2
O (OH)Si(OC
2
H
5
)
3
+ C
2
H
5
OH
(OH)Si(OC
2
H
5
)
3
+ H
2
O (OH)
2
Si(OC
2
H
5
)
2
+ C
2
H
5
OH
(OH)
2
Si(OC
2
H
5
)
2
+ H
2
O (OH)
3
Si(OC
2
H
5
) + C
2
H
5
OH
(OH)
3
Si(OC
2
H
5
) + H
2
O Si(OH)
4
+ C
2
H
5
OH
Drugim typem reakcji zachodzących podczas przemiany roztwór zol żel jest polikondensacja.
W wyniku tych reakcji powstają wiązania mostkowe typu Si-O-Si, Si-O-Me, charakterystyczne dla
sieci szkła tlenkowego. W przypadku szkła krzemianowego domieszkowanego tlenkami typu MeO
przebieg tych reakcji jest następujący (R = C
2
H
5
, CH
3
):
Si –OR + HO – Si Si – O – Si + ROH
Si –OH + HO – Si Si – O – Si + H
2
O
Si –OR + RO – Si Si – O – Si + R
2
O
– Me – OH + HO – Si – Me – O – Si + ROH
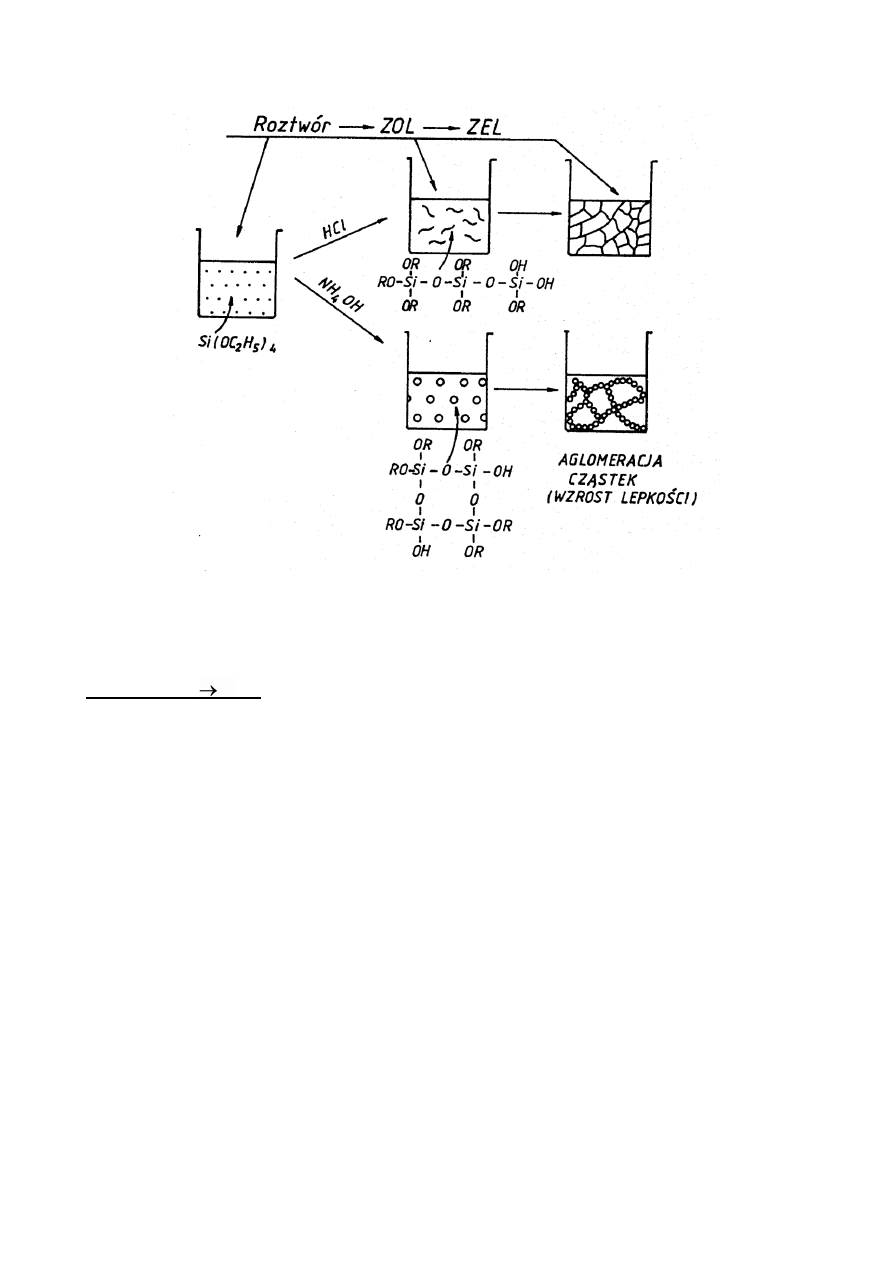
Schemat podany na rysunku 1 ilustruje makroskopowy przebieg wyżej opisanych reakcji. W
roztworze znajdują się pojedyncze cząsteczki częściowo z hydrolizowanych alkoholanów. W zolu
cząsteczki są już częściowo spolimeryzowane, ale stopień polimeryzacji jest niewielki. Przejściu
zolu w żel towarzyszy aglomeracja spolimeryzowanych cząsteczek i na skutek tego wzrost
lepkości. Wszystkie wyżej opisane reakcje odbywają się w temperaturach pokojowych.
3
Rys.1 Schemat przemian zachodzących przy przejściu roztwór – zol – żel.
Przemiany żel szkło
Otrzymany w warunkach otoczenia "wilgotny" żel zbudowany jest z fragmentów sieci tlenkowej,
ale posiada również dużą ilość grup OH- i grup organicznych. Jest to materiał o bardzo wysokiej
porowatości. Zawarte w porach woda i alkohol, pochodzące z roztworu wyjściowego oraz będące
produktami reakcji hydrolizy i polikondensacji ulegają w dużym stopniu usunięciu przez suszenie
w temperaturze pokojowej w ciągu kilkunastu do kilkudziesięciu dni. W tym czasie żel kurczy się i
odstaje od ścian naczynia, w którym dotąd przebywał, zachowując jego kształt. Taki "zestarzony"
żel poddaje się wygrzewaniu w temperaturze około 400°C. Sprzyja to dalszemu usunięciu wody i
grup OH nie tylko z porów ale i ze struktury żelu. Najpierw wydzielana jest woda (100-200°C),
następnie części organiczne (300-400°C). Otrzymuje się wówczas amorficzny materiał z ciągłą
więźbą tlenkową. Jest on na ogół przeźroczysty. Porowatość znacznie się zmniejsza, ale gęstość
jeszcze różni się od gęstości szkła topionego; o tym samym składzie. Dalsze zagęszczanie struktury
uzyskuje się poprzez dodatkową obróbkę termiczną. Prowadzona ona jest wieloetapowo i bardzo
wolno, przy czym w temperaturze ok. 500°C następuje zapadanie się małych porów, zamykanie
dużych porów odbywa się w przedziale temperatur 700-900°C. Pełne zagęszczenie żelu uzyskuje
się przy obróbce do temperatury około 1000°C. Przy prawidłowo prowadzonej obróbce termicznej
właściwości szkła żel owego nie różnią się od odpowiedniego szkła topionego.

4
Zalety i wady metody zol-żel
Ponieważ jest to metoda całkowicie odmienna od innych, celowym wydaje się podkreślenie, jakie
posiada ona zalety w stosunku do metod konwencjonalnych. Metoda żelowa pozwala na uzyskanie
materiałów o bardzo wysokiej jednorodności i czystości chemicznej. Ponieważ roztwór sporządza
się ze związków chemicznych w stanie ciekłym, cała synteza odbywa się w warunkach
zapewniających jednorodność na skalę molekularną. Materiał końcowy wolny jest również od
smug, pęcherzyków, wtrąceń, charakterystycznych dla szkieł topionych. Metodą zol-żel można
uzyskać materiały amorficzne, o bardzo różnych składach chemicznych, często trudnych lub
niemożliwych do uzyskania na drodze topienia (np. szkła z układu SiO
2
- TiO
2
-ZrO
2
, o unikalnym
połączeniu bardzo niskiego współczynnika rozszerzalności cieplnej, wysokiego współczynnika
załamania światła i dużej odporności chemicznej w środowisku alkalicznym). Oprócz tego metoda
pozwala na syntetyzowanie szkieł trudnotopliwych, omijając charakterystyczne dla nich zjawiska
likwacji i krystalizacji, ułatwiając ich otrzymywanie, a czasem i rozszerzając granice obszaru
szklistego w układzie (np. układ SiO
2
- TiO
2
).
Stosując metodę zol-żel i posługując się różnymi technikami (wyciąganie nici, osadzanie z
roztworu powłok poprzez zanurzanie, wirowanie lub rozpylanie, zwykłe mieszanie i odlewanie)
można uzyskać monolity o różnych kształtach, nie wymagających prasowania, obróbki
mechanicznej a wykorzystując reologiczne właściwości zoli -włókna szklane, warstwy cienkie (50-
200 nm) i grubsze (do 3 m).
Tak sytuacja wygląda w przypadku otrzymywania materiałów amorficznych. Jednakże metoda
żelowa jest użyteczna również przy otrzymywaniu materiałów krystalicznych, kompozytów,
ceramiki. Jako następną zaletę można wymienić stosunkowo niskie temperatury obróbki termicznej
(np. dla szkieł z układu SiO
2
-TiO
2
-1000°C w porównaniu z temperaturą topienia ponad 1600°C) i
wynikającą z tego energooszczędność. Niestety, użyteczność tej metody w przemyśle szklarskim
nadal jest ograniczona, ze względu na trudności, towarzyszące tej syntezie, których pojawienie się
decyduje o wadach tej metody.
Wszystkie procesy zachodzące podczas przemiany zol - mokry żel - suchy żel są nieodwracalne i
niemożliwe do zahamowania ich w czasie. Z tego wynikają trudności w utrzymywaniu stałej
lepkości zolu, stanowiącej niezbędny warunek do otrzymywania materiałów na skalę przemysłową.
Istnieją również bardzo duże trudności w uzyskaniu końcowych materiałów w formie monolitów,
gdyż niebezpieczeństwo pękania istnieje na każdym etapie przechodzenia żelu w szkło. Przyczyną,
jak już wspomniano, są naprężenia, które powstają w suchym żelu po usunięciu wody i
rozpuszczalnika oraz duży skurcz towarzyszący termicznej obróbce żelu. Oprócz tego dużo
niepowodzeń związanych jest z porowatością żeli. Nieodpowiedni program obróbki termicznej,
przede wszystkim -prędkość wzrostu temperatury, powoduje zmiany tekstury żelu. Zbyt szybkie
ogrzewanie powoduje wzrost średniej średnicy porów w żelu w porównaniu z żelem wygrzewanym
powoli, a skoki temperatur mogą doprowadzić również do spękania żelu. Dużym minusem,
działającym na niekorzyść tej metody jest to, że wszystkie procesy w tej metodzie są bardzo
długotrwałe i technicznie niemożliwe jest ich przyspieszenie.
Dodatkowo, odczynniki używane w metodzie zol-żel są bardzo drogie, ze względu na koszty ich
syntetyzowania. Wszystkie wymienione negatywne strony tej metody powodują, że zastosowanie
jej tylko w nielicznych przypadkach wyszło poza granice laboratorium i ogranicza się do
otrzymywania w niewielkich ilościach materiałów specjalnych, trudnych lub niemożliwych do
uzyskania innym sposobem.

5
Warstwy zol-.żel na szkle
Intensywne badania nad otrzymaniem cienkich warstw żelowych prowadzono już w latach
60-tych, lecz w ostatnich 20-tu latach chemiczne procesy nakładania powłok, między innymi przy
pomocy metody zol-żel stały się szczególnie popularne.
Rozróżnia się dwie grupy metod, na których oparte są procesy otrzymywania warstw:
Metody I grupy -bazują na wykorzystaniu stabilnych roztworów koloidalnych, sporządzonych w
wodzie lub rozpuszczalnikach niewodnych z wykorzystaniem substancji amorficznych w postaci
cząstek koloidalnych. Takie koloidalne cząstki otrzymuje się metodą zol-żel przy użyciu chlorków
metali lub alkoholanów metali jako wyjściowych substancji. Można je otrzymać również przez
utlenianie w fazie gazowej metali lub związków metaloorganicznych, bądź też poprzez wymianę
jonową w roztworach.
Metody II grupy opierają się na hydrolitycznej polikondensacji alkoholanów metali i tetraetoxy-
względnie tetrametoxykrzemu w rozpuszczalnikach bezwodnych, najczęściej w alkoholach. Jako
wyjściowe substancje stosowane są również, podobnie jak w I grupie metod, alkoholany metali,
estry , względnie nieorganiczne związki niektórych pierwiastków, np. azotany, chlorki, octany.
Jako substancje wyjściowe służą też wodne, alkoholowe lub alkoholowo-wodne roztwory soli
nieorganicznych metali.
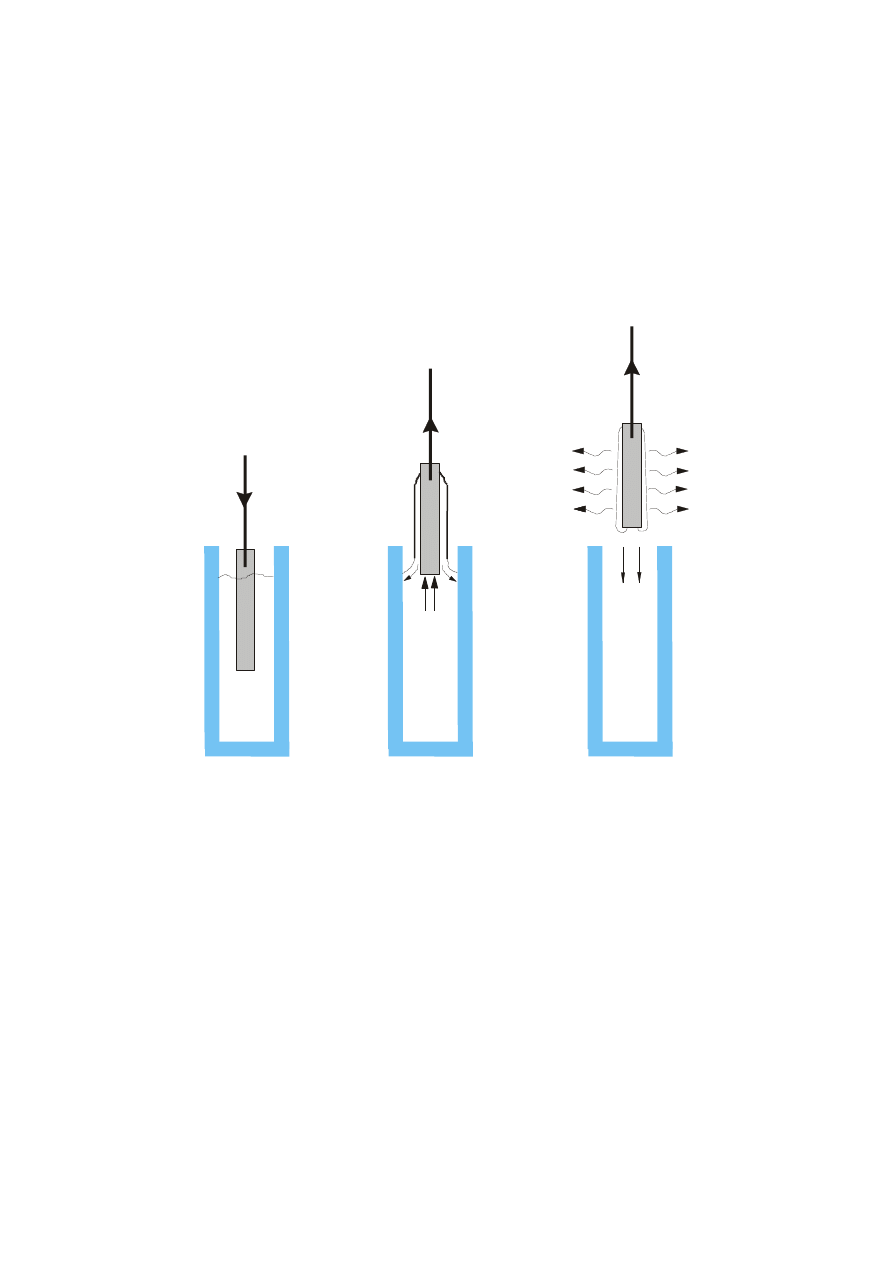
Nakładanie powłok metodą zol-żel może się odbywać przy pomocy różnych technik:
techniką zanurzeniową (szkło podstawowe zanurzano i wyciągano z roztworu pionowo w
górę, ze stałą prędkością; roztwór nie przesuwa się); techniką obniżenia poziomu lustra
roztworu (szkło zanurzano w roztworze, po czym obniża się poziom lustra ze stałą prędkością
–szkło pozostaje w tym samym miejscu);
techniką wirowania – na powierzchnię obracającego się szkła podawana jest porcja roztworu,
warstwa tworzy się pod działaniem siły odśrodkowej;
techniką natrysku – roztwór rozprowadza się na powierzchni szkła przy pomocy aerografu;
6
Metoda zanurzeniowa
W metodzie tej powierzchnia pokrywana zostaje zanurzona w roztworze, z którego ma być
nałożona warstwa, a następnie wynurzona ze ściśle określoną prędkością. Podczas doboru
parametrów procesu istotny jest dobór temperatury roztworu, z którego warstwa będzie
otrzymywana. Proces odbywa się przy ciśnieniu atmosferycznym. Grubość powłoki regulowana
jest poprzez szybkość wynurzania pokrywanej powierzchni oraz lepkość cieczy.
Nakładanie powłok metodą zanurzeniową
Jeżeli szybkość wynurzania pozwala zachować parametry charakterystyczne dla cieczy
newtonowskich grubość nałożonej warstwy możemy wyliczyć przy pomocy równania LANDAU-
LEVICH’a
h=0,94(ηV)
2/3
/γ
LV
1/6
(ρg)
1/2
gdzie:
h – grubość powłoki
η – lepkość roztworu; γ
LV
– napięcie na granicy faz ciecz/gaz; ρ – gęstość
g – przyspieszenie ziemskie; V – szybkość wynurzania
zanurzanie
formowanie warstwy
odparowanie
rozcieńczalnika
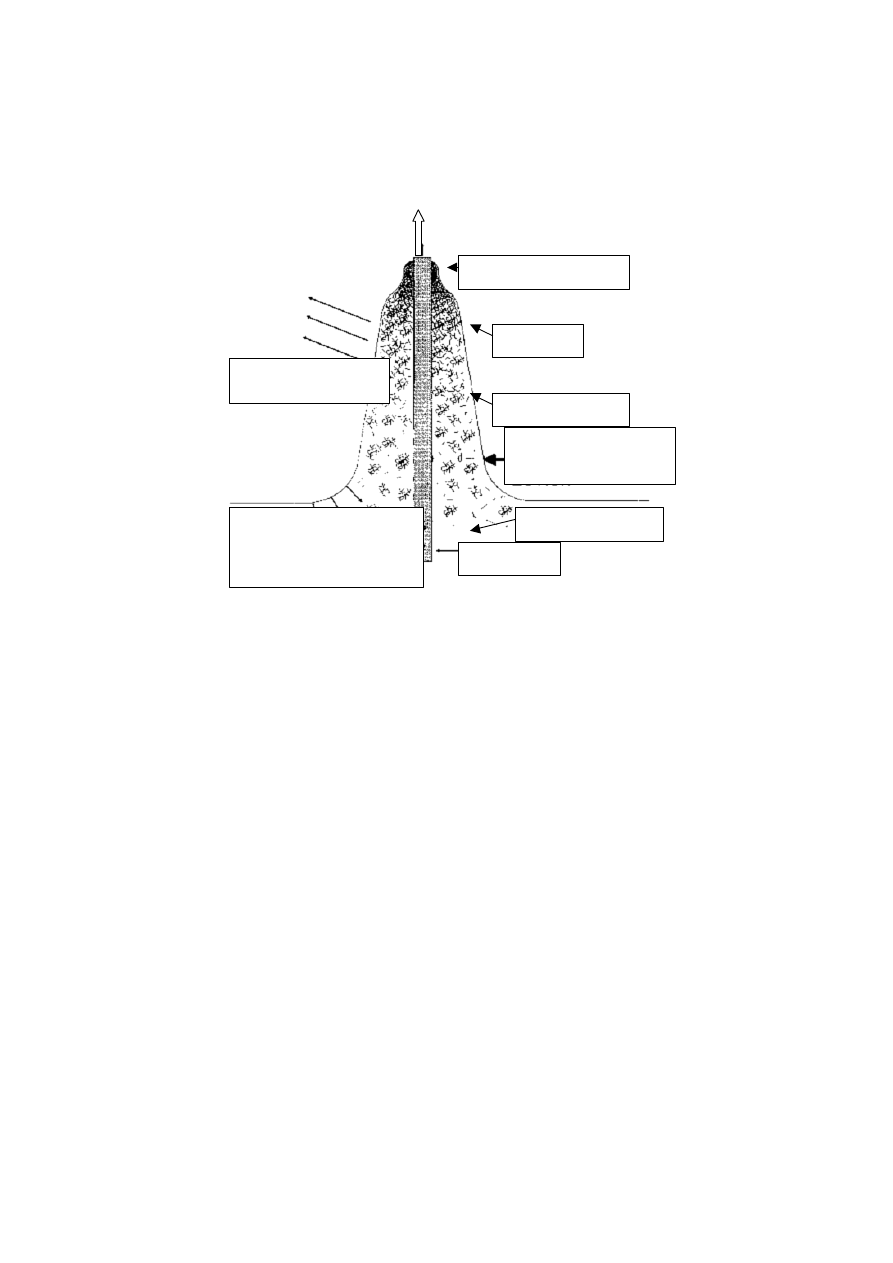
7
Najistotniejszym etapem nakładania powłok poprzez zanurzanie jest początek formowania
powłoki. Procesy zachodzące na tym etapie przedstawia poniższy rysunek.
Formowanie powłoki w metodzie zanurzeniowej
Naniesiona warstwa
żelowanie
agregacja
podłoże
Formowanie warstwy
powstrzymywane poprzez
napięcie powierzchniowe
Parowanie
Woda/alkohol
Rozcienczony zol
Początkowe stadium
uformowanej warstwy
Otrzymana powłoka żelowa zwykle wymaga obróbki termicznej w celu jej zagęszczenia, a
temperatura tego procesu uzależniona jest od składu chemicznego warstwy.
8
Materiały hybrydowe
Hybrydowe szkła organiczno- nieorganiczne stanowią nowy rodzaj materiałów, łączących
w sobie cechy szkieł nieorganicznych oraz organicznych polimerów. Hybrydy takie otrzymywane
są zwykle chemiczną metodą zol- żel, przy zastosowaniu, jako materiałów wyjściowych,
alkoholanów odpowiednich pierwiastków oraz związków organicznych typu (RO)
4-n
SiR
n
. Materiał
finalny otrzymany w wyniku takiej syntezy, stanowi swoisty konglomerat złożony z nano-struktur
tlenków organicznych i organicznych polimerów połączonych wzajemnie wiązaniami
chemicznymi. Taka budowa wewnętrzna sprawia, że szkła hybrydowe mogą w szerokim zakresie
zmieniać swoje właściwości; jest to szczególnie ważne w przypadku właściwości optycznych,
bowiem w zależności od rodzaju i ilości modyfikatora organicznego można otrzymać szkła o
parametrach optycznych (współczynnik załamania światła, dyspersja) nieosiągalnych przy
zastosowaniu tradycyjnych technologii topienia. Ponadto, zmodyfikowane organicznie szkła
tlenkowe stanowią kompatybilną matrycę do której można wprowadzać szereg związków
organicznych o właściwościach barwnych, luminescencyjnych, laserowych uzyskując nowy rodzaj
materiałów typu- hybrydowe szkła barwne, fotoczułe, fotochromatyczne, laserowe i inne.
Modelowy schemat struktury szkieł hybrydowych.
Si
O
Si
O
Si
O
Si
O
C
C
H
O
O
C
C
H
H
H
H
H
O
C
H
H
H
H
H

9
Wykonanie ćwiczenia
Aparatura
Szkło laboratoryjne
Zlewki
Pipety
Cylindry miarowe
Szkiełka zegarkowe
Urządzenia
Mieszadła magnetyczne, elementy mieszające
Waga analityczna
Urządzenie do wyciągania warstw

10
Synteza roztworów do otrzymania żeli i nanoszenia warstw
Otrzymywanie barwnych żeli hybrydowych i barwnych warstw żelowych
Przygotowanie roztworów:
Założona zawartość składników:
Si(OC
2
H
5
)
4
TEOS/Dynasylan A – 25 [%mol]
(C
6
H
5
)Si(OC
2
H
5
)
3
PhTES/Dynasylan 9256 – 30 [%mol]
(OCH
3
)
3
Si(CH
2
)
3
OCH
2
CHOCH GPTMS/Dynasylan GLYMO – 38 [%mol]
C
8
H
20
O
4
Ti TEOT – 7 [%mol]
Materiały wyjściowe:
Odczynnik
Cel użycia
Gęstość
[g/cm
3
]
Masa
molowa
[g/mol]
Czystość[%]
Tetraetoksysilan
Si(OC
2
H
5
)
4
TEOS
Prekursor
nieorganicznej
składowej
hybrydy
0,93
208,33
99
Phenyltrietoksysilan
(C
6
H
5
)Si(OC
2
H
5
)
3
PhTES
Prekursor
organicznej
składowej
hybrydy
0,99
240,38
98
Glycidixypropyltrimethoxysilane
(OCH
3
)
3
Si(CH
2
)
3
OCH
2
CHOCH
GPTMS
Prekursor
organicznej
składowej
hybrydy
1.07
236,34
98
tetraetyloortotytanian
C
8
H
20
O
4
Ti Ti
Prekursor
nieorganicznej
składowej
hybrydy
1,088
228,1
98
Kwas solny 1mol/l
HCl
Katalizator
reakcji hydrolizy
i polikondensacji
1,18
36,6
Etanol C
2
H
5
OH
Rozpuszczalnik
0,79
46
96
Barwniki organiczne typu Orasol: Blue GN, Red BL, Orange RG.
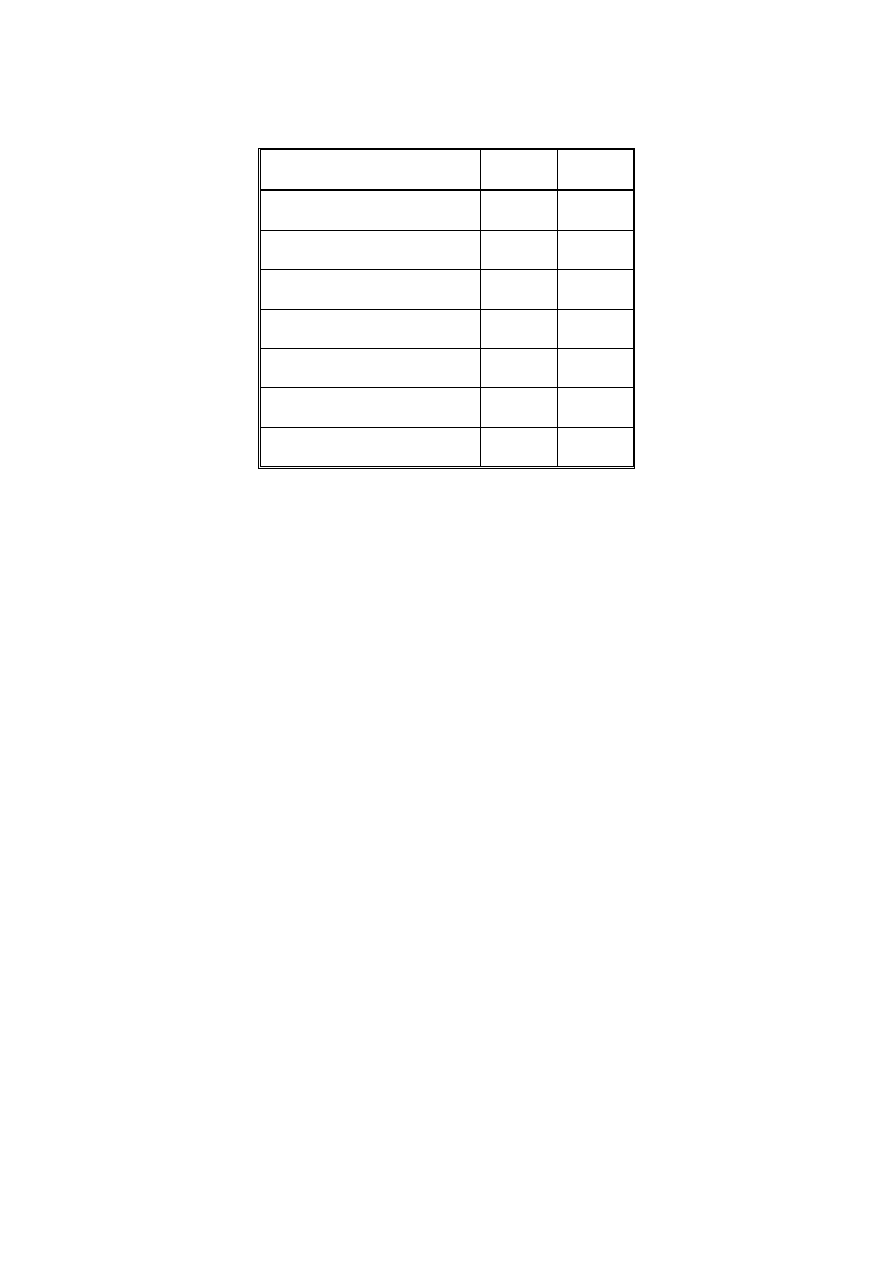
11
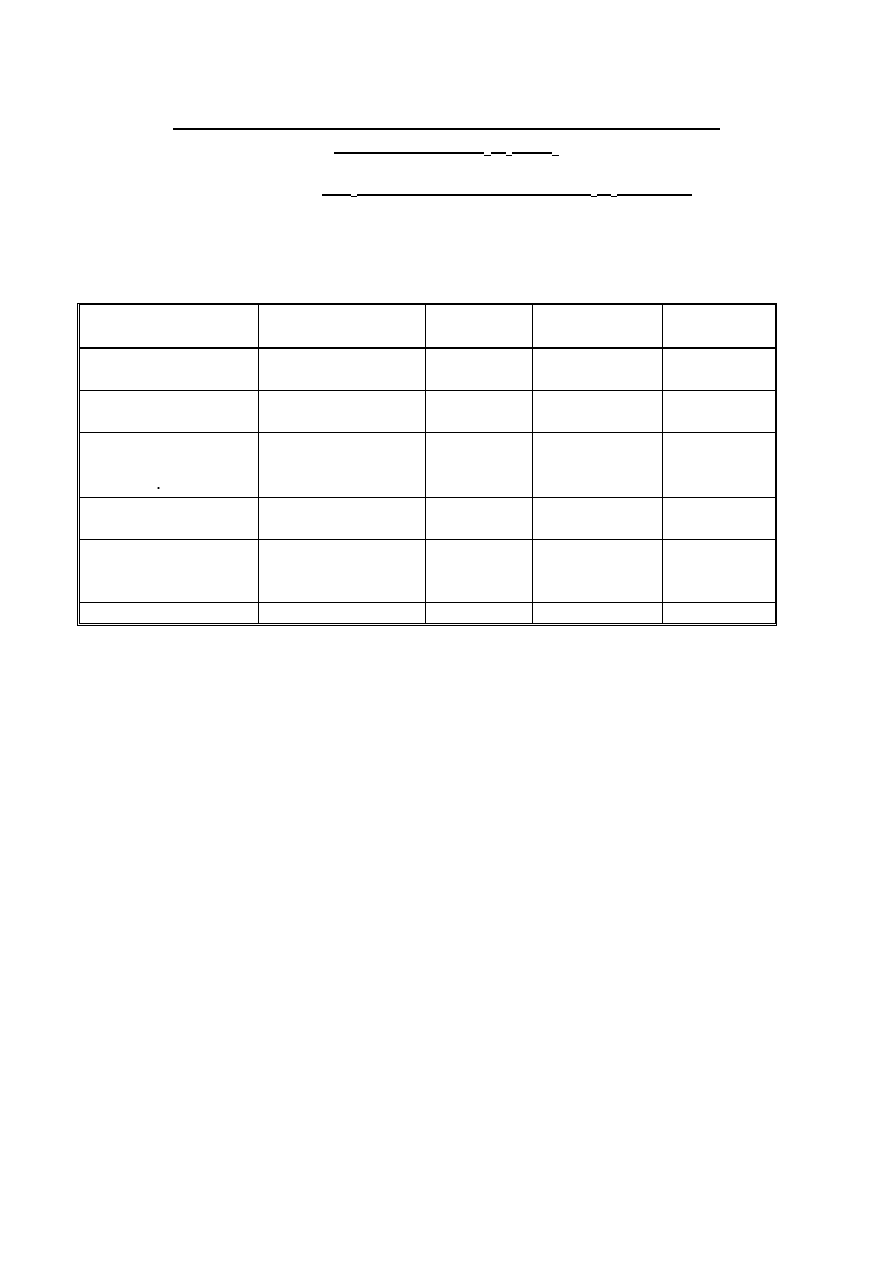
Ilość surowców użytych do syntezy [ml]:
Odczynnik
I(ml)
II(ml)
Si(OC
2
H
5
) TEOS
8
6
(C
6
H
5
)Si(OC
2
H
5
)
3
PhTES
10
7,5
GPTMS
12
9
C
8
H
20
O
4
Ti TEOT
2
1,5
H
2
O
-
-
HCl
4
3
C
2
H
5
OH
12
9
Przygotowanie barwnika:
Barwnik typu Orasol – 100 [mg]
Orasol Blue GN
Orasol Orange RG
I. Odważyć 100 mg barwnika, następnie rozpuścić (w suchej czystej zlewce) w 12 ml. EtOH;
II. Odważyć 75 mg barwnika, następnie rozpuścić (w suchej czystej zlewce) w 9 ml. EtOH;

12
Schemat syntezy roztworów wyjściowych:
Wszystkie odczynniki odmierzamy cylindrem miarowym lub pipetą, osobną dla każdego związku i
SUCHĄ i CZYSTĄ!
W trakcie syntezy zlewki powinny być nakryte szkiełkami zegarkowymi.
Żel
Roztwór końcowy pozostawia się w warunkach otoczenia aż do momentu zżelowania – utworzenia
wilgotnego żelu. W tym czasie zachodzą w dalszym ciągu procesy polikondensacji, roztwór
przechodzi stopniowo w zol a potem w żel. Następnie wilgotny żel poddaje się obróbce
termicznej: suszenie – otrzymujemy „suchy” żel i wygrzewanie – materiał finalny. Parametry
obróbki termicznej zwykle ustala się eksperymentalnie.
Warstwy
Uzyskany roztwór mieszamy w temperaturze 100
o
C przez okres około 25 minut (należy zwrócić
uwagę, aby konsystencja roztworu nie była zbyt gęsta, gdyż wtedy powłoki nie będą dobrze
przylegały do powierzchni szkła). Przed naniesieniem warstwy metodą zanurzeniową, roztwór
należy schłodzić do temperatury otoczenia.
TEOS + PhTES
mieszanie
10 min, T
ot
HCl (1n)
mieszanie
15 min, T
ot
barwnik organiczny Orasol
®
rozpuszczony w EtOH
mieszanie
25 min, T
ot
GPTMS
mieszanie
10 min, T
ot
mieszanie
20 min, T
ot
TEOT
ROZTWÓR KOŃCOWY
13
Otrzymywanie bioaktywnych materiałów pochodzenia żelowego
z układu CaO-P
2
O
5
-SiO
2
Skład tlenkowy materiału A2: SiO
2
- 40%mol. CaO - 54%mol. P
2
O
5
- 6%mol.
Przygotowanie roztworu:
Materiały wyjściowe
Odczynnik
Cel użycia
Gęstość
[g/cm
3
]
Masa molowa
[g/mol]
Czystość[%]
Tetraetoksysilan
Si(OC
2
H
5
)
4
TEOS
Prekursor SiO
2
0,93
208,33
99
Trietanolan fosforu
OP(OC
2
H
5
)
3
Prekursor P
2
O
5
1,068
182,16
98
Czterowodny azotan
wapnia
Ca(NO
3
)
2
4H
2
O
Prekursor CaO
236,15
99
H
2
O
Rozpuszczalnik
azotanu
1
18
Kwas solny 1mol/l
HCl
Katalizator reakcji
hydrolizy i
polikondensacji
1,18
36,6
Etanol C
2
H
5
OH
Rozpuszczalnik
0,79
46
96
14
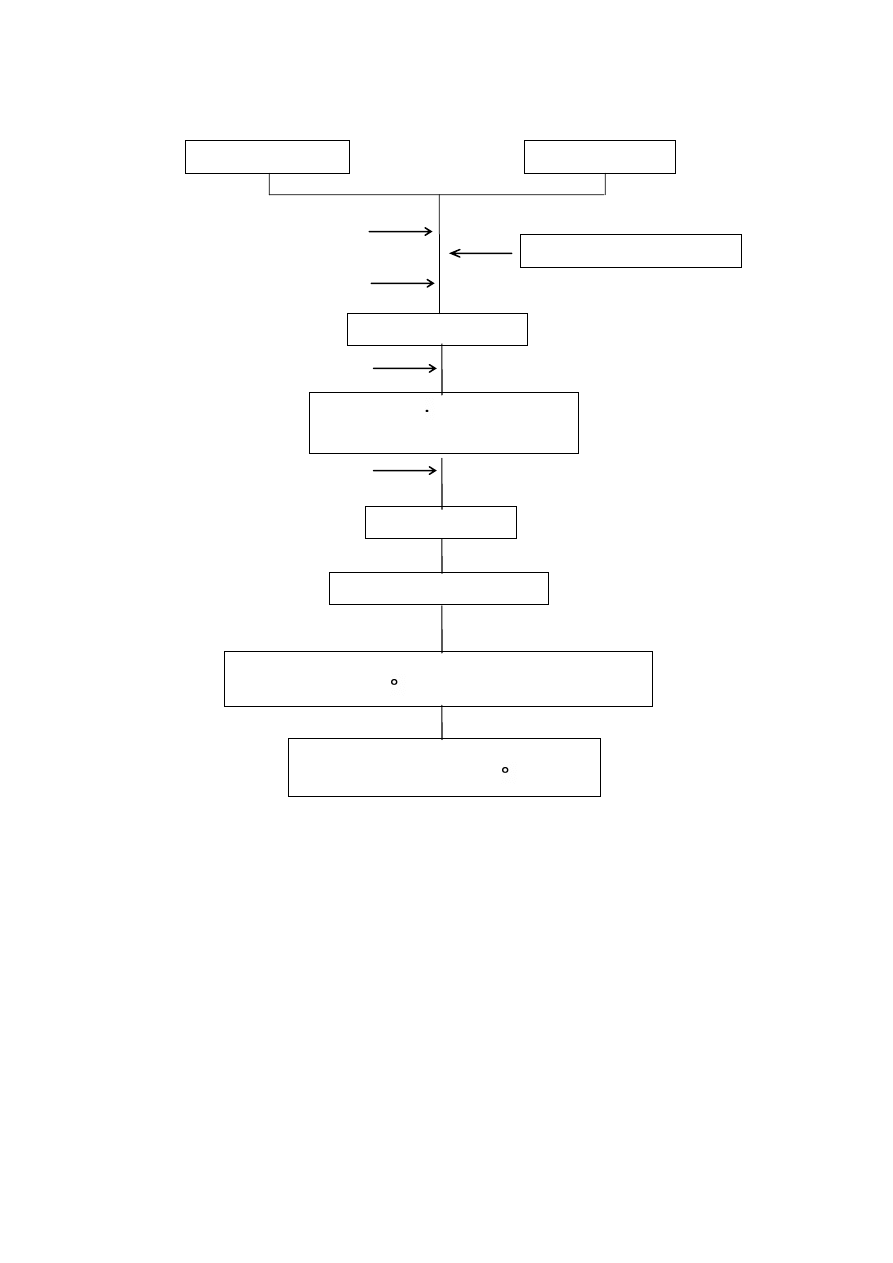
Schemat syntezy roztworów wyjściowych:
mieszanie 15 min.
mieszanie 15 min.
mieszanie 35 min.
mieszanie 60 min
Si(OC
2
H
5
)
4
- 30 ml.
wilgotny żel (10dni)
C
2
H
5
OH - 34 ml.
suszenie: - w warunkach otoczenia 7-14 dni
- w 60-100 C (6 dni)
HCl - 2,5 ml. + H
2
O - 3 ml.
Wygrzewanie wieloetapowe do temp.
200, 400, 600, 800 C
OP(OC
2
H
5
)
3
- 6,9 ml.
Ca(NO
3
)
2
4H
2
O - 42,7 g.
rozpuszczony w C
2
H
5
OH + H
2
O
roztwór końcowy
15
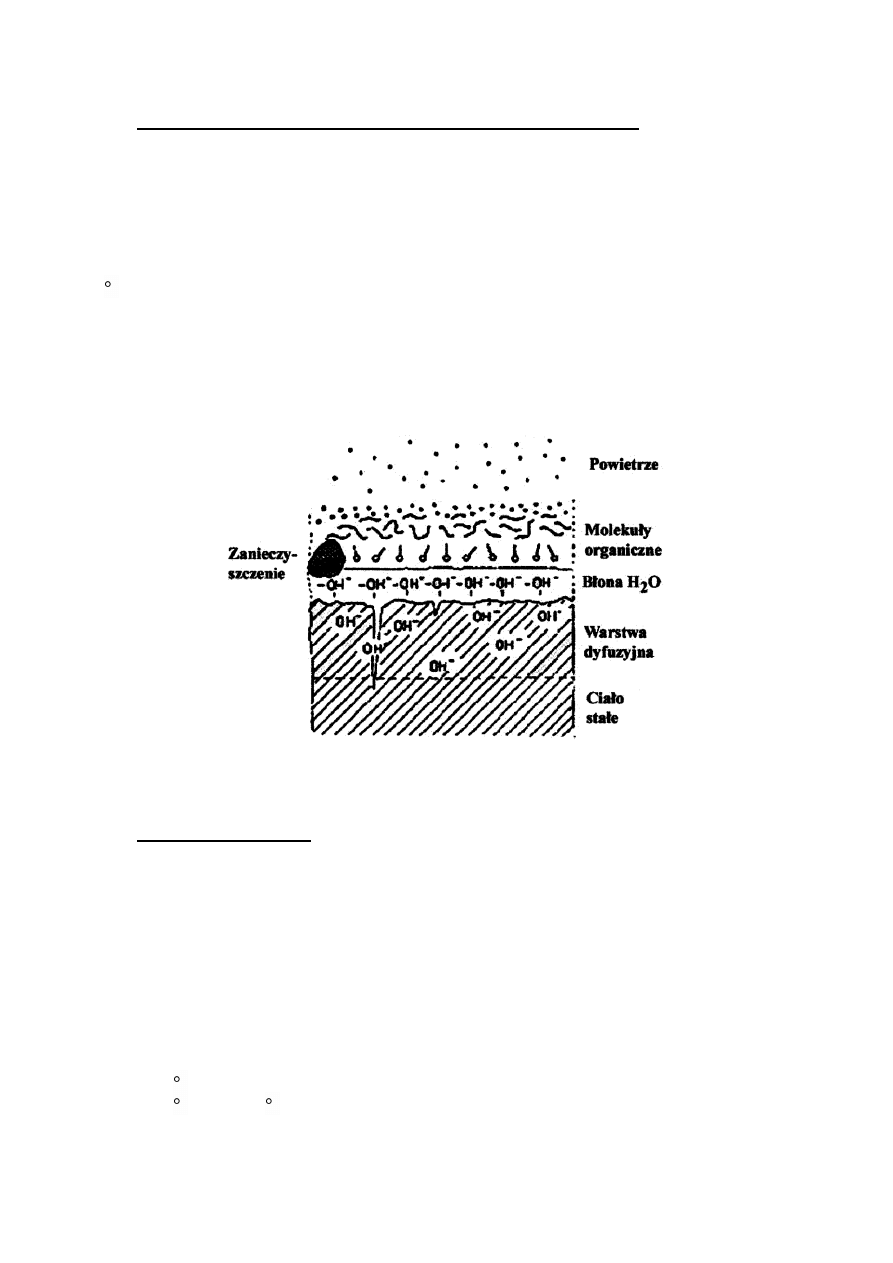
Przygotowanie powierzchni szkła do nanoszenia warstw
Jako materiał podłożowy do nanoszenia warstw żelowych można stosować szkiełka
mikroskopowe.
Ze względu na wymaganą czystą powierzchnię pokrywanego szkła należy szkiełka najpierw
odtłuścić przy użyciu specjalnego płynu do szkła lub roztworu detergentu, i bardzo dobrze
wypłukać wodą destylowaną. Następnie szkiełka zanurza się w rozcieńczonym roztworze kwasu
fluorowodorowego i dokładnie opłukuje wodą destylowaną, i suszy w suszarce w temperaturze
80 C.
Odpowiednie przygotowanie materiału podłożowego jest istotne, gdyż dodatkowa warstwa (np.
błona H
2
O) oraz zanieczyszczenia powierzchni będą powodować zakłócenia w formowaniu się
warstwy i tworzeniu wiązań między warstwą a podłożem.
Typowa powierzchnia szkła przed procesem czyszczenia
Nakładanie warstw
Uzyskany wg odpowiedniego schematu roztwór mieszamy przez okres około 25 minut (należy
zwrócić uwagę, aby konsystencja roztworu nie była zbyt gęsta, gdyż wtedy powłoki nie będą
dobrze przylegały do powierzchni szkła). Przed naniesieniem warstwy metodą zanurzeniową,
roztwór należy schłodzić do temperatury otoczenia.
Przygotowane, czyste szkiełka mikroskopowe (wg poprzedniego schematu) zakłada się do uchwytu
mocującego i zanurza w uprzednio przygotowanym roztworze z prędkością 5cm/min.
Bezpośrednio po zanurzeniu płytkę szklaną wyciąga się z taką samą prędkością. Następnie należy
ostrożnie zdjąć szkiełko z naniesioną warstwą z uchwytu i włożyć do pojemnika.
Pojemnik umieszcza się w eksykatorze i suszy warstwy przez 1 dzień w warunkach otoczenia a po
tym czasie poddaje się następującej obróbce termicznej:
Suszenie 40 C/1h
Suszenie 80 C/0,5h; 130 C/0,5h
Wyszukiwarka
Podobne podstrony:
MSIB Instrukcja do Cw Lab krystalizacja
[18] zol żel
MSIB Instrukcja do wiczenia LAB Nieznany
CVD+zol żel
MSIB Instrukcja do Cw Lab krystalizacja
[18] zol żel
Synteza zol żel i jej wykorzystanie w ceramice
Instrukcja obslugi AUDI A2 PL up by dunaj2
INSTRUKCJA ZAKŁADANIA ŻELI ŻEL NA PAZNOKCIU NATURALNYM
INSTRUKCJA ZAKŁADANIA ŻELI ŻEL NA PAZNOKCIU NATURALNYM, Kosmetyka, paznokcie
Instrukcja montażu Audi A2
Instrukcja obslugi AUDI A2 PL up by dunaj2
więcej podobnych podstron