
Właściwości białek oraz rozdział barwników roślinnych.
Regulamin porządkowy pracy w laboratorium w Katedrze Biochemii.
1.
Do udziału w zajęciach laboratoryjnych dopuszczeni są studenci/uczniowie po
przeszkoleniu w zakresie BHP w związku z wykonywaniem czynności na salach
ćwiczeń w Katedrze Biochemii. Udział w szkoleniu musi być zakończony pisemnym
potwierdzeniem studenta/ucznia.
2. W sali ćwiczeń obowiązuje kategoryczny zakaz spożywania pokarmów i napojów.
3. Do sali ćwiczeniowej grupę studentów/uczniów wprowadza prowadzący ćwiczenia.
4.
W pracowniach obowiązkowe jest noszenie odzieży ochronnej, odzież wierzchnią
należy pozostawić w szatni.
5. Wszelkiego rodzaju torby, plecaki itp. nie powinny utrudniać poruszania się po
laboratorium – nie należy ich również przechowywać w trakcie zajęć na stołach
laboratoryjnych.
6. Na każde ćwiczenie studenci/uczniowie otrzymują wyposażenie obejmujące zestawy
odczynników niezbędnych do przeprowadzenia doświadczeń, szkło laboratoryjne,
pipety automatyczne, spektrofotometry i inne przyrządy laboratoryjne. Po zakończeniu
pracy student/uczeń jest zobowiązany do uporządkowania swojego stanowiska pracy
oraz umycia szkła laboratoryjnego.
7. Odczynniki chemiczne, które znajdują się pod wyciągiem, nie mogą być przenoszone
na stoły laboratoryjne, należy korzystać z nich w miejscu przechowywania.
8. Wszystkie urządzenia elektryczne, mechaniczne itp. należy używać zgodnie z
zaleceniami osoby prowadzącej ćwiczenia.
9. Zabrania się uruchamiania urządzeń bez zgody prowadzącego ćwiczenia.
10. Zapalanie palników gazowych może odbywać się z należytą ostrożnością po
uzyskaniu zgody prowadzącego ćwiczenia.
1
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.

Właściwości białek oraz rozdział barwników roślinnych.
a. Badanie właściwości białek
Wprowadzenie
Białka są to wielkocząsteczkowe polimery występujące w komórkach organizmów
żywych. Zbudowane są z reszt aminokwasowych połączonych za pomocą wiązań
peptydowych. Specyficzna struktura, właściwości oraz funkcje biologiczne białek zależą od
kolejności występowania (sekwencji) oraz rodzaju reszt aminokwasowych. Aminokwasy to
aminowe pochodne kwasów karboksylowych. Wszystkie aminokwasy przy węglu alfa (α) (
to
węgiel, który jest bezpośrednio połączony z grupą –COOH
) mają jednakowy układ
podstawników. Są to grupa aminowa (-NH
2
), grupa karboksylowa (-COOH), atom wodoru
(H) i łańcuch boczny oznaczany symbolem R. Od struktury chemicznej łańcucha bocznego
zależy rola aminokwasu w białku. Łańcuchy boczne o charakterze polarnym lub ulegające
jonizacji uczestniczą w stabilizowaniu struktur przestrzennych białek. Aminokwasy
połączone wiązaniami kowalencyjnymi (peptydowymi) tworzą strukturę pierwszorzędową
(pierwotną) białka.
Białko o określonej strukturze pierwszorzędowej ulega następnie
procesowi zwijania (fałdowania) w trzy typy struktur przestrzennych (wtórnych). Są to
struktury drugorzędowe: helisa α i struktura β oraz struktura trzeciorzędowa, a w przypadku
białek o budowie podjednostkowej struktura czwartorzędowa. W stabilizacji struktur
przestrzennych białek biorą udział wiązania niekowalencyjne (siły elektrostatyczne,
oddziaływania hydrofobowe, wiązania wodorowe) powstające pomiędzy wiązaniami
peptydowymi lub łańcuchami bocznymi aminokwasów oraz wiązania dwusiarczkowe. Tylko
cząsteczki, które uległy zwinięciu do swoistej dla siebie struktury przestrzennej, mogą pełnić
właściwą danemu białku rolę biologiczną. Ze względu na skład chemiczny, białka dzielimy
na proste i złożone. Białka proste zbudowane są wyłącznie z aminokwasów, natomiast białka
złożone oprócz aminokwasów zawierają dodatkowe cząsteczki lub grupy chemiczne.
Kazeina jest głównym składnikiem białkowym mleka. Należy do białek złożonych, tak
zwanych fosfoprotein, ponieważ zawiera reszty fosforanowe połączone za pomocą wiązań
estrowych z grupami –OH aminokwasów seryny i treoniny oraz kompleksowo przez jony
wapnia związane aminokwasów grupami karboksylowymi aminokwasów kwaśnych. W
mleku, kazeina występuje głównie w postaci sferycznych skupisk, zwanych micelami.
Micele utworzone są z podjednostek, submiceli, złożonych cząsteczek kazeiny typu alfa (α),
beta (β) oraz kappa (κ). Alfa i beta kazeiny to wysoko ufosforylowane białka, które łatwo
strącają się w obecności jonów wapnia i które stanowią rdzeń submiceli. Kappa-kazeina
posiada tylko jedną ufosforylowaną resztę seryny, co sprawia, że jest rozpuszczalna w
obecności jonów wapnia. Zlokalizowana na powierzchni kappa-kazeina stabilizuje micele, a
reszty cukrowców przyłączone do karboksylowego końca łańcucha polipeptydowego,
wystającego ponad powierzchnię miceli, zapewniają micelom odpowiednie uwodnienie i
zapobiegają agregacji. Kazeina wykazuje podobne do innych białek właściwości chemiczne,
dlatego może być wykorzystana w reakcjach wykrywania wiązań peptydowych i
aminokwasów zawierających w łańcuchu bocznym pierścienie aromatyczne. Kazeina, tak jak
inne białka jest wrażliwa na działanie różnych czynników fizycznych i chemicznych, które
mogą powodować wytrącanie jej cząsteczek z roztworu. W warunkach ćwiczenia, wytrącenie
kazeiny w postaci osadu następuje pod wpływem kwasu octowego oraz na skutek działania
podpuszczki, czyli enzymu rozkładającego wiązania peptydowe.
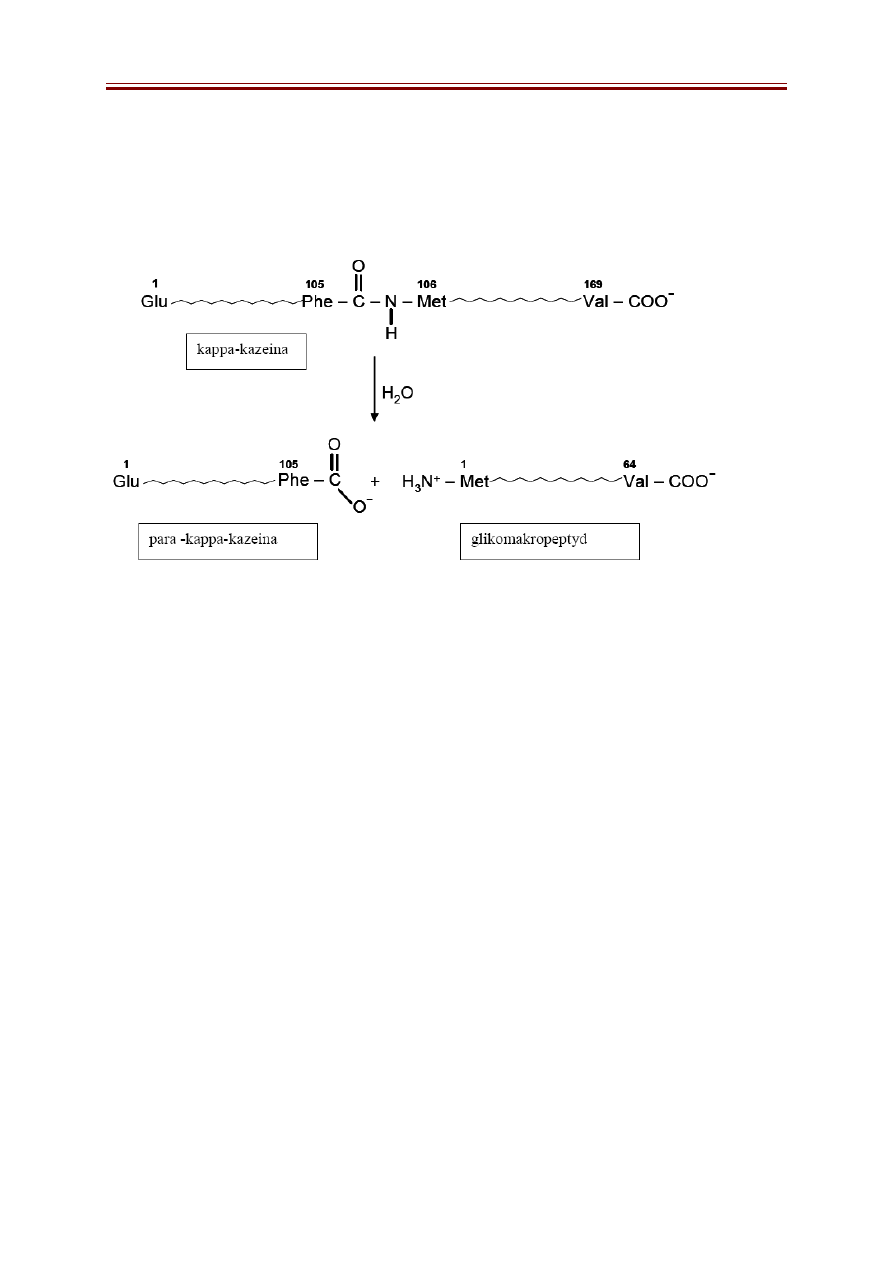
Działanie podpuszczki na białka mleka. Koagulacja kazeiny przez podpuszczkę
następuje w dwóch fazach. Pierwsza faza ma charakter enzymatyczny. W wyniku hydrolizy
przez chymozynę (znajdującą się w podpuszczce) wiązania peptydowego pomiędzy Phe105
oraz Met106 łańcucha polipeptydowego kappa-kazeiny, ma miejsce odszczepienie z
cząsteczek kappa-kazeiny C-końcowego fragmentu łańcucha polipeptydowego, tzw.
glikomakropeptydu i powstanie para-kappa-kazeiny. Glikomakropeptyd zawiera 64 reszty
2
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Właściwości białek oraz rozdział barwników roślinnych.
aminokwasowe, jest łatwo rozpuszczalny w wodzie i przechodzi do roztworu. Druga faza.
Usunięcie hydrofilowego C-końca kappa-kazeiny przez podpuszczkę sprawia, że w obecności
jonów wapnia micele agregują i tworzy się skrzep para-kazeiny (dokładniej parakazeinianu
wapnia). Skrzep powstaje wskutek hydrofobowych oddziaływań pomiędzy micelami,
spotęgownych odłączeniem glikomakropeptydu i utratą otoczki hydratacyjnej. Powyższy
mechanizm koagulacji jest szeroko wykorzystywany w technologii otrzymywania serów
podpuszczkowych.
Rys. 1. Hydroliza wiązania peptydowego kappa-kazeiny przez chymozynę
(podpuszczkę).
Odczynniki
1.
Roztwór podpuszczki.
2.
Odtłuszczone mleko.
3.
Roztwór kazeiny.
4. Roztwór glicyny.
5. 6M NaOH.
6.
0,5% CuSO
4
.
7.
Stężony HNO
3
.
8.
Stężony CH
3
COOH.
Wykonanie
1.
Wytrącanie kazeiny za pomocą kwasu octowego i podpuszczki.
Białka są związkami wrażliwymi na wpływ wielu czynników, które mogą
spowodować nieodwracalne zmiany w ich strukturze i utratę właściwości biologicznych. W
wyniku denaturacji zniszczona zostaje drugo-, trzecio- i czwartorzędowa struktura białka,
natomiast pierwszorzędowa struktura nie ulega zmianie. Zachowane pozostają mocne
wiązania peptydowe, a zniszczeniu ulegają słabe wiązania wodorowe, oddziaływania
elektrostatyczne, hydrofobowe oraz mostki disulfidowe.
Denaturacja białka może nastąpić pod wpływem podwyższonej temperatury,
stężonych kwasów i zasad, wysokich stężeń soli metali ciężkich, rozpuszczalników
organicznych (alkohol lub aceton). W wyniku denaturacji obniża się najczęściej
rozpuszczalność białka i wytrąca się ono z roztworu w postaci osadu.
3
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Właściwości białek oraz rozdział barwników roślinnych.
Uzyskany w probówce pierwszej osad kazeiny powstaje wskutek denaturacji
zachodzącej pod wpływem stężonego kwasu octowego. Osad w probówce drugiej jest
wynikiem koagulacji kazeiny na skutek działania podpuszczki. Brak osadu w probówkach
trzy i cztery jest spowodowany zbyt niską aktywnością podpuszczki w temperaturze 0
°
C i w
temperaturze pokojowej.
Wykonanie. Do czterech probówek odmierzyć po 5 ml mleka. Dwie pierwsze
umieścić w łaźni wodnej o temp. 37°C, trzecią umieścić w naczyniu z lodem, natomiast
czwartą pozostawić w statywie w temperaturze pokojowej. Po 5 minutach do pierwszej dodać
0,5 ml stężonego kwasu octowego (CH
3
COOH), a do pozostałych probówek dodać po 0,5 ml
podpuszczki. Następnie w ciągu 10 min. od dodania odczynników obserwować pojawienie się
osadu kazeiny.
2. Wykrywanie wiązań peptydowych.
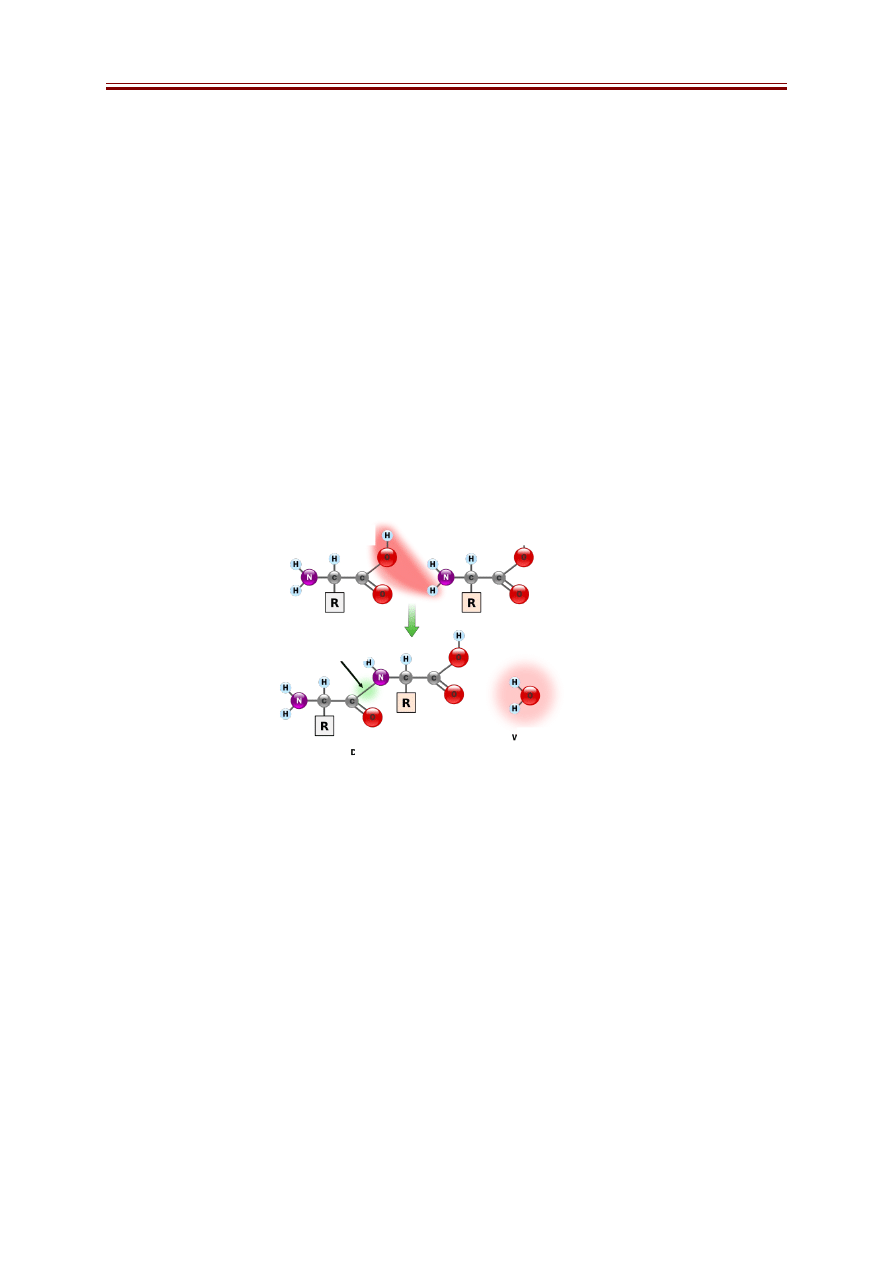
Aminokwasy mają zdolność do łączenia się kowalencyjnie wiązaniami amidowymi
zwanymi wiązaniami peptydowymi (Rys. 2) tworząc liniowe i nierozgałęzione polimery.
Wiązanie peptydowe powstaje pomiędzy grupą α-karboksylową jednego aminokwasu (grupa
aminowa pozostaje wolna, N-końcowa), a grupą α-aminową drugiego aminokwasu (grupa
karboksylowa pozostaje wolna, grupa C-końcowa). Zapis Ala-Gly oznacza, ze aminokwasem
N-końcowym jest alanina, a C-końcowym, glicyna. Czyli zapis Gly-Ala oznacza zupełnie
inny dipeptyd.
Rys. 2. Powstawanie wiązania peptydowego. http://pl.wikipedia.org
Obecność wiązań peptydowych w białkach lub peptydach, zawierających, co najmniej
dwa takie wiązania, można wykryć za pomocą reakcji biuretowej Piotrkowskiego. Reakcja
polega na tworzeniu przez jony miedziowe w środowisku zasadowym fioletowego kompleksu
z tymi wiązaniami.
Wykonanie. Do jednej probówki odmierzyć 1 ml kazeiny, do drugiej 1 ml glicyny, do
trzeciej 1 ml mleka Następnie do wszystkich probówek dodać po 2 ml wodorotlenku
sodowego wymieszać, dodać 0,5 ml siarczanu miedziowego i ponownie wymieszać.
3. Wykrywanie aminokwasów zawierających pierścień aromatyczny.
Obecność aminokwasów (wolnych i wchodzących w skład peptydów i białek)
zawierających grupę aromatyczną można wykryć za pomocą reakcji ksantoproteinowej
(Rys. 3). Polega ona na powstaniu pod wpływem kwasu azotowego nitrowych pochodnych
pierścieni aromatycznych, mających w środowisku zasadowym zabarwienie pomarańczowe.
4
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
aminokwas (1)
aminokwas (2)
wiązanie peptydowe
dipeptyd
woda

Właściwości białek oraz rozdział barwników roślinnych.
żółty
pomarańczowy
tyrozyna
-
NaOH
-
N
H
2
CH CH
2
OH
N
H
2
CH CH
2
N O
O
OH
N
H
2
CH CH
2
N O
O
COOH
COOH
COOH
ONa
HNO
3
+
+
-
NaOH
-
N
H
2
CH CH
2
OH
N
H
2
CH CH
2
N O
O
OH
N
H
2
CH CH
2
N O
O
COOH
COOH
COOH
ONa
HNO
3
+
+
Rys. 3. Przebieg reakcji ksantoproteinowej.
Wykonanie. Do jednej probówki odmierzyć 1 ml kazeiny, do drugiej 1 ml glicyny, do
trzeciej 1 ml mleka Następnie do wszystkich probówek dodać po 1 ml stężonego kwasu
azotowego (HNO
3
) i ogrzewać we wrzącej łaźni wodnej przez 5 min. Ostudzić i dodać
stopniowo 3,5 ml wodorotlenku sodowego (NaOH) – ostrożnie!
Opracowanie wyników
Porównać warunki otrzymania osadów kazeiny za pomocą różnych czynników. Podać
wyniki uzyskane dla reakcji charakterystycznych (zabarwienie, osad) wraz z uzasadnieniem.
5
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.

Właściwości białek oraz rozdział barwników roślinnych.
b. Rozdział barwników roślinnych metodą cienkowarstwowej chromatografii adsorpcyjnej.
Wiadomości wstępne
Chromatografia to fizykochemiczna metoda rozdzielania mieszanin, których składniki
ulegają zróżnicowanemu podziałowi pomiędzy dwie fazy, fazę ruchomą i stacjonarną. Jeżeli
fazą ruchomą jest gaz, to chromatografia nosi nazwę gazowej, gdy ciecz, wówczas nazywana
jest cieczową. Fazą stacjonarną może być ciało stałe bądź ciecz, osadzona na stałym nośniku.
Faza ruchoma przepływając przez fazę stacjonarną powoduje migrację poszczególnych
składników mieszaniny. Składniki te przemieszczają się z różną szybkością wynikającą z ich
odmiennego powinowactwa do adsorbenta, swoistego powinowactwa do ligandu, z różnic w
ich masie cząsteczkowej, z różnic w wypadkowym ładunku, bądź z różnej rozpuszczalności w
określonych warunkach rozdziału. Stąd, ze względu na naturę oddziaływań
fizykochemicznych będących podstawą rozdziału wyróżniamy pięć podstawowych metod
chromatograficznych: chromatografię adsorpcyjną, powinowactwa, sita molekularnego,
jonowymienną i podziałową. Ze względu na technikę prowadzenia rozdziału wyróżniamy
natomiast chromatografię kolumnową, w której faza stacjonarna umieszczana jest w
kolumnie, lub chromatografię planarną, w której faza stacjonarna umieszczana jest na
płaszczyźnie (chromatografia bibułowa i cienkowarstwowa).
Cel ćwiczenia
Celem ćwiczenia jest teoretyczne i praktyczne zapoznanie studentów/uczniów z
metodą cienkowarstwowej chromatografii adsorpcyjnej i jej zastosowaniem do rozdzielania
barwników roślinnych.
Wprowadzenie
W chromatografii cienkowarstwowej rozdział mieszaniny substancji wykonuje się na
cienkich warstwach nośnika osadzonych na płytkach szklanych, plastikowych lub
aluminiowych. W zależności od zastosowanego nośnika, rozdział może mieć charakter
chromatografii adsorpcyjnej (np.: na żelu krzemionkowym, tlenku glinu), podziałowej (np.:
na celulozie, skrobi) lub jonowymiennej (np.: na karboksymetylo-celulozie).
Chromatografia adsorpcyjna opiera się na zjawisku adsorpcji, czyli nagromadzeniu
cząsteczek rozdzielanych substancji na powierzchni adsorbenta za pomocą słabych
oddziaływań fizykochemicznych. W czasie przesuwania się fazy ruchomej po powierzchni
adsorbenta (faza stacjonarna), substancje słabo adsorbujące się (o mniejszym powinowactwie
do adsorbenta) przesuną się na większą odległość niż substancje silnie adsorbowane (o
większym powinowactwie do adsorbenta). Powinowactwo adsorpcyjne zatrzymywanej na
adsorbencie substancji (adsorbatu) uzależnione jest od natury chemicznej i właściwości
adsorbentu, adsorbatu oraz fazy ruchomej. Fazę ruchomą stanowi najczęściej rozpuszczalnik
lub mieszanina rozpuszczalników o różnych stopniach polarności, od węglowodorów po
alkohole i kwasy organiczne. Adsorbentem jest nierozpuszczalna w stosowanym układzie
rozpuszczalników, wysokoporowata substancja. Adsorbenty można podzielić na dwie
zasadnicze grupy, tj. polarne, np. żel krzemionkowy, tlenek glinowy, i niepolarne, np. węgiel
aktywny, talk.
Najczęściej stosowanym adsorbentem jest żel krzemionkowy - kwas krzemowy,
którego aktywność uwarunkowana jest obecnością na jego powierzchni grup
hydroksylowych. Grupy te mogą tworzyć wiązania wodorowe z polarnymi grupami
rozdzielanych substancji. Termiczna aktywacja żelu (110°C) przed rozdziałem ma na celu
usunięcie z jego powierzchni wody blokującej grupy hydroksylowe. Na polarnym adsorbencie
zachodzi silna adsorpcja substancji o charakterze polarnym, a bardzo słaba substancji
niepolarnych, stąd droga migracji substancji bardziej polarnej jest mniejsza w stosunku do
6
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.

Właściwości białek oraz rozdział barwników roślinnych.
drogi którą pokonuje substancja mniej polarna, słabiej adsorbowana. Stopień adsorpcji rośnie
wraz ze wzrostem liczby polarnych grup funkcyjnych oraz ilością podwójnych wiązań
występujących w cząsteczce adsorbatu. Na powinowactwo adsorpcyjne ma również wpływ
polarność fazy ruchomej. Rozpuszczalniki stosowane w chromatografii adsorpcyjnej
wykazują różną zdolność do wymywania (elucji) zaadsorbowanych substancji. Im większa
siła elucyjna rozpuszczalnika, tym silniej wypiera on z powierzchni adsorbenta
zaadsorbowane substancje. Tak więc, przepływ rozpuszczalnika po powierzchni żelu
krzemionkowego powoduje przemieszczanie się rozdzielanych substancji, tym szybsze, im
substancja mniej polarna i większa siła elucyjna rozpuszczalnika.
Prędkość wędrówki poszczególnych składników mieszaniny, czyli odległość, na jaką
przesunęły się one od miejsca startu w określonym czasie, wyraża się podobnie jak w
chromatografii podziałowej, tzw. współczynnikiem przesunięcia (Rf):
przesunięcie badanej substancji
przesunięcie czoła rozpuszczalnika
Rf
=
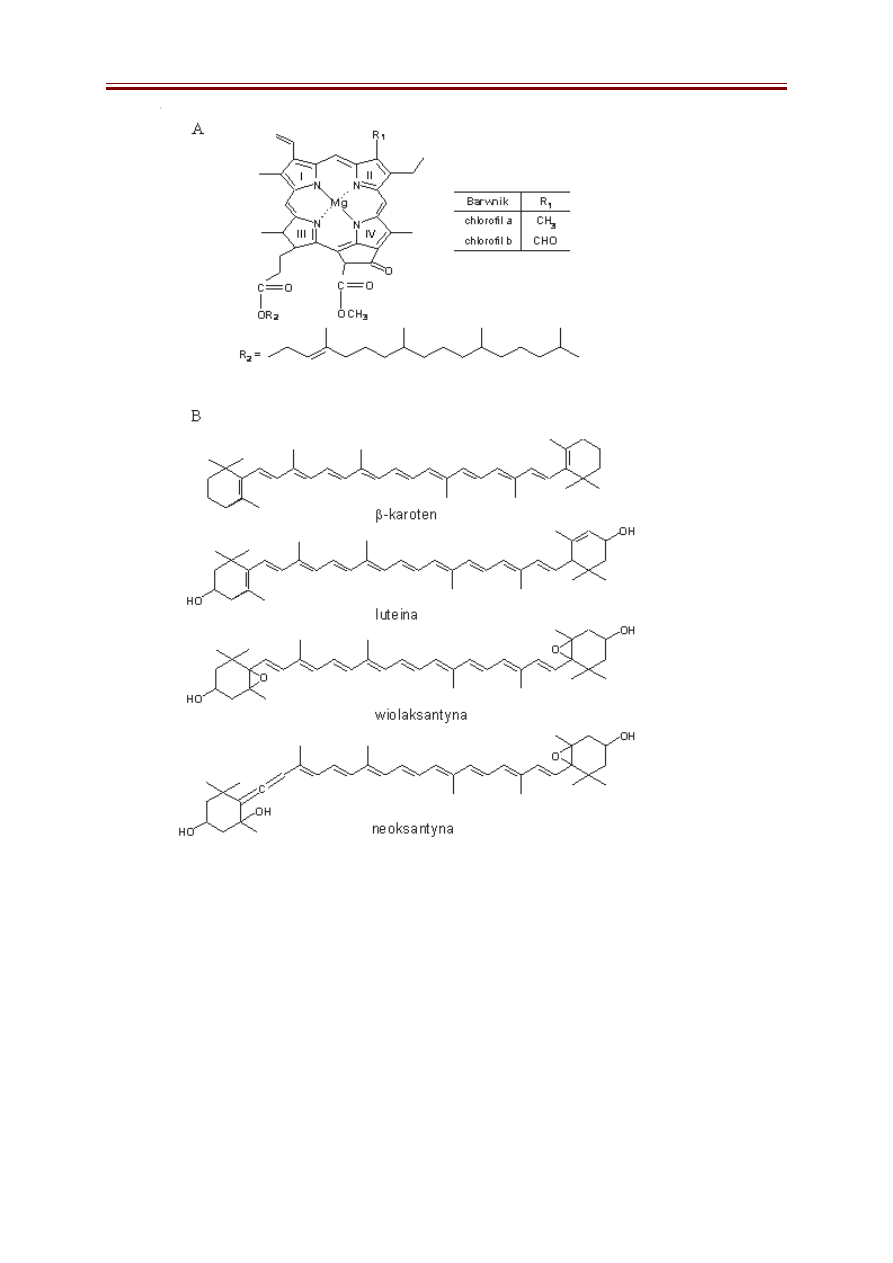
Barwniki roślinne to związki nierozpuszczalne w wodzie, natomiast dobrze
rozpuszczalne w rozpuszczalnikach organicznych. Należą do nich chlorofile oraz karotenoidy
(Rys. 4). W zielonych liściach najwięcej jest chlorofili i to one maskują barwę karotenoidów.
Ze względu na charakter budowy (brak lub obecność polarnych grup funkcyjnych) i długość
łańcuchów węglowych w cząsteczce, barwniki roślinne różnią się znacznie polarnością.
Chlorofile są to związki porfirynowe zbudowane z 4 pierścieni pirolowych
połączonych mostkami metinowymi. Atomy azotu pierścieni pirolowych są związane z
centralnie położonym atomem magnezu. Charakterystyczną cechą chlorofili jest także
obecność fitolu, hydrofobowego 20-węglowego alkoholu, związanego estrowo z grupą
propionową jednego z pierścieni (III). Chlorofil b różni się tym od chlorofilu a, że grupa
metylowa przy atomie C jednego z pierścieni (II) jest zastąpiona grupą aldehydową.
Karotenoidy to barwniki roślinne z grupy tetraterpenów. Należą do nich
pomarańczowe karoteny oraz żółte ksantofile. W liściach głównym składnikiem
karotenoidowym jest
β
-karoten, którego cząsteczka na obu końcach zawiera pierścienie
β
-jononu. Oba pierścienie połączone są długim łańcuchem węglowodorowym, w którym
występują na przemian wiązania pojedyncze i podwójne. Ksantofile są to utlenione pochodne
karotenów, zawierające w pierścieniach jononu grupy hydroksylowe, karbonylowe lub
karboksylowe. Najpowszechniej występującym ksantofilem jest luteina.
W warunkach ćwiczenia, barwniki zostaną wyekstrahowane z roślin za pomocą
acetonu, następnie zostaną naniesione w postaci mieszaniny na płytkę chromatograficzną
pokrytą warstwą żelu krzemionkowego i rozdzielone w kamerze zawierającej układ
rozpuszczalników - eter naftowy: aceton. Do rozdziału barwników zostanie wykorzystana
technika wstępująca rozwijania chromatogramu, w której rozpuszczalnik podsiąka od dołu
żelu do góry dzięki działaniu sił kapilarnych. Podczas rozwijania chromatogramu,
poszczególne związki barwne będą się przemieszczać się z różną prędkością i ułożą się w
następującej kolejności od góry płytki: karoteny o barwie pomarańczowej (ciemnożółtej),
feofityna (chlorofil, w którym Mg zastąpiony jest przez 2 atomy H) o barwie
oliwkowobrunatnej, chlorofil a o barwie niebieskozielonej, chlorofil b o barwie żółtozielonej
oraz najbardziej polarne z rozdzielanych barwników ksantofile - luteina, wiolaksantyna i
neoksantyna o barwie żółtej.
7
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Właściwości białek oraz rozdział barwników roślinnych.
Rys. 4. Wzory strukturalne podstawowych barwników roślinnych: chlorofili (A) oraz
karotenoidów (B).
Odczynniki
1. Żel krzemionkowy typu 60 G (60 - rozmiar porów 6 nm, G - 11 % domieszka gipsu)
2. Aceton
3.
Układ rozwijający - eter naftowy: aceton (7: 3)
Wykonanie
1. Przygotowanie wyciągu z liści. Odważyć 1g liści pietruszki, rozetrzeć w
moździerzu, dodać 3 ml acetonu (3) i znowu rozcierać szybko tak, aby nie wyparował aceton.
Zawartość moździerza przesączyć przez mały zwitek waty, umieszczony w lejku, do suchej
8
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.

Właściwości białek oraz rozdział barwników roślinnych.
kalibrowanej probówki.
Ewentualnie przepłukać sączek niewielką objętością acetonu, aby
końcowa objętość ekstraktu wynosiła 3 ml. Probówkę szczelnie zamknąć parafilmem.
2. Nanoszenie ekstraktu barwników na płytki z adsorbentem. Ekstrakt barwników
(60
µ
l) nanosić na wcześniej przygotowaną płytkę chromatograficzną o wymiarach 2,3
×
7,5
cm z żelem krzemionkowym bardzo małymi kroplami w postaci pasma przyjmując, że linia
startu jest oddalona 1 cm od krawędzi dolnej płytki i 0,5 cm od krawędzi bocznych. Preparat
nanosić mikropipetą w trzech porcjach (3 x 20
µ
l), za każdym razem kolejną porcję ekstraktu
nanieść dopiero po wyschnięciu poprzedniej. Uważać, aby podczas nakraplania ekstraktu nie
naruszyć warstwy żelu końcówką mikropipety !!!
3. Rozwijanie chromatogramu). Po wyschnięciu naniesionego ekstraktu, płytkę
wstawić pionowo do kamery zawierającej 4,5 ml mieszaniny rozpuszczalników (4) i przykryć
pokrywą. Linia naniesionych barwników musi znajdować się powyżej poziomu mieszaniny
rozpuszczalników, w przeciwnym razie barwniki będą przechodziły do roztworu. Zwrócić
uwagę, aby płytka w kamerze była ustawiona w pozycji możliwie dokładnie pionowej, i nie
opierała się o ściany komory jedną z krawędzi bocznych, gdyż powoduje to nierównomierne
wznoszenie się układu rozwijającego. Rozwijanie chromatogramu trwa ok. 20-30 minut.
Płytkę wyjąć z kamery w momencie, kiedy czoło rozpuszczalnika dojdzie na odległość 0,5 cm
od górnego końca płytki, i suszyć w temperaturze pokojowej przez kilka minut pod
włączonym wyciągiem.
Opracowanie wyników
Przedyskutować schemat ułożenia pasm barwników na rozwiniętym chromatogramie oraz
podać ich zabarwienie.
Literatura
1. Bielawski W., Zagdańska B. (2011) Przewodnik do ćwiczeń z biochemii.
Wydawnictwo SGGW.
2. Kacprzak F., Klimek B., Kwapińska H. (1969) Chromatografia barwników. WN-T.
3. Narval S.S., Bogatek R., Zagdańska B.M., Sampietro D.A., Vattuone M.A., (2009)
Plant Biochemistry,
4.
Sherma J., Lippstone G. S. (1964). Chromatography of chloroplast pigments on
preformed thin layers. J. Chrom. A 41, 220-227
5.
Strain H. H., Sherma J. (1969). Modifications of solution chromatography illustrated
with chloroplast pigments. J. Chem. Educ. 46, 476-483.
6. Stryer L., (2009) Biochemia, PWN
7. Witkiewicz Z. (2000). Podstawy chromatografii. WN-T.
9
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Document Outline
Wyszukiwarka
Podobne podstrony:
Fizyka II instr 2 Oswietlenie i Nieznany
6spalanie labor instr piroliza Nieznany (2)
Meteorologia almanach instr id Nieznany
Altivar 58 instr programowania Nieznany (2)
Laboratorium nr 1 instr warunko Nieznany
04 1 TRANSF OLEJOWY INSTR INSTi Nieznany (2)
2spalanie labor instr struktura Nieznany (2)
05 LF1 LF2 LF3 WYL SN INSTR UZY Nieznany
Algorytmy Lab1 INSTR WARUNKOWE Nieznany (2)
Fizyka II instr 4 Mikroklimat i Nieznany
instr serw 29z012 29z013 kuch m Nieznany
Fizyka II instr 3 Wsp U id 1767 Nieznany
instr sImpuls id 215403 Nieznany
opiekun roby instr id 336626 Nieznany
PAiRAII Instr 2007 lab2 id 3455 Nieznany
instr'11 id 215359 Nieznany
instr fin dr pop zal4 Ewidencja Nieznany
APT LAB instr 4 id 67339 Nieznany (2)
więcej podobnych podstron