
Laboratorium PRODUKTY CHEMICZNE
OZNACZANIE LICZBY KWASOWEJ W SUROWCACH
I PALIWACH
Opracowanie: dr inż. Ewa Śliwka

2
WPROWADZENIE
Ropa naftowa stanowi podstawowy surowiec, z którego otrzymuje się paliwa silnikowe i oleje
opałowe. Zwiększenie zapotrzebowania na paliwa płynne oraz wyczerpywanie się zasobów
ropy naftowej powoduje wzrost zainteresowania alternatywnymi surowcami, do których
należą biomasa oraz odpady organiczne. Rozważane są przy tym względy ekologiczne,
zwłaszcza związane z emisją ditlenku węgla oraz unieszkodliwianiem odpadów. Jako
surowiec do produkcji paliw płynnych może być wykorzystywany także węgiel.
Paliwa płynne z węgla na skalę przemysłową zaczęto uzyskiwać prawie 100 lat temu
dzięki badaniom Bergiusa, który uzyskał olej w wyniku bezpośredniego uwodornienia węgla
pod wysokim ciśnieniem wodoru (ok. 200 atm) i w temperaturze ok. 400°C. Upłynnianie
węgla może być również prowadzone na drodze uwodornienia cieczy węglowych: ciekłych
produktów pirolizy i ekstrakcji węgla oraz wytlewania węgli niskouwęglonych. Technologie
te straciły znaczenie po II-ej wojnie światowej. Obecnie zastosowanie ma pośrednia metoda
przeróbki węgla polegająca na katalitycznej konwersji gazu syntezowego, uzyskanego w
procesie zgazowania węgla (metoda Fischera-Tropscha opracowana w 1925 r.). Aktualne
prace nad upłynnianiem węgla zmierzają do opracowania procesów hybrydowych, łączących
metody bezpośredniego i pośredniego upłynniania węgla. Ze względu na to, że zasoby węgla
oceniane są na bardziej perspektywiczne niż ropa naftowa, a paliwa płynne z węgla są
paliwem bardziej przyjaznym dla środowiska niż węgiel naturalny, to mogą one stanowić
alternatywne źródło energii.
Biomasa należy do najstarszych źródeł energii, najbardziej zróżnicowanych pod
względem fizykochemicznym oraz możliwości wykorzystania. Przepisy prawne definiują
biomasę jako ulegające biodegradacji części produktów, odpady lub pozostałości pochodzenia
biologicznego z rolnictwa, łącznie z substancjami roślinnymi i zwierzęcymi, leśnictwa i
rybołówstwa oraz powiązanych z nimi działów przemysłu, w tym z chowu i hodowli ryb oraz
akwakultury, a także ulegającą biodegradacji część odpadów przemysłowych i komunalnych,
w tym z instalacji służących zagospodarowaniu odpadów oraz uzdatniania wody
i oczyszczania ścieków. Z ekologicznego punktu widzenia energetyczne wykorzystanie
biomasy jest korzystniejsze, gdyż daje zerowy bilans emisji ditlenku węgla (rośliny
pochłaniają CO
2
w trakcie uprawy, co redukuje emisję pochodzącą z użytkowania paliwa)
oraz mniejszą emisję SO
2
i CO. Unia Europejska promuje stosowanie energii ze źródeł
odnawialnych. Wg dyrektywy 2009/28/WE z dnia 23 kwietnia 2009 do roku 2020 ma
nastąpić wzrost udziału energii wytworzonej z odnawialnych źródeł w całkowitej wielkości

3
wyprodukowanej energii w krajach UE do 20%, a udział biopaliw w całkowitym zużyciu
paliw transportowych do 10%. Należy zwrócić uwagę, że przepisy dotyczące wykorzystania
alternatywnych źródeł energii zmieniają się i wprowadzają nowe definicje biomasy, odpadów
oraz biopaliw i ich podziału.
Biopaliwa ciekłe z biomasy otrzymywane są w procesach biochemicznych,
fizykochemicznych oraz termochemicznych. Obejmują one szereg różnorodnych produktów,
do których zalicza się m.in:
bioalkohole (np. bioetanol, otrzymywany w procesach biochemicznej konwersji),
biodiesel (estryfikacja oleju rzepakowego),
czyste oleje roślinne (surowe oleje, niemodyfikowane chemicznie, otrzymywane na
drodze tłoczenia i ekstrakcji).
tzw. bioolej, uzyskiwany z biomasy na drodze szybkiej pirolizy w temperaturze 400-
600
°
C
Bioalkohole, biodisel, oleje roślinne stosowane są jako substytuty lub dodatki do oleju
napędowego albo benzyny. Po raz pierwszy olej roślinny z orzechów ziemnych jako paliwo
zastosował Rudolf Diesel w 1900 roku w silniku wysokoprężnym. Bioolej może być
wykorzystany jako olej opałowy np. w kotłach, palnikach lub przerabiany na komponenty
paliw silnikowych.
Skład pierwiastkowy ropy naftowej, węgla i biomasy jest bardzo zróżnicowany
(Tabela 1). W porównaniu do ropy naftowej węgiel, zwłaszcza brunatny oraz biomasa i
biooleje zawierają znacznie więcej heteroatomów, głównie tlenu. Zawartość tlenu w ropie
naftowej wynosi od 0,01% mas. do 1% mas. (max. do 2% mas.). Około 90% tlenu występuje
w substancjach żywiczno-asfaltowych, reszta w kwasach naftenowych i tłuszczowych oraz
fenolach, alkoholach, furanach i innych ugrupowaniach. Zawartość tlenu w węglu zmienia się
w szerokich granicach od 2% mas. (antracyt) do 10% mas. w węglu kamiennym i 23% mas. w
węglu brunatnym. Ugrupowania tlenu w węglu kamiennym dzieli się na:
reaktywne, do których zalicza się: grupy karboksylowe, hydroksylowe, karbonylowe,
niereaktywne: eterowe (liniowe i cykliczne) lub zawierające tlen w rdzeniu
aromatycznym.
W węglu brunatnym występują również ugrupowania metoksylowe, które obecne są również
w torfie. W cieczach węglowych (ekstrakty, prasmoły, smoły węglowe) występują
ugrupowania fenolowe (-OH), i w znacznie mniejszych ilościach ugrupowania karboksylowe
(-COOH), które zalicza się do kwaśnych grup hydroksylowych. Uważane są one za jedne z
najbardziej reaktywnych ugrupowań cieczy węglowych. Zawartość tych ugrupowań zależy od

4
stopnia uwęglenia węgla i warunków uzyskania cieczy węglowych, np. w ekstraktach z węgla
kamiennego wynosi do ok. 4% mas., a z węgla brunatnego ponad 5% mas.
Tabela 1. Skład pierwiastkowy surowców energetycznych i wybranych paliw płynnych
Biomasa charakteryzuje się największą zawartością tlenu (do prawie 50% m/m) spośród
surowców energetycznych, przetwarzanych do paliw płynnych. Występuje on w
różnorodnych grupach funkcyjnych: hydroksylowych, karboksylowych, eterowych,
ketonowych. Odpady organiczne np. polimery syntetyczne (polietylen, polipropylen, styren)
nie zawierają tlenu, natomiast dużo tlenu zawierają frakcje organiczne odpadów
komunalnych.
Przeróbka ropy naftowej oraz surowców węglowych, biomasy i odpadów
organicznych do paliw płynnych wymaga eliminacji tlenu występującego w ugrupowaniach o
charakterze kwasowym. Do związków o charakterze kwaśnym należą kwasy karboksylowe
oraz fenole, które powodują korozję urządzeń, muszą więc być usunięte w procesach
przetwórczych. Kwaśne związki tlenowe mogą się ponadto tworzyć w produktach
Skład elementarny,
[%mas.]
C
H
N
S
O
Ropa naftowa
Wartość średnia
83-87,0
84,5
10-14
13,0
0,0-1,6
0,5
0,1-8
1,5
0,1-1,8
0,5
Węgiel kamienny
81-88
4-6
1,6-1,9
0,3-2,5
4-10
Węgiel brunatny
71
5
1
0,3-2,5
23
Drewno
46-53
5,4-7,0
0,0-0,6
0,0-0,1
44-45
Biomasa (min-max)
42-60
3-10
0,1-12,2
0,01-1,7
21-49
Smoła niskotemperaturowa
83
8,2
0,6
0,8
8,4
Smoła koksownicza
91,8
5,8
0,9
0,8
0,9
Biooleje z drewna
72,3-82,0
8,6- 8,8
0,2-0,6
17,6-9,2
Benzyna
85-88
12-14
0,1
Olej napędowy
86
14
0,1
Biodiesel (FAME)
77
12
11

5
paliwowych w wyniku działania tlenu powietrza. Szczególnie podatne na reakcje utleniania
(reakcja autokatalityczna) są nienasycone kwasy tłuszczowe, które obecne są w bioestrach.
W porównaniu do oleju napędowego biodiesel charakteryzuje się zmniejszoną odpornością na
utlenianie.
Obecność kwaśnych ugrupowań tlenowych w substancjach o dużej zawartości tlenu
może być określona jako %-owa zawartość kwaśnych grup hydroksylowych, natomiast w
ropie naftowej, w produktach paliwowych i olejach smarowych oraz biokomponentach
parametrem oceny jakości ze względu na obecność związków kwaśnych jest tzw. liczba
kwasowa (LK), wyrażana w mg KOH/g. Dla ropy naftowej wartość LK mieści się na ogół w
zakresie 0,1 – 0,5 mg KOH/g, ale może osiągać wartość do 1 mg KOH/g. Znacznie wyższą
LK (rzędu kilkudziesięciu i pow.100 mg KOH/g) charakteryzują się surowe biooleje, w
których związki kwaśne powstają w procesie pirolizy biomasy oraz podczas dłuższego
przechowywania.
Rozporządzenie Ministra Gospodarki z dnia 22 stycznia 2009 r. (Dz. U. z dnia 4
lutego 2009 r.) w sprawie wymagań jakościowych dla biopaliw ciekłych określa max. wartość
liczby kwasowej (mg KOH/g):
dla estru metylowego stanowiącego samoistne paliwo - 0,50,
dla oleju napędowego zawierającego 20% estru metylowego - 0,20.
METODY OZNACZANIA LICZBY KWASOWEJ
Za podstawowy parametr określający zawartość związków kwaśnych w ropie naftowej,
produktach naftowych, bioestrach przyjęto oznaczenie tzw. liczby kwasowej (LK, TAN –
ang. total acid number) - jest to liczba miligramów KOH potrzebna do zobojętnienia
składników kwaśnych zawartych w 1g próbki. Należy odróżniać parametr LK od
kwasowości, która jest definiowana jako liczba mg KOH potrzebna do zobojętnienia kwasów
zawartych w 100ml produktu (mg KOH/100ml). Kwasowość oznaczana jest dla produktów
zawierających niewielki ilości kwasów, np. benzyny, rozpuszczalników naftowych.
W produktach, takich jak np. ciecze węglowe, zawierających znaczne ilości tlenu, w
tym o charakterze kwaśnym (karboksylowe i fenolowe), zawartość tych substancji podawana
jest w % mas. grup OH (Z
OH
) lub tlenu (analogicznie jak skład pierwiastkowy). W przypadku,
gdy kwaśne grupy hydroksylowe są oznaczane przy użyciu miareczkowania roztworem KOH,
zawartość substancji kwaśnych można łatwo przeliczyć na LK.

6
Oznaczanie liczby kwasowej wykonuje się metodami miareczkowania przy użyciu
mianowanego alkoholowego roztworu KOH, a próbki rozpuszcza się w rozpuszczalnikach
organicznych, takich jak: izopropanol, mieszanina alkoholu izopropylowego(49,5% obj.),
toluenu (50% obj.) i wody(0,5% obj.), aceton.
Do określenia punktu równoważnikowego stosuje się wskaźniki organiczne
(fenoloftaleina, błękit alkaliczny 6B, p-naftolobenzeina). Gdy próbki są zabarwione i
niemożliwe jest użycie wskaźników wizualnych, stosuje się wtedy miareczkowanie
potencjometryczne. Można też zastosować miareczkowanie termometryczne.
Miareczkowanie wobec wskaźników
Oznaczenia LK dla produktów naftowych wykonuje się zgodnie z normami ASTM D-974, IP
177, PN-85/C-04066. Norma ASTM D-974 może być zastosowana do próbek
rozpuszczalnych lub prawie rozpuszczalnych w mieszaninie toluenu i alkoholu
izopropylowego. Ma ona zastosowanie do oznaczania kwasów i zasad, których stałe
dysocjacji w wodzie są większe niż 10
-9
i bardzo słabych kwasów. Jako wskaźnik stosuje się
p-naftolobenzeinę. Do oznaczania LK dla bioestrów przewidziana jest metoda PN-EN 14104,
w której wskaźnikiem jest fenoloftaleina.
Miareczkowanie potencjometryczne
Oznaczenie to wykonuje się w określonych normą warunkach (ASTM D 664, IP 177, ISO
6619, PN-88/C-04049). Polega ono na potencjometrycznym miareczkowaniu próbki
rozpuszczonej w mieszaninie toluenu i alkoholu izopropylowego, zawierającego 0,5 % wody,
za pomocą alkoholowego roztworu KOH z użyciem elektrody szklanej i kalomelowej. Za
punkt równoważnikowy przyjmuje się punkt przegięcia krzywej miareczkowania. W
przypadku krzywej bez wyraźnie zaznaczonego punktu przegięcia za punkt równoważnikowy
przyjmuje się odczyt potencjometru dla odpowiedniego bezwodnego roztworu buforowego.
Miareczkowanie termometryczne
Miareczkowanie termometryczne (entalpimetryczne) jest metodą analizy objętościowej, w
którym przebieg reakcji jest kontrolowany za pomocą czułego urządzenia do pomiaru
temperatury (termistor, termoelement, termometr), zanurzonego w środowisku reakcji w
naczyniu izolowanym termicznie.
Metoda ta
,
przy użyciu acetonu jako rozpuszczalnika i wskaźnika entalpimetrycznego
(opracowana przez Vaughana i Swithenbanka) może być zastosowana do oznaczania grup o
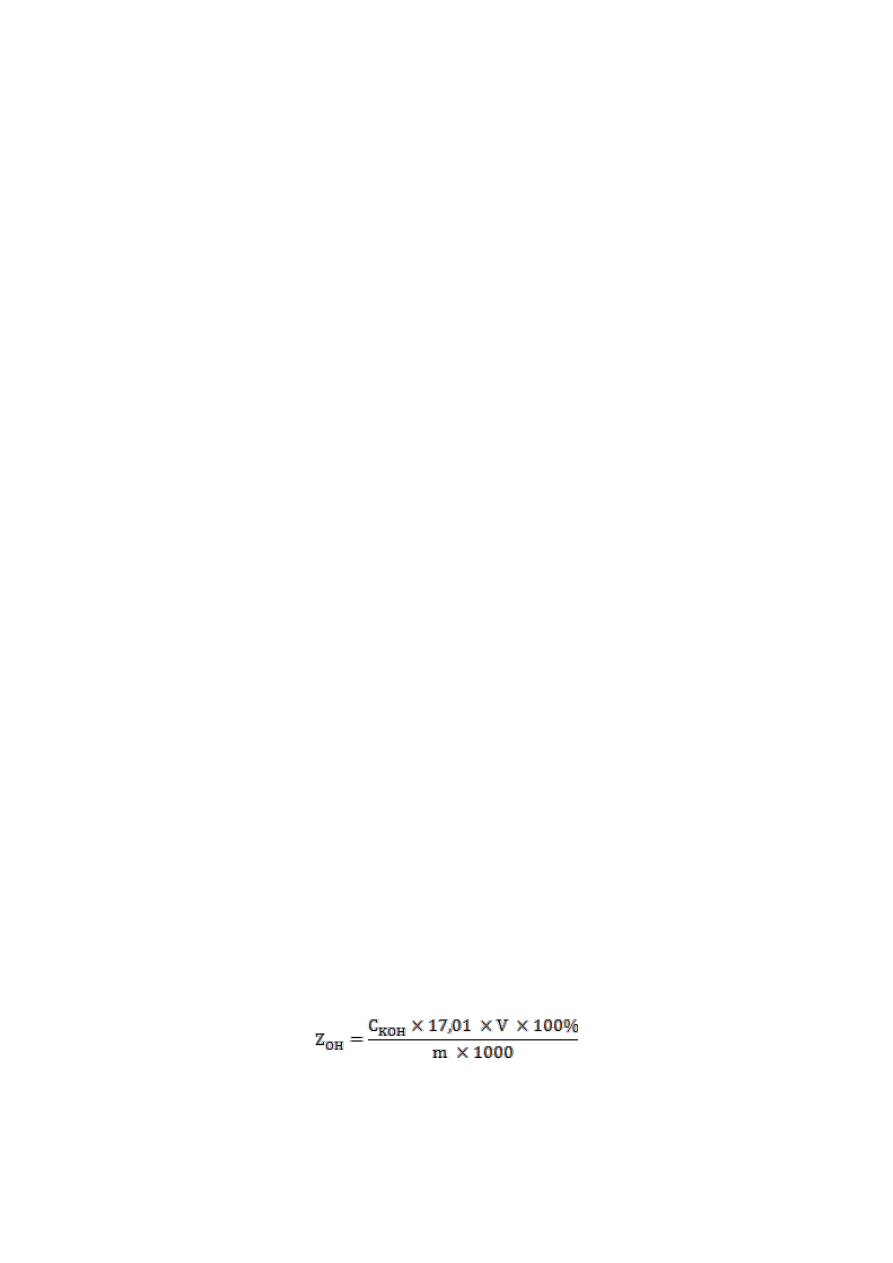
7
charakterze kwaśnym w połączeniach typu: kwasy mono-, poli- i karboksyfenoloe w próbkch
węgla i cieczy węglowych oraz innych materiałach zawierających takie ugrupowania.
Istota metody oparta jest na reakcji tworzenia alkoholu diacetonowego z acetonu,
przebiegającej z wytworzeniem ciepła. Reakcja ta jest katalizowana jonami
wodorotlenowymi, pochodzącymi z wodorotlenku potasu. Podczas miareczkowania
alkoholowym roztworem KOH obecne w próbce ugrupowania o charakterze kwaśnym:
karboksylowe i fenolowe, reagują z KOH.
Po zobojętnieniu kwaśnych grup hydroksylowych
zachodzi reakcja tworzenia alkoholu diacetonowego z acetonu, która powoduje wzrost
temperatury miareczkowanego roztworu.
2CH
3
-CO-CH
3
↔ CH
3
-CO-CH
2
-C(OH)-(CH
3
)
2
+ Q
Zmiany temperatury wykorzystuje się do wyznaczenia punktu końcowego miareczkowania,
śledząc ΔT lub T jako funkcję objętości titrantu. Do szybkiego ustalania chemicznych i
termicznych równowag konieczne jest intensywne mieszanie.
CEL ĆWICZENIA
Celem ćwiczenia jest oznaczenie liczby kwasowej w wybranych surowcach do produkcji
paliw płynnych oraz produktach paliwowych metodami miareczkowania termometrycznego
oraz z użyciem wskaźników.
WYKONANIE ĆWICZENIA
Oznaczanie zawartości kwaśnych grup hydroksylowych/liczby kwasowej metodą
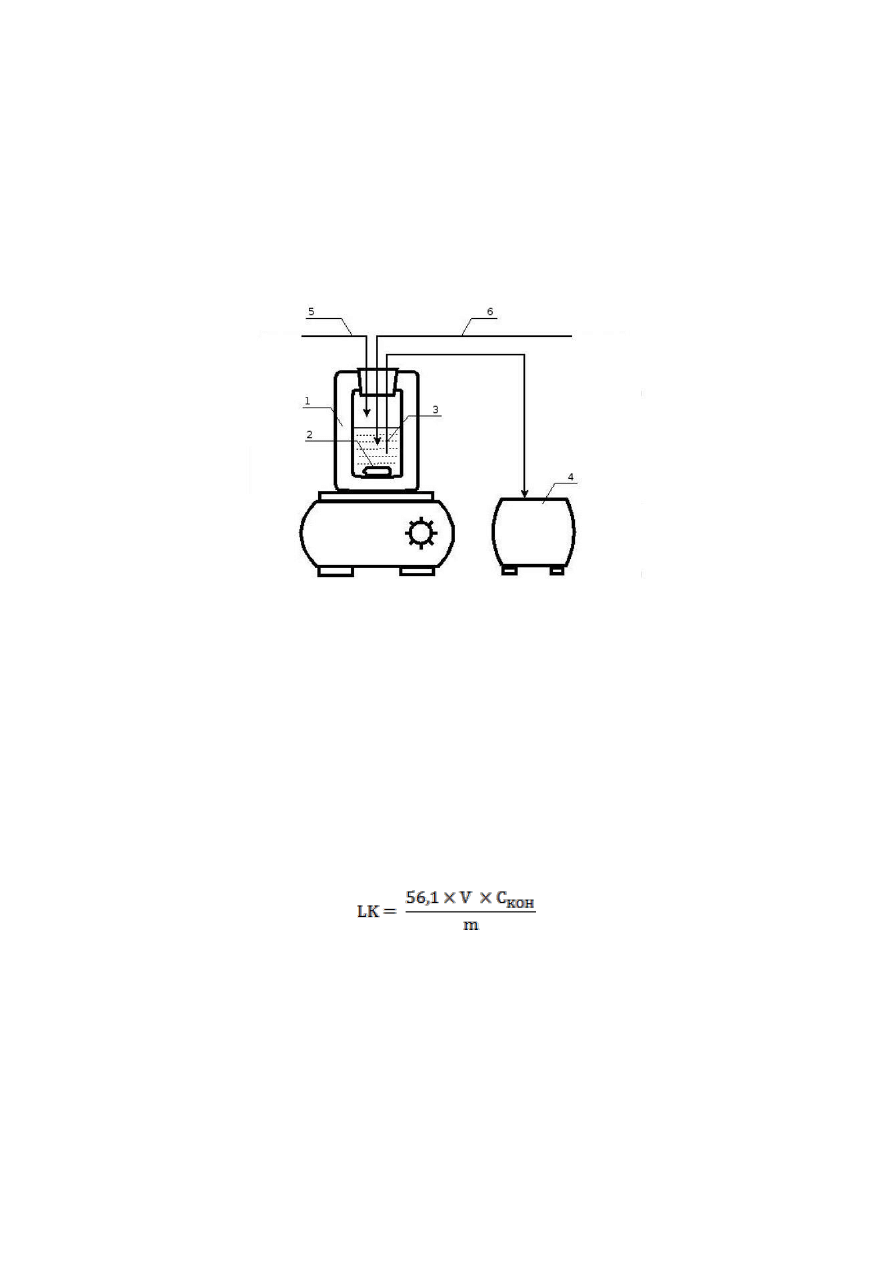
miareczkowania termometrycznego. Oznaczenie wykonuje się na aparacie, którego
schemat jest przedstawiony na Rys.1. Szczegółowy opis wykonania oznaczenia jest dostępny
na stanowisku laboratoryjnym. Miano titrantu nastawia się na odważkę kwasu benzoesowego.
Po zakończonym miareczkowaniu kwasu benzoesowego oraz badanych próbek należy
wyznaczyć objętość w punkcie równoważnikowym, wykreślając zależność temperatury w
funkcji objętości titrantu. Zawartość (%) Z
OH
kwaśnych grup hydroksylowych obliczyć wg
wzoru:
gdzie: Z
OH
– zawartość kwaśnych grup hydroksylowych [% mas.],
C
KOH
– stężenie titrantu [mol/l],
8
V
– objętość titrantu [ml],
m – masa próbki [g],
17,01 – masa molowa grupy OH
-
[g/mol].
Wynik przeliczyć również jako wartość LK.
Rys.1. Schemat aparatury do miareczkowania termometrycznego
1 – naczynie Dewara, 2 – mieszadło magnetyczne, 3 - czujnik temperatury,
4 – rejestrator temperatury, 5 – wprowadzenie acetonu, 6 – wprowadzenie roztworu KOH
Oznaczanie liczby kwasowej bioestrów. Na podstawie normy PN-EN 14104:2004 Produkty
przetwarzania olejów i tłuszczów -- Estry metylowe kwasów tłuszczowych (FAME) --
Oznaczanie liczby kwasowej, wykonać oznaczenia dla próbek surowych bioestrów. Liczbę
kwasową obliczyć wg wzoru:
gdzie: LK – liczba kwasowa [mg KOH/g]
C
KOH
– stężenie KOH [mol/l],
V
– objętość titrantu [ml],
m – masa próbki [g],
56,1 – masa molowa KOH [g/mol].
Wymienione poniżej normy są dostępne w laboratorium.

9
Sprawozdanie powinno zawierać:
krótki wstęp teoretyczny i cel ćwiczenia,
wyniki pomiarów, wykresy krzywych miareczkowania, obliczenia,
zestawienie w tabeli uzyskanych wyników,
wnioski.
LITERATURA
1. Vademecum rafinera. Praca zbiorowa pod red. J. Surygały, Warszawa: WNT, 2006.
2. Technologia przetwórstwa węgla i biomasy, pod red. M. Ściążko, H. Zielińskiego.
Instytut Chemicznej Przeróbki Węgla, Instytut Gospodarki Surowcami Mineralnymi i
Energią PAN; Zabrze - Kraków 2003.
3. Śliwka E., Rutkowska J., Metody analityczne stosowane w ocenie jakości ropy i
produktów jej przerobu,. (w) Vademecum rafinera. Praca zbiorowa pod red. J.
Surygały; Warszawa, WNT, 2006, s.92-138.
4. ASTM D-974 - 11 Standard Test Method for Acid and Base Number by Color-
Indicator Titration.
5. PN-85/C-04066 Przetwory naftowe. Oznaczanie liczby kwasowej i zasadowej oraz
kwasowości metodą miareczkowania wobec wskaźników.
6. PN-EN 14104:2004 Produkty przetwarzania olejów i tłuszczów -- Estry metylowe
kwasów tłuszczowych (FAME) -- Oznaczanie liczby kwasowej.
7. ASTM D-664 Test Method for Acid Number of Petroleum Products by Potentiometric
Titration.
8. Vaughan G.A., Swithenbank J.J., Acetone as Solvent in the Enthalpimetric Titration of
Acidic Substances, Analyst, 1965, vol. 90, 594-599.
Wyszukiwarka
Podobne podstrony:
PS i PC ćwiczenia
pc cwiczenia
Pocket PC cwiczenia praktyczne cwpopc
Komputer PC Cwiczenia praktyczne ver2 (2)
PC ćwiczenia
Cwiczenia na PC
3 ćwiczenia BADANIE asfaltów
Ćwiczenie7
Cwiczenia 2
Ćwiczenia V
więcej podobnych podstron