2013-01-12
1
CHEMIA
CHEMIA
CIAŁA STAŁEGO
CIAŁA STAŁEGO
WŁAŚCIWOŚCI MAGNETYCZNE CIAŁ STAŁYCH
Zaawansowane materiały i nanotechnologia
Zaawansowane materiały i nanotechnologia
Uniwersytet Jagiello
Uniwersytet Jagiellońński
ski
dr hab. Krzysztof Kruczała
konsultacje: środa 11:30-12:30, pokój 139
Wszystkie ciała ulegają działaniu pola magnetycznego.
Różnice w ich zachowaniu w polu magnetycznym
stanowią podstawę klasyfikacji na:
- diamagnetyki,
- paramagnetyki,
- ferromagnetyki,
- ferrimagnetyki,
- antyferromagnetyki.
Klasyfikacja ciał stałych
ze względu na właściwości magnetyczne
Diamagnetyki
(zamknięte powłoki elektronowe - brak trwałego momentu
magnetycznego, indukowany moment magnetyczny przeciwny do kierunku
zewnętrznego pola).
Paramagnetyki
(niesparowane elektrony – trwały moment magnetyczny).
Ferro-, antyferro- i ferrimagnetyki
(trwałe, uporządkowane momenty
magnetyczne).
Diamagnetyzm związany z obecnością zamkniętych powłok elektronowych
(sparowane elektrony) jest powszechną właściwością materii. Niektóre
substancje mają ponadto niesparowane elektrony, powodujące
występowanie trwałego momentu magnetycznego. Momenty magnetyczne
mogą być zorientowane przypadkowo i wówczas substancja jest
paramagnetyczna.
W przypadku uporządkowania trwałych momentów w obrębie płaszczyzn
krystalograficznych występuje ferro-, antyferro- lub ferrimagnetyzm.
paramagnetyki
ferromagnetyki
ferrimagnetyki
antyferromagnetyki
Klasyfikacja ciał stałych
ze względu na właściwości magnetyczne
B – indukcja magnetyczna
,
tj. gęstość linii sił pola magnetycznego
Gęstość linii sił pola
w substancjach
diamagnetycznych
znajdujących się
w jednorodnym polu magnetycznym
jest
mniejsza niż w próżni
.
W paramagnetykach, ferro- i ferri-
magnetykach
umieszczonych
w zewnętrznym jednorodnym polu
magnetycznym
gęstość linii sił pola
jest
większa
niż w próżni.
B < B
vac
diamagnetyki
B = B
vac
B > B
vac
paramagnetyki
ferromagnetyki
Jednorodne pole magnetyczne
elektromagnes
pró bka
b
c
a
waga Gouy’a
diamagnetyki
paramagnetyki
ferromagnetyki
Diamagnetyki
są
wypychane
z niejednorodnego pola magnetycznego.
Paramagnetyki
są
wciągane
, a
ferromagnetyki silnie wciągane
w
niejednorodne pole magnetyczne.
Niejednorodne pole magnetyczne
Gdy substancja zostaje umieszczona w jednorodnym polu
magnetycznym H, gęstość linii sił pola w próbce (
indukcja
magnetyczna, B
) jest dana przez sumę H i członu 4
l, związanego z
samą próbką:
B = H + 4
l
gdzie
l
jest
momentem magnetycznym
próbki na jednostkę objętości.
Przenikalność magnetyczna P
i
podatność
są definiowane
równaniami:
P = B/H = 1 + 4
= l /H
Podatność molowa
jest dana równaniem:
= M/d
gdzie
M
jest masą mola, a
d
gęstością próbki.
Definicje…

2013-01-12
2
Alfabet grecki
Gdy substancja zostaje umieszczona w jednorodnym polu
magnetycznym H, gęstość linii sił pola w próbce (
indukcja
magnetyczna, B
) jest dana przez sumę H i członu 4
l, związanego z
samą próbką:
B = H + 4
l
gdzie
l
jest
momentem magnetycznym
próbki na jednostkę objętości.
Przenikalność magnetyczna P
i
podatność
są definiowane
równaniami:
P = B/H = 1 + 4
= l /H
Podatność molowa
jest dana równaniem:
= M/d
gdzie
M
jest masą mola, a
d
gęstością próbki.
Definicje…
ciało stałe
P
diamagnetyki
paramagnetyki
ferromagnetyki
antyferromagnetyki
-1
10
-6
P<1
0 - 10
-2
P>1
10
-2
– 10
6
P>>1
0 – 10
-2
P>1
diamagnetyki -
P < 1
, a
i
małe i ujemne
paramagnetyki -
P > 1
, a
i
są dodatnie
Po umieszczeniu w jednorodnym polu magnetycznym liczba linii sił
przechodząca przez próbkę jest większa niż w próżni dla
paramagnetyków, a mniejsza dla diamagnetyków.
W konsekwencji
paramagnetyki są wciągane w pole magnetyczne
, a
diamagnetyki wypychane z pola
.
ferromagnetyki -
P >> 1
i obserwuje się duże wartości
i
.
Substancje te są silnie wciągane w pole magnetyczne. W
substancjach antyferromagnetycznych
P > 1
, a
i
są dodatnie.
Wartości
i
są porównywalne lub nieco mniejsze niż dla
paramagnetyków.
T
C
T
N
temperatura
Para-, ferro-
i antyferro-magnetyki
Ferromagnetyki
wykazują bardzo wysoką podatność magnetyczną
w niskich temperaturach, która spada coraz to szybciej w miarę
wzrostu temperatury. Powyżej temperatury zwanej temperaturą
Curie (T
C
) zachodzi przejście
ferromagnetyzm → paramagnetyzm
Antyferromagnetyki
wykazują wzrost
ze wzrostem temperatury
aż do krytycznej temperatury zwanej temperaturą Nėela. Powyżej
T
N
antyferromagnetyk wykazuje własności paramagnetyczne.
Zależność temperaturowa
pa
ra
m
ag
ne
ty
ki
an
ty
fe
rro
m
ag
ne
ty
ki
fer
ro
ma
gn
ety
ki
= C/(T - )
1/
prawo Curie-Weissa
Prawo Curie i Curie – Weissa
Wiele paramagnetyków spełnia
prawo Curie, szczególnie w
wysokich temperaturach:
= C/T
gdzie C jest stałą Curie.
Często lepszą zgodność z danymi
doświadczalnymi daje prawo Curie –
Weissa:
= C/(T - θ)
gdzie θ jest stałą Weissa.
T
- θ
θ
Dla substancji ferro- i antyferromagnetycznych zależność
temperaturowa
spełnia prawa Curie – Weissa dla T>T
c
lub T>T
N
W
paramagnetykach
są obecne niesparowane elektrony, których
momenty w zewnętrznym polu magnetycznym wykazują tendencję do
uporządkowanej orientacji.
W
ferromagnetykach
dipole magnetyczne ustawiają się równolegle już pod
nieobecność pola, dzięki kooperatywnym oddziaływaniom
pomiędzy spinami sąsiednich jonów w sieci krystalicznej.
Duże wartości
odzwierciedlają tu równoległe
ustawienie dużej liczby spinów. Na ogół nie wszystkie spiny są równoległe
chyba, że zastosujemy bardzo wysokie pole magnetyczne i niskie
temperatury.
W
antyferromagnetykach
momenty magnetyczne są ustawione
antyrównolegle i znoszą się wzajemnie, stąd małe wartości
.
Resztkowe wartości
są związane z zaburzeniami w
antyrównoległym ułożeniu spinów.
Dla wszystkich materiałów efekt rosnącej temperatury polega na
wzroście energii termicznej jonów i elektronów, prowadzącym do wzrostu
nieporządku strukturalnego, co osłabia efekt pola magnetycznego. Stąd dla
paramagnetyków
zmniejsza się ze wzrostem temperatury zgodnie z
prawem Curie lub Curie – Weissa.
Dla ferro- i antyferromagnetyków wzrost temperatury wnosi
nieporządek do perfekcyjnego uporządkowania spinów. Dla
ferromagnetyków powoduje to gwałtowny spadek
z rosnącą temperaturą.
W przypadku antyferromagnetyków następuje wzrost
z temperaturą.
2013-01-12
3
Diamagnetyki.
Są to ciała stałe, w których wszystkie elektrony są
sparowane. Pod nieobecność zewnętrznego pola magnetycznego
diamagnetyki nie wykazują obecności trwałych dipoli magnetycznych.
W polu magnetycznym są w nich indukowane słabe dipole magnetyczne
skierowane przeciwnie w stosunku do zewnętrznego pola.
Paramagnetyki.
Są to ciała stałe wykazujące obecność niesparowanych
elektronów, z którymi związany jest trwały moment magnetyczny. Pod
nieobecność zewnętrznego pola magnetycznego dipole są skierowane
przypadkowo. W obecności pola magnetycznego występuje tendencja do
ustawiania się dipoli zgodnie z kierunkiem tego pola. Uporządkowanie na ogół
nie jest całkowite z powodu ruchów termicznych atomów. Stąd podatność
magnetyczna
, która jest dodatnia, zależy od temperatury zgodnie z prawem
Curie:
= C/T
lub prawem Curie-Weissa:
= C/(T- θ)
Podsumowanie właściwości
magnetycznych
Ferro-
i
antyferromagnetyki
.
W
tym
typie
magnetyków
występują
oddziaływania
pomiędzy
dipolowymi
momentami
magnetycznymi,
prowadzące
do
równoległego
lub
antyrównoległego
uporządkowania
dalekiego zasięgu. W pierwszym przypadku prowadzi to do wytworzenia
silnego wewnętrznego pola magnetycznego.
Powyżej temperatury Curie ferromagnetyki przechodzą w paramagnetyki –
energia termiczna jest większa od energii oddziaływań magnetycznych,
powodując zburzenie uporządkowania dipoli. Przejście jest odwracalne –
obniżenie temperatury poniżej T
C
przywraca uporządkowanie.
Dla
pewnych
substancji
korzystne
jest
uporządkowanie
antyferromagnetyczne. Powyżej temperatury Néela uporządkowanie zanika i
następuje przejście do paramagnetyzmu.
Ferrimagnetyzm
występuje, gdy obecne są dwa rodzaje dipoli magnetycznych
o różnej wielkości. Ich antyferromagnetycznemu uporządkowaniu towarzyszą
właściwości ferromagnetyczne.
Podsumowanie właściwości
magnetycznych
Własności magnetyczne są często wyrażane w terminach momentu
magnetycznego μ, ponieważ jest to parametr, który może być
związany bezpośrednio z liczbą niesparowanych elektronów.
Zależność między
a μ wyraża się wzorem:
= N μ
2
μ
B
2
/3kT
gdzie N jest liczbą Avogadro, μ
B
magnetonem Bohra, k stałą
Boltzmanna, a T temperaturą w skali Kelvina.
Po podstawieniu wartości liczbowych na N i k otrzymujemy:
μ = 2,83 (
T)
½
μ
B
Podatność magnetyczna i moment magnetyczny, są często
wyznaczane przy pomocy wagi Gouy’a - w przypadku
paramagnetyków próbka jest wciągana w pole magnetyczne, co
objawia się pozornym wzrostem masy próbki po włączeniu pola.
Zmierzona podatność jest korygowana na różne czynniki, m. in. na
diamagnetyzm próbki i rurki na próbkę.
Moment magnetyczny
W skali atomowej źródłem magnetyzmu są niesparowane elektrony.
Właściwości magnetyczne niesparowanych elektronów pochodzą od spinu
elektronowego kwantowanego liczbą kwantową
s
i od momentu orbitalnego
kwantowanego liczbą kwantową
l
. Jednostką momentu magnetycznego jest
magneton Bohra:
μ
B
= BM = β = eh/4πmc = 9,27 x 10
-24
JT
-1
Składowa spinowa momentu magnetycznego pojedynczego elektronu wynosi:
μ
s
= g
s
[s(s+1)]
½
μ
B
gdzie g
s
= 2,0023 jest czynnikiem rozszczepienia spektroskopowego
swobodnego elektronu, a s = ½, co daje wartość momentu spinowego dla
pojedynczego elektronu równą μ
s
= 1,73 μ
B
.
Dla atomów i jonów zawierających więcej niż 1 niesparowany elektron,
całkowity moment spinowy wynosi:
μ
S
= g
S
[S(S+1)]
½
μ
B
gdzie S jest sumą spinowych liczb kwantowych poszczególnych
niesparowanych elektronów np. dla wysokospinowego jonu Fe
3+
, o 5
elektronach 3d, S = 5/2 i μ
S
= 5,92 μ
B
.
Ź
ródła magnetyzmu
Moment orbitalny związany jest w klasycznym ujęciu z ruchem elektronu
wokół jądra. Składowa orbitalna momentu magnetycznego pojedynczego
elektronu, opisywanego orbitalną liczbą kwantową l, wynosi:
μ
l
= g
l
[l(l+1)]
½
μ
B
Dla atomów i jonów zawierających więcej niż 1 niesparowany elektron,
całkowity moment orbitalny wynosi:
μ
L
= g
L
[L(L+1)]
½
μ
B
gdzie L jest sumą orbitalnych liczb kwantowych poszczególnych
niesparowanych elektronów, a g
l
= 1.
Spinowe i orbitalne składowe momentów magnetycznych ulegają
sprzężeniu według
mechanizmu Russela-Saundersa
, dając momenty
wypadkowe kwantowane liczbami kwantowymi L i S:
μ
(S+L)
= [4S(S+1) + L(L+1)]
½
μ
B
Wieloelektronowe liczby kwantowe L i S ulegają dalszemu sprzężeniu dając
całkowitą liczbę kwantową J i odpowiedni moment magnetyczny:
μ
J
= g
J
[J(J+1)]
½
μ
B
gdzie g
J
jest współczynnikiem Landego danym równaniem:
g
J
= 1 + [J(J+1)- L(L+1) + S(S+1)]/2J(J+1)
Ź
ródła magnetyzmu
Powyższe równania stosują się do wolnych atomów lub jonów.
Na ogół nie stosują się one do ciał stałych, gdyż orbitalny moment
magnetyczny jest w nich całkowicie lub częściowo zamrożony.
Efekt ten występuje szczególnie w przypadku, gdy pole elektryczne
otaczających atomów lub jonów ma niską symetrię, co może ograniczyć
orbitalny ruch elektronów.
Momenty magnetyczne obserwowane doświadczalnie są więc bardzo często
bliskie momentom ,,tylko spinowym” (spin only, s.o.).
Czynnik rozszczepienia spektroskopowego wynosi wówczas 2:
g
S
= 1 + [S(S+1) + S(S+1)]/2S(S+1) = 2, a
μ
s.o.
= g
S
[S(S+1)]
½
μ
B
, lub
μ
s.o.
= [n(n+2)]
½
μ
B
,
gdzie n – liczba niesparowanych elektronów.
Często występują dwa stany spinowe: „wysoko spinowy” i „nisko spinowy”.
Ź
ródła magnetyzmu
2013-01-12
4
Jon
Liczba
niesparowanych
elektronów
μ
S (obliczone)
μ
S+L(obliczone)
μ
zmierzone
V
4+
1
1,73
3,00
1,8
V
3+
2
2,83
4,47
2,8
Cr
3+
3
3,87
5,20
3,8
Mn
2+
5
5,92
5,92
5,9
Cu
2+
1
1,73
3,00
1,7
Momenty magnetyczne / μ
B
Paramagnetyczne kompleksy
metali przejściowych
●
Metoda wagi Gouy`a pozwala na wyznaczenie zależności
= f(T).
● Ze wzoru: μ = 2,83 (
T)
½
μ
B
możemy obliczyć efektywny moment
magnetyczny.
● Z zależności:
μ
s.o.
= g
S
[S(S+1)]
½
μ
B
, lub
μ
s.o.
= [n(n+2)]
½
μ
B
obliczamy liczbę niesparowanych elektronów w atomie przy założeniu,
że jest to moment „tylko spinowy”.
Podstawy - Hans A. Betheg (1929) i John H. Van Vleck (1932).
- wiązanie pomiędzy centralnym kationem metalu przejściowego
a otaczającymi go ligandami jest wiązaniem jonowym
- rozpatruje wpływ pola ujemnych ligandów, traktowanych jako
ładunki punktowe, na energię orbitali d centralnego atomu
(jonu)
- pod wpływem tego oddziaływania następuje rozszczepienie
orbitali d na grupy o różnej energii zależnie od tego czy orbitale
d są skierowane wzdłuż osi x, y, z, czy też pomiędzy osiami
Teoria pola krystalicznego
x
x
y
y
z
z
d
d
d
xy
xz
y z
x
y
z
d
d
Z 2
X
2-Y 2
Kształty konturów orbitali d
pięciokrotnie zdegenerowany (bez pola ligandów)
poziom d ulega rozczepieniu na dwa podpoziomy:
e
g
–
dwukrotnie zdegenerowany poziom o wyższej energii
t
2g
–
trójkrotnie zdegenerowany poziom o niższej energii
e
g
atom w polu
sferycznym
E
0
d
n
t
2g
10Dq
6Dq
4Dq
atom swobodny atom w oktaedrycznym polu
ligandów
Teoria pola krystalicznego
x
y
z
ligandy
kompleksy
oktaedryczne
liczba koordynacji -
6
e
g
d’
+3/5
-2/5
t
2g
d
= 10Dq –
rozszczepienie
w polu krystalicznym
przykłady zmiany energii elektronów w polu krystalicznym:
1 elektron zysk energii = 4Dq–energia stabilizacji
2 elektrony zysk energii = 24Dq-energia stabilizacji
6 elektronów zysk energii = 64Dq = 24Dq (
maksymalna
)
8 elektronów zysk energii = 6 4Dq – 2 6Dq = 12Dq
10 elektronów zysk energii = 6 4Dq – 4 6Dq = 0
2013-01-12
5
1.
Kolejność poziomów e i t
2g
odwrotna niż w przypadku kompleksów
oktaedrycznych (przyczyną jest to, iż ligandy zbliżają się z kierunków
leżących między osiami X,Y,Z).
2.
Energia rozczepienia w polu krystalicznym
dla kompleksów
tetraedrycznych
jest
znacznie
niższa
niż
dla
kompleksów
oktaedrycznych (na orbitale d atomu centralnego działa znacznie
mniejsza liczba ligandów )
kompleksy tetraedryczne
Teoria pola krystalicznego
x
y
z
liczba koordynacji -
4
atom w
oktaedrycznym
polu ligandów
atom w polu
sferycznym
okta
tetr
Dq
9
4
Dq
E
t
2
e
g
e
g
t
2g
sym. kulista
tetraedr
oktaedr
Rozszczepienie w polu
tetraedryczne i oktaedrycznym
1.
reguła wzrastającej energii
2. reguła Hunda
oczywiste są konfiguracje d
1
, d
2
, oraz d
3
wątpliwości zaczynają się od konfiguracji
d
4
możliwe są dwie konfiguracje:
(t
2g
)
3
(e
g
)
1
(t
2g-
)
4
4 elektrony niesparowane
2 elektrony niesparowane
konfiguracja wysokospinowa
konfiguracja niskospinowa
Zapełnianie orbitali
10 Dq(okta)
10 Dq(okta)
e
g
e
g
t
2 g
t
2g
l.k. = 6
l.k. = 6
4
3 d
Realizacja konfiguracji zależy od wartości rozszczepienia w polu
krystalicznym:
1. jeśli 10Dq < E
s
(energia sparowania elektronów) to tworzone są
kompleksy wysokospinowe
2. jeśli 10Dq > E
s
- powstają
kompleksy niskospinowe
Wartość energii rozszczepienia w polu krystalicznym
(10Dq) jest
funkcją pola elektrycznego wytwarzanego przez ligandy (im
silniejsze pole tym większa wartość
).
Ligandy
ułożone
według
wyznaczonej
eksperymentalnie
wzrastającej wartości
tworzą tzw.
szereg
szereg spektrochemiczny
spektrochemiczny::
I
-
<Br
-
<Cl
-
<F
-
<OH
-
<C
2
O
4
-
<H
2
O
O
2-
<NH
3
<NO
2
-
<<CN
-
wysokospinowe niskospinowe
Szereg spektrochemiczny
Wielkość rozczepienia w
polu krystalicznym :
1)
wartość w kompleksach jonów danego okresu
przejściowego o tej samej wartościowości i z tymi samymi
ligandami jest w przybliżeniu stała (zmienia się w wąskich
granicach)
2)
wartość w kompleksach tych samych ligandów szybko
rośnie ze wzrostem wartościowości kationu
3)
wartość w kompleksach tych samych ligandów rośnie o
około 30% przy przejściu od jonu metalu jednego okresu
przejściowego do odpowiadającego mu jonu metalu
okresu
następnego
Cr
3+
:
1s
2
2s
2
p
6
3s
2
p
6
d
3
Dlaczego jony Cr
3+
wykazują preferencję do zajmowania
pozycji oktaedrycznych?
Energia
10 Dq(tetra)
10 Dq(okta)
e
g
e
t
2g
t
2
l.k. = 4
l.k. = 6
(CFSE)tetra
3,5 Dqokta
(CFSE)okta
12 Dqokta
= 2 x (6 Dqtetra) - 4 Dqtetra = 8 Dqtetra
8 Dqtetra x 4/9 =
= 3 x 4 Dqokta =
Energia stabilizacji jonów Cr
3+
w polu krystalicznym
(ang. Crystal Field Stabilization Energy)
2013-01-12
6
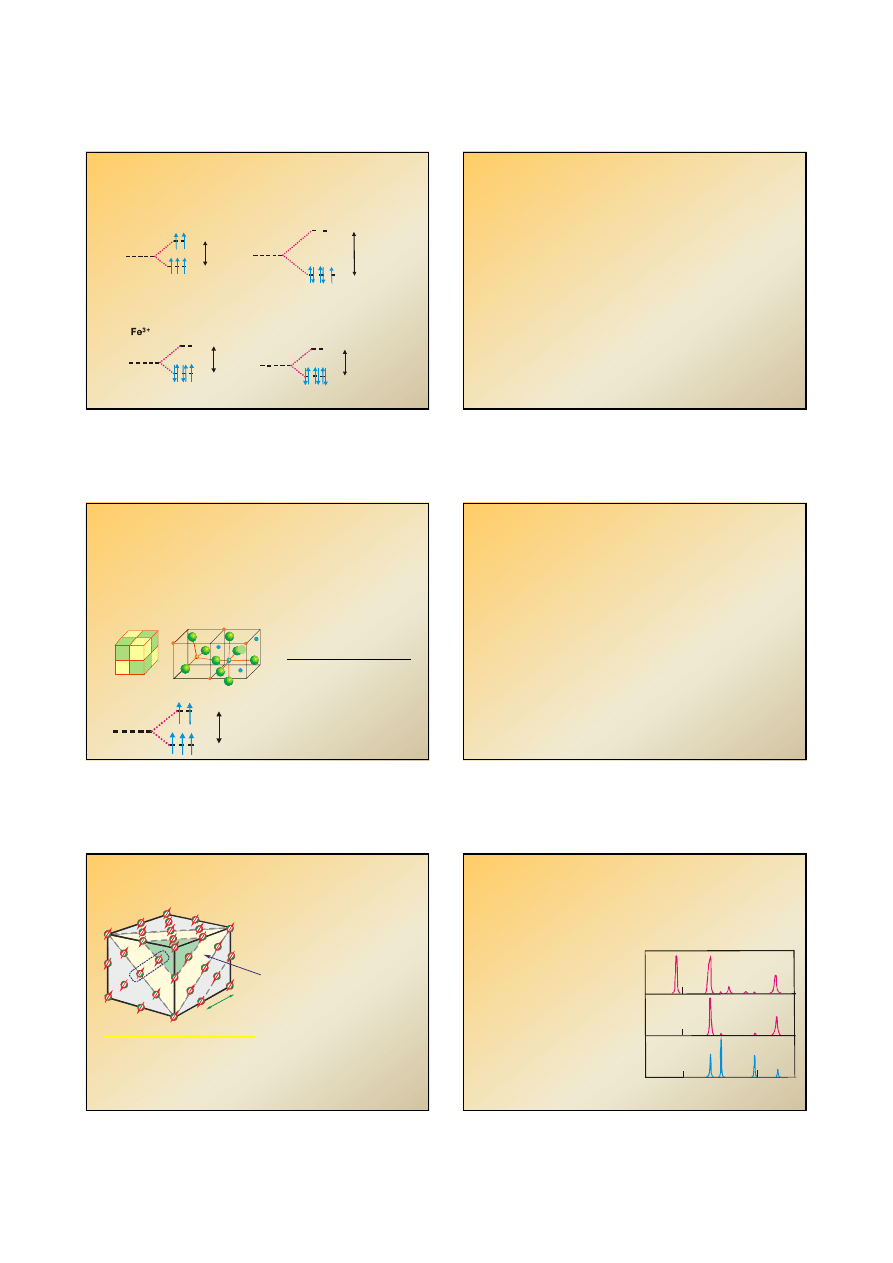
Kompleksy oktaedryczne wysoko- i nisko- spinowe
10 Dq(okta)
e
g
t
2g
l.k. = 6
wysoko-spinowy
nisko-spinowy
10 Dq(okta)
e
g
t
2g
l.k. = 6
np. d
5
, Fe
3+
Np. K
3
[FeF
6
]
Np.
K
3
[Fe(CN)
6
]
Różne stopnie utlenienia
10 Dq(okta)
10 Dq(okta)
e
g
e
g
t
2g
t
2g
l.k. = 6
l.k. = 6
diamagnetyczny
paramagnetyczny
Fe
2+
Przykłady
związki o ogólnym wzorze AB
2
O
4
– najczęściej
gdzie
A - metal z drugiej grupy układu okresowego lub metalem
przejściowym na drugim stopniu utlenienia,
B - metal z trzeciej grupy układu okresowego lub metalem
przejściowym na trzecim stopniu utlenienia.
Jony tlenkowe tworzą sieć
regularną o najgęstszym ułożeniu
, w
której występują
luki tetraedryczne
i
luki oktaedryczne
.
Komórka elementarna spinelu (8 AB
2
O
4
) obejmuje 32 jony tlenu, 64
luki tetraedryczne, z których 8 jest zajętych przez jony metalu, oraz
32 luki oktaedryczne, które są obsadzone w połowie.
spinel jest normalny
- jony M
2+
obsadzają luki tetraedryczne, a jony
M
3+
luki oktaedryczne
spinelu odwróconego
- połowa jonów M
3+
znajduje się w lukach
tetraedrycznych, a druga połowa wraz ze wszystkimi jonami M
2+
obsadza luki oktaedryczne, mówimy o strukturze
Spinele
4
3
2
2
O
B
A
- magnetyczne spinele,
- ważne z komercyjnych względów,
-MFe
2
O
4
, gdzie obok Fe
3+
występuje kation M
2+
, np. Fe
2+
, Ni
2+
, Cu
2+
.
Są to spinele częściowo lub całkowicie odwrócone, gdyż jon Fe
3+
o
konfiguracji d
5
nie ulega stabilizacji w pozycjach oktaedrycznych w
słabym polu krystalicznym ligandów tlenkowych. Duże jony M
2+
lokują
się w pozycjach oktaedrycznych, a Fe
3+
zostaje rozmieszczony
zarówno w lukach o symetrii tetraedrycznej jak oktaedrycznej.
A
B
A
B
O
2-
AB
2
O
4
A = Fe
2+
, Mn
2+
, Co
2+
, Zn
2+
B = Fe
3+
, Cr
3+
, Al
3+
, Mn
3+
luki T
d
64 1/8 8 8 A
spinel normalny [A]
T
[B
2
]
O
O
4
spinel odwrócony [B]
T
[AB]
O
O
4
10 Dq(okta)
e
g
t
2g
l.k. = 6
Fe
3+
Ferryty
Tlenki pierwszego szeregu przejściowego wykazują duże zróżnicowanie
własności w zależności od liczby atomowej i liczby elektronów d.
Tlenki
występujące
na
początku
pierwszego
szeregu
pierwiastków
przejściowych (Sc,
Ti, V, Cr
, Mn, Fe, Co, Ni, Cu) są
diamagnetyczne
(T
iO, VO,
CrO
). Elektrony d w tych tlenkach nie są zlokalizowane na indywidualnych
jonach M
2+
lecz zdelokalizowane na całą strukturę w częściowo zapełnionym
paśmie
t
2g
.
Nie
ma
magnetycznego
oddziaływania
pomiędzy
tymi
zdelokalizowanymi elektronami i w konsekwencji są to diamagnetyki i dobre
przewodniki elektryczności.
Dalsze tlenki w tym szeregu,
MnO, FeO, CoO i NiO
są
antyferromagnetyczne
w niskich temperaturach i przechodzą w paramagnetyki powyżej temperatury
Neela T
N
. W tych tlenkach elektrony d są zlokalizowane na poszczególnych
jonach M
2+
. Lokalizacja niesparowanych elektronów jest odpowiedzialna
zarówno za antyferromagnetyczne właściwości tych tlenków jak i za brak
przewodnictwa elektrycznego.
Tlenki metali przejściowych o
strukturze antyferromagnetycznej
(111)
a
MnO FeO CoO NiO
T
N
/
o
C -153 -75 -2 +250
Temperatura Neela wynosi
dla MnO -153
o
C (120 K),
dla FeO –75
o
C (198 K),
dla CoO -2
o
C (271 K),
a dla NiO 250
o
C (523 K).
Struktura jest taka sama w obu
zakresach temperatur, lecz np. NiO
poniżej 250
o
C ulega romboedrycznej
dystorsji.
W NiO zachodzi słaba kontrakcja
struktury
wzdłuż
jednej
z
trójkrotnych osi równoległych do
kierunku [111].
Podobna
kontrakcja
zachodzi
w
MnO, lecz np. w FeO przeciwnie,
struktura jest nieco wydłużona.
neutrony, 80 K
neutrony, 293 K
RTG, 293 K
a = 8,85 A
a = 4,43 A
a = 4,43 A
111
111
222
111
200
220
311
200
220
311
622
511
331
0
20
40
60
80
2Θ/
o
MnO
Struktury antyferromagnetyczne można badać metodą
dyfrakcji neutronów
.
Dwa
rodzaje
rozpraszania
uczestniczą
w
tak
otrzymanym
obrazie
dyfrakcyjnym:
rozpraszanie przez jądra atomowe
i przez
niesparowane
elektrony
. Pierwsze daje obraz podobny do dyfrakcji rentgenowskiej, choć
intensywności mogą być nieco różne.
W przypadku struktur
antyferromagnetycznych
występuje także
drugi typ rozpraszania powodujący
pojawienie się
dodatkowych linii
w
dyfraktogramie neutronowym.
Jest on skutkiem
kooperatywnego
oddziaływania
pomiędzy
niesparowanymi
elektronami
, co może powodować
powstanie nadstruktury.
Ponadto, zachodzi
silne rozpraszanie
neutronów
przez niesparowane elektrony,
podczas gdy promienie rentgenowskie nie
ulegają takiemu rozpraszaniu.
Dyfrakcja neutronów
Wyszukiwarka
Podobne podstrony:
fizyka ?danie właściwości magnetycznych ciał stałych
20 mg?danie właściwości magnetycznych ciał stałych, temp Curie
Fizyka laboratorium 4?danie ciepła właściwego cieczy i ciał stałych
kk6 Właściwości elektryczne ciał stałych
kk9 Właściwości mechaniczne ciał stałych
Fizyka laboratorium 4?danie ciepła właściwego cieczy i ciał stałych
kk6 Właściwości elektryczne ciał stałych
MAGNETYCZNE WŁAŚCIWOŚCI CIAŁ STAŁYCH
wyznaczanie Ciepła właściwego ciał stałych - 1
Pomiar ciepła właściwego ciał stałych
Wyznaczanie ciepła właściwego ciał stałych, Automatyka i Robotyka Rok I
Wyznaczanie ciepła właściwego ciał stałych, Automatyka i Robotyka Rok I
WYZNACZANIE ZALEZNOSCI CIEPLA WLASCIWEGO CIAL STALYCH OD TEMPERATURY 2
ciepło właściwe ciał stałych poprawione
wyznaczanie ciepła właściego ciał stałych, Transport i Logistyka (AM) 1 (semestr I), Fizyka, fiza la
SPR26, Studia, Pracownie, I pracownia, 26 Wyznaczanie ciepła właściwego ciał stałych metodą kaloryme
więcej podobnych podstron