1 |
S t r o n a
MIKROBIOLOGIA JAMY USTNEJ, WYKŁAD 1, 14.03.2013
dr n.med. Małgorzata Brauncajs
Klasyfikacja bakterii. Budowa i biologia komórki bakteryjnej. Mechanizmy chorobotwórczości
bakterii. Podstawy epidemiologii - rezerwuar zarazka, źródła zakażenia, przenosiciele
zarazków, drogi i wrota zakażenia, nosicielstwo bakterii chorobotwórczych.
Fizjologiczna flora bakteryjna człowieka.
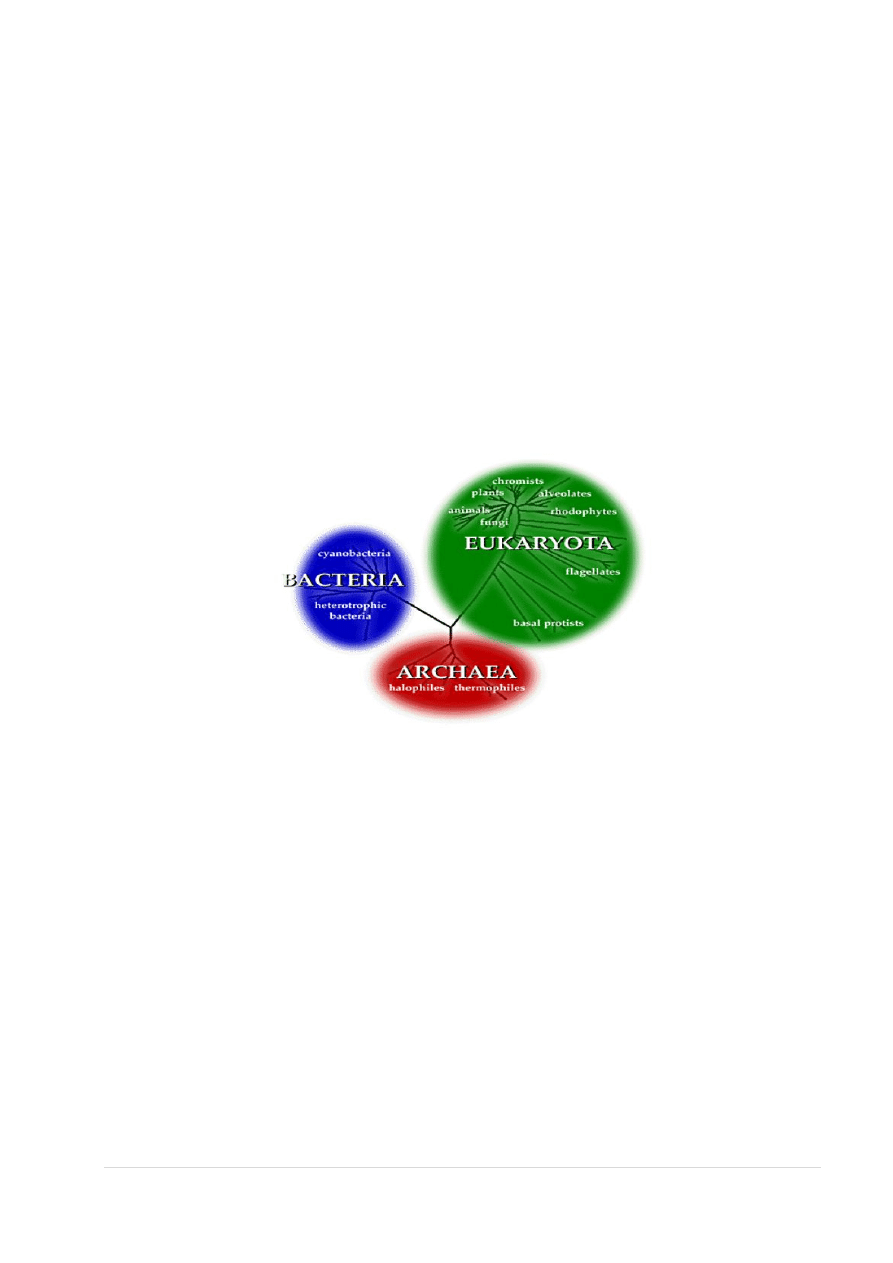
Drzewo życia – czyli filogenetyczny podział organizmów planety Ziemia
FILOGENETYKA - dyscyplina biologii zajmująca się odtwarzaniem dróg rozwoju rodowego poszczególnych
grup organizmów, zarówno żyjących współcześnie, jak i w epokach minionych.
• Drzewo filogenetyczne zbudowane jest w oparciu o taksony
• Takson - grupa organizmów na tyle do siebie podobnych, że można ją wyróżnić i zaklasyfikować do
jakiejś kategorii systematycznej np. klasy, rodziny, gatunku
• Podstawową jednostką klasyfikacji biologicznej jest gatunek
Systematyka:
Królestwo:
bakterie
Typ :
Firmicutes
Klasa:
Bacilli
Rząd:
Bacillales
Rodzina:
Staphylococcaceae
Rodzaj :
Staphylococcus
Gatunek:
Staphylococcus epidermidis
Klasyfikacja/ Identyfikacja bakterii
Cechy fenotypowe
- Morfologiczne- morfologia komórki, barwienie, morfologia i fizjologia kolonii
- Biochemiczne- biotyp
- Antygenowe- serotyp, serowar, serogrupa
- Skład chemiczny: lipidów, cytochromów, aminokwasów, profile białkowe, profile
produktów fermentacji kwasów tłuszczowych, charakterystyka enzymów

2 |
S t r o n a
Cechy genotypowe
- Skład zasad w DNA (C+ G- od 25 do 75 mol%)
-
Badanie materiału nieulegającego transferowi- rRNA
(podjednostki rybosomy: 16S rRNA (mała),
%S i 23S rRNA (duże) - tworzą operon, który zawiera regiony z sekwencjami konserwatywnymi- 100 %
homologii pomiędzy organizmami i regionami zmiennymi)
- Badanie homologii DNA- pokrewieństwo w obrębie gatunku
- Identyfikacja genów zjadliwości, oporności..- PCR
- Sekwencjonowanie DNA- określenie genomu
Budowa komórki bakteryjnej:
1. Ściana komórkowa— występuje u wszystkich bakterii z wyjątkiem rodzaju Mycoplasma,
sferoplastów, protoplastów oraz form L bakterii. Peptydoglikan (mureina, mukopeptyd) –
składnik nie występujący u Chlamydii.
Cząsteczka peptydoglikanu to heteropolimer o złożonej budowie:
Szkielet mureiny – naprzemiennie ułożone reszty N-acetyloglukozoaminy i kwasu N-
acetylomuraminowego, połączonych wiązaniami β-1,4 (wiązanie wrażliwe na działanie
lizozymu).
Ściana komorkowa bakterii Gram(+):
• Peptydoglikan – stanowi 50-90% składnikow ściany komórkowej (40 warstw),
• Kwasy tejchojowe zawierające reszty rybitolu lub glicerolu połączone wiązaniami
fosfodiestrowymi
- rybitolowy kwas tejchojowy (kwas tejchojowy ściany), zbudowany z fosforanu
polirybitolu, związany kowalencyjnie z peptydoglikanem,
- glicerolowy kwas tejchojowy (lipotejchojowy) – zbudowany z fosforanu glicerolu,
związany z glikolipidami błony,
• Polisacharydy (mannoza, ramnoza, glukoza, arabinoza itp.),
• Białka (np. białko M u Streptococcus pyogenes – czynnik wirulencyjny; białko A
u Staphylococcus aureus).
Ściana komórkowa bakterii Gram(-):
• Peptydoglikan – 5-20% składników ściany komórkowej; zwykle pojedyncza warstwa
mureiny (2-3) zlokalizowana w przestrzeni periplazmatycznej.
• Błona zewnętrzna ściany komórkowej – podwójna warstwa fosfolipidów, w której
zewnętrzna warstwa została zastąpiona lipopolisacharydem. W skład błony zewnętrznej
wchodzą:
- lipopolisacharyd (LPS) – zbudowany z 3 części: lipidu A (warunkuje aktywność
endotoksyny),oligosacharydu rdzeniowego (antygen wspólny — CA = common
antigen) oraz O-swoistego łańcucha bocznego (antygen somatyczny O),
- białka porynowe (np. OmpC) – umożliwiają swobodną dyfuzję cząsteczek przez błonę,
- białka receptorowe dla bakteriofagów,
- białka nieporynowe (np. OmpA, receptor fimbrii płciowych),
- białka enzymatyczne: proteazy, fosfolipazy, białka wiążące penicyliny – PBP
• Przestrzeń periplazmatyczna – między błoną wewnętrzną (cytoplazmatyczną) a błoną
zewnętrzną; zawiera liczne białka enzymatyczne (transportowe, degradujące
(hydrolazy),syntetyzujące.
• Lipoproteina (LP) — tworzy mostki między peptydoglikanem a błoną zewnętrzną.
3 |
S t r o n a
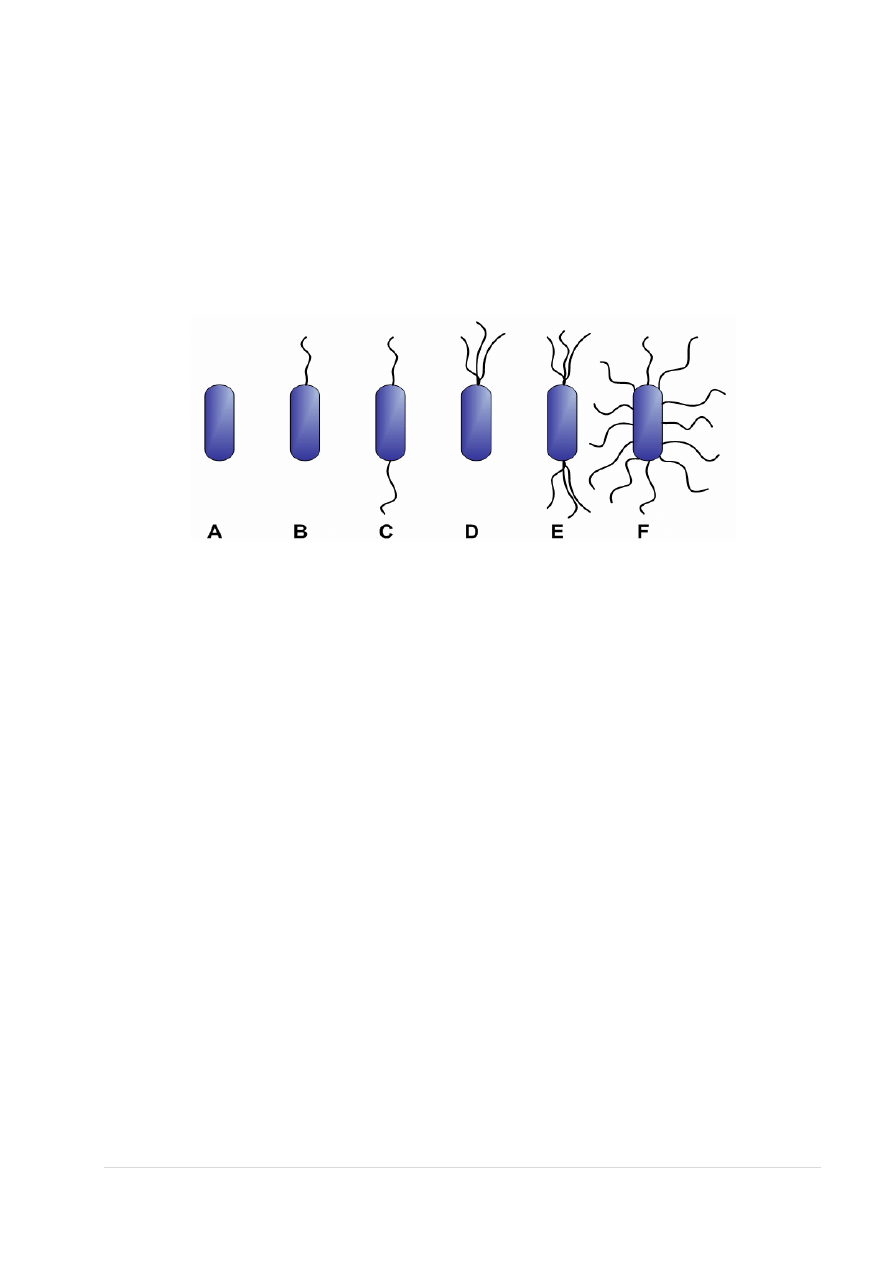
2. Rzęski- To zewnątrzkomórkowe struktury odpowiadające za ruch bakterii. Najczęściej spotykane
są wśród bakterii spiralnych i cylindrycznych. Zbudowane są z białka kurczliwego – flagelliny
i zakotwiczone są w cytoplazmie, błonie i ścianie komórkowej za pomocą haczyka i ciałka
podstawowego (bazalnego). Liczba i rozmieszczenie rzęsek ma znaczenie taksonomiczne .
3. Przetrwalniki – zdolność wytwarzania przetrwalników posiadają laseczki czyli bakterie Gram-
dodatnie, cylindryczne z rodzajów Bacillus i Clostridium. Przetrwalniki są to formy przetrwalne
bakterii, które tworzą się w niekorzystnych warunkach środowiska w procesie sporulacji wewnątrz
komórki bakteryjnej. Typ przetrwalnikowania jest cechą diagnostyczną (u laseczek Bacillus sp.
przetrwalnik nie deformuje komórki, a deformuje u laseczek Clostridium sp.). Przetrwalnik
zbudowany jest z rdzenia stanowiącego cytoplazmę otoczoną błoną cytoplazmatyczną, ścianą
komórkową oraz korteksu (kory).
Typy urzęsienia bakterii:
A) bezrzęse
B) monotrichalne
C) amfitrichalne
D) lofotrichalne
E) ditrichalne
F) peritrichalne
4. Błona cytoplazmatyczna – jest położona pomiędzy ścianą komórkową a cytoplazmą. Zbudowana jest z
białka i fosfolipidów. Błona pełni funkcję transportową przepuszczając substancje odżywcze do
wnętrza komórki i wydalając zbędne metabolity. Transport ten może się odbywać na drodze pasywnej,
zgodnie z gradientem stężeń lub aktywnej wbrew gradientowi stężeń z wykorzystaniem energii oraz
enzymów – permeaz.
5. Cytoplazma – wypełnienie komórki, w którym zawieszone są organelle wewnątrzkomórkowe. Składa
się w 80% z wody i substancji organicznych. Stanowi środowisko reakcji enzymatycznych.
6. Rybosomy – organelle zawieszone w cytoplazmie, biorące udział w syntezie białek. W komórkach
prokariotycznych występują rybosomy 70S składające się z dwóch podjednostek 30S i 50S. Zbudowane
są głównie z RNA. W cytoplazmie mogą tworzyć skupiska zwane polisomami.
7. Nukleoid – to materiał genetyczny (genom) w postaci DNA, w którym znajduje się informacja
genetyczna odnośnie podstawowych funkcji życiowych komórki bakterii. Nukleoid jest zakotwiczony w
błonie cytoplazmatycznej lub w ścianie komórkowej.

4 |
S t r o n a
8. Otoczki – bakteryjne egzopolimery (polimery zewnątrzkomórkowe) o grubości 0,2-1,0
m, ściśle
związane ze strukturami powierzchniowymi komórki bakteryjnej. Synteza otoczek jest kontrolowana
genetycznie, ale może być też zależna od warunków środowiska (np. obecność CO2 indukuje syntezę
otoczki u Bacillus anthracis).
Szczepy otoczkowe wytwarzają na podłożu stałym kolonie gładkie (typu S), zaś bezotoczkowe kolonie
szorstkie(typu R). Otoczki trudno barwią się konwencjonalnymi metodami barwienia. Ich obecność
można wykryć stosując:
- barwienie negatywne (tusz chiński, nigrozyna),
- barwienie negatywno – pozytywne (metoda Burin-Ginsa),
Budowa chemiczna otoczek:
otoczki polisacharydowe – większość bakterii otoczkowych (np. Enterobacteriaceae, Streptococcus
pneumoniae, Neisseria, Haemophilus) – zbudowane z cukrów obojętnych (heksozy, pentozy),
aminocukrów lub kwasów uronowych:
• homopolimery cukrowe (np. otoczka szczepu E. coli K1 zbudowana z kwasu N-
acetyloneuraminowego),
• heteropolimery cukrowe (otoczki Streptococcus pneumoniae),
otoczki peptydowe (niektore bakterie Gram(+)):
• Bacillus anthracis (otoczka zbudowana z kwasu D-glutaminowego),
• Bacillus subtilis (otoczka zbudowana z mieszaniny izomerow D i L kwasu glutaminowego)
Otoczki bakteryjne indukują odporność humoralną w zakażonym organizmie (produkcja przeciwciał).
Ze względu na właściwości serologiczne otoczki wielu gatunków bakterii (np. Enterobacteriaceae)
noszą nazwę antygenu K .
Różnice w budowie chemicznej otoczek są podstawą wyodrębnienia typów otoczkowych w obrębie
określonego gatunku bakterii. Przykłady:
Streptococcus pneumoniae – 85 typów otoczkowych,
Escherichia coli – ponad 100 typów otoczkowych.
Biologiczne właściwości otoczek:
• ochrona komórek bakteryjnych przed niekorzystnymi czynnikami środowiska (wyschnięciem),
• wpływ na dyfuzję rożnych molekuł zarówno z, jak i do komórki (utrudniona penetracja
niektórych antybiotyków do komórek okrytych otoczką),
• udział w patogenezie; bakterie chorobotwórcze, izolowane z materiałów klinicznych prawie
zawsze wykazują obecność otoczek, pasażowanie szczepów bakteryjnych in vitro z reguły
prowadzi do ich utraty.
9. Na powierzchni błony komórkowej występuje glikokaliks. Zbudowany jest on z reszt cukrowych
połączonych z białkami błonowymi (glikoproteinami) lub lipidami zewnętrznej warstwy błony
(glikolipidy). Glikokaliks pośredniczy w transporcie, nawilża komórkę, odpowiada za procesy
immunologiczne (rozpoznawanie obcych ciał) oraz za tworzenie zespołów komórkowych. Glikoproteidy
powierzchniowe nadają właściwości antygenowe komórkom, tworzą osłonę dla komórek, są
odpowiedzialne za agregację i aglutynizację komórek.

5 |
S t r o n a
10. Fimbrie - sztywne, powierzchniowe twory zbudowane z białka piliny (białko immunogenne). Występują
u bakterii G(-) oraz nielicznych Gram(+) (Corynebacterium, Streptococcus). Fimbrie są krótsze i
delikatniejsze od rzęsek. Ich liczba na powierzchni komórki jest zrożnicowana (od kilku do kilkuset).
Wyróżnia się dwa typy fimbrii: fimbrie płciowe oraz fimbrie adhezyjne (zwykłe).
Fimbrie płciowe – obecne w niewielkiej liczbie (1-3) na powierzchni komórek bakterii Gram(-).
Uczestniczą w transferze materiału genetycznego (plazmidy, chromosomalny DNA) z komórki
dawcy (F+, R+, Hfr) do biorcy (F-, R-, Hfr-) w procesie koniugacji. Fimbrie płciowe rozpoznają,
a następnie wiążą się z białkiem receptorowym (OmpA) na powierzchni komórki biorcy. Zawierają
one kanał umożliwiający przekazywanie materiału genetycznego. Geny kodujące fimbrie płciowe
znajdują się w obrębie plazmidów koniugacyjnych. Niektóre fimbrie płciowe są miejscem
receptorowym dla bakteriofagów (np. fimbrie F – f1, f2, QB).
Fimbrie zwykłe (adhezyjne) – syntetyzowane w dużej liczbie (kilkaset) na powierzchni komórek
bakterii G(-) (Enterobacteriąceae, Haemophilus, Pseudomonas, Acinetobacter, Neisseria
gonorrhoeae). Należą do lektyn – białek rozpoznających i wiążących swoiste receptory
(polisacharydy, glikoproteiny, glikolipidy) na komórkach gospodarza. Uznawane za wyznaczniki
chorobotwórczości – uczestniczą w adhezji / asocjacji komórek bakteryjnych do powierzchni
nabłonka wyścielającego drogi oddechowe, przewód pokarmowy, układ moczowy (kolonizacja).
11. Wtręty cytoplazmatyczne:
• ziarnistości wolutyny (polimer metafosforanu) – Corynebacterium diphtheriae,
• polimer kwasu poli-P-hydroksymasłowego,
• ziarenka wolnej siarki,
• ziarenka skrobi,
• ziarenka lipidów.
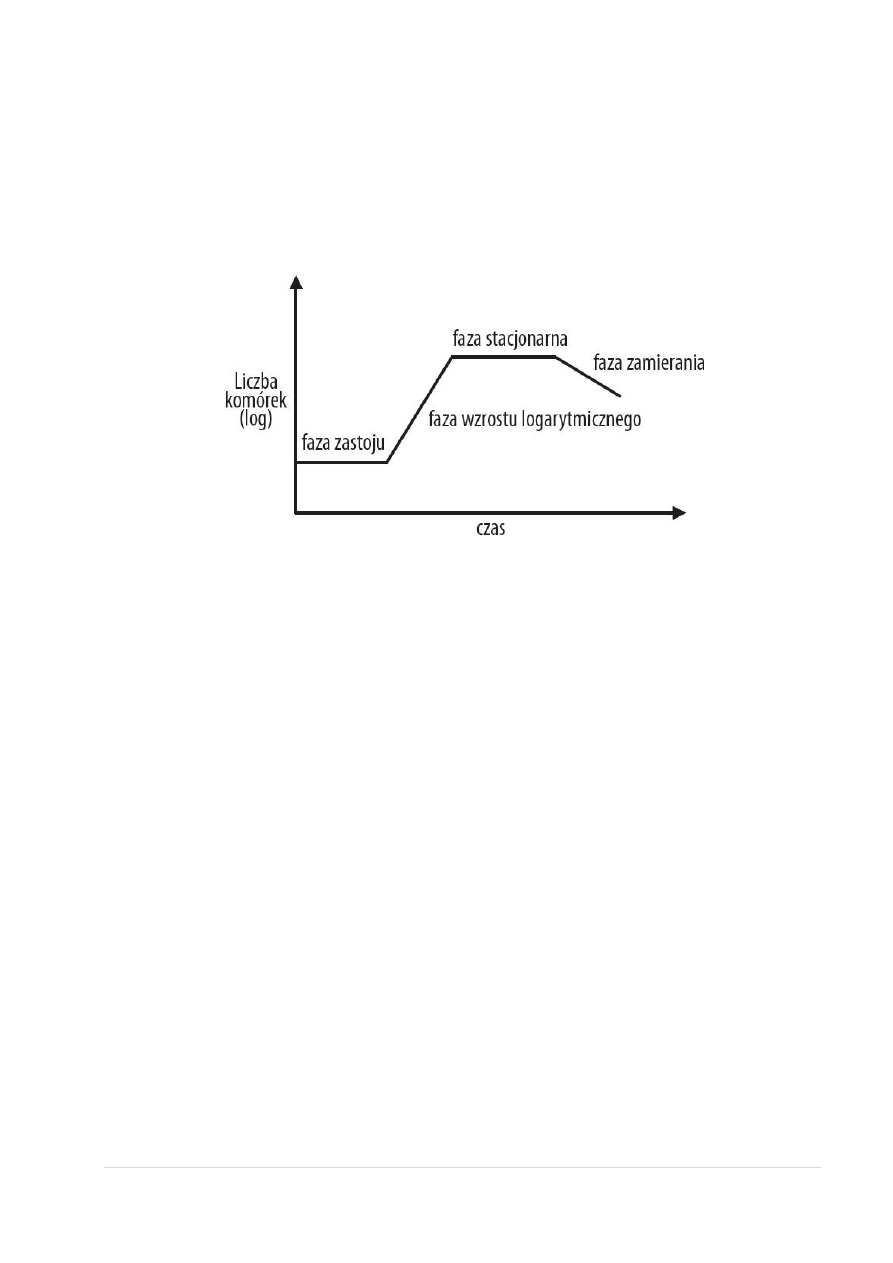
W hodowli statycznej mikroorganizmy posiane do pożywki rosną i rozmnażają się do czasu wyczerpania
się składników pokarmowych lub (i) nagromadzenia się toksycznych produktów przemiany materii. W
tego typu hodowli rozwój populacji bakterii przebiega w kilku charakterystycznych fazach, które można
zobrazować na wykresie w postaci tzw. krzywej wzrostu:
1) faza zastoju,
2) faza wzrostu logarytmicznego (wykładniczego),
3) faza stacjonarna,
4) faza zamierania.
W fazie zastoju w zaszczepionych komórkach (inokulum) zachodzą procesy adaptacji polegające
na syntezie potrzebnych enzymów, replikacji DNA, syntezie białek i w efekcie komórki zwiększają
swoje rozmiary. Długość tej fazy zależy od podobieństwa warunków hodowli poprzedniej (z której
pochodzi inokulum) do warunków panujących w nowej hodowli. Im jest ono większe, tym faza jest
krótsza.
W fazie wzrostu logarytmicznego komórki zaczynają się dzielić. Sygnałem do podziałów jest
osiągnięcie przez komórki odpowiedniej długości. Każda komórka dzieli się na dwie. Po
określonym czasie wzrostu powstałe komórki znowu dzielą się na dwie, stąd liczbę powstałych
komórek (czyli wzrost populacji) określa wzór 2
n
, gdzie n – to liczba podziałów, która jest
równoznaczna z liczbą pokoleń. Czas między dwoma kolejnymi podziałami, to tzw. czas generacji
lub wiek osobniczy. Zależy on od warunków hodowli i od cech gatunkowych drobnoustroju. W
konkretnej hodowli jest on więc stały. Jeśli liczba komórek w inokulum wynosi N
0
, to powstała
liczba komórek N po n pokoleniach wyniesie N = N
0
x 2
n
. Liczba bakterii podwaja się co każdy
okres generacji, rośnie więc wykładniczo z upływem czasu. Do czasu hodowli proporcjonalny jest
więc logarytm liczby bakterii, a nie sama ich liczba. Stąd nazwa – faza logarytmiczna.
6 |
S t r o n a
W fazie stacjonarnej obserwuje się spadek przyrostu liczby bakterii, w wyniku zamierania części
komórek z powodu wyczerpywania się składników pokarmowych, tlenu i wytwarzania produktów
przemiany materii. Zamieranie to jest w pewnej równowadze z dzieleniem się innych komórek
Z czasem komórek zamierających jest więcej i dochodzi do spadku ogólnej liczby komórek –
hodowla się przerzedza i z czasem zamiera.
Mechanizmy chorobotwórczości bakterii:
Czynniki zjadliwości to cechy charakterystyczne bakterii umożliwiające im wywoływanie chorób. Bakterie
mogą mieć ich jeden lub więcej. Niektóre (wspólne dla rodzaju / gatunku) powstały w drodze ewolucji,
inne zaś (znamienne dla szczepu) zostały nabyte w wyniku wymiany genetycznej. Medycyna wykorzystuje
zmodyfikowane czynniki wirulencji do szczepień oraz immunoprofilaktyki. Do czynników zjadliwości
należą: otoczki, adhezyny, ezgoenzymy oraz toksyny (endo- i egzo-).
a) Otoczki są jednym z najczęstszych czynników zjadliwości. Występują one na zewnątrz ściany
komórkowej i pozwalają bakteriom na uniknięcie lub przeżycie fagocytozy. Otoczkowe formy
bakterii są z reguły patogenne, bezotoczkowe – nie. Otoczki wytwarzane są przez enzymy ściany
komórkowej, które syntetyzują ochronną warstwę polimeru, najczęściej polisacharydu.
Wytwarzanie otoczek jest zdeterminowane genetycznie, a zdolność ta może być przekazywana
np. w drodze transdukcji.
b) Adhezyny – przyleganie do komórek śluzówki to często pierwszy etap choroby, gdyby bowiem nie
czynniki adhezyjne, bakterie szybko zostałyby wypłukane. Czynniki oddziałują na komórki w
zależności od receptorów, do których wykazują powinowactwo – tłumaczy do osiadanie w
rożnych narządach po dostaniu się bakterii do krążenia systemowego. Czynniki adhezyjne są
strukturami powierzchniowymi:
w większości przypadków są to fimbrie, niekiedy określane jako antygeny czynnika
kolonizacyjnego =colonization factor antygen (CFA),
boczne łańcuchy LPS (antygeny O) również odgrywają rolę w adhezji,
białko M – ułatwia przyleganie S. pyogenes do nabłonka gardła, przez co jest jego
najważniejszym czynnikiem zjadliwości.

7 |
S t r o n a
c) Egzoenzymy = enzymy wydzielnicze, tj. wydzielane na zewnątrz bakterii. Mają one rożna
działanie:
• rozkładają kolagen (kolagenazy i hialuronidazy) i włóknik (fibrynolizyny), umożliwiając
lepszą penetracjedo tkanek,
• rozkładają materiał komórkowy (proteinazy i lecytynazy) – występują u rodzaju Clostridium,
• modyfikują i inaktywują antybiotyki (np. β-laktamazy), stanowiąc mechanizm oporności.
d) Toksyny można podzielić na endotoksyny i egzotoksyny.
Egzotoksyny to białka wytwarzane i uwalniane z komórki w celu wywołania toksyczności.
Mogą być wspólne dla wszystkich bakterii z rodzaju / gatunku (kodowane przez geny
chromosomalne) lub charakterystyczne wyłącznie dla szczepu patogennego (kodowane przez
plazmidy i fagi lizogenne).
Większość egzotoksyn składa się z domeny wiążącej oraz domeny aktywnej – pierwsza łączy
się z określonym receptorem i determinuje rodzaj atakowanej tkanki i wywiera efekt
toksyczny (rzadko toksyczność polega na zablokowaniu samego miejsca wiązania). Dzielą się
na:
enterotoksyny – działają na przewód pokarmowy, np. toksyny ciepłochwiejne (Lt-I,
LT-II), ciepłostałe (ST) czy toksyna cholery,
neurotoksyny – działają na układ nerwowy, np. toksyna botulinowa i tężcowa
(tetanospazmina),
cytotoksyny – działają na komórki rożnych tkanek, np. toksyna błonicy i toksyna A
Pseudomonas.
Endotoksyny są lipopolisacharydami (LPS) pochodzącymi ze ściany komórkowej bakterii G(-).
Endotoksyny rożnych bakterii różnią się siłą i zdolnością do wywoływania objawów
klinicznych. Nie są one wydzielane aktywnie – uwalniane są w momencie śmierci (lizy)
bakterii. Endotoksyny są odpowiedzialne za rozwój posocznicy i wstrząsu septycznego, które
charakteryzują się hipotensją, gorączką, leukopenią, zahamowaniem fagocytozy i ciężką
biegunką. Patogeneza obejmuje aktywację makrofagów i uwolnienie cytokin prozapalnych
(TNF-α, IL-1, IL-6, IL-8), odpowiedzialnych za większość objawów ogólnoustrojowych.
Posocznica i wstrząs septyczny są związane z dużą chorobowością i śmiertelnością.
Podstawy epidemiologii
Drogi zakażenia:
1. Pionowa – zakażenie wertykalne, od matki na dziecko, mogące nastąpić poprzez:
drogę łożyskową (wrodzone postacie chorób: różyczka, toksoplazmoza) ,
w czasie porodu (droga pochwowa, na przykład zakażenie opryszczkowe) lub podczas
karmienie piersią .
2. Pozioma - zakażenie horyzontalne.
przeniesienie z jednej osoby na drugą, które nie są w relacji matka - dziecko .
przez wektory - owady, kleszcze.
Pod pojęciem droga zakażenia rozumiemy sposób, w jaki drobnoustroje przenoszą się ze źródła zakażenia
do organizmu wrażliwego. Wyróżniamy następujące drogi zakażenia: droga zakażenia kropelkowego bądź
powietrznego, droga zakażenia pokarmowego, droga zakażenia przez kontakt bezpośredni, droga
zakażenia przez kontakt pośredni.
Drogą zakażenia kropelkowego nazywamy przenoszenie się drobnoustrojów od chorego do zdrowego na
kropelkach śliny i wydzielin błony śluzowej.

8 |
S t r o n a
Odmianą tego zakażenia jest zakażenie powietrzne. Różni się ono od zakażenia kropelkowego tym, że te
drobnoustroje, które są bardziej odporne na wysychanie od kropelek śluzu, mogą się jeszcze unosić same
w powietrzu i w ten sposób dostawać się do organizmu. Rodzajem tego zakażenia jest też zakażenie
wywołane pyłem zanieczyszczonym drobnoustrojami.
O drodze zakażenia pokarmowego mówimy wówczas, gdy drobnoustroje dostają się do organizmu wraz z
pokarmem. Produktem najczęściej przenoszącym zakażenie jest woda, mleko i jego przetwory, mięso,
owoce i warzywa.
Droga zakażenia przez kontakt bezpośredni występuje wówczas, gdy chory bezpośrednio styka się
z osobnikiem zdrowym.
Droga zakażenia przez kontakt pośredni jest to zakażenie przenoszące się z osobnika na osobnika za
pośrednictwem przedmiotów lub osób trzecich. Największą rolę poza przedmiotami codziennego użytku
(bielizna, naczynia, zabawki) odgrywają owady (komary, muchy, wszy, pchły).
Rezerwuar zarazków – środowisko ludzkie i zwierzęce wraz z warunkami naturalnymi na ograniczonym
terenie, w którym krąży drobnoustrój wywołujący określoną chorobę.
Wrota zakażenia – wrotami zakażenia mogą być wszystkie otwory naturalne ciała ludzkiego oraz
uszkodzona skóra. Są to miejsca, przez które z otaczającego środowiska od organizmu dostają się zarazki.
Okres wylęgania – czas od wniknięcia zarazka do organizmu do wystąpienia pierwszych objawów
chorobowych. W tym okresie zarazek przystosowuje się do warunków panujących w organizmie,
rozmnaża się i zaczyna działać patogennie.
Nosiciel - osoba , która nie wykazuje widocznych objawów chorobowych ale równocześnie wydala
z kałem, moczem, plwociną drobnoustroje chorobotwórcze. Jest on potencjalnym źródłem zakażenia dla
otoczenia.
Zdrowi nosiciele – którzy nie chorowali i nie spostrzegli u siebie zaburzeń czynności organizmu, a mimo
to izoluje się od nich zarazki. W surowicy krwi nosicieli stwierdza się podwyższony poziom przeciwciał
specyficznych dla drobnoustroju.
Ozdrowieńcy – ludzie, którzy chorowali i w okresie rekonwalescencji wydzielają chorobotwórczy
drobnoustrój.
-
stały
-
okresowy
Mikrobiom, mikrobiota
Ogół mikroorganizmów występujących w danym siedlisku. Termin mikrobiom zaproponował Joshua
Lederberg na przełomie XX i XXI w., nawiązując zwłaszcza do słów genom i proteom. Ponieważ większość
organizmów mikrobioty (zwłaszcza bakterie, mikroskopijne grzyby) niegdyś zaliczano do roślin, termin ten
jest bliskoznaczny z terminem mikroflora. Z kolei w przypadku mikrobioty glebowej odnosi się w znacznej
mierze do mikrofauny. W odróżnieniu od pojęcia mikroflory fizjologicznej, obejmuje on wszystkie
mikroorganizmy, nie wyłączając chorobotwórczych. W pewnych ujęciach mikrobiom stosowany jest nie
tyle do zespołu organizmów, ile raczej do zespołu ich genomów

9 |
S t r o n a
Fizjologiczna flora bakteryjna:
Spełnia ona bardzo ważną funkcję w zapobieganiu osiedlania się patogennych drobnoustrojów, głównie
poprzez działanie konkurencyjne. Poza tym flora jelitowa bierze udział przemianach pierwotnych kwasów
żółciowych do wtórnych i ich częściowym wchłanianiu, oraz przemianach bilirubiny do sterkobillnogenu.
Bakterie jelitowe są także niezbędne w syntetyzowaniu części witamin (B1, B2, D, K, PP) oraz białek
transportujących.
Komensale:
Ponad 99% flory fizjologicznej błony śluzowej stanowią beztlenowce, z przewagą bakterii Gram-
ujemnych.
Komensale nieustannie stymulują układ odpornościowy człowieka, wnikając do organizmu
gospodarza poprzez mikrouszkodzenia.
Konkurując z gatunkami chorobotwórczymi o przestrzeń życiową, warunkują tzw. odporność
kolonizacyjną.
Z drugiej strony, potencjalnie szkodliwe działanie fizjologicznej flory bakteryjnej związane jest
z możliwością wywołania zakażeń np. u osób w stanie immunosupresji.
Przez biofilm rozumie się obecnie zbiorowisko osiadłych drobnoustrojów, bytujących – w przeciwieństwie
do tzw. postaci planktonowej, swobodnie przemieszczającej się w środowisku wodnym - w śluzowej
macierzy międzykomórkowej. Postać ta wg współczesnych poglądów jest podstawową formą bytowania
drobnoustrojów, zaś komórki swobodnie pływające mają charakter "transportowy".
Jest to trójwymiarowa struktura utworzona z agregatów komórek bakteryjnych i wydzielanej przez nie
macierzy pozakomórkowej mikrokolonie oddzielone są od siebie kanałami, przez które przepływa woda,
dostarczająca koloniom substancji odżywczych oraz usuwająca resztki przemiany materii.
Cechy biofilmu:
miejscowe warunki wpływają również na wytwarzanie przez bakterie wielu toksyn i innych
substancji wywołujących objawy choroby; czasami bakterie jednego gatunku żywią się zbędnymi
metabolitami bakterii innego gatunku, z korzyścią dla obu
ogromna odporność na antybiotyki
W chwili obecnej uważa się, że 60 do 80% zakażeń z którymi spotyka się człowiek jest związane
z tworzeniem biofilmów; są to szczególnie często infekcje dotyczące np. implantów z tworzyw sztucznych,
ale obecność biofilmów stwierdzono m.in. w zapaleniach ucha środkowego, zakażeniach dróg
moczowych, zakażeniach dróg oddechowych w przebiegu mukowiscydozy itp. Infekcje związane
z biofilmem mają szczególne znaczenie, ponieważ mają zwykle charakter przewlekły, niejednokrotnie
groźny dla życia, a bakterie tworzące biofilm są szczególnie oporne zarówno na działanie prawie
wszystkich leków przeciwdrobnoustrojowych, jak i na mechanizmy odpornościowe człowieka i zwierzęcia.
Obecnie płytka nazębna uznana jest za biofilm - naturalne, dynamiczne środowisko utrzymywane przez
swój własny ekosystem. Wiele z wchodzących w skład płytki nazębnej gatunków bakterii jest
odpowiedzialna za powstawanie próchnicy i jest przyczyną periodontitis.
Cykl powstawania biofilmu na matrycy EPS – proces formowania „dojrzałego” biofilmu obejmuje cztery
stadia:
1. wstępna adsorpcja bakterii na powierzchni stałej
2. sekrecja EPS i nieodwracalna adhezja bakterii
3. kolonizacja bakterii, ich wzrost i powiększanie objętości biofilmu
4. proces dojrzewania biofilmu oraz powstawanie mikrokolonii
5. śmierć komórek i ich dyspersja do planktonu

10 |
S t r o n a
MIKROBIOLOGIA JAMY USTNEJ, WYKŁAD 2, 14.03.2013
dr n.med. Małgorzata Brauncajs
Antybiotyki i chemioterapeutyki przeciwbakteryjne. Powstawanie i mechanizmy oporności
bakterii na leki. Przenoszenie genów oporności - poziome, pionowe. Szczepionki i surowice
odpornościowe.
Antybiotyki, grupa leków mających zdolność niszczenia bakterii lub hamowania ich wzrostu. Antybiotyki
nie działają (lub działają w znikomy sposób) na zdrowe komórki organizmu. Początkowo otrzymywane
były z hodowli gł. grzybów czy bakterii, obecnie wiele z nich wytwarza się sztucznie.
Chemioterapeutyki są to leki przeciwdrobnoustrojowe otrzymane na zasadzie całkowitej syntezy
chemicznej, nieposiadające swojego odpowiednika w przyrodzie.
Chemioterapeutyki bywają niekiedy zaliczane do antybiotyków, jednak nie jest to prawidłowe, gdyż
antybiotyki w większości powstają na drodze półsyntezy z substratów naturalnych, a jeśli uzyskiwane są w
całości syntetycznie, to ich budowa wywodzi się od związków, które obserwowane są w naturze.
Chemioterapeutyki natomiast nie mają takich odpowiedników. Obecnie jednak w piśmiennictwie
medycznym coraz częściej używana jest ta nieprawidłowa definicja – wynika to z tego, że anglojęzyczne
określenia antibiotic (oznaczające antybiotyk) i antimicrobial (oznaczające każdy lek
przeciwdrobnoustrojowy) (czyli antybiotyki i chemioterapeutyki) tłumaczone są przeważnie jako
„antybiotyk”.
Profilaktyka antybiotykowa: profilaktyka okołozabiegowa, po kontakcie z pacjentem z chorobą zakaźną
(krztusiec, meningokokowe zap. opon m-r, grypa), przy skłonnościach do nawrotów (nawracające
zakażenia dróg moczowych), u osób z grup ryzyka rozwoju zakażeń (chorzy z neutropenia, profilaktyka izw
u osób ze schorzeniami serca);
Terapia empiryczna: leczenie włączone bez wyniku badania bakteriologicznego (zakres:
znajomość sytuacji epidemiologicznej, preparat barwiony metodą Grama)
Terapia celowana: leczenie włączone na podstawie wyniku badania bakteriologicznego
Terapia deeskalacyjna: zastosowanie początkowo leczenia o szerokim spektrum, a następnie
zawężanie zakresu działania po uzyskaniu wyników badań bakteriologicznych
Terapia sekwencyjna: leczenie rozpoczynane jest drogą pozajelitową, w określonych sytuacjach
kontynuowane jest doustnie (eliminacja czynników ryzyka, względy ekonomiczne)
Podział antybiotyków ze względu na pochodzenie:
• Naturalne – produkowane przez drobnoustroje (metabolity drobnoustrojów), oczyszczone i
podawane jako leki.
• Półsyntetyczne – pochodne antybiotyków naturalnych uzyskiwane poprzez chemiczną
modyfikację.
• Syntetyczne – syntetyzowane chemicznie w sposób odtwarzający budowa antybiotyku
występującego naturalnie.

11 |
S t r o n a
Mechanizmy działania przeciwbakteryjnego:
Hamowanie biosyntezy ściany komórkowej → beta-laktamy, glikopeptydy
Zwiększenie przenikalności błon cytoplazmatycznych → polimyksyny
Hamowanie syntezy białek → aminoglikozydy, tetracykliny, linkozamidy, makrolidy
Hamowanie metabolizmu kwasów nukleinowych → chinolony (gyraza DNA), rifampicyna
(polimeraza DNA)
Hamowanie procesów przemiany materii (antymetabolity) → sulfonamidy, trimetoprim
1) Hamowanie syntezy ściany komórkowej
Β-laktamy – wiążą się z PBP („białka wiążące penicylinę”). PBP mają powinowactwo do penicyliny i
innych antybiotyków β-laktamowych.
Glikopeptydy - Hamują polimeryzację. Wiążą się z końcami dipeptydowymi podstawowej cegiełki
peptydoglikanu, które łączą się z innymi elementami ściany komórkowej.
2) Hamowanie syntezy białka
Tetracykliny – łączą się z podjednostką 30S rybosomu i nie dopuszczają do wiązania aminoacylo-
tRNA w rybosomie. Hamują przyłączanie kolejnych aminokwasów do łańcucha peptydowego.
Makrolidy i linkozamidy– wiążą się odwracalnie z większą podjednostką rybosomu 50S,
uniemożliwiając wydłużanie łańcucha białka.
Aminoglikozydy – hamują translację poprzez wiązanie z małą podjednostką rybosomu 30S.
Powodują zaburzenia sekwencji aminokwasów lub zakańczenie procesu translacji. Antybiotyki te
działają również na błonę komórkową co w sumie doprowadza do śmierci komórki.
Chloramfenkol – łączy się z 50S rybosomu, co uniemożliwia łączenie z aminoacylo-tRNA .
Oksazolidynony – uniemożliwiają połączenie podjednostki 30S i 50S i powstanie kompleksu 70S
rybosomu.
3) Hamowanie syntezy DNA
Chinolony – hamują aktywność z gyrazy DNA i topoizomerazy IV. Poprzez stabilizację połączenia
enzym-DNA. Połączenie jest nieodwracalne. Skutkiem jest zahamowanie syntezy DNA i szybka
śmierć komórki.
Gyraza DNA – wprowadza ujemne superhelikalne skręty do nici DNA, co umożliwia replikację
i transkrypcję.
Topoizomeraza IV – bierze udział w rozdzielaniu chromosomów, co pozwala na przechodzenie ich
do komórki potomnej.
4) Hamowanie syntezy RNA
Ryfampicyna – hamuje działanie DNA-zależnej polimerazy RNA
5) Niszczenie błony zewnętrznej i cytoplazmatycznej
Polipeptydy (polimyksyna A-E) – łączą się z lipidowymi składnikami błony zewnętrznej
i cytoplazmatycznej, co powoduje utratę szczelności obu błon.
6) Hamowanie syntezy nukleotydów
Sulfonamidy –są antagonistami kwasu p-aminobenzoesowego, który bierze udział w syntezie
kwasu foliowego. Zastępowanie kwasu prowadzi do zahamowania syntezy nukleotydów
i uniemożliwia namnażanie bakterii.
Trimetoprim – inhibitor bakteryjnej reduktazy kwasu dihydrofoliowego, hamuje powstawanie w
komórce bakteryjnej kwasu tetrahudrofoliowego (aktywnej postaci kwasu foliowego),
co powoduje zahamowanie syntezy nukleotydów .

12 |
S t r o n a
EFEKT DZIAŁANIA ANTYBIOTYKÓW
Bakteriostatyczny – hamowanie wzrostu bakterii.
• Tetracykliny
• Makrolidy, ketolidy
• Sulfomamidy
• Oksazolidynony
• Tigecyklina
Bakteriobójczy – zabijanie komórek bakteryjnych.
• Aminoglikozydy
• Β-laktamy
• Chloramfenikol
• Chinolony
• Polimyksyny
• Glikopeptydy
• Daptomycyna
• Linkozamidy
OPORNOŚĆ NA ANTYBIOTYKI:
Oporność wrodzona – stała cecha gatunku, szczepu lub grupy bakterii (np. penicylina działa
na Gram +, a nie działa na Gram -)
Oporność nabyta – początkowo wrażliwe bakterie nabywają oporność na skutek mutacji
lub nabycia genu/genów oporności od innych bakterii; zmiana ta staje się dziedziczna
Oporność krzyżowa – rozwój jednej oporności pociąga za sobą oporność na leki tej samej grupy
Mutacje spontaniczne - zachodzą samorzutnie, niezależnie od obecności antybiotyku w środowisku. Są to
błędy podczas replikacji DNA.
Mutacje indukowane – pojawiają się po zadziałaniu mutagenów – w warunkach naturalnych zachodzi
niezwykle rzadko.
Selekcja – utrwalenie mutacji. Komórki, które uległy mutacji prowadzącej do powstania oporności
na antybiotyk obecny w środowisku, przeżywają w obecności tego antybiotyku i stają się początkiem
populacji opornej .
Lokalizacja genów oporności:
chromosomy
plazmidy
transpozony
integrony

13 |
S t r o n a
Sposoby przenoszenia oporności:
Pionowe (wertykalne) – z komórki macierzystej do komórki potomnej
Poziome (horyzontalne) – przenoszenie z jednej komórki bakteryjnej do innej (również innych
gatunków) genów oporności na drodze:
koniugacji - wymiana materiału genetycznego pomiędzy komórką męską a żeńską (tego
samego gatunku)
transdukcji – przenoszenie materiału genetycznego pomiędzy komórkami bakterii (tego
samego gatunku, a nawet szczepu) za pośrednictwem bakteriofagów.
transformacji – bezpośrednie pobieranie materiału genetycznego ze środowiska. Materiał
genetyczny w pobierany dostaje się do środowiska na skutek śmierci komórki lub jej
rozpadu. W ten sposób mogą być pobierane geny oporności od innych gatunków
drobnoustrojów.
MECHANIZMY OPORNOŚCI NA ANTYBIOTYKI
Modyfikacja (inaktywacja
antybiotyku
-laktamazy
-laktamy
plazmidy
acetylotransferaza chloramfenikolu
chloramfenikol
plazmidy
acetylotransferazy, fosforylazy,
adenylotransferazy
aminoglikozydy
plazmidy
Zmiany w transporcie antybiotyku
zmniejszone wychwytywanie lub
wypompowywanie antybiotyku
tetracykliny
chinolony
karbapenemy
plazmidy
Modyfikacja miejsca docelowego
modyfikacja PBP
penicyliny
cefalosporyny
chromosom
lub plazmid
modyfikacja końców peptydoglikanu
glikopeptydy
zmiana podjednostki 50S rybosomu
makrolidy
plazmid
zmiana podjednostki 30S rybosomu
streptomycyna
chromosom
zmiana polimerazy RNA
ryfampicyna
chromosom
Uruchamianie alternatywnej ścieżki
metabolizmu omijającej etap
blokowany przez antybiotyk lub
zwiększenie nadprodukcji kluczowego
metabolitu
synteza enzymów mniej wrażliwych
na leki
sulfonamidy
trimetoprim
plazmid
β-LAKTAMY:
Charakteryzują się obecnością w cząsteczce pierścienia β-laktamowego, odpowiedzialnego
za działanie przeciwbakteryjne.
Każda grupa antybiotyków β-laktamowych posiada w swojej budowie charakterystyczny rdzeń,
podstawiony różną liczba podstawników. Liczba antybiotyków w obrębie danej grupy zależy od liczby
miejsc, które można podstawić.
Wykazują podobny mechanizm działania. Cechą charakterystyczną β-laktamów jest niewielka ich
toksyczność.
Spektrum p-bakteryjne β-laktamów:
Bakterie tlenowe i beztlenowe
- ziarniaki Gram-dodatnie
- ziarniaki Gram-ujemne
- pałeczki Gram-ujemene (Enterobacteriaceae, niefermentujące, hemofilne)
- laseczki Gram-dodatnie
- pałeczki Gram-dodatnie
- krętki
- promieniowce
Nie są aktywne wobec bakterii atypowych (bakterie nieposiadające ściany komórkowej)
14 |
S t r o n a
Podział β-laktamów:
Penicyliny
Cefalosporyny
Monobaktamy
Karbapenemy
Inhibitory β-laktamaz
A. Penicyliny
Naturalne
Penicylina benzylowa
Fenoksymetylopenicylina
Feneticylina
Przeciwgronkowcowe
Meticylina
Nafcylina
Izoksazolilowe
Oksacylina
Kloksacylina
Dikloksacylina
Flukloksacylina
Penicyliny o szerokim zakresie działania:
Aminopenicyliny
Ampicylina
Amoksycylina
Karboksypenicyliny
Karbenicylina
Tikarcylina
Ureidopenicyliny
Piperacylina
Azlocylina
Mezlocylina
Penicyliny oporne na
-laktamazy
Temocylina
Amidynopenicyliny
Mecylinam
15 |
S t r o n a
B. Cefalosporyny
I generacji
Cefadroksyl
Cefaleksyna
Cefradryna
Cefalotyna
Cefapiryna
Cefatrizyna
Cefazolina
Ceftezol
II generacji
Cefaklor
Cefprozil
Cefroksadyna
Lorakerbef
Cefamandol
Cefonicid
Cefuroksym
Cefuroksym aksetyl
Ceforanid
Cefotiam
Cefmetazol
Cefoteten
Cefoksytyna
III generacji
Cefiksim
Cefotaksym
Cefpodoksym
Ceftazydym
Ceftibuten
Ceftriakson
Ceftizoksym
Cefmenoksym
Cefodizim
Cefetamet
Cefdinir
Cefditoren
Cefoperazon
Cefsulodyna
IV generacji
Cefepim
Cefpirom
tzw. V generacji – działają na MRSA
Ceftobiprol
Ceftarolina
16 |
S t r o n a
Cefamycyny
Cefoksytyna
Cefmetazol
Cefotetan
C. Monobaktamy
Aztreomam
D. Karbapenemy
Doripenem
Ertapenem
Imipenem
Meropenem
E. Inhibitory
-laktamaz
Kwas klawulanowy
Sulbaktam
Tazobaktam
F. Połączenia penicylin z inhibitorami
Ampicylina z sulbaktamem
Amoksycylina z kwasem klawulanowym
Piperacylina z tazobaktamem
Tikarcylina z kwasem klawulanowym
G. Połączenia cefalosporyn z inhibitorami
Cefoperazon z sulbaktamem
Mechanizmy oporności β-laktamów
A. Enzymatyczna
produkcja β-laktamaz - enzymów niszczących aktywne wiązanie w pierścieniu β-laktamowym.
Bakterie Gram-dodatnie wydzielają je na zewnątrz komórki, a bakterie Gram-ujemne wydzielają je do
przestrzeni periplazmatycznej.
Mogą mieć powinowactwo do penicylin, cefalosporyn, karbapenemów:
penicylinazy – gronkowce, paciorkowce, enterokoki, moraxella catarrhalis, neisseria sp.
haemophilus sp., pałeczki Gram-ujemne.
cefalosporynazy – pałeczki Gram-ujemne
ESBL - β-laktamazy o rozszrzonym spektrum substratowym - zdolne do hydrolizy penicylin,
cefalosporyn (z wyjątkiem cefamycyn, np. cefoksytyny) i monobaktamów (aztreonamu). Są wrażliwe
na działanie inhibitorów β-laktamaz.
Produkowane są przez pałeczki Gram-ujemne, ale największe znaczenie kliniczne
i epidemiologiczne mają w przypadku pałeczek należących do rodziny Enterobacteriaceae.
AmpC (cefalosporynazy klasy - hydrolizują penicyliny, cefalosporyny (z wyjątkiem leków IVgeneracji) i
aztreonam. Z reguły nie są one też podatne na działanie inhibitorów β-laktamowych.
Produkowane przez pałeczki Gram-ujemne fermentujące i niefermentujące. Ale znaczenie
kliniczne i epidemiologiczne mają w przypadku pałeczek z rodziny Enterobacteriaceae.
Szczepy AmpC (+) mogą być wrażliwe na cefepim i karbapenemy.

17 |
S t r o n a
Karbapenemazy MBL (metalo-beta-laktaazy) – szczepy posiadające enzymy zdolne do hydrolizy
wszystkich beta-laktamów: penicylin, cefalosporyn i karbapenemów (a także połączenia
-laktamów
z inhibitorami).
Produkowane przez pałeczki niefermentujące i fermentujące.
Szczepy MBL(+) mogą być wrażliwe jedynie na aztreonam i kolistynę
Karbapenemazy KPC (Klebsiella pneumoniae carbapenemase) - szczepy posiadające enzymy zdolne
do hydrolizy wszystkich beta-laktamów: penicylin, cefalospory, karbapenemów i aztreonamu (a
także połączenia b-laktamów z inhibitorami).
Wśród szczepów KPC(+) obserwuje się wrażliwość jedynie na gentamicynę (i niekiedy amikacynę),
kolistynę i tigecyklinę. - Jednak brak jest badań klinicznych udowadniających skuteczność tych
antybiotyków w leczeniu zakażeń wywołanych przez szczepy KPC+.
Są one stosowane na ratunek („salvage therapy”) z powodu braku opcji terapeutycznych
o udowodnionej skuteczności.
U Enterobacteriaceae należy wykrywać jednocześnie oba typy karbapenemaz MBL i KPC u wszystkich
izolatów niewrażliwych (średniowrażliwych i opornych) przynajmniej na jeden karbapenem
(imipenem, meropenem, ertapenem, doripenem).
Przed wprowadzeniem rekomendacji EUCAST (2010r.) wykrycie takiego mechanizmu oporności jak
ESBL, MBL lub KPC wykluczało użycie antybiotyków objętych spektrum działania tych enzymów z
terapii zakażenia bakterią posiadającą mechanizm oporności typu ESBL.
Obecnie: „wykrycie ESBL nie wyklucza zastosowania cefalosporyn III i IV generacji oraz aztreonamu w
przypadku stwierdzenia na nie wrażliwości. Jednocześnie w przypadku szczepów ESBL+ zaleca się
oznaczenie MIC cefalosporyny wyższej generacji (lub aztreonamu), jeśli jest ona planowana do
leczenia, a także monitorowanie skuteczności stosowanej terapii”.
B. Receptorowa
Zmiana struktury punktu docelowego działania antybiotyku. Zmiana w genach kodujących białka PBP
powodująca zmniejszenie lub utratę powinowactwa do antybiotyku.
PRP – (ang. Penicillin resistant pneumococci) oporność na penicylinę. Występuje u pneumokoków.
BLNAR - szczepy β-laktamazo-ujemne oporne na ampicylinę (ang. Beta-Lactamase- Negative,
Ampicillin Resistant). Mechanizm oporności związany ze zmianami w strukturze białek wiążących
penicylinę PBP
3
MRSA (ang. Metycillin restant Staphylococcus aureus) – gronkowce złociste oporne na metycylinę -
są oporne na wszystkie z obecnie stosowanych antybiotyków β-laktamowych, z wyjątkiem
cefalosporyn o udowodnionej aktywności wobec MRSA i z ustalonymi wartościami granicznymi
(w Polsce niedostępne).
- Posiadają gen oporności na metycylinę mecA warunkujący syntezę zmienionego białka PBP2 -
PBP2a lub PBP2’.
- MRCNS - Szczepy oporne na metycylinę wśród gronkowców koagulazo-ujemnych.
- Szczepy MRCNS są również oporne na wiele dostępnych antybiotyki zachowaną wrażliwością na
glikopeptydy, kwas fusydowy, linezolid, daptomycynę oraz tygecyklinę.
- Pierwsze szczepy MRSA pojawiły się w 1961 uważane za synonim szczepów szpitalnych (HA-
MRSA - hospital acquired MRSA).
- Toksynotwórcze szczepy metycylinooporne nie związane ze środowiskiem szpitalnym (CA-MRSA
- community acquired MRSA) - pierwsze szczepy w latach 90-tych.

18 |
S t r o n a
Działania niepożądane - nadwrażliwość
Natychmiastowa - występuje 0-1 godz. od podania. Reakcją jest: wstrząs, podciśnienie, obrzęk
głośni, pokrzywka, obrzęk naczyniouchowy, skurcz oskrzeli.
Przyspieszona – występuje 1-72 godz. Od podania. Reakcją jest: obrzęk głośni, pokrzywka, obrzęk
naczynioruchowy, skurcz oskrzeli.
Późna – występuje >72 godz. Od podania. Reakcją jest: wysypka odropodobna, śródmiąższowe
zapalenie nerek, niedokrwistość hemolityczna, neutropenia, trombocytopenia, choroba
posurowicza, gorączka polekowa, zespół Stevensa-Johnsona, Złuszczające zapalenie skóry.
CHINOLONY/FLUOROCHINOLONY
Fluorochinolony - grupa chinolonów, które posiadają atom fluoru jako podstawnik
Chinolony nie zawierające fluoru, zwane są po porostu chinolonami („stare chinolony”). Ich
stosowanie nie jest zalecane (ze względu na szerzenie się oporności i działania niepożądane).
Wychodzą z użycia i nie będą szerzej omawiane.
Hamują aktywność gyrazy DNA i topoizomerazy IV. Poprzez stabilizację połączenia enzym-DNA.
Połączenie jest nieodwracalne. Skutkiem jest zahamowanie syntezy DNA i szybka śmierć komórki.
Gyraza DNA – wprowadza ujemne superhelikalne skręty do nici DNA, co umożliwia replikację
i transkrypcję.
Topoizomeraza IV – bierze udział w rozdzielaniu chromosomów, co pozwala na przechodzenie ich
do komórki potomnej.
I generacja („stare chinolony”)
Kwas nalidyksowy
Kwas oksolinowy
Cinoksacyna
Kwas pipemidowy
II generacja
Ciprofloksacyna
Enoksacyna
Fleroksacyna
Lewofloksacyna
Lomefloksacyna
Norfloksacyna
Ofloksacyna
Perfloksacyna
Temafloksacyna
III generacja
Gatifloksacyna
Pazufloksacyna
Sparfloksacyna
Tosufloksacyna
IV generacja
Maxifloksacyna
19 |
S t r o n a
Zakres działania - tylko bakterie tlenowe:
- Pałeczki Gram-ujemne fermentujące i niefermentujące
- Gronkowce (szybko nabywają oporność!)
- Paciorkowce
- Enterokoki
- Haemophilus
- Neisseria
- Bakterie atypowe
Mechanizm oporności
Oporność nabyta związana jest przede wszystkim z:
Zahamowaniem transportu do komórki
Modyfikacją gyrazy
Działania niepożądane
Dolegliwości ze strony układu pokarmowego – biegunki, nudności, wymioty, brak łaknienia,
wolne stolce.
Reakcje skórne – nadwrażliwość na światło (najczęściej reakcje fototoksyczne). Występują w
kilka godzin po pierwszym kontakcie z lekiem
Ból głowy, zawroty głowy, senność
Zaburzenia czynności wątroby
Nefrotoksycznosć - rzadko
AMINOGLIKOZYDY
Ze względu na ich potencjalną toksyczność powinny być zarezerwowane do stosowania szpitalnego.
Poznanie mechanizmów działania przeciwbakteryjnego i toksyczności wpływa na bardziej
bezpieczne ich stosowanie.
Wykazują synergizm działania z antybiotykami β-laktamowymi i właśnie w skojarzeniu powinny być
stosowane.
Zbudowane są z aminocukru i aminocyklitolu.
Pierwsza zastosowana – streptomycyna – izolowana z hodowli Streptomyces griseus (1944r)
Aminoglikozydy to:
Gentamycyna
Amikacyna
Tobramycyna
Netymycyna
Neomycyna
Sisomycyna
Dibekacyna
Isepamycyna
Streptomycyna
Spektinomycyna
Mechanizm działania
Hamują translację poprzez wiązanie z małą podjednostką rybosomu 30S. Powodują zaburzenia
sekwencji aminokwasów lub zakończenie procesu translacji. Antybiotyki te działają również na błonę
komórkową co w sumie doprowadza do śmierci komórki.
Działają tylko na bakterie tlenowe:
- Pałeczki Gram-ujemne
- Ziarniaki Gram-dodatnie
- Prątki gruźlicy

20 |
S t r o n a
Mechanizm oporności
Oporność na aminoglikozydy spowodowana jest najczęściej:
Wytwarzaniem enzymów (aminoglikozydazy-transferazy) – powodują modyfikację cząsteczki
tych leków
Zmianą w miejscu wiązania antybiotyku (oporność rybosomalna) – uniemozliwienie
lub utrudnienie w wiązaniu antybiotyku
Obniżenie lub inaktywacja mechanizmów czynnego transportu.
HLAR (ang. high-level aminoglycoside resistance) - szczepy enterokoków opornych na wysokie
stężenia aminoglikozydów.
Enterokoki są naturalnie oporne na niskie stężenia aminoglikozydów. Związane jest to ze słaba
przepuszczalnością bakteryjnych osłon komórkowych dla cząsteczek antybiotyku i uniemożliwia
stosowanie tych leków w monoterapii. Skuteczne w leczeniu jest natomiast zastosowanie terapii
skojarzonej aminoglikozydu z penicylinami lub glikopeptydami, pod warunkiem wrażliwości in vitro
na te grupy antybiotyków. Połączenie wykazuje działanie synergistyczne i umożliwia osiągniecie
efektu bakteriobójczego. Badanie lekowraliwosci enterokoków powinno uwzględniać oznaczenie
poziomu oporności na antybiotyki aminoglikozydowe, bowiem wystąpienie wysokiego poziomu
oporności na aminoglikozydy oznacza nabycie oporności (fenotyp HLAR) i wyklucza zastosowanie
terapii skojarzonej aminoglikozydu z penicylinami lub glikopeptydami.
Działania niepożądane
Ototoksyczność – uszkodzenie komórek receptorowych VIII nerwu czaszkowego, może dotyczyć
ślimaka lub błędnika. Odstawienie leku w bardzo wczesnej fazie może umożliwić powrót do ich
funkcji, ale kliniczna utrata słuchu jest z reguły nieodwracalna.
Neferotoksyczność – objawowe uszkodzenie nerek. Pierwszy objaw, to wzrost aktywności
fosfatazy alkalicznej w moczu. Pierwsze objawy o znaczeniu klinicznym, to wzrost poziomu
kreatyniny i zmniejszenie przesączania kłębuszkowego.
MAKROLIDY I KETOLIDY
Zbudowane są z dużego pierścienia laktonowego zawierającego 14-15 atomów węgla połączonego z
cząsteczką cukru kladinozy i aminocukru desozaminy.
Cechą charakterystyczną makrolidów jest szybkie i łatwe narastanie oporności bakterii, zwykle
mającej charakter krzyżowy.
Ketolidy – makrolidy, które zamiast cukru kladinozy mają grupę ketonową (od tego pochodzi ich
nazwa).
Makrolidom przypisuje się działanie przeciwzapalne, ale nie udowodnione jeszcze klinicznie.
Makrolidy w większości zakażeń są lekiem drugiego rzutu (zakażenia dróg oddechowych).
Lekiem z wybory są w leczeniu zakażeń bakteriami atypowymi!!!
Makrolidy i ketolidy to:
Erytromycyna
Azitromycyna
Klaritromycyna
Diritromycyna
Spiramycyna
Roksytromycyna
Telitromycyna – ketolid

21 |
S t r o n a
Mechanizm działania
Wiążą się odwracalnie z większą podjednostką rybosomu 50S, uniemożliwiając wydłużanie łańcucha
białka. Efektem jest zahamowanie wzrostu.
Działają przede wszystkim na bakterie Gram-dodatnie tlenowe i beztlenowe
W mniejszym stopniu na bakterie Gram-ujemne w tym tlenowe i beztlenowe pałeczki oraz Neisseria i
Moraxella
Duże znaczenie kliniczne ma ich aktywność wobec bakterii wewnątrzkomórkowych, takich jak
Mycoplasma, Chlamydia i Legionella (bakterie atypowe)
STREPTOGRAMINY, MAKROLIDY I LINKOZAMIDY
Często zaliczane są do jednej dużej grupy antybiotyków. Antybiotyki te wykazują znaczne różnice w
budowie i zakresie działania przeciwbakteryjnego, ale mają wspólne miejsce docelowe (wiązania) i
wspólne mechanizmy oporności.
Szczepy posiadające mechanizm oporności MLS
B
- oporne są na makrolidy, linkozamidy
i streptograminy B. Oporność typu MLS
B
występuje u ziarniaków Gram-dodatnich (gronkowce,
paciorkowce)
Linkozamidy
Linkomycyna – obecnie wychodzi z użycia
Klindamycyna – półsyntetyczna pochodna linkomycyny
Streptograminy – antybiotyki makrocykliczne o budowie laktonowej
Pristamycyna (pristamycyna Ia i Ib) – zarejestrowana w Polsce, ale nie jest szeroko stosowana ze
względu na ograniczenia w drodze podawania (źle rozpuszcza się w wodzie). Podawana może
być tylko drogą doustną – niemożliwe leczenie ciężkich zakażeń.
Chinupristina – pochodna pristamycyny Ia, rozpuszczalna w wodzie. Należy do streptogramin B.
Dalfopristina – pochodna pristamycyny IIa, rozpuszczalna w wodzie. Należy do streptogramin A.
Preparat chinupristina/dalfopristina (w stosunku wagowym 70:30) – jedyny antybiotyk z grupy
streptogramin stosowany w lecznictwie
GLIKOPEPTYDY
Są to antybiotyki o dużych cząsteczkach, zbudowane z pierścienia peptydowego połączonego
z dwiema cząsteczkami cukru.
Wankomycyna
Teikoplanina
Telawacyna
Mechanizm działania
Hamują syntezę peptydoglikanu. Wiążą się z końcami dipeptydowymi podstawowej cegiełki
peptydoglikanu, które łączą się z innymi elementami ściany komórkowej, a to uniemożliwia
polimeryzację. Efektem jest śmierć komórki.
Działają tylko na bakterie Gram-dodatnie tlenowe i beztlenowe
Oporność
VRE – szczepy enterokoków oporne na wankomycyne.
Szczepy o fenotypie vanA są również oporne na teikoplaninę. Gen oporności VanA zlokalizowany jest
na transpozonie Tn 1546. Szczepy o fenotypach VanB i VanC oporne są tylko na wankomycynę.
Pierwszy VRE w Polsce w 1999r

22 |
S t r o n a
VISA - szczepy gronkowca złocistego średniowrażliwe na wankomycynę – pojawiły się w latach 90-
tych. Mechanizm oporności związany ze zmianą przepuszczalności ściany komórkowej.
VRSA – szczepy gronkowca złocistego oporne na wankomycynę - pierwsze doniesienia w 2002 roku.
Posiadają operon VanA w transpozonie Tn156 występujący u gatunków należących do rodzaju
Enterococcus opisanych w 1968 roku.
GISA i GRSA - szczepy średniowrażliwe i oporne na glikopeptydy
Działania niepożądane
Wankomycyna:
Reakcje alergiczne
Zapalenia żył w miejscu wstrzyknięcia
Zespół czerwonego karku
Gorączka
Uszkodzenie słuchu
Uszkodzenie nerek
Neutropenia – pojawia się zwykle, gdy czas leczenia przekracza 14 dni
Teikoplanina:
Ocenia się, że powoduje mniej działań niepożądanych niż wankomycyna, ale brak dużych
badań porównawczych.
TETRACYKLINY
Wprowadzone do lecznictwa niedługo po penicylinie. Ze względu na szeroki zakres działania
i zachęcająca reklamę (zachęcała do używania bez ograniczeń m.in. w zakażeniach dróg
oddechowych), były masowo przepisywane. Ostrzeżenia , że „częste stosowanie antybiotyków
o szerokim zakresie działania jest zwykle przykrywką braku precyzji diagnostycznej” nie przyniosły
oczekiwanych rezultatów. Oporność na tą grupę leków zaczęła gwałtownie narastać na całym
świecie. Reakcją na to zjawisko był spadek zużycia tych antybiotyków, a co za tym idzie stopniowe
zmniejszanie oporności, w wielu krajach, niestety nie w Polsce.
Do pojawienia się wysokiej oporności drobnoustrojów na tetracykliny przyczyniło się również
powszechne stosowanie ich w rolnictwie ( w lecznictwie weterynaryjnym i dla przyspieszenia
przyrostu masy ciała zwierząt hodowlanych). Oporność na tę grupę leków ma charakter krzyżowy.
Narastającej oporności nie można ograniczyć syntetyzowaniem nowych preparatów, dlatego
stosowanie tetracyklin powinno być ograniczone.
Tetracykliny to:
Tetracyklina
Doksycyklina
Minocyklina – niezarejestrowana w Polsce
Tigecyklina – pochodna minocykliny (grupa glicylcyklin)
Chlorotetracyklina – przeznaczona tylko do receptury (stosowanie miejscowe)
Mechanizm działania
Zbudowane są z 4 pierścieni karbocyklicznych.
Pierwotnie otrzymane ze szczepów Streptomyces aureofaciens
Mają szerokie spektrum działania (bakterie tlenowe i beztlenowe):
- Bakterie Gram-dodatnie
- Bakterie Gram-ujemne
- Krętki
- Bakterie atypowe

23 |
S t r o n a
Łączą się z podjednostką 30S rybosomu i nie dopuszczają do wiązania aminoacylo-tRNA w rybosomie.
Hamują przyłączanie kolejnych aminokwasów do łańcucha peptydowego. Efektem jest zahamowanie
wzrostu komórki.
Działania niepożądane
Dolegliwości pokarmowe – nudności, wymioty, biegunka, zgaga, ból brzucha
Zapalenie lub owrzodzenie przełyku
Uszkodzenie wątroby
Hamowanie syntezy białka gospodarza – przerwanie procesów katabolicznych, co prowadzi
do nasilenia azotemii u osób z niewydolnością nerek
Nadwrażliwość na światło
OKSAZOLIDYNONY
Nowa grupa leków syntetycznych. Tylko linezolid dopuszczony do obrotu w niektórych krajach
w tym w Polsce.
Mechanizm działania - uniemożliwiają połączenie podjednostki 30S i 50S i powstanie kompleksu
70S rubosomu.
Zakres działania: bakterie Gram-dodatnie
Mechanizm oporności - szczepy wytwarzające kodowaną przez plazmidy metylazę Cfr – po raz
pierwszy opisane w 2008 roku. W Polsce jeszcze nie występuje Dotychczas nie wykazano groźnych
działań niepożądanych.
SULFONAMIDY
Działają na:
- gronkowce
- paciorkowce
- enterobacteriaceae
Kotrimoksazol
NITROIMIDAZOLE
Działają tylko na bakterie beztlenowe.
Ornidazol
Metronidazol
NITROFURANY
Działają na bakterie:
- Gram(+)
- Gram(-)
Stosowane w leczeniu zakażeń układu moczowego.
Furagin
Nifuroksazyd
Nitrofurantoina
24 |
S t r o n a
POLIPEPTYDY
Polimyksyny – mają budowę peptydową. Łączą się z lipidowymi składnikami błony zewnętrznej
i cytoplazmatycznej, co powoduje utratę szczelności obu błon.
Do tej grupy należy 5 antybiotyków (polimyksyny A-E). W lecznictwie stosowane są tylko:
Polimyksyna B (stosowana miejscowo)
Polimyksyna E (kolistyna)
Inne polimyksyny – wysokotoksyczne, stosowane tylko miejscowo
Bacytracyna – działa na bakterie Gram-dodatnie
Gramicydyna – działa wyłącznie na bakterie Gram-dodatnie
Zakres działania: pałeczki Gram-ujemne fermentujące i niefermentujące
Działania niepożądane – są to związki o znacznej toksyczności, stosowane w wyjątkowych sytuacjach.
nefrotoksyczność (u ponad 25% leczonych!)
parestezje, zwłaszcza twarzy
nudności, wymioty
neuropatie obwodowe
NAJWAŻNIEJSZE MECHANIZMY ODPORNOŚCI
antybiotyki
mechanizm odporności
drobnoustroje, u których występują
-laktamowe
enzymatyczna
(
-laktamazy)
penicylinazy
gronkowce, paciorkowce, enterokoki, Moraxella
catarrhalis, Neisseria sp., Haemophilus sp., pałeczki
Gram(-)
cefalosporynazy
AmpC
pałeczki Gram(-)
ESBL
pałeczki Gram(-), ale największe znaczenie kliniczne i
epidemiologiczne mają w przypadku pałeczek
należących do rodziny Enterobacteriaceae
MBL
pałeczki Gram(-) fermentujące i niefermentujące
KPC
pałeczki Gram(-) fermentujące i niefermentujące.
Należy wykrywać u pałeczek należących do rodziny
Enterobacteriaceae
receptorowa
PRP
Streptococcus pneumoniae
BLNAR
Haemophilus sp.
MRSA/MRCNS
Staphylococcus aureus/ Staphylococcus sp. (koagulazo-
ujemne)
Aminoglikozydy
HLAR
Enterococcus sp.
Makrolidy
Linkozamidy
Streptograminy
ML5B
Ziarniaki Gram(+) – gronkowce, paciorkowce
Glikopeptydy
VRE
Enterococcus foecium, Enterococcus faecalis
VISA, VRSA, GISA, GRSA
Staphylococcus aureus

25 |
S t r o n a
Szczepionki
Celem stosowania szczepienia jest aktywacja układu immunologicznego, przygotowanie organizmu
na infekcje wywołana przez określony czynnik etiologiczny (drobnoustrój mogący wywołać określone
schorzenie)
Rodzaje szczepionek ze względu na swoistość, specyficzność odpowiedzi immunologicznej:
Szczepionki swoiste – zapobiegające konkretnym jednostkom chorobowym (np.: błonica,
krztusiec, tężec, odra, świnka, różyczka)
Szczepionki nieswoiste – zwiększające poziom ogólnej odporności (np. preparat Panodina).
Rodzaje szczepionek ze względu na postać preparatu:
Szczepionki płynne
Szczepionki liofilizowane produkowane w postaci proszku; przed szczepieniem należy rozpuścić
proszek w rozpuszczalniku dołączonym do opakowania szczepionki. Przykład: szczepionka
przeciwko odrze, śwince, różyczce czy ospie wietrznej.
Rodzaje szczepionek ze względu na formę antygenu:
Szczepionki żywe atenuowane (odzjadliwione, czyli pozbawione właściwości zakaźnych) – w 1881
wprowadzone przez Ludwika Pasteura, obecnie przykładem są: doustna szczepionka przeciw
poliomyelitis (OPV), szczepionka przeciw odrze, śwince i różyczce (MMR)
Szczepionki zabite – np: pełnokomórkowa składowa krztuścowa (Pw) szczepionki DTPw.
Szczepionki zawierające produkty metabolizmu bakterii (toksoidy, dawniej anatoksyny) – toksyny
pozbawione zjadliwości, lecz o zachowanych właściwościach antygenowych. Przykład: składowa
tężcowa (T) i błonicza (D), szczepionki DTP.
Szczepionki otrzymywane metodą inżynierii genetycznej, np: szczepionka przeciw WZW B.
Szczepionki podjednostkowe – zawierają rozbite drobnoustroje lub ich fragmenty. Antygen
danego patogenu jest połączony (skoniugowany) z nośnikiem białkowym. Przykład: antygen
Haemophilus influenzae b (Hib) na nośniku białkowym.
Rodzaje szczepionek ze względu na sposób podawania:
Doustne, np. szczepionka przeciwko rotawirusom
Domięśniowe, np. szczepionka przeciwko pneumokokom
Śródskórne, np. szczepionka przeciwko gruźlicy
Podskórne, np. ospa wietrzna
Donosowe np. szczepionka przeciwko grypie dostępna w USA
Rodzaje szczepionek ze względu na rodzaj drobnoustroju stosowanego w szczepionce:
Wirusowe – szczepionka przeciwko odrze, śwince, różyczce
Bakteryjne – szczepionka przeciwko pneumokokom
Mieszane
Szczepionki skojarzone - szczepionki, które uodparniają jednocześnie przed kilkoma chorobami
zakaźnymi. Zawierają one w swym składzie różne drobnoustroje lub antygeny pochodzące
z różnych drobnoustrojów (wirusów i/lub bakterii np. szczepionki 3-składnkowe - DTPw, DTPa,
MMR, szczepionki 5 składnikowe - DTPa-IPV-Hib, a nawet 6-składnikowe - DTPa-IPV-Hib-HBV)
- DTPw – szczepionka przeciw błonicy, tężcowi, krztuścowi (zawierająca pełnokomórkowy
składnik krztuśca)
- MMR - skojarzona szczepionka przeciw odrze, śwince i różyczce
- DTPa-IPV-Hib - szczepionka przeciw błonicy, tężcowi, krztuścowi (zawierająca bezkomórkowy
składnik krztuśca), poliomielitis, zakażeniom Haemophilus influenzae typu b

26 |
S t r o n a
Szczepionki monowalentne - zawierają jeden rodzaj drobnoustroju lub antygeny z drobnoustroju jednego
rodzaju. Szczepionki te uodparniają przeciwko jednej chorobie zakaźnej; np. szczepionka monowalentna
przeciwko tężcowi.
Szczepionki poliwalentne:
zawierające antygeny kilku serotypów (podtypów) jednego gatunku drobnoustroju – uodparniają
przeciwko kilku chorobom, które może spowodować każdy z serotypów. Np. szczepionka przeciwko
pneumokokom,
zawierające antygeny kilku typów (podtypów) jednego gatunku drobnoustroju – uodparniają
przeciwko jednej chorobie. Np. szczepionka przeciwko infekcjom rotawirusowym przewodu
pokarmowego u dzieci, czy szczepionka przeciwko grypie sezonowej
Surowice odpornościowe, surowice zwierzęce, rzadziej ludzkie, zawierające wysoki poziom
immunoglobulindziałających przeciwko określonym gatunkom drobnoustrojów (surowice
przeciwbakteryjne, anatoksyna lub przeciwko ich toksynom (surowice antytoksyczne, antytoksyna).
Surowice odpornościowe ludzkie uzyskiwane są od ludzi, którzy niedawno przechodzili określone choroby
zakaźne. Surowice odpornościowe zwierzęce otrzymuje się przez uodpornienie zwierząt (najczęściej koni,
rzadziej jałówek lub baranów) za pomocą zawiesin bakteryjnych lub ektotoksyn. Surowice odpornościowe
stosuje się zapobiegawczo (profilaktycznie) lub leczniczo. Najczęściej stosowane surowice antytoksyczne:
przeciwbłonicza, przeciwtężcowa przeciw zgorzeli gazowej, przeciw jadowi kiełbasianemu, przeciw jadowi
żmij oraz ludzka gamma-globulina.
Surowice przeciwbakteryjne są mniej skuteczne i dlatego rzadziej używane. Surowice zwierzęce zawierają
duże ilości białka obcogatunkowego i mogą wywoływać swoistą nadwrażliwość (alergia) ujawniającą się
objawami anafilaktycznymi ,zwłaszcza przy powtórnym ich zastosowaniu (dlatego przed użyciem należy
wykluczyć możliwość uczulenia).
Szczepionka jest szczepem bakterii danej choroby, a surowica osoczem pozbawionym wszystkiego oprócz
przeciwciał (białych krwinek)
Wyszukiwarka
Podobne podstrony:
MIKROBIOLOGIA JAMY USTNEJ, WYKŁAD 3, 28 03 2013
MIKROBIOLOGIA JAMY USTNEJ, WYKŁAD 7, 23 05 2013
MIKROBIOLOGIA JAMY USTNEJ, WYKŁAD 3, 28 03 2013
Nowotwory jamy ustnej wykład 2004, Nowotwory jamy ustnej:
Nowotwory jamy ustnej wykład 2004, Nowotwory jamy ustnej:
Nowotwory jamy ustnej wykład(1)
wejscie 1 2, 3 rok stoma, mikroby jamy ustnej
Mikrobiologia jamy ustnej tresc cwiczen
nadwrazliwosc, 3 rok stoma, mikroby jamy ustnej
WEJŚCIÓWKI MIKROBIOLOGIA JAMY USTNEJ 10
Mikrobiologia jamy ustnej, tresc cwiczen
Pobieranie i przesyłanie materiału do badań, UM Wrocław - Stomatologia, Mikrobiologia i mikrobiolog
MIKROBIOLOGIA JAMY USTNEJ (TEMATY ĆWICZEŃ)
Morfologia bakterii-barwienie, UM Wrocław - Stomatologia, Mikrobiologia i mikrobiologia jamy ustnej
Gruźlica, UM Wrocław - Stomatologia, Mikrobiologia i mikrobiologia jamy ustnej, Materiały
mikro odp, 3 rok stoma, mikroby jamy ustnej, Zaliczenie
więcej podobnych podstron