ĆW I C Z E N I E Nr 51
POMIAR S E M OGNIWA ELEKTROCHEMICZNEGO
Cel ćwiczenia : Pomiar siły elektromotorycznej ogniwa.
Siłą elektromotoryczną, SEM, E, ogniwa lub napięciem ogniwa w warunkach
bezprądowych, nazywamy różnicę potencjałów ogniwa otwartego, przez które nie płynie
prąd, mierzoną w warunkach zrównoważenia napięcia ogniwa zewnętrznym źródłem
napięcia (metoda kompensacyjna Poggendorfa).
E = lim U
(1)
I
→0
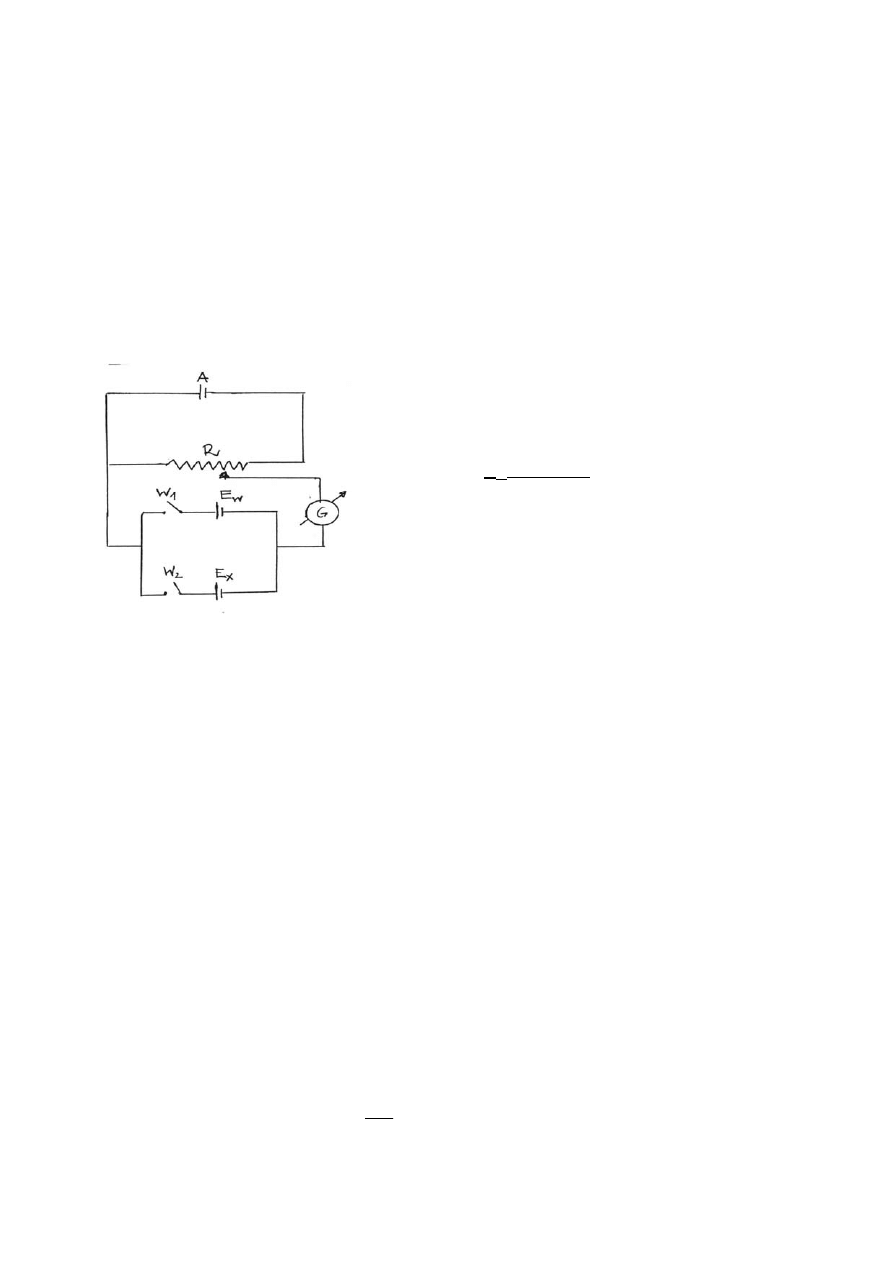
A - źródło prądu stałego o napięciu U
Z
E
w
- ogniwo wzorcowe (ogniwo Westona,
E
W
= 1,018 V)
E
x
- ogniwo badane o SEM = E
X
R - opornik suwakowy lub dekadowy
G - galwanometr
W
i
- przełącznik zamykający odpowiedni
obwód
Rys. 1. Schemat układu pomiarowego.
Pomiar polega na ustawieniu wartości oporu (odpowiednie pokrętła na oporniku
dekadowym) dla ogniwa badanego i wzorcowego (zmiana położenia przełącznika) przy
którym przez galwanometr nie płynie prąd (strzałka galwanometru w pozycji „zero”). Spadek
napięcia, U
X
, dla ogniwa badanego równy jest jego sile elektromotorycznej, E
x
, zgodnie z
równaniem:
E
X
= U
X
=
(2)
X
O
R
I
gdzie I
0
= U
z
/R
0
- natężenie prądu w obwodzie górnym (AR), R
0
– opór całego obwodu (AR),
a R
X
– odczytana z opornika dekadowego wartość oporu przy którym przez galwanometr nie
płynie prąd.
Wielkość I
0
= U
Z
/R
0
nie jest znana, należy więc wykonać pomiar porównawczy włączając do
obwodu ogniwo wzorcowe (przełącznik w pozycji „ogniwo wzorcowe”). Nastawiamy na
oporniku dekadowym wartość oporu przy którym przez galwanometr nie płynie prąd. Spadek
napięcia, U
W
, równy jest sile elektromotorycznej ogniwa wzorcowego, E
w
, zgodnie z
równaniem:
E
W
= U
W
=
(3)
W
O
R
I
Z porównania zależności (2) i (3) można obliczyć siłę elektromotoryczną ogniwa badanego
zgodnie ze wzorem (4).
E
X
= E
W
W
X
R
R
(4)
Wykonanie ćwiczenia
1. Pobrać sprzęt i przygotować roztwory chlorku cynku o stężeniach podanych przez
prowadzącego.
2. Napełnić zlewkę pomiarową najbardziej rozcieńczonym roztworem ZnCl
2
. Wstawić do
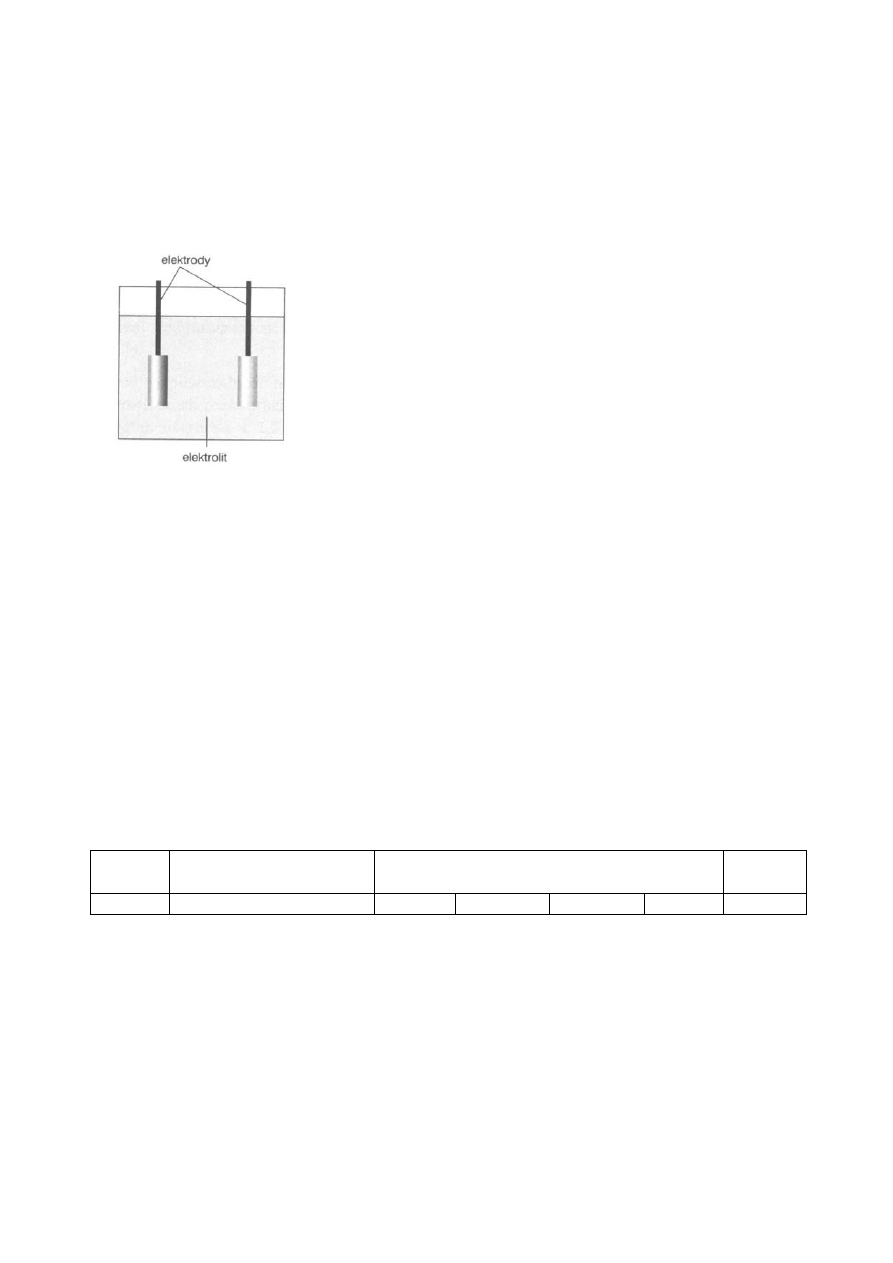
zlewki elektrody, cynkową i chlorosrebrową (Rys. 2).
Schemat ogniwa badanego:
Zn | ZnCl
2
(m) | AgCl | (Ag)
Zn Ag(AgCl)
Rys. 2. Schemat ogniwa badanego
3. Zmierzyć SEM ogniwa Westona. W tym celu:
a. ustawić przełącznik K w pozycji „ogniwo Westona”,
b. zamknąć obwód naciskając przycisk i na oporniku dekadowym ustawić taki opór
R
W
, aby przez galwanometr nie płynął prąd (strzałka w pozycji „zero”). Wartość
tego oporu zapisać w tabeli 1. Pomiar powtórzyć trzykrotnie.
4. Zmierzyć SEM ogniwa badanego:
a. ustawić przełącznik K w pozycji „ogniwo badane”,
b. zamknąć obwód naciskając przycisk i ustawić na oporniku dekadowym taki opór
R
X
, aby przez galwanometr nie płynął prąd (strzałka w pozycji „zero”). Wyniki
zapisać w tabeli 1. Pomiar powtórzyć trzykrotnie.
5. Obliczyć wartości średnie dla oporów R
W
i R
X
.
Tabela 1.
Ogniwo Stężenie elektrolitu
mol/dm
3
Opór, Ω SEM
V
R
1
R
2
R
3
R
śr
6. Obliczyć SEM badanych ogniw w oparciu o równanie (4).
8. Elektrody opłukać wodą destylowaną i zostawić je zanurzone w wodzie, uprzątnąć
stanowisko pracy, oddać pobrany sprzęt.
Opracowanie wyników
1. Napisać schemat reakcji zachodzącej w ogniwie.
2. Obliczyć, dla każdego zbadanego ogniwa :
a. średnie stężenie molarne m
±
wg. wzoru (5)
m
±
=
)
(
1
)
(
−
+
−
+
+
−
+
ν
ν
ν
ν
m
m
gdzie
ν
+
i
ν
-
są współczynnikami stechiometrycznymi.
b. średnią aktywność elektrolitu, a
±
:
a
±
= (
γ
±
)(m
±
)
Wartości średnich jonowych współczynników aktywności elektrolitu podano w tabeli B.
3. Korzystając z równania Nernsta obliczyć teoretyczną wartość SEM badanych ogniw,
E
teor
:
±
−
=
a
F
RT
E
E
ln
2
3
0
gdzie: E
0
jest standardową siłą elektromotoryczną ogniwa, równą różnicy potencjałów
standardowych obu elektrod; R – stała gazowa; T – temperatura; F – stała Faraday’a,
równa 96500 C.
Potencjały standardowe elektrod podano w tabeli A.
4. Obliczyć błąd względny pomiaru SEM ( w procentach). Wyniki zapisać w tabeli 2.
Tabela 2.
Ogniwo
E
dośw
m
±
γ
±
a
±
ln a
±
E
teor
|E
dosw
-E
teor
|*100%
E
teor
Tabela A. Potencjały standardowe elektrod
Elektroda
Zn, Zn
2+
(Ag)AgCl , Cl
-
E
0
, V
- 0,763
+ 0,222
Tabela B. Średnie jonowe współczynniki aktywności,
γ
±
, roztworów elektrolitów w 25
o
C.
Molarność, mol kg
-1
Elektrolit
0,001 0,005 0,01 0,05 0,1 0,5 1,0 2,0
ZnCl
2
0,88 0,79 0,73 0,58
0,518 0,396 0,341 0,291
CdCl
2
0,819 0,623 0,524 0,304 0,228 0,101 0,0696 0,0441
Document Outline
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 51
51, Cwiczenie 51 d, SPRAWOZDANIE Z LABORATORIUM
Ćwiczenie 51, Studia, 1 rok, od Magdy, FIZYKA, Fizyka, Labolatorium
cwiczenie 51
51, Cwiczenie 51 a, Miros?aw FLORK?W
51, Cwiczenie 51 c, fiz51
ćwiczenie 51 Oscylator doc
Egzamin 41-51, sem III, +Mechanika Techniczna II - Wykład.Ćwiczenia.Laboratorium, mechana
Ćwiczenie nr 51(1)
s 5 Nemar Piotr Miśkiewicz ID A0 51 IIIA ćwiczenie 3
3 ćwiczenia BADANIE asfaltów
Ćwiczenie7
Cwiczenia 2
Ćwiczenia V
więcej podobnych podstron