Politechnika Śląska w Gliwicach
Wydział Chemiczny
Polskie Towarzystwo Chemiczne
Gliwice, 25 marca 2006
Numer startowy:
.......................
Nazwisko
............................................................................
Imię
............................................................................
.
Szkoła (pełna nazwa, miejscowość, adres, telefon, e-mail):
.....................................................................................................
.....................................................................................................
.....................................................................................................
...
Klasa ................ Liczba punktów ....................
Imię i nazwisko nauczyciela ......................................................
.....................................................................................................
XIV Ogólnopolski Konkurs Chemiczny
dla młodzieży szkół średnich
Część pisemna
Tabela liczby punktów
1
2
3
4
5
6
7
8
9
Suma
Uwaga! W razie braku rozwiązania jakiegoś zadania, prosimy wpisać „0” w odpowiedniej rubryce tabelki
znajdującej się pod nagłówkiem formularza. Masy atomowe pierwiastków powinny być użyte
z dokładnością do drugiego miejsca po przecinku. Na rozwiązanie wszystkich zadań masz 120 minut
i możesz w tym czasie zdobyć 80 punktów.
1. Produktami wybuchowego rozkładu trójazotanu gliceryny (d = 1,596 g/cm
3
) są:
dwutlenek węgla, azot, tlen i para wodna. W momencie wybuchu temperatura gazów
wzrasta do 2600
°
C.
a) Napisz równanie reakcji rozkładu.
b) Oblicz ciśnienie gazów w chwili wybuchu, przyjmując że początkowa objętość
gazów jest taka jak objętość cieczy przed wybuchem, a produkty wybuchu można
traktować jak gazy doskonałe.
10 punktów
2. 1,40 g fosforu roztworzono na gorąco w 15,0 cm
3
32,0% kwasu azotowego(V) o
gęstości 1,20 g/cm
3
. Jedynym gazowym produktem reakcji był tlenek azotu NO. Ile
cm
3
1 M roztworu NaOH trzeba zużyć, aby zobojętnić otrzymaną mieszaninę
kwasów do pH = 7, jeżeli wiadomo, że taka wartość pH charakteryzuje
równomolową mieszaninę wodorofosforanu(V) i dwuwodorofosforanu(V)
sodu, a
obecność azotanu(V) sodu nie wpływa na odczyn roztworu?
15 punktów
3. Podaj pełne nazwy systematyczne związków organicznych, których wzory
strukturalne są podane poniżej:
H
3
C C
CH
3
CH
3
CH
2
CH
CH
3
CH
3
H
3
C CH
2
CH CH CH CH
3
Cl
Br
F
C C
CH
3
H
CH
3
CH
2
H
C C
CH
2
CH
3
H
H
H
3
C
C
CH
3
CH
3
CH
2
OH
H
Cl
H
H
Cl
a)
b)
c)
d)
e)
f)
10 punktów
4. W reakcji utleniania 10,0 g toluenu otrzymano 10,0 g czystego kwasu
benzoesowego. Kwas ten poddano estryfikacji i otrzymano 10,0 g czystego
benzoesanu etylu. Napisz równanie reakcji estryfikacji używając wzorów
strukturalnych. Oblicz i podaj wydajności pierwszego i drugiego etapu oraz
wydajność estru w przeliczeniu na wyjściowy toluen.
9 punktów
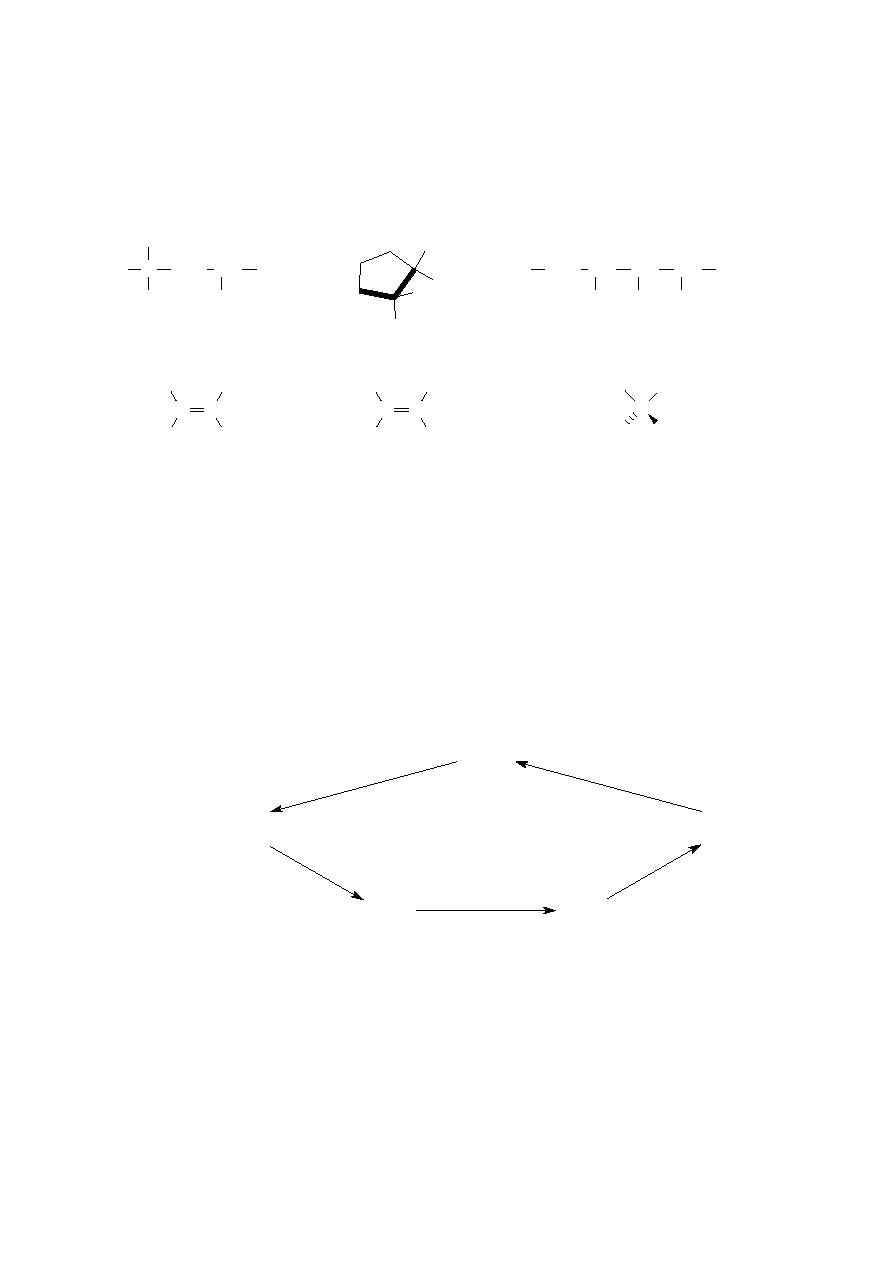
5. Ustal, jakie związki chromu: X
1
, X
2
, X
3
, X
4
(nazwy i wzory) powstają podczas
przemian przedstawionych na poniższym schemacie:
r-r Cr
2
(SO
4
)
3
r-r NaOH
3% r-r H
2
O
2
ogrzewanie
r-r H
2
SO
4
3% r-r H
2
O
2
X
1
X
2
X
3
X
4
nadmiar
r-ru NaOH
r-r = roztwór
Napisz równania zachodzących reakcji (jonowe lub cząsteczkowe).
10 punktów
6. Pewien metal (M) tworzy tlenki, w których zawartość tlenu wynosi:
a) 22,55% b)30,40% c) 36,81% d) 46,63% e) 50,48%.
Wyprowadź najprostsze wzory sumaryczne tych tlenków i uszereguj je wg
wzrastającego charakteru zasadowego (lub malejącego charakteru kwasowego).
9 punktów
7. Zaproponuj po jednej parze odczynników i napisz odpowiednie reakcje, które
umożliwiłyby wytrącenie następujących osadów: BaSO
4
, Fe(OH)
3
, CaCO
3
, FeS.
8 punktów
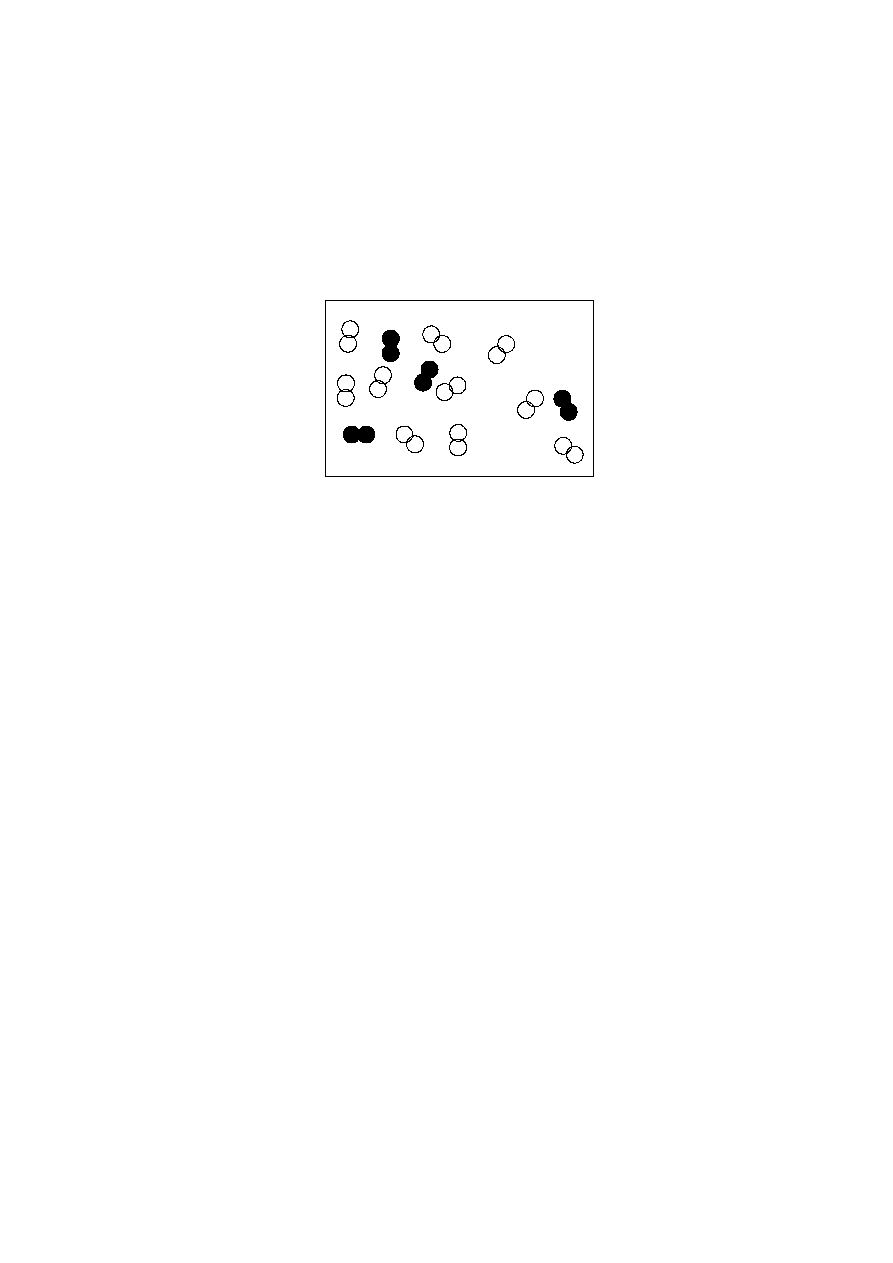
8. Na rysunku atomom azotu odpowiadają zapełnione kule, zaś atomom tlenu –
bezbarwne kule. Ile cząsteczek NO
2
można utworzyć z cząsteczek zawartych w
pojemniku?
4 punkty
9. Zadanie konkursowe z wykładu
5 punktów
Wyszukiwarka
Podobne podstrony:
konkurs XIV 2006 etapII
SZKOLNY KONKURS 2005 - 2006, Klasa VI(1)
KONKURS PODKARPACKIE 2006
konkurs XIII 2005 etapI
konkurs VIII 2000 etapI
Konkurs-2003-XI-etapI
Konkurs-2008-XVI-etapI-rozwiazania
Klasaa V (pati 89), SZKOLNY KONKURS 2005-2006, STYCZEŃ 2005
konkurs XII 2004 etapI
konkurs VII 1999 etapI
SZKOLNY KONKURS 2005 - 2006, Klasa VI(1)
KONKURS PODKARPACKIE 2006
Konkurs 1994 II etapI
Konkurs Deutschmeister 2006 final test pisemny
Konkurs 2008 XVI etapI
KONKURS PODKARPACKIE 2006
Konkurs 2000 VIII etapI
Konkurs 1995 III etapI
więcej podobnych podstron