Chemia Fizyczna, ćwiczenia rachunkowe
Chemia, semestr IV
(9) Zależność stałej szybkości reakcji od temperatury. Równanie Arrheniusa
1.
W temperaturze 0
o
C oraz 20
o
C stałe szybkości pewnej reakcji chemicznej wynoszą
odpowiednio 2,46 i 47,5 s
-1
. Oblicz energię aktywacji tej reakcji i wartość czynnika częstości.
2.
W temperaturze 651,7 K czas połowicznej przemiany dla pierwszorzędowej reakcji rozkładu
termicznego tlenku etylenu wynosi 19780 s. Energia aktywacji tej reakcji wynosi 218 kJ
.
mol
-1
.
Oblicz czas, po którym nastąpi rozkład 75% początkowej ilości tlenku etylenu w temp. 723,2 K.
3.
Badając reakcję rozpadu N
2
O wobec katalizatora metalicznego (złoto) w temperaturze 1173 K
otrzymano następujące dane kinetyczne:
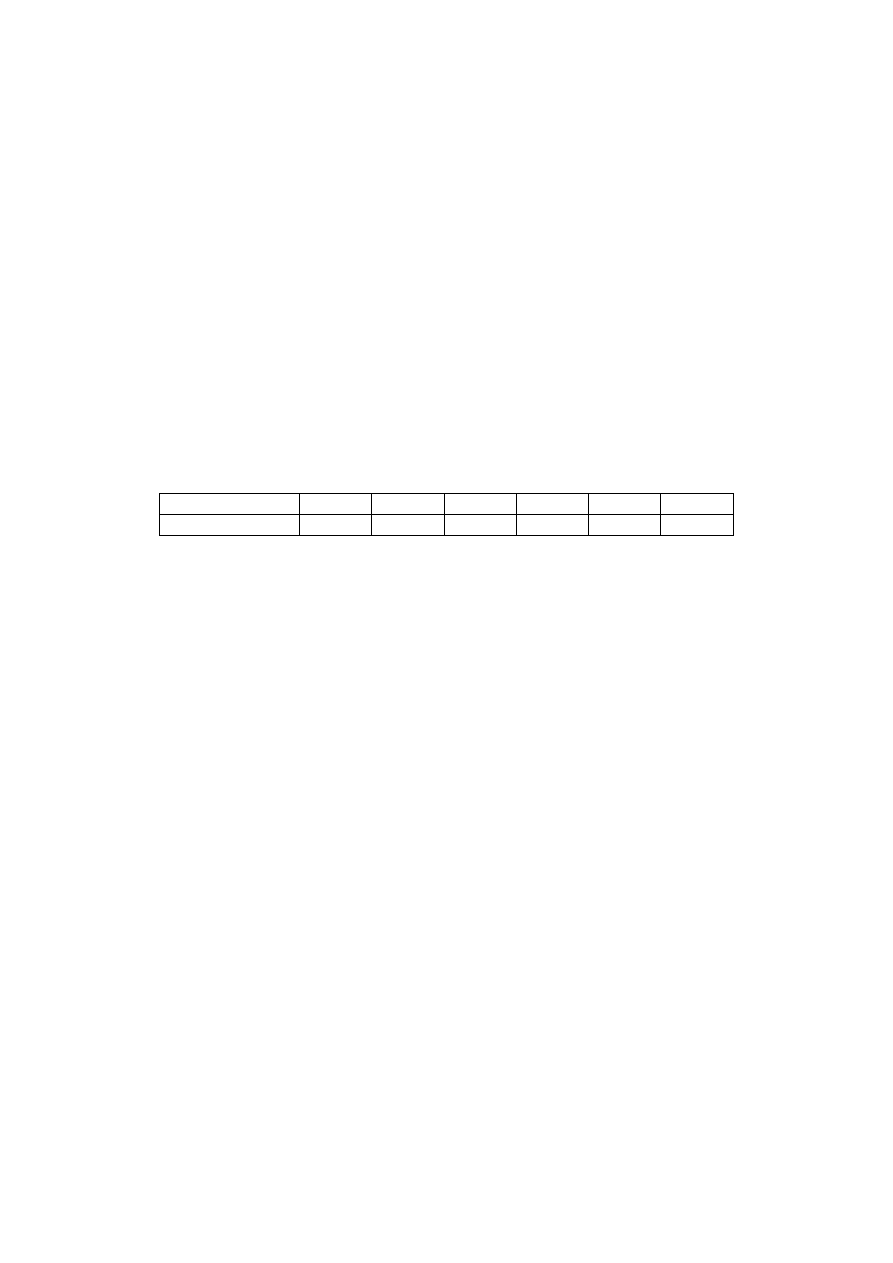
t [s]
0
1800
3180
3900
4800
6000
10
-4
P(N
2
O) [Pa]
2,67
1,81
1,33
1,14
0,932
0,72
Oblicz energię aktywacji reakcji rozpadu N
2
O wobec złota, jeżeli jej stała szybkości w temp. 1073
K wynosi 2,00
.
10
-9
s
-1
.
4.
Czynniki częstości w równaniu Arrheniusa dla dwu reakcji pierwszego rzędu są takie same
i wynoszą 10
13
s
-1
, a ich energie aktywacji różnią się o 15 kJ. W temperaturze 373 K czas
połowicznej przemiany reakcji pierwszej wynosi 100 min. W jakim czasie druga reakcja zajdzie
w 90% w tej temperaturze?
5.
W wysokiej temperaturze pary chlorku etylu rozkładają się według równania reakcji:
C
2
H
5
Cl = C
2
H
4
+ HCl. Energia aktywacji tej reakcji wynosi 249 kJ, a czynnik przedwykładniczy
w równaniu Arrheniusa równa się 1,6
.
10
14
s
-1
. Ile procent chlorku etylu rozpadnie się w ciągu 10
minut w temperaturze 700 K? W jakiej temperaturze szybkość reakcji rozpadu będzie dwukrotnie
większa niż w temperaturze 700 K?
6.
W fazie gazowej atomy chloru reagują szybko z ozonem zgodnie z równaniem reakcji:
Cl + O
3
= ClO + O
2
, której stała szybkości wynosi k = 1,7
.
10
10.
e
-260/T
dm
3
.
mol
-1
.
s
-1
. Oszacuj
szybkość tej reakcji dla: (a) T = 220 K, na wysokości 20 km, gdzie [Cl] = 5
.
10
-17
mol
.
dm
-3
,
a [O
3
] = 8
.
10
-9
mol
.
dm
-3
; (b) dla T = 270 K, na wysokości 45 km, gdzie [Cl] = 3
.
10
-15
mol
.
dm
-3
,
a [O
3
] = 8
.
10
-11
mol
.
dm
-3
.
Wyszukiwarka
Podobne podstrony:
chf ch I cr 019
chf ch I cr 012
chf ch I cr 028
chf ch I cr 014
chf ch I cr 003
chf ch I cr 039
chf ch I cr 027
chf ch I cr 013
chf ch I cr 018
chf ch I cr 004
chf ch I cr 009
chf ch I cr 029
chf ch I cr 022
chf ch I cr 034
chf ch I cr 004
więcej podobnych podstron