2010-01-22
1
Chemia XII
Dysocjacja
elektrolityczna
S
ubstancje chemiczne można
podzielić na dwie grupy.
grupa I - roztwory wodne
przewodzą prąd
elektryczny
grupa II - praktycznie nie
przewodzą prądu w
tych samych warunkach.
Teoria Arrheniusa - substancje
- grupy I
elektrolitami
,
-
grupę II
nieelektrolitami
.
2010-01-22
2
Zdolności przewodzenia prądu
elektrycznego
-
przez roztwory wodne elektrolitów,
tłumaczył Arrhenius obecnością w nich
cząstek zdolnych do przenoszenia
ładunków elektrycznych - obdarzonych
ładunkami.
Do elektrolitów mocnych
należą
• prawie
wszystkie sole
• niektóre kwasy (H
2
SO
4
, HNO
3
, HCl,).
• niektóre zasady (NaOH, KOH ).
Elektrolitami słabymi są;
kwasy - HF, HNO
2
, H
2
S, CH
3
COOH, H
2
CO
3
,
zasady - Cu(OH)
2
, NH
4
OH.
2010-01-22
3
Teoria Arrheniusa
– cztery założenia
• Elektrolity - kwasy, zasady i sole rozpuszczając się
w wodzie
rozpadają się na elementy naładowane
elektrycznie -
ulegają
dysocjacji elektrolitycznej
.
Powstają
jony
-
naładowane dodatnio nazywa się
kationami
, ujemne
anionami
.
• suma ładunków elektrycznych kationów i anionów,
powstających na skutek dysocjacji elektrolitycznej
elektrolitów jest zawsze równa zeru.
• nieelektrolity – substancje w roztworach i w stanie
stopionym nie
przewodzą prądu elektrycznego, nie
ulegają dysocjacji elektrolitycznej.
• właściwości chemiczne jonów różnią się zupełnie
od
własności obojętnych atomów i cząsteczek
Stopień dysocjacji
• elektrolitu określa się stosunkiem liczby moli
cząsteczek zdysocjowanych na jony do liczby moli
cząsteczek substancji rozpuszczonej.
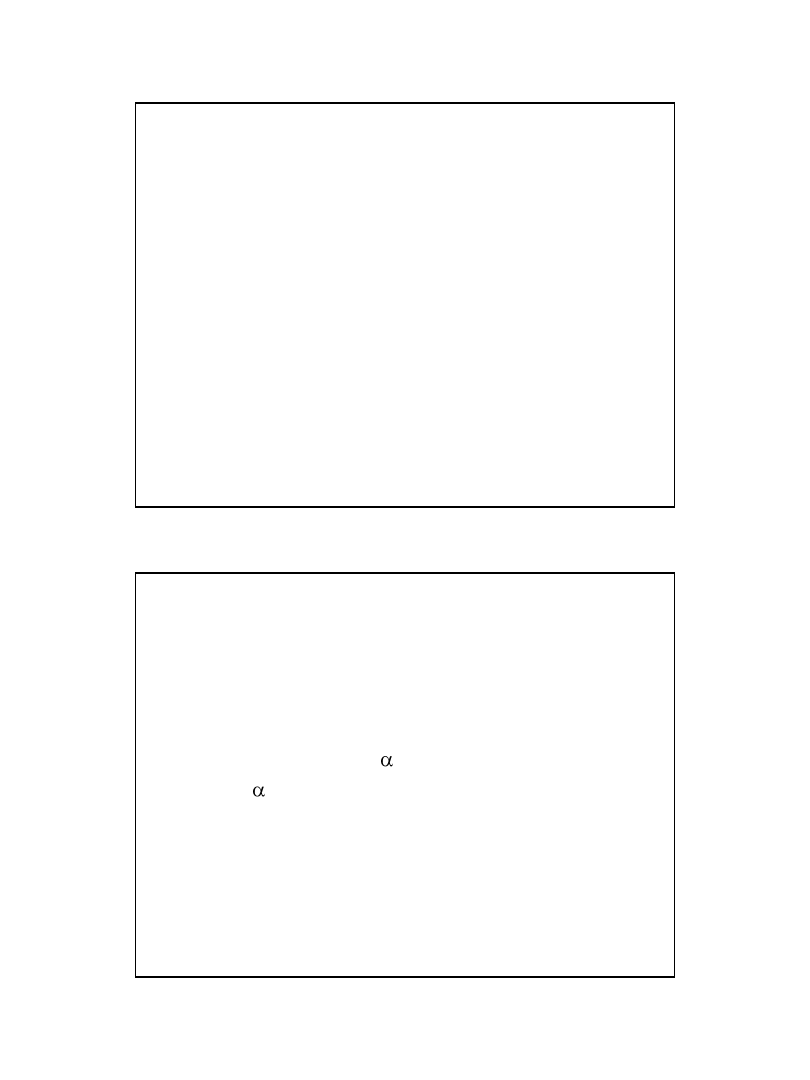
= x/n
• gdzie: ( ) - stopień dysocjacji, x - liczba moli
cząsteczek zdysocjowanych na jony, n - liczba moli
cząsteczek substancji rozpuszczonej
• Stopień dysocjacji wyrażany jest w % lub jedności
2010-01-22
4
Stopień dysocjacji
Jeżeli stopień dysocjacji jest równy lub bliski
jedności - elektrolit jest prawie całkowicie
zdysocjowany na jony a przewodnictwo
elektryczne takiego roztworu jest znaczne.
całkowicie dysocjują elektrolity mocne ( = 1),
elektrolity słabe mają < 1.
Dla elektrolitów słabych, wartości stopnia
dysocjacji wynoszą kilka procent.
Stopień dysocjacji zależy:
• od rodzaju elektrolitu i rodzaju
rozpuszczalnika
• od stężenia roztworu
• nieznacznie od temperatury
• od obecności innych elektrolitów w
roztworze
2010-01-22
5
Rodzaj elektrolitu
• Podstawowym czynnikiem decydującym o
wartości stopnia dysocjacji jest siła wiązania
w cząsteczce dysocjującej.
• Przykładem może być cząsteczka HF.
• Mimo znacznie bardziej polarnego wiązania
H-F
niż w H-Cl, HF jest słabym, a HCl jest
mocnym elektrolitem.
• Częściowo odpowiedzialne za to jest bardzo
silne wi
ązanie H-F - wodór oddziela się z
trudnością.
Rodzaj rozpuszczalnika
• Zmiana rozpuszczalnika może w sposób
znaczący wpłynąć na wartość stopnia
dysocjacji.
Na przykład HCl, w podobnych warunkach,
• w wodzie jest w 100% zdysocjowany,
• w benzenie dysocjacja HCl jest mniejsza
niż 1%.
2010-01-22
6
Stężenie roztworu
• stopień dysocjacji wzrasta z rozcieńczeniem
elektrolitu i w roztworach bardzo
rozcieńczonych wszystkie elektrolity
wykazują stopień dysocjacji zbliżony do
jedności,
• tzn. niemal wszystkie cząsteczki lub
zgrupowania jonów substancji rozpuszczonej
ulegają zdysocjowaniu na jony.
Stała dysocjacji
Dysocjację słabych elektrolitów można traktować jako
odwracalną reakcje chemiczną.
Słaby elektrolit, o wzorze ogólnym AB, ulega w
roztworze wodnym dysocjacji według równania:
• AB <=> A
+
+ B
-
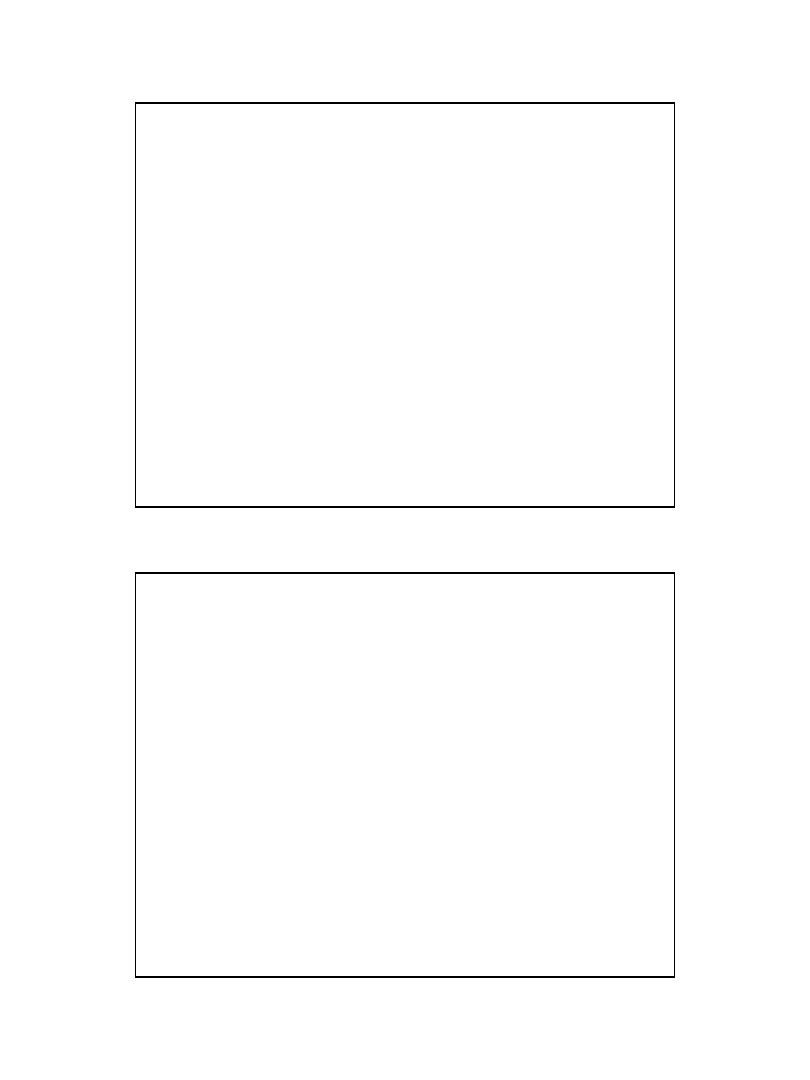
W stanie równowagi równanie można wyrazić
zależnością:
• gdzie:
K
c
-
nosi nazwę stałej dysocjacji,
[A
+
], [B
-
] -
stężenia molowe jonów
[AB] -
stężenie molowe cząsteczek
niezdysocjowanych
2010-01-22
7
Stała K
c
• jest wielkością praktycznie biorąc stałą w
określonej temperaturze,
• niezależną od stężenia.
• może służyć jako miara mocy elektrolitów.
• im elektrolit jest mocniejszy, tym wartość
stałej K
c
jest większa.
• Niektóre elektrolity, np. kwas fosforowy mogą
dysocjować w kilku stadiach i stała dysocjacji ma
wartość dla poszczególnych etapów:
• H
3
PO
4
=
H
+
+ H
2
PO
4
-
• H
2
PO
4
-
=
H
+
+ HPO
4
2-
• HPO
4
2-
=
H
+
+ PO
4
3-
• Stałe dysocjacji dla poszczególnych etapów:
• K
1
= 7.5 x10
-3
• K
2
= 6.3 x10
-8
• K
3
= 4.8 x10
-13
2010-01-22
8
• Jak wynika z poszczególnych wartości K,
najłatwiej przebiega dysocjacja pierwszego jonu
wodorowego z cząsteczki kwasu fosforowego, a
najtrudniej trzecia. Całkowitą dysocjację można
przedstawić w postaci:
• H
3
PO
4
=
3H
+
+ PO
4
3-
• a całkowita stała dysocjacji jest równa
iloczynowi trzech kolejnych dysocjacji:
• K = K
1
x K
2
x K
3
Przykład dla kwasu octowego
CH
3
COOH
• jest zaliczany do słabych kwasów.
• K
c
= [CH
3
COO
-
][H
+
]/[CH
3
COOH]
• = 1,75*10
-
5mol/dm
3
Odpowiednio dla elektrolitu mocnego wartość K
c
> 1.
Umownie -
dla elektrolitów słabych wartości
K
c
wynoszą odpowiednio - 10
-7
< K
c
< 10
-3
.
CH
3
COOH <=> CH
3
COO
-
+ H
+
2010-01-22
9
• Jeśli słaby elektrolit Np. kwas octowy dysocjuje
na jony:
• CH
3
COOH =
CH
3
COO
-
+ H
+
• To stężenie każdego z tych jonów jest równe
iloczynowi stężeń kwasu octowego c i stopnia
dysocjacji :
• [CH
3
COO
-
] = [H
+
] = c
• a stężenie niezdysocjowanych cząstek kwasu
octowego wynosi
• [CH
3
COOH] = c- c = c (1- )
P
rawo rozcieńczeń Oswalda
• Związek pomiędzy stopniem dysocjacji a stałą
dysocjacji ujmuje ogólnie
• K
c
=
2
c/(1 – )
• gdzie c - molowe stężenie wyjściowe [mol/dm
3
]
• Dla elektrolitów słabych wartość stopnia dysocjacji jest
bardzo mała. Wtedy [1- ] jest bliskie 1 i możemy
zapisać:
• K
c
=
2
c
• Stopień dysocjacji słabego elektrolitu jest odwrotnie proporcjonalny do
pierwiastka kwadratowego stężenia molowego tego elektrolitu i wprost
proporcjonalny do pierwiastka kwadratowego jego stałej dysocjacji.
Prawo rozcieńczeń Oswalda słuszne jest jedynie w
przypadku
roztworów elektrolitów słabych i bardzo
rozcieńczonych.
2010-01-22
10
Kwasy, zasady i sole według
Arrheniusa
• Kwasy to związki, które w wodnych roztworach
dysocjują na kationy wodorowe i aniony reszty
kwasowej:
• HCl = H
+
+ Cl
-
• HNO
3
= H
+
+ NO
3
-
• H
3
PO
4
= 3H
+
+ PO
4
3-
• Kwasy zawierające więcej jonów wodorowych
noszą nazwę wielozasadowych. Kwas siarkowy
jest zatem dwuzasadowy, a kwas ortofosforowy
- trójzasadowy.
Zasady
• Zasady to związki, które w wodnych roztworach
dysocjują na aniony wodorotlenowe i kationy
metali lub kationy złożone (NH
4
+
):
• NaOH = Na
+
+ OH
-
• NH
4
OH = NH
4
+
+ OH
-
• Al(OH)
3
= Al
3+
+ 3OH
-
2010-01-22
11
Sole
• Sole są to związki które w roztworach wodnych
dysocjują na kationy metali lub kationy złożone oraz
aniony reszt kwasowych:
• NaCl = Na
+
+ Cl
-
• Oprócz soli obojętnych są też:
- wodorosole, zawierające w cząsteczkach jony wodorowe,
które po dysocjacji nadają roztworowi charakter kwaśny
• NaHSO
4
= Na
+
+ H
+
+ SO
4
2-
• -sole zasadowe, nadające roztworowi charakter zasadowy
• Fe(OH) SO
4
= Fe
3+
+ OH
-
+ SO
4
2-
Przykłady
Kwas
Zasada
Kwas
Zasada
HCl
H
2
O
H
3
O
+
HCO
3
-
H
2
O
+ H
2
O
+ NH
3
+ OH
-
+ H
2
O
+ HCO
3
-
<=> H
3
O
+
<=> NH
4
+
<=> H
2
O
<=> H
3
O
+
<=> H
2
CO
3
+ Cl
-
+ OH
-
+ H
2
O
+ CO
3
2-
+ OH
-
2010-01-22
12
Kwasy i zasady według Bronsteda i
Lowry’ego
• Bardziej ogólna i współcześnie użyteczna jest
teoria Bronsteda i Lowry’ego, według której kwas
jest donorem jonów H
+
, a zasada jest ich
akceptorem.
• HA = H
+
+ A
-
• HA jest kwasem, ponieważ w wyniku reakcji
dostarcza jon wodorowy. W reakcji biegnącej w
przeciwną stronę A
-
jest zasada ponieważ wiąże
H
+
. HA i A
-
określa się jako sprzężoną parę
kwasu i zasady.
Równowagi kwasowo - zasadowe
• W roztworach mają miejsce równowagi w
obecności akceptorów jonów wodorowych,
którymi mogą być cząsteczki reagentów lub
rozpuszczalnika.
Równanie
kwasowo
–
zasadowe przebiega zgodnie z formą ogólną:
• HA + B = HB
+
+ A
-
•
zasada
kwas
• HCl + H
2
O
=
H
3
O
+
+ Cl
-
•
kwas1 + zasada2
kwas2 + zasada1
2010-01-22
13
Teoria Lewisa
• teoria kwasów i zasad jest jeszcze bardziej
ogólna niż teoria protonowa Lowry’ego i
Bronsteda.
• Według Lewisa
- zasadą jest każdy donor pary elektronowej,
- kwasem jest akceptor pary elektronowej -
każda substancja przyłączając parę
elektronową tworząc trwałe wiązanie.
- w ujęciu teorii Bronsteda HCl jest kwasem -
oddaje proton.
- w teorii Lewisa nie jest HCl, sam jon H
+
jako
akceptor pary elektronowej jest kwasem.
Według Lewisa
• kwasem nazywamy związek lub jon, który
przyjmując parę elektronową tworzy wiązanie
kowalencyjne spolaryzowane,
• zasadą związek lub jon, który dostarcza pary
elektronowej do utworzenia tego wiązania.
• Zgodnie z elektronową teorią kwasów i zasad
kation wodorowy (H
+
) jest kwasem, a
amoniak (NH
3
) zasadą - wolna para
elektronowa atomu azotu przyjmowana jest
przez kation wodorowy:
• H
+
+ NH
3
<=> NH
4
+
2010-01-22
14
Przykłady kwasów i zasad według
Lewisa
Kwas
Zasada
H
+
H
+
AlCl
3
BF
3
Ag
+
+ Cl
-
+ NH
3
+ Cl
-
+ F
-
+ 2NH
3
<=> HCl
<=> NH
4
+
<=> AlCl
4
-
<=> BF
4
-
<=> Ag(NH
3
)
2
+
Woda może być kwasem i zasadą
• (kwas)H
+
+ (zasada)HOH <=> H
3
O
+
• (kwas)HOH + (zasada)NH
3
<=> NH
4
+
+ OH
-
Wyszukiwarka
Podobne podstrony:
Chemia labolatorium, Dysocjacja elektrolityczna edycja, Rat
Chemia labolatorium, Dysocjacja elektrolityczna, Dysocjacja elektrolityczna-proces rozpadu związków(
Dysocjacja elektrolityczna, AGH WIMiC, Rok II, Chemia Nieograniczna ROK II
w03 Dysocjacja elektrolity, Szkoła, penek, Przedmioty, Chemia, Laboratoria
8.Dysocjacja elektrolityczna - stopień i stała dysocjacji, Chemia ogólna ćwiczenia
Dysocjacja elektrolityczna, Studia, Chemia
Dysocjacja elektrolityczna, Chemia
Dysocjacja elektrolityczna
DYSOCJCJA ELEKTROLITYCZNA
07 Dysocjacja elektrolityczna, pH sprawozdanie
Zjawisko dysocjacji elektrolitycznej, Sprawozdania - Fizyka
07 Dysocjacja elektrolityczna, pH sprawozdanie
Dysocjacja elektrolityczna i hydroliza Referat
chemia 2, Szkoła, Technikum Elektroniczne, szkoła II TA 2012;2013, Chemia, chemia spr odp
Dysocjacja elektrolityczna id 1 Nieznany
chemia, ogniwa, Potencjał elektrochemiczny - różnica potencjału na granicy faz metal/roztwór
więcej podobnych podstron