
Podstawy Chemii Nieorganicznej
Ć
wiczenia laboratoryjne
kod kursu:
CHC 0120
SZYBKOŚĆ REAKCJI CHEMICZNYCH
Opracowanie: Piotr Drożdżewski
WPROWADZENIE
Badanie szybko
ś
ci reakcji chemicznych nale
ż
y do działu chemii zwanego kinetyk
ą
che-
miczn
ą
. Dział ten obejmuje równie
ż
badanie wpływu ró
ż
nych czynników na szybko
ść
danej reakcji
oraz szczegółowe poznanie jej przebiegu (mechanizmu).
Zgodnie z powszechnym znaczeniem poj
ę
cia szybko
ś
ci, w przypadku reakcji chemicznej
wielko
ść
ta jest okre
ś
lona poprzez zmiany liczno
ś
ci reagentów w stosunku do czasu w którym te
zmiany nast
ę
puj
ą
. Praktycznie oznacza to,
ż
e dla wyznaczenia szybko
ś
ci okre
ś
lonej reakcji trze-
ba ustali
ć
ile moli wybranego substratu reaguje w jednostce czasu lub ile moli którego
ś
z produk-
tów powstaje w tym samym czasie. Definicja ta mo
ż
e jednak doprowadzi
ć
do tego,
ż
e konkretna
warto
ść
szybko
ś
ci reakcji b
ę
dzie zale
ż
e
ć
od wyboru reagenta którego zmiany liczno
ś
ci zostan
ą
wzi
ę
te do obliczenia szybko
ś
ci. Problem ten mo
ż
na zilustrowa
ć
na przykładzie prostej reakcji:
2 H
2
+ O
2
= 2 H
2
O
Je
ż
eli przybli
ż
ona szybko
ść
powy
ż
szej reakcji zostanie wyznaczona na podstawie liczby moli tle-
nu (
∆
nO
2
) zu
ż
ywanego w czasie
∆
t:
v
1
=
−
∆
nO
2
/
∆
t (1)
to warto
ść
ta b
ę
dzie dwukrotnie mniejsza od szybko
ś
ci wyznaczonej ze wzrostu liczno
ś
ci wody:
v
2
=
∆
nH
2
O /
∆
t (2)
Powy
ż
sza ró
ż
nica wynika z faktu,
ż
e w okre
ś
lonym, tym samym czasie, z jednego mola tlenu po-
wstaj
ą
dwa mole wody. Problem ten mo
ż
na usun
ąć
dziel
ą
c wyra
ż
enie na szybko
ść
reakcji
∆
n
i
/
∆
t
przez współczynnik stechiometryczny
ν
i
reagenta u
ż
ytego do jej wyznaczenia. Szybko
ść
reakcji
b
ę
dzie wtedy okre
ś
lona jednoznacznie jako:
v =
∆
n
i
/
ν
i
∆
t (3)
co w przypadku reakcji syntezy wody daje nast
ę
puj
ą
ce zale
ż
no
ś
ci:
v =
−
∆
nO
2
/
∆
t =
−
∆
nH
2
/ 2
∆
t =
∆
nH
2
O /2
∆
t (4)
Znak minus pojawił si
ę
w równaniach (1) i (4) z tego powodu,
ż
e liczno
ś
ci substratów malej
ą
w
miar
ę
upływu czasu i wielko
ś
ciom tym (np.
∆
nO
2
i
∆
nH
2
) przypisuje si
ę
warto
ść
ujemn
ą
, dla od-
ró
ż
nienia od wzrostu liczno
ś
ci produktów (np.
∆
nH
2
O), które to wyra
ż
enia przyjmuje si
ę
jako do-
datnie.
2
Dokładne zdefiniowanie szybko
ś
ci reakcji wymaga zastosowania rachunku ró
ż
niczkowego
czyli zast
ą
pienia wyra
ż
e
ń
∆
n
i
/
∆
t przez dn
i
/dt co daje
v = dn
i
/
ν
i
dt (5)
W równaniu (5), iloraz dn
i
/
ν
i
okre
ś
la si
ę
jako zmian
ę
post
ę
pu reakcji d
ξ
, którego warto
ść
jest dla
wszystkich reagentów jednakowa, a szybko
ść
reakcji mo
ż
na wtedy zdefiniowa
ć
jako stosunek
zmiany post
ę
pu reakcji do czasu w którym ta zmiana nast
ą
piła.
v = d
ξ
i
/ dt (6)
Je
ż
eli reakcja zachodzi w stałej obj
ę
to
ś
ci, to zmiany liczno
ś
ci reagentów dn
i
(lub
∆
n
i
) s
ą
propor-
cjonalne do zmian st
ęż
e
ń
molowych dc
i
(
∆
c
i
) i szybko
ść
reakcji mo
ż
na wyznaczy
ć
z wyra
ż
enia:
v = dc
i
/
ν
i
dt
≈
∆
c
i
/
ν
i
∆
t (7)
Reakcja chemiczna jest rezultatem wielu elementarnych reakcji zachodz
ą
cych pomi
ę
dzy
poszczególnymi atomami czy cz
ą
steczkami. Ka
ż
da elementarna reakcja wymaga uprzedniego
zderzenia si
ę
bior
ą
cych w niej udział cz
ą
stek (atomów, cz
ą
steczek, jonów). Szybko
ść
reakcji za-
le
ż
y wi
ę
c od liczby zderze
ń
a ta od st
ęż
e
ń
reagentów c
i
. Przedstawia to równanie kinetyczne o
ogólnej postaci:
v = k c
A
α
·
c
B
β
· · · (8)
Wykładniki pot
ę
gowe
α
,
β
nosz
ą
nazw
ę
rz
ę
du reakcji wzgl
ę
dem odpowiednich reagentów A, B,
natomiast suma
α
+
β
+ · · · daje ogólny rz
ą
d reakcji. Współczynnik k jest okre
ś
lany jako stała
szybko
ś
ci reakcji.
Nie wszystkie zderzenia cz
ą
stek ko
ń
cz
ą
si
ę
ich przereagowaniem. Aby było to mo
ż
liwe,
zderzaj
ą
ce si
ę
cz
ą
stki musz
ą
mie
ć
na tyle du
żą
energi
ę
by mogły pokona
ć
odpychanie ich chmur
elektronowych i zbli
ż
y
ć
si
ę
do siebie tak blisko aby utworzy
ć
jedn
ą
du
żą
cz
ą
stk
ę
zwan
ą
komplek-
sem aktywnym. Energi
ę
t
ą
, okre
ś
lon
ą
dla jedne-
go mola substancji i mierzon
ą
wzgl
ę
dem prze-
ci
ę
tnej w danych warunkach energii substratów,
nazywa si
ę
energi
ą
aktywacji, E
a
. W kompleksie
aktywnym zachodzi cz
ęś
ciowe przegrupowanie
elektronów prowadz
ą
ce do utworzenia nowych
wi
ą
za
ń
chemicznych kosztem osłabienia innych,
wyst
ę
puj
ą
cych w substratach. Kompleks aktywny
jest bardzo nietrwały i szybko rozpada si
ę
na
produkty reakcji lub te
ż
z powrotem na substraty.
Fakt istnienia energii aktywacji objawia si
ę
cz
ę
sto
jako konieczno
ść
zainicjowania reakcji np.
podczas zapalania gazu energia aktywacji po-
chodzi od zapalonej zapałki lub iskry elektrycznej.
W miar
ę
wzrostu temperatury ro
ś
nie ener-
gia wszystkich cz
ą
stek, co powoduje wzrost liczby zderze
ń
aktywnych ko
ń
cz
ą
cych si
ę
reakcj
ą
, a
tym samym wzrost szybko
ś
ci reakcji. Według przybli
ż
onej reguły, podwy
ż
szenie temperatury o 10
K powoduje 2
÷
4 krotny wzrost szybko
ś
ci reakcji. W równaniu kinetycznym reakcji (8) wpływ tem-
peratury uwzgl
ę
dnia si
ę
poprzez temperaturow
ą
zale
ż
no
ść
stałej szybko
ś
ci reakcji.
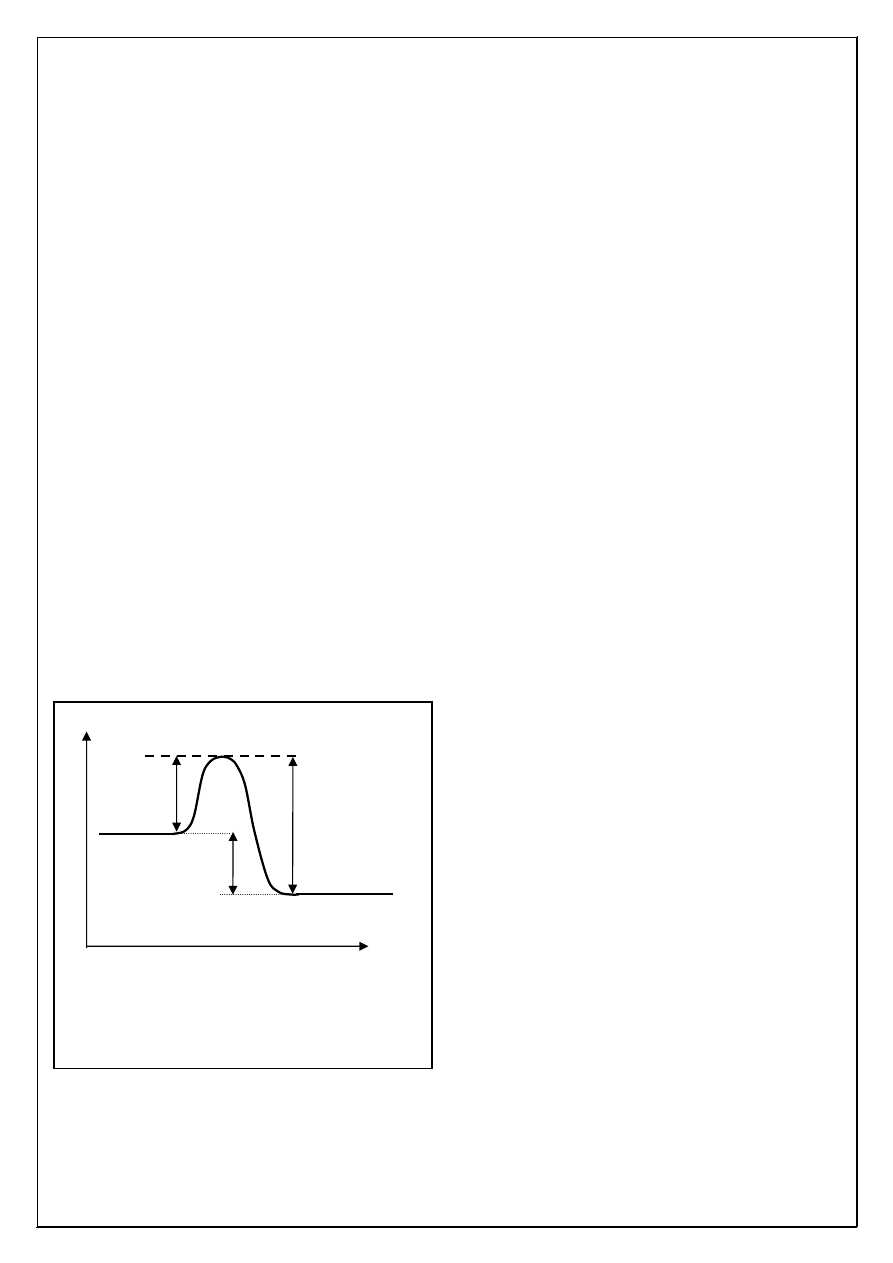
Substraty
Produkty
Kompleks aktywny
E
a
E
a’
∆
H
r
Droga reakcji
E
Przebieg energetyczny reakcji egzotermicznej.
E
a
– energia aktywacji,
∆
H
r
– energia reakcji
E
a’
– energia aktywacji reakcji
odwrotnej

3
Prawdopodobie
ń
stwo zderzenia si
ę
cz
ą
stek prowadz
ą
ce do utworzenia kompleksu aktyw-
nego jest tym mniejsze im wi
ę
ksza liczba cz
ą
stek musi wzi
ąć
w nim udział. Praktycznie obserwuje
si
ę
reakcje w których nast
ę
puj
ą
jednoczesne zderzenia co najwy
ż
ej trzech cz
ą
stek – jest to reak-
cja elementarna trójcz
ą
steczkowa. Bardziej prawdopodobne s
ą
reakcje dwucz
ą
steczkowe, znane
s
ą
tak
ż
e reakcje jednocz
ą
steczkowe, których szybko
ść
zale
ż
y od okre
ś
lonych przemian energe-
tycznych wewn
ą
trz cz
ą
steczek. Je
ż
eli z równania stechiometrycznego wynika,
ż
e w reakcji po-
winna wzi
ąć
udział wi
ę
ksza liczba cz
ą
steczek, to reakcja taka przebiega w kilku etapach z których
ka
ż
dy jest jedn
ą
z wy
ż
ej wymienionych reakcji elementarnych. Poznanie wszystkich etapów po-
zwala na ustalenie pełnego mechanizmu reakcji.
Przemiana substratów w produkty mo
ż
e przebiega
ć
ró
ż
nymi drogami, według ró
ż
nych me-
chanizmów reakcji. Z mo
ż
liwo
ś
ci tej korzysta si
ę
szczególnie wtedy, gdy reakcja przebiega zbyt
wolno, lub z mał
ą
wydajno
ś
ci
ą
żą
danego produktu. Wprowadzenie do reakcji specyficznej sub-
stancji zwanej katalizatorem zmienia jej mechanizm przez co obni
ż
a si
ę
energia aktywacji i wzra-
sta szybko
ść
. Prostym przykładem mo
ż
e tu by
ć
reakcja samorzutnego rozkładu nadtlenku wodo-
ru:
2 H
2
O
2
= 2 H
2
O + O
2
Reakcja ta przebiega wolno, o czym
ś
wiadczy fakt,
ż
e roztwór nadtlenku wodoru wyra
ź
nie traci
swoje wła
ś
ciwo
ś
ci dopiero po dłu
ż
szym czasie. Je
ż
eli jednak doda si
ę
do tego roztworu jonów
jodkowych, nadtlenek wodoru rozkłada si
ę
prawie natychmiast, przy czym proces ten zachodzi w
dwóch etapach. Etap pierwszy to redukcja nadtlenku wodoru do wody przy jednoczesnym utle-
nianiu jonów jodkowych do jodanowych(I). W drugim etapie jony jodanowe(I) redukuj
ą
si
ę
z po-
wrotem do jodkowych utleniaj
ą
c przy tym kolejn
ą
porcj
ę
nadtlenku wodoru do gazowego tlenu (z
wydzieleniem wody).
Reakcje powy
ż
sze ilustruj
ą
istotn
ą
cech
ę
katalizatora jak
ą
jest fakt,
ż
e nie zu
ż
ywa si
ę
on w czasie
reakcji. Katalizator mo
ż
e by
ć
w tej samej fazie co reagenty (kataliza homogeniczna) lub w innej
fazie (kataliza heterogeniczna). W tym drugim przypadku katalizator przewa
ż
nie jest substancj
ą
stał
ą
, a reakcja przebiega pomi
ę
dzy substratami zaadsorbowanymi na jego powierzchni. Szyb-
ko
ść
reakcji zale
ż
y w takich przypadkach nie tylko od poprzednio przedstawionych czynników
(st
ęż
enia, temperatura), lecz tak
ż
e od wielko
ś
ci powierzchni katalizatora oraz od szybko
ś
ci dyfuzji
substratów do katalizatora oraz dyfuzji produktów od powierzchni katalizatora w gł
ą
b mieszaniny
reakcyjnej.
Reakcje z udziałem katalizatorów wyst
ę
puj
ą
powszechnie w funkcjonowaniu organizmów
ż
ywych.
Specyficzne białka - enzymy pełni
ą
rol
ę
biokatalizatorów wielu procesów fizjologicznych (np. kata-
laza katalizuje wy
ż
ej przedstawiony rozkład nadtlenku wodoru). W wielu enzymach istotn
ą
rol
ę
pełni
ą
jony metali, stanowi
ą
ce aktywne centra na których zachodz
ą
katalizowane reakcje.
Istniej
ą
tak
ż
e substancje zwane inhibitorami, które spowalniaj
ą
szybko
ść
reakcji. Stosuje si
ę
je w
przypadkach kiedy zachodzi konieczno
ść
powstrzymania niekorzystnych procesów chemicznych
jak np. korozji metali i innych materiałów.

4
LITERATURA:
1. Biela
ń
ski, Podstawy chemii nieorganicznej, PWN 2001.
2. K.Skudlarski (Red.) Podstawy chemii.
Ć
wiczenia laboratoryjne, Wydawnictwo P.Wr. 1982.
3. I. Barycka, K. Skudlarski, Podstawy chemii, Oficyna Wydawnicza Politechnika Wrocławska, 2001.
Pytania kontrolne:
1. Czym zajmuje si
ę
kinetyka chemiczna?
2. Jak definiuje si
ę
szybko
ść
reakcji chemicznej?
3. Jaki jest wpływ temperatury na szybko
ść
reakcji chemicznej?
4. Co to jest rz
ą
d reakcji?
5. Od jakich dodatkowych czynników zale
ż
y szybko
ść
reakcji chemicznej w układzie heterogenicznym?
6. Dlaczego nie wszystkie zderzenia cz
ą
stek substratów ko
ń
cz
ą
si
ę
ich przereagowaniem?
7. Co to jest kompleks aktywny i jaka jest jego energia w stosunku do
ś
rednich energii substratów i pro-
duktów?
8. Jakie s
ą
wzgl
ę
dne energie substratów i produktów w reakcjach egzo- i endotermicznych?
9. Jakie s
ą
podstawowe cechy katalizatora?
10. Jaki jest wpływ inhibitora na reakcj
ę
chemiczn
ą
.

5
WYKONANIE DO
Ś
WIADCZE
Ń
Do
ś
wiadczenie 1. Wpływ temperatury na szybko
ść
reakcji
Materiały i odczynniki: 0,001M manganian(VII) potasu (KMnO
4
), 3 M kwas siarkowy(VI)
(H
2
SO
4
), 0,5 M szczawian amonu ( (NH
4
)
2
C
2
O
4
), ła
ź
nia wodna, stoper (zegarek z se-
kundnikiem)
Przygotowa
ć
dwie probówki i gor
ą
c
ą
ła
ź
ni
ę
wodn
ą
(prawie wrz
ą
c
ą
). Do jednej probówki
wla
ć
2 cm
3
0,001 M manganianu(VII) potasu, 10 kropli 3 M kwasu siarkowego i 3 krople
0,5 M szczawianu amonu. Zawarto
ść
probówki szybko wymiesza
ć
, odla
ć
połow
ę
do drugiej
probówki, umie
ś
ci
ć
j
ą
w ła
ź
ni wodnej i rozpocz
ąć
pomiar czasu.
•
Zanotowa
ć
czasy potrzebne do całkowitego odbarwienia roztworów w poszczególnych
probówkach.
•
Zapisa
ć
równanie reakcji (jonowo).
•
Oszacowa
ć
wpływ temperatury na szybko
ść
reakcji redukcji jonów manganiano-
wych(VII) podaj
ą
c ile razy czas potrzebny do odbarwienia roztworu w probówce
ogrzewanej był krótszy od czasu odbarwienia si
ę
roztworu w drugiej probówce.
Do
ś
wiadczenie 2. Wpływ st
ęż
enia reagentów na szybko
ść
reakcji
Materiały i odczynniki: 3 M kwas siarkowy(VI) (H
2
SO
4
), 0,5 M tiosiarczan sodu (Na
2
S
2
O
3
),
stoper (zegarek z sekundnikiem)
Przygotowa
ć
trzy jednakowe probówki. Do pierwszej probówki wla
ć
4 cm
3
wody i 1 cm
3
0,50 M roztworu tiosiarczanu sodu. Do drugiej probówki wla
ć
5 kropli 0,5 M roztworu
Na
2
S
2
O
3
, a do trzeciej 1 kropl
ę
0,5 M roztworu Na
2
S
2
O
3
i uzupełni
ć
wod
ą
obydwie pro-
bówki do obj
ę
to
ś
ci 5 cm
3
. Do wszystkich probówek doda
ć
po 3 krople 3 M kwasu siarko-
wego(VI) i dokładnie wymiesza
ć
roztwory rozpoczynaj
ą
c równocze
ś
nie pomiar czasu, który
upłynie do momentu pojawienia si
ę
zauwa
ż
alnego zm
ę
tnienia w poszczególnych probów-
kach. (zm
ę
tnienie łatwiej mo
ż
na zauwa
ż
y
ć
zagl
ą
daj
ą
c do wn
ę
trza probówki).
•
Zapisa
ć
równanie reakcji rozkładu jonów tiosiarczanowych w
ś
rodowisku kwa
ś
nym.
•
Zrobi
ć
zestawienie „st
ęż
enie – czas reakcji” dla trzech wykonanych eksperymentów.
•
Przyjmuj
ą
c,
ż
e obj
ę
to
ść
pojedynczej kropli wynosi 0,05 cm
3
, oszacowa
ć
wpływ st
ęż
enia
jonów tiosiarczanowych na szybko
ść
reakcji.

6
Do
ś
wiadczenie 3. Wpływ obecno
ś
ci katalizatora lub inhibitora na
szybko
ść
reakcji
Materiały i odczynniki: 5 % roztwór nadtleneku wodoru (H
2
O
2
), 1,0 M kwas fosforowy(V)
(H
3
PO
4
), stały jodek potasu (KI),
ś
rodek pianotwórczy
Do trzech długich probówek wla
ć
po 1 cm
3
5 % roztworu nadtlenku wodoru i po jednej kro-
pli
ś
rodka pianotwórczego. Do pierwszej probówki doda
ć
1 kropl
ę
1,0 M kwasu fosforowe-
go(V), do drugiej probówki doda
ć
szczypt
ę
stałego jodku potasu, po czym wszystkie pro-
bówki umie
ś
ci
ć
w ła
ź
ni wodnej o temperaturze 60-70
o
C (przy tej temperaturze zaczyna by
ć
wyra
ź
nie widoczne parowanie wody).
•
Oszacowa
ć
szybko
ść
rozkładu nadtlenku wodoru obserwuj
ą
c szybko
ść
tworzenia piany
przez wydzielaj
ą
cy si
ę
tlen.
•
Okre
ś
li
ć
charakter dodanych substancji (katalizator, inhibitor) ze wzgl
ę
du na ich
wpływ na szybko
ść
reakcji rozkładu przyjmuj
ą
c,
ż
e trzecia probówka zawieraj
ą
ca
jedynie roztwór nadtlenku wodoru pełni rol
ę
odno
ś
nika.
•
Napisa
ć
reakcj
ę
samorzutnego rozkładu nadtlenku wodoru oraz reakcje zachodz
ą
ce w
obecno
ś
ci katalizatora.
Do
ś
wiadczenie 4. Działanie biokatalizatora
Materiały i odczynniki: 5 % roztwór nadtleneku wodoru (H
2
O
2
), plasterek ziemniaka, mały
przedmiot metalowy (moneta)
Na plasterek ziemniaka poło
ż
y
ć
niewielki metalowy przedmiot (np. monet
ę
) rozgrzany do
około 200
O
C. Po zdj
ę
ciu przedmiotu pola
ć
powierzchni
ę
ziemniaka roztworem nadtlenku
wodoru.
•
Zaobserwowa
ć
rozkład (p
ę
cherzyki tlenu) nadtlenku wodoru katalizowany przez enzy-
my nie uszkodzone działaniem wysokiej temperatury.
Do
ś
wiadczenie 5. Wpływ powierzchni reagentów na szybko
ść
reakcji
Materiały i odczynniki: 2 M kwas solny (HCl), Zn (granulki oraz bardziej rozdrobniony)
Do dwóch probówek wla
ć
po 1 cm
3
2,0 M kwasu solnego. W pierwszej probówce umie
ś
ci
ć
jedn
ą
granulk
ę
cynku, w drugiej porównywaln
ą
ilo
ść
(w sensie masy) opiłek lub wiórków
cynku.
•
Porówna
ć
szybko
ść
reakcji roztwarzania cynku w obu probówkach obserwuj
ą
c inten-
sywno
ść
wydzielania gazowego wodoru.
•
Napisa
ć
zachodz
ą
ca reakcj
ę
.
Do
ś
wiadczenie 6. Katalityczne utlenianie metanolu do metanalu (pokaz)

7
Materiały i odczynniki: metanol (CH
3
OH), siatka platynowa
Do zlewki o pojemno
ś
ci 250 cm
3
wla
ć
około 10 cm
3
metanolu. Rozgrza
ć
siatk
ę
platynow
ą
w utleniaj
ą
cym płomieniu palnika do czerwono
ś
ci, wyj
ąć
z płomienia i w momencie gdy
przestanie
ś
wieci
ć
, wło
ż
y
ć
do zlewki i przytrzyma
ć
2
÷
3 cm nad powierzchni
ą
cieczy w
zlewce. Po chwili siatka powinna si
ę
roz
ż
arzy
ć
ponownie pod wpływem ciepła reakcji utle-
niania metanolu (alkoholu metylowego) do metanalu (aldehydu mrówkowego). Nad zlewk
ą
powinien by
ć
wyczuwalny zapach aldehydu.
•
Napisa
ć
reakcj
ę
katalitycznego utleniania metanolu tlenem z powietrza.
Do
ś
wiadczenie 7. Wyznaczanie stałej szybko
ś
ci reakcji
Materiały i odczynniki: 0,01 M siarczan(IV) sodu (Na
2
SO
3
) w 1% roztworze skrobi (roztwór
jest nietrwały i powinien by
ć
przygotowany krótko przed wykonaniem do
ś
wiadcze-
nia), 0,02 M kwas jodowy(V) (HIO
3
), 5 zlewek o pojemno
ś
ci od 50 do 100 cm
3
, stoper
(zegarek z sekundnikiem)
Celem do
ś
wiadczenia jest pomiar szybko
ś
ci reakcji utleniania jonów siarczanowych(IV) przez
jony jodanowe(V). Proces ten przebiega w dwóch etapach:
Etap I: jony siarczanowe(IV) s
ą
utleniane do siarczanowych(VI) przez jony jodanowe(V) które re-
dukuj
ą
si
ę
do jonów jodkowych. Reakcja ta przebiega powoli.
Etap II: w
ś
rodowisku kwa
ś
nym, jony jodkowe s
ą
utleniane do wolnego jodu przez jony jodano-
we(V) które redukuj
ą
si
ę
tak
ż
e do wolnego jodu. Reakcja ta zachodzi bardzo szybko, a o jej
przebiegu
ś
wiadczy zmiana barwy wywołana powstaj
ą
cym jodem (barw
ę
mo
ż
na dodatko-
wo wzmocni
ć
przez dodanie roztworu skrobi z któr
ą
jod daje kompleks molekularny skro-
bia-I
2
o bardzo intensywnym, niebieskim zabarwieniu).
Poniewa
ż
jony siarczanowe(IV) s
ą
w
ś
rodowisku kwa
ś
nym silniejszym reduktorem od jonów jod-
kowych
wi
ę
c reakcja etapu II nie zachodzi tak długo, jak długo w roztworze s
ą
jeszcze jony siar-
czanowe(IV). W momencie całkowitego zu
ż
ycia jonów siarczanowych(IV) reakcja etapu II zaczyna
biec bardzo szybko, w wyniku czego roztwór w jednej chwili zmienia zabarwienie. Ta efektowna
reakcja nosi nazw
ę
chemicznego zegara, który mo
ż
na „nastawi
ć
” na okre
ś
lon
ą
długo
ść
mierzo-
nego czasu poprzez dobranie odpowiednich st
ęż
e
ń
reagentów, tak jak to wynika z równania (8).
Je
ż
eli do
ś
wiadczenie b
ę
dzie przeprowadzane przy ustalonym st
ęż
eniu jonów siarczanowych(IV)
to szybko
ść
ich utleniania b
ę
dzie zale
ż
e
ć
od st
ęż
enia utleniacza czyli jonów jodanowych(V)
v = k[IO
3
–
]
Je
ż
eli przygotuje si
ę
kilka roztworów, w których zawarto
ść
jonów siarczanowych(IV) b
ę
dzie taka
sama, to zmieniaj
ą
c st
ęż
enie jonów jodanowych(V) mo
ż
na zaobserwowa
ć
ró
ż
ne czasy pojawienia
si
ę
niebieskiego zabarwienia, co
ś
wiadczy o ró
ż
nych szybko
ś
ciach reakcji (czas trwania reakcji
jest odwrotnie proporcjonalny do
ś
redniej szybko
ś
ci reakcji). Konstruuj
ą
c wykres zale
ż
no
ś
ci
ś
red-
niej szybko
ś
ci reakcji V (odwrotno
ść
czasu koniecznego do pojawienia si
ę
barwy) od st
ęż
enia jo-
nów jodanowych(V), mo
ż
na wyznaczy
ć
stał
ą
szybko
ś
ci k z nachylenia otrzymanej prostej.
Wykonanie:
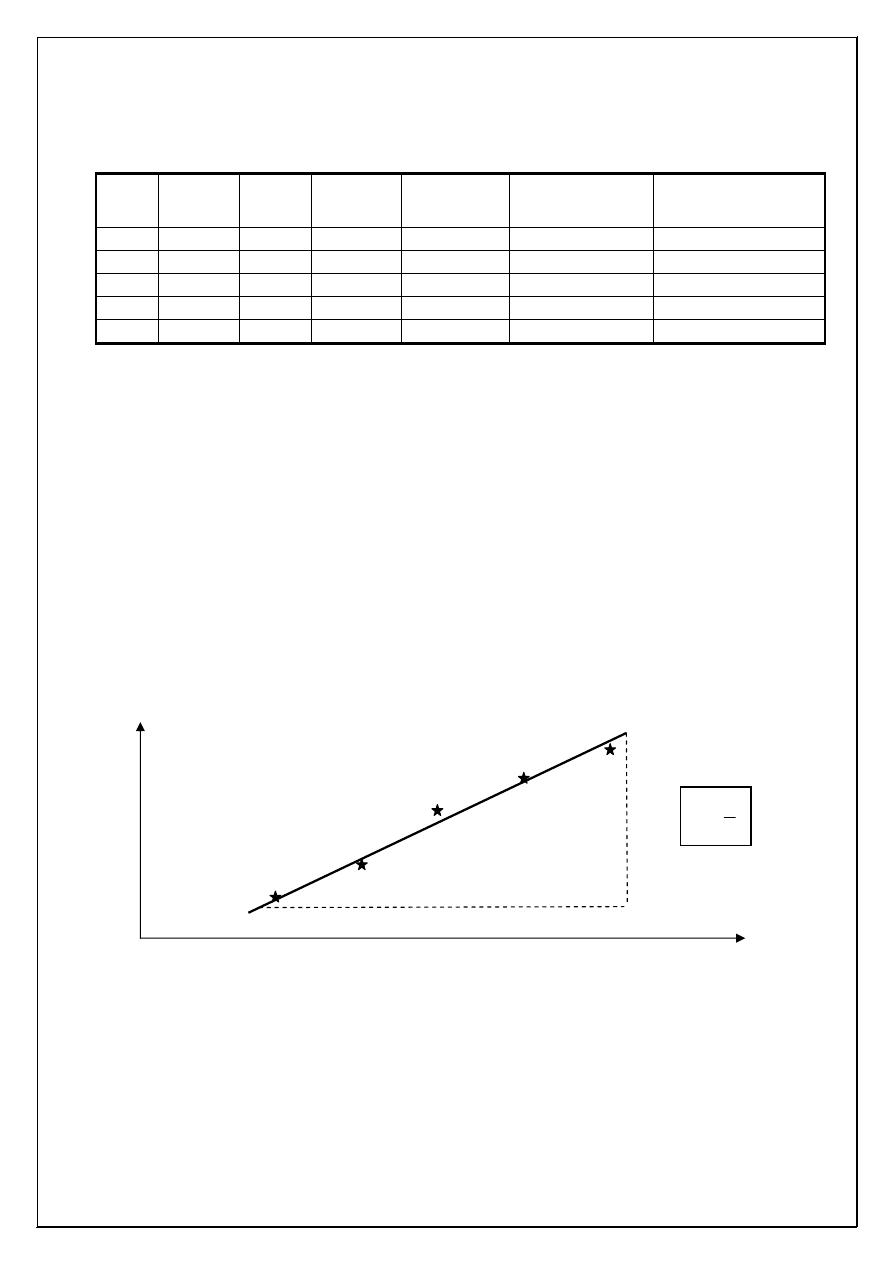
8
Do 5 zlewek wla
ć
podane w tabeli ilo
ś
ci 0,01 M roztworu siarczanu(IV) sodu (roztwór ten
jest 0.1% wzgl
ę
dem skrobi) oraz wody.
St
ęż
enie roztworu podstawowego kwasu jodowego(V) (lub odpowiednio zakwaszonego
kwasem siarkowym(VI) roztworu jodanu(V) potasu) wynosi 0,02 mol/dm
3
.
Roz-
twór
3
SO
2
Na
V
[cm
3
]
O
2
H
V
[cm
3
]
3
HIO
V
[cm
3
]
3
HIO
c
[mol/dm
3
]
Czas reakcji
t [s]
Ś
rednia szybko
ść
re-
akcji V=1/t [s
-1
]
1
6,0
7,0
7,0
2
6,0
8,0
6,0
3
6,0
9,0
5,0
4
6,0
10,0
4,0
5
6,0
11,0
3,0
Zlewk
ę
z roztworem „1” umie
ś
ci
ć
na kartce papieru, przygotowa
ć
si
ę
do pomiaru czasu. W
innej zlewce przygotowa
ć
odpowiedni
ą
obj
ę
to
ść
(według tabeli) 0.02 M roztworu kwasu
jodowego(V). Wla
ć
szybko roztwór kwasu jodowego(V) do zlewki „1” i rozpocz
ąć
pomiar
czasu do chwili pojawienia si
ę
niebieskiego zabarwienia. Zawarto
ść
zlewki cały czas mie-
sza
ć
bagietk
ą
. Post
ę
powanie powtórzy
ć
dla pozostałych roztworów „2”
÷
„5”. Wyniki umie-
ś
ci
ć
w tabeli.
•
Sporz
ą
dzi
ć
wykres zale
ż
no
ś
ci szybko
ś
ci reakcji V od st
ęż
enia jonów jodanowych(V).
Wzdłu
ż
zaznaczonych punktów pomiarowych poprowadzi
ć
prost
ą
tak, aby odchylenie
od niej wszystkich punktów było jak najmniejsze (patrz przykładowy wykres poni
ż
ej).
•
Z wykresu wyznaczy
ć
ś
redni
ą
warto
ść
stałej szybko
ś
ci reakcji (k).
•
W sprawozdaniu umie
ś
ci
ć
zapis jonowy równa
ń
zachodz
ą
cych reakcji.
V
[IO
3
-
]
a
b
b
a
k
=
Wyszukiwarka
Podobne podstrony:
05 Szybkośc reakcji chemicznych II sprawozdanie
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
5.Badanie wpływu stężenia substancji reagujących na szybkość reakcji chemicznej., Państwowa Wyższa S
szybkość reakcji chemicznej(1), NAUKA, chemia, lab
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH nowy
Walkowiak, Chemia ogólna, Szybkość reakcji chemicznych
SZYBKOŚĆ REAKCJI CHEMICZNYCH, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Wyklad 8. Szybkosc reakcji chemicznych PCHN SKP studport
Od czego zależy szybkość reakcji chemicznych
Szybkość reakcji chemicznych
5,6 szybkość reakcji chemicznych istrukcja
SZYBKOŚĆ REAKCJI CHEMICZNYCH
Wyklad 9. Szybkosc reakcji chemicznych, chomikowe, WYKŁADY z Chemii
Wykład 9. Szybkosc reakcji chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
Szybkość reakcji chemicznych
więcej podobnych podstron