IX. SZYBKOŚĆ REAKCJI CHEMICZNYCH
1. Definicja szybkości reakcji chemicznej
Rozpatrzmy reakcję chemiczną przebiegającą w fazie gazowej:
2NH3 = N2 + 3H2
Jako szybkość reakcji można uznać pochodne:
Możemy zapisać, że:
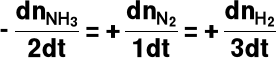
Wprowadźmy pojęcie postępu reakcji (ξ):
gdzie ξ(ksi) - postęp reakcji
ν (ni) - współczynnik stechiometryczny
Szybkość reakcji:
dla V = const.
2. Od czego zależy szybkość reakcji chemicznej?
Cząsteczkowość i rzędowość reakcji.
Dla reakcji:
a ⋅ A + b ⋅ B + c ⋅ C = .........
![]()
gdzie k - stała szybkości reakcji
cA, cB, cC - stężenia substratów A, B i C
Cząsteczkowość reakcji wynosi:
W rzeczywistości zdarza się iż wyznaczone doświadczalnie współczynniki potęgowe nie wynoszą a, b i c lecz przyjmują inne wartości.
Załóżmy iż wynoszą one α, β, γ
α, β, γ - rzędy reakcji w stosunku do reagentów A, B i C.
![]()
n = α + β + γ ogólny rząd reakcji
n może być: 0, 1, 2
↑ ↑ ↑
reakcja rzędu: 0" "1" "2"
Rząd reakcji może też być ułamkowy lub nawet ujemny.
Jaka jest cząsteczkowość i rzędowość wybranych reakcji?
Przykład 1:
1NO(g) + 1O3(g) = 1NO2(g) + 1O2(g)
Cząsteczkowość tej reakcji wynosi 2 (a = 1, b = 1, a + b = 2)
Eksperymentalnie ustalono, że:
r = k ⋅ cNO ⋅ cO3
A więc rzędowość tej reakcji wynosi też 2 (α = 1, β = 1, α + β = n = 2)
Tutaj rzędowość pokrywa się z cząsteczkowością reakcji !
Przykład 2:
4HBr(g) + O2(g) = 2H2O(g) + 2Br2(g)
Cząsteczkowość tej reakcji wynosi 5 (4 + 1 = 5)
Doświadczalnie ustalono, że:
r = k ⋅ cHBr ⋅cO2
A więc rzędowość tej reakcji wynosi n = 1 + 1 = 2 (n ≠ 5)
Tutaj rzędowość nie pokrywa się z cząsteczkowością reakcji.
Oznacza to, że reakcja ta przebiega poprzez kilka etapów.
Ustalono, że reakcja ta przebiega poprzez 3 etapy:
(1) HBr + O2 = HOOBr (etap powolny)
(2) HOOBr + HBr = 2HOBr (etap szybki)
(3) 2HOBr + 2HBr = 2H2O + 2Br2 (etap szybki)
4HBr + O2 = 2H2O + 2Br2 po dodaniu stronami
Szybkość sumaryczna reakcji chemicznej zależna jest od szybkości etapu najwolniejszego (w tym przypadku od reakcji (1)) |
Badania kinetyczne prowadzą do poznania mechanizmu reakcji.
3. Zmiana energii w czasie reakcji chemicznej
Jak zmienia się energia zespołu zderzających się cząsteczek w reakcji? Dla reakcji egzotermicznej:
CO + NO2 = CO2 + NO ΔHθ = -226 kJ/mol
Aktywny kompleks jest produktem pośrednim o bardzo krótkim okresie życia.
Schematycznie można to przedstawić następująco:
C O2 C O2 C O2
+ ⇔ ⇔
O N O N O N
substraty kompleks produkt
aktywny
(T1/2 = 10-10s)
Szybkość reakcji związana jest z wartością potrzebnej do jej przebiegu energii aktywacji. Im wyższa jest ta energia tym wolniej przebiega reakcja |
4. Wpływ temperatury
Równanie Arrheniusa:
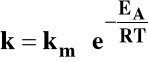
Wzrost temperatury zawsze zwiększa szybkość reakcji chemicznej!
Szybkość reakcji chemicznej rośnie wraz z temperaturą wykładniczo!
5. Kataliza, katalizator
Katalizator jest to substancja, która przyspiesza reakcję chemiczną, a po zakończeniu reakcji pozostaje w stanie niezmienionym. Zjawisko przyspieszania reakcji chemicznej przez katalizatory nazywamy katalizą |
Katalizator nie zwiększa wydajności reakcji.
Katalizator obniża energię aktywacji reakcji chemicznej.
Przykład katalizatora stałego dla reakcji:
N2 + 3H2 = 2NH3
Energia aktywacji reakcji bez katalizatora 335 kJ/mol
z katalizatorem osmowym 195 kJ/mol
z katalizatorem wolframowym 165 kJ/mol
Enzymy pełnią rolę katalizatorów procesów biologicznych.
Inhibitor - działa odwrotnie niż katalizator, tzn. podwyższa energię aktywacji, (np. inhibitory korozji). Inhibitor obniża więc szybkość reakcji chemicznej.
Koniec Rozdziału IX-go.
Władysław Walkowiak - Chemia Ogólna, kurs WPC 1002w
11 z 11
Rozdział IX. Szybkość reakcji chemicznych
Gdzie:
EA - energia
aktywacji
R - stała gazowa
T - temperatura
a + b + c
k
T
Wyszukiwarka
Podobne podstrony:
Wyklad 8. Szybkosc reakcji chemicznych PCHN SKP studport
Wykład 9. Szybkosc reakcji chemicznych, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DOC
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
05 Szybkośc reakcji chemicznych instrukcja
05 Szybkośc reakcji chemicznych II sprawozdanie
5.Badanie wpływu stężenia substancji reagujących na szybkość reakcji chemicznej., Państwowa Wyższa S
szybkość reakcji chemicznej(1), NAUKA, chemia, lab
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH nowy
Walkowiak, Chemia ogólna, Szybkość reakcji chemicznych
SZYBKOŚĆ REAKCJI CHEMICZNYCH, Szkoła, penek, Przedmioty, Chemia, Laboratoria
Od czego zależy szybkość reakcji chemicznych
Szybkość reakcji chemicznych
5,6 szybkość reakcji chemicznych istrukcja
SZYBKOŚĆ REAKCJI CHEMICZNYCH
Szybkość reakcji chemicznych
Szybkość reakcji chemicznych
1 0 Szybkość reakcji chemicznych
więcej podobnych podstron