
Prof. dr hab. Andrzej L. Małecki
Wydział Inżynierii Materiałowej i Ceramiki
Katedra Chemii Nieorganicznej
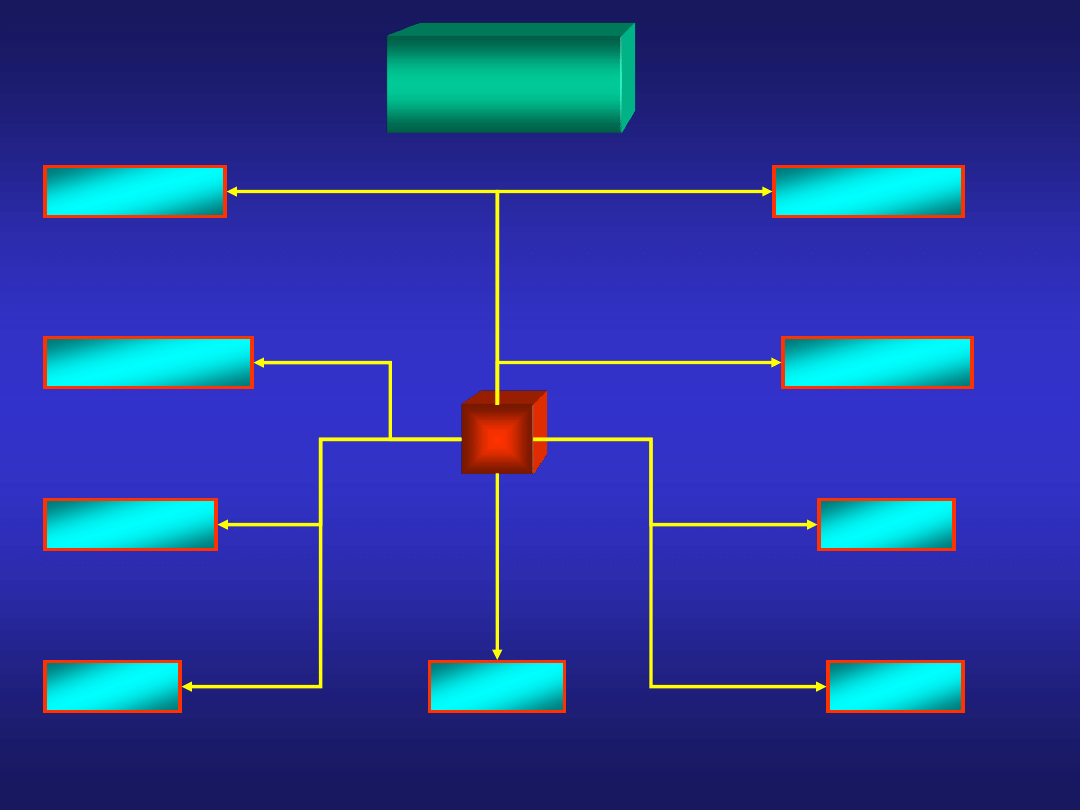
METALE I NIEMETALE


tendencja do tworzenia kationu
tendencja do tworzenia anionu
METALE
METALOIDY
NIEMETALE
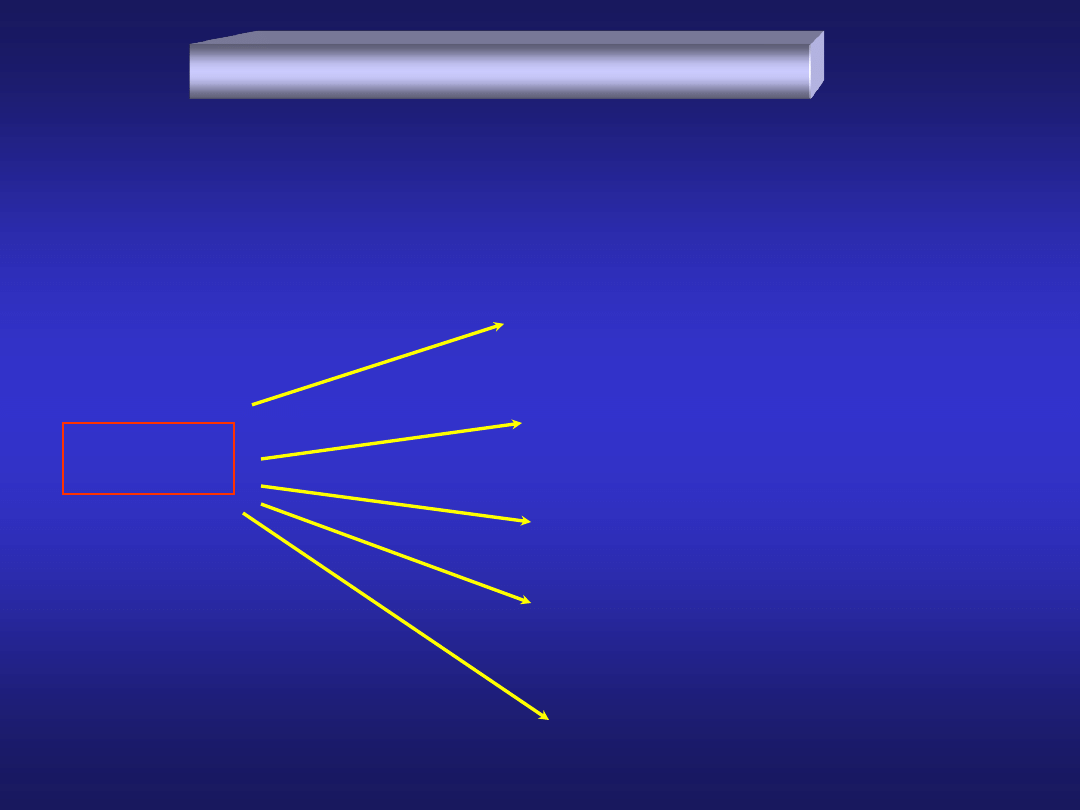
przewodnictwo elektryczne i cieplne
elektroujemność
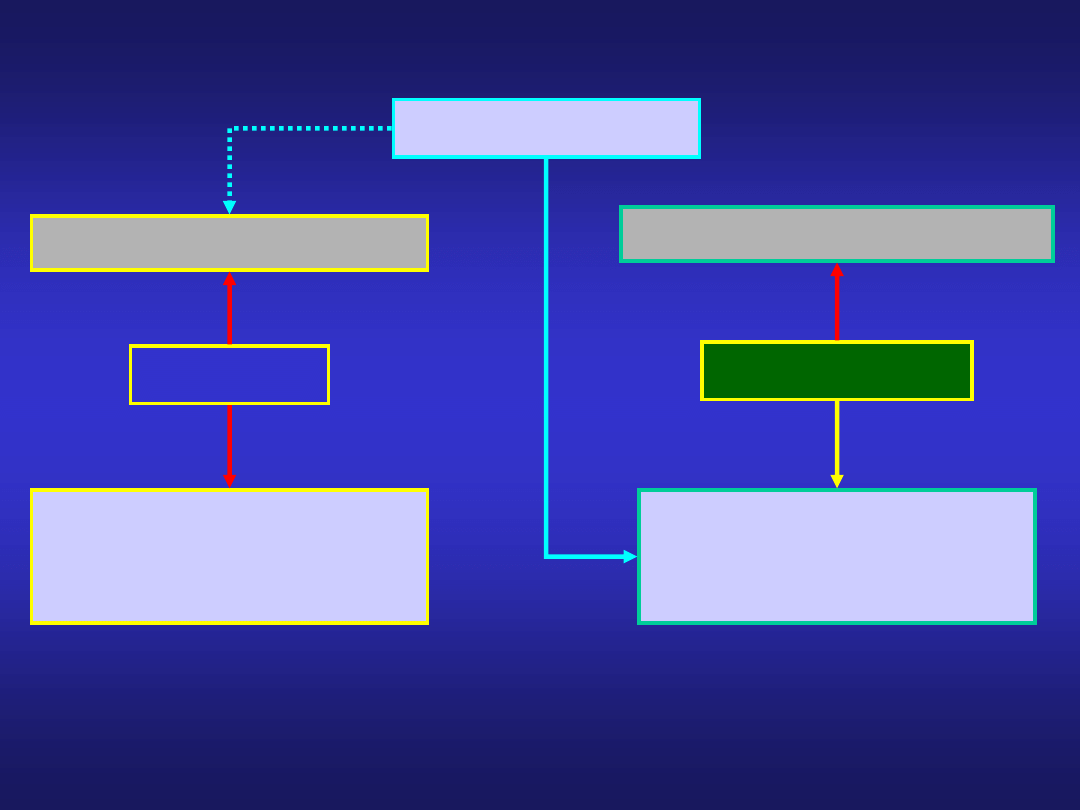
METALE
NIEMETALE
METALOIDY
w
związkach występują
wyłącznie na dodatnich
stopniach utlenienia
w
związkach występują
na dodatnich i ujemnych
stopniach utlenienia
tworzą kationy M
(+)
tworzą aniony X
(-)
METALE

H
75.49%
He
23.08%
niemetale
1.31%
metale
0.12%
Rozpowszechnienie metali w Przyrodzie
% masowe

Rozpowszechnienie metali na Ziemi
metal
%
Al
7.5
Fe
4.71
Ca
3.39
Na
2.63
K
2.4
Mg
1.93
Ti
0.58
Al
Fe
Ca
Na
K
Mg
Ti
Formy występowania metali w Przyrodzie
w stanie wolnym
w postaci związków
(rudy, minerały)
tlenki, wodorotlenki,
uwodnione tlenki
sole
sole kwasów beztlenowych
(siarczki, chlorki)
sole kwasów tlenowych
(glinokrzemiany, węglany,
siarczany, fosforany, azotany)
Formy występowania metali w Przyrodzie
Au, Pt
w postaci związków
(rudy, minerały)
SnO
2
(kasyteryt)
AlO(OH) boksyt
sole
HgS (cynober),
Bi
2
S
3
(bizmutynit)
MgCO
3
, BaSO
4
, Ca
3
(PO
4
)
2
,
KNO
3
, Ca[Al
2
Si
2
O
8
] (anortyt)

Formy występowania litowców
Li
Na
K
ambligonit
LiAlPO
4
(F,OH)
halit
NaCl
saletra chilijska
NaNO
3
sylwin
KCl
karnalit
KCl·MgCl
2
·6H
2
O
litowce występują w Przyrodzie wyłącznie w postaci soli
kwasów tlenowych i beztlenowych

Formy występowania berylowców
Mg
Ca
Ba
magnezyt
MgCO
3
dolomit
MgCO
3
·CaCO
3
gips
CaSO
4
·2H
2
O
apatyt
Ca
3
(PO
4
)
3
(OH,F,Cl)
fluoryt
CaF
2
baryt
BaSO
4
metaliczne berylowce występują w Przyrodzie praktycznie
wyłącznie w postaci soli kwasów tlenowych i beztlenowych

Formy występowania metalicznych borowców
metaliczne borowce występują w Przyrodzie w postaci soli
kwasów tlenowych, uwodnionych tlenków i wodorotlenków
Glin Al
glinokrzemiany
boksyt AlO(OH)
hydrargilit Al(OH)
3
kriolit Na
3
AlF
6
kaolin Al
2
O
3
·2SiO
2
·2H
2
O
anortyt Ca(Al
2
Si
2
O
8
)
albit Na(AlSi
3
O
8
)

Formy występowania metali z grupy węglowców i azotowców
Sn
Pb
Bi
kasyteryt
SnO
2
cerusyt
PbCO
3
anglezyt
PbSO
4
bizmutynit
Bi
2
S
3
bismit
Bi
2
O
3
Cyna, ołów i bizmut występują w Przyrodzie przede wszystkim
postaci tlenków i soli kwasów tlenowych i beztlenowych

Formy występowania w Przyrodzie najważniejszych metali
bloku d (1)
tytan Ti
ilmenit FeTiO
3
, rutyl TiO
2
wanad V
wanadynit 3Pb
3
(VO
4
)
2
·PbCl
2
chrom Cr
chromit FeCr
2
O
4
molibden Mo
molibdenit MoS
2
wolfram W
wolframit (Fe,Mn)WO
4
, szelit CaWO
4

Formy występowania w Przyrodzie najważniejszych metali
bloku d (2)
mangan Mn
braunsztyn MnO
2
, rodochrozyt MnCO
3
żelazo Fe
magnetyt Fe
3
O
4
, hematyt Fe
2
O
3
, limonit
Fe
2
O
3
·nH
2
O, syderyt FeCO
3
, piryt FeS
2
nikiel Ni
nikielin NiAs
kobalt Co
smaltyn CoAs
2
, kobaltyn CoAsS
miedź Cu
chalkopiryt CuFeS
2
, chalkozyn Cu
2
S

Formy występowania w Przyrodzie najważniejszych metali
bloku d (3)
srebro Ag
rodzime Ag, argentyt Ag
2
S
złoto Au
rodzime Au, kalaweryt AuTe
2
cynk Zn
galman ZnCO
3
, sfaleryt ZnS, cynkit ZnO
kadm Cd
grenokit CdS
rtęć Hg
cynober HgS,
OTRZYMYWANIE METALI (1)
redukcja tlenków metali za pomocą wodoru, metali I i II
grupy układu okresowego, glinu, węgla, tlenku węgla
Me
x
O
y
Me + H
2
O
H
2
Me + (M
2
O lub MO)
M
I
, M
II
Me + Al
2
O
3
Al
Me + CO + CO
2
C
Me + CO
2
CO

Ograniczenia metody otrzymywania metali za pomocą
redukcji tlenków
Me
x
O
y
+ Red
Me + RedO
z
Me(Red)
q
NiO + CO
Ni + CO
2
Ni(CO)
4

OTRZYMYWANIE METALI (2)
rozkład termiczny związków metali:
rozkład termiczny tlenków metali:
HgO
d Hg + O
2
Ag
2
C
2
O
4
d Ag + CO
2
rozkład termiczny soli:
proces ten może być zastosowany wyłącznie do metali szlachetnych,
które tworzą nietrwałe tlenki i sole

OTRZYMYWANIE METALI (3)
elektroliza
ELEKTROLIZA
to zespół procesów towarzyszących
przepływowi prądu stałego przez elektrolity:
1. przewodzenie prądu przez nośniki jakimi są jony
dodatnie i ujemne
2. pierwotne reakcje elektrodowe:
na katodzie: A
n+
+ ne
-
= A
0
na anodzie: B
m-
- me
-
= B
0
3. wtórne reakcje elektrodowe:
A
0
+ RR
d (AR) + .......
B
0
+ RR
d (BR) + .......

Elektroliza roztworu wodnego NaCl
dysocjacja elektrolityczna:
NaCl
Na
Cl
na katodzie:
0
2
Cl
e
2
Cl
2
na anodzie:
NaOH
H
Na
e
Na
2
O
H
0
2
proces pierwotny
proces wtórny
HCl + HClO
H
2
O

Elektroliza stopionego NaCl
dysocjacja termiczna:
NaCl
Na
Cl
na katodzie:
0
2
Cl
e
2
Cl
2
na anodzie:
0
Na
e
Na
proces pierwotny

Elektroliza roztworu wodnego CuSO
4
- przykład
dysocjacja:
2
4
2
4
SO
Cu
CuSO
na katodzie:
0
2
Cu
e
2
Cu
na anodzie:
2
4
2
O
H
*
4
2
4
O
SO
H
SO
e
2
SO
2
proces pierwotny
proces wtórny
formalnie:

na anodzie:
2
4
2
O
H
*
4
2
4
O
SO
H
SO
e
2
SO
2
Jednak obiektu [SO
4
]
*
nie udało się zaobserwować. Jon
siarczanowy
trudno
rozładowuje
się
na
elektrodzie.
Alternatywą jest przyjęcie, że przy anodzie rozładowaniu
ulega jon wodorotlenkowy:
2
2
1
1
OH
H O
O
e
2
4

PRAWO ELEKTROLIZY
(prawo Faradaya)
prąd o natężeniu I w czasie t przenosi ładunek Q:
Q = I·t
1 mol jonów A
n(
!)
posiada bezwzględny ładunek:
Q
M
= n·|e|·N
A
zatem jeżeli przez elektrolit przepłynie ładunek Q
M
to na
elektrodzie wydzieli się 1 mol (M
A
) produktu A
Q
M
M
A
Q
m
t
I
k
t
I
N
|
e
|
n
M
Q
Q
M
m
A
A
M
A
F = |e|N
A
l 96500 C
stała Faradaya
nF
M
k
A
równoważnik
elektrochemiczny

PODSTAWOWE WŁAŚCIWOŚCI METALI
duże przewodnictwo elektryczne i cieplne
silne odbijanie światła, połysk powierzchniowy
tworzenie sieci krystalicznych o dużych liczbach
koordynacyjnych
odkształcalność plastyczna
zdolność tworzenia stopów
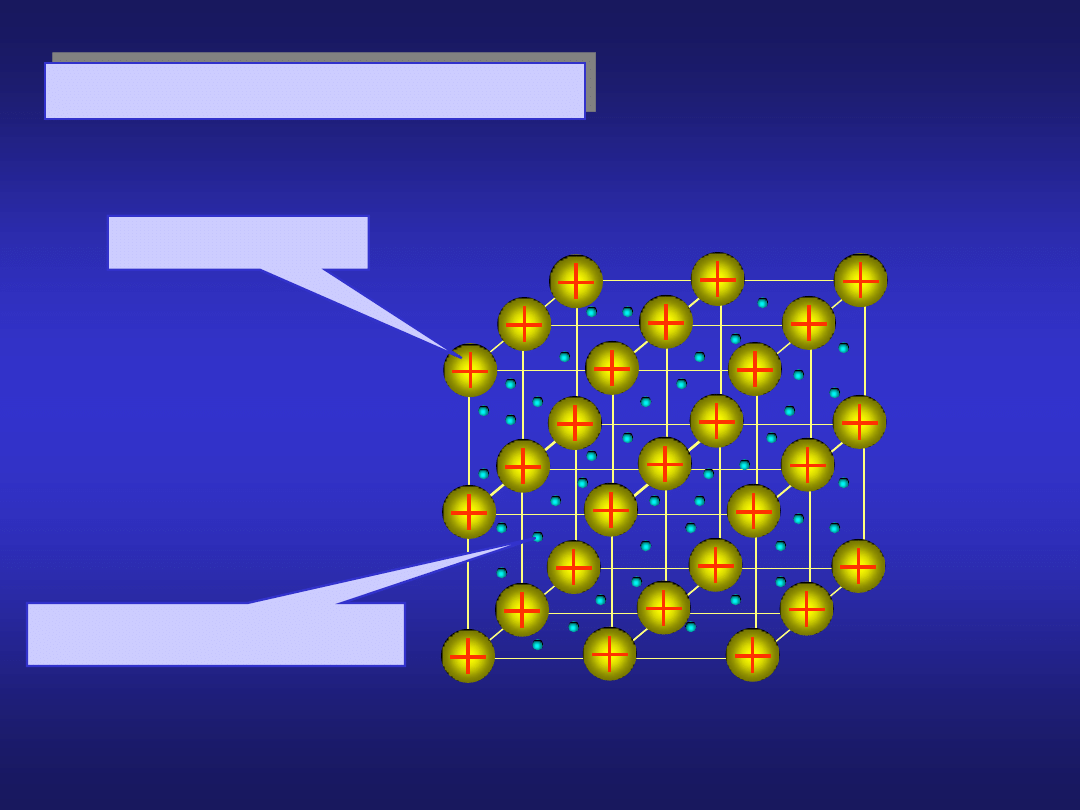
WIĄZANIE METALICZNE
jony dodatnie
gaz elektronowy
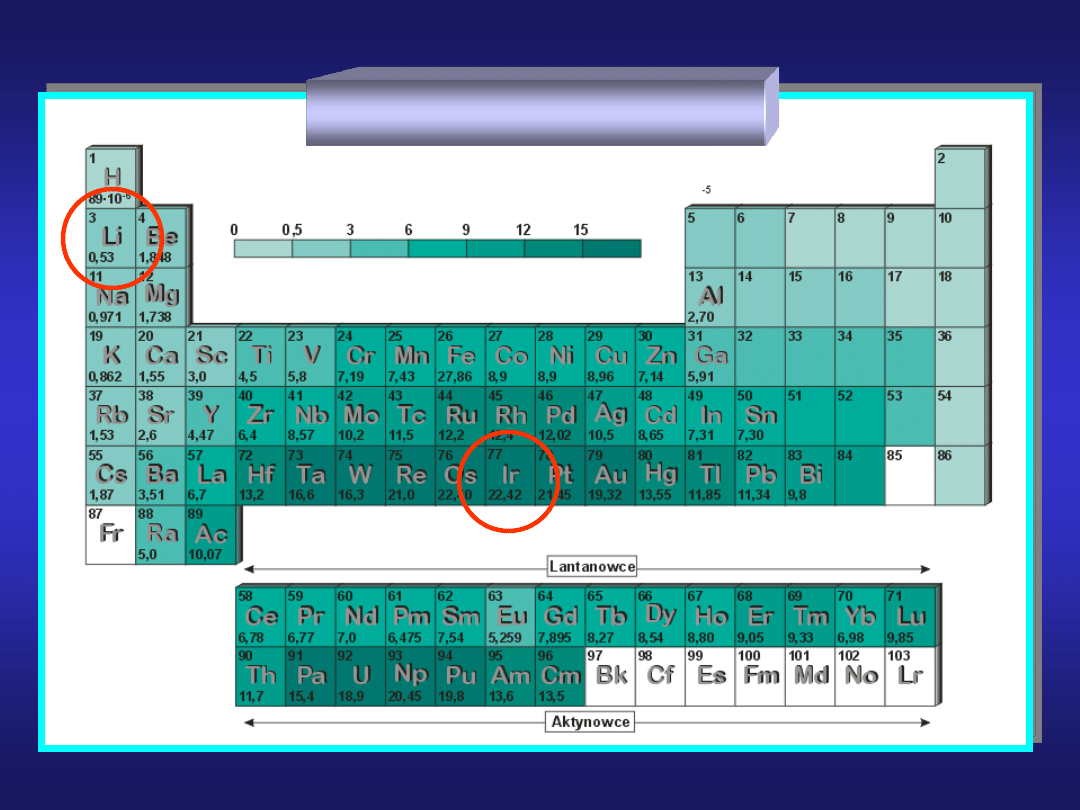
GĘSTOŚĆ METALI
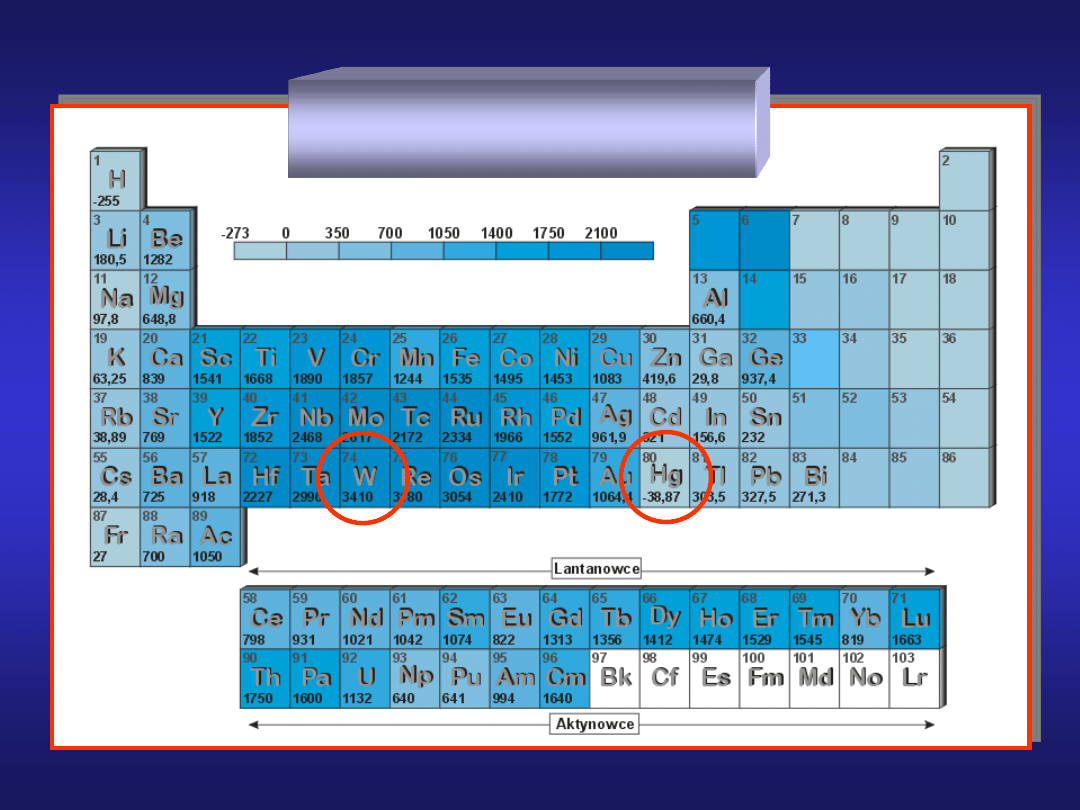
Temperatury topnienia
metali

KLASYFIKACJA METALI (1)
grupa
właściwości
przykłady
metale lekkie
(15 metali)
< 5 g·cm
-3
litowce, Be-Ba, Al
metale ciężkie
(70 metali)
> 5 g·cm
-3
Fe, Ni, Co, Os.....
metale niskotopliwe
t. top. < 700°C
litowce, Mg, Al, Sn
metale wysokotopliwe
t.top. 700-2000°C
Be, Ca, Fe, Co, Cu
metale o najwyższych
temperaturach
topnienia
t.top. > 2000°C
Mo, W, Os, Ir

KLASYFIKACJA METALI (2)
grupa
właściwości
przykłady
metale nieszlachetne
mała odporność
chemiczna
litowce, Al, Fe, Zn
metale szlachetne
duża odporność
chemiczna
Au, Pt, Hg, Pt
metale
elektrolityczne
otrzymywane lub
oczyszczane
elektrolitycznie
Al, Pb, Cu, Ni, Ag
metale spiekane
wytwarzane przez
prasowanie i
spiekanie proszków
Mo, W

KLASYFIKACJA METALI (3)
grupa
właściwości
przykłady
stopy twarde
wytwarzane przez
prasowanie i
spiekanie stopy o
dużej twardości
metaliczne węgliki
Mo, Ti, V
metale kolorowe
nieszlachetne
metale ciężkie ,
które są kolorowe
lub tworzą
kolorowe stopy
Pb, Zn, Ni, Cu
metale „czarne”
-
żelazo i jego stopy

KLASYFIKACJA METALI (4)
grupa
właściwości
przykłady
metale „białe”
stopy cyny
zawartość cyny 5-
80%+Pb, Sb, Cu
metale nieżelazne
wszystkie metale
oprócz żelaza
parametry sieciowe
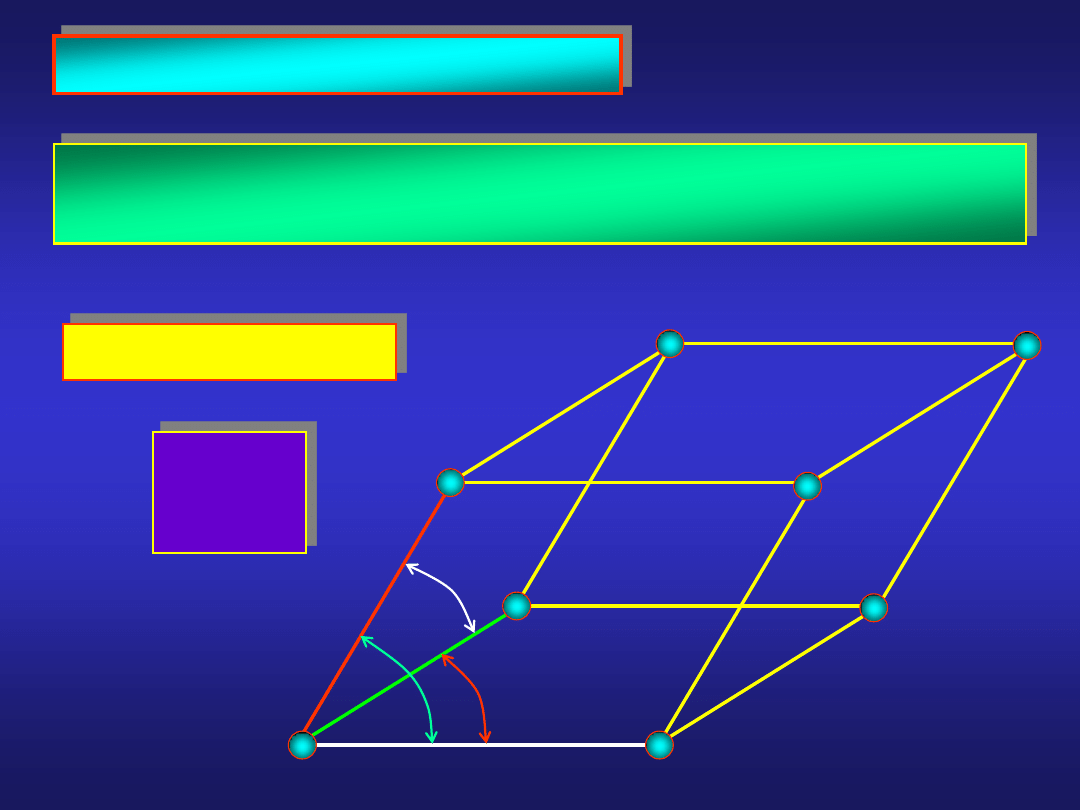
KOMÓRKA ELEMENTARNA...
...to równoległościan stanowiący podstawowy, powtarzający
się okresowo w przestrzeni, element sieci przestrzennej
a
b
c
g
b
a
a, b, c
a, b, g
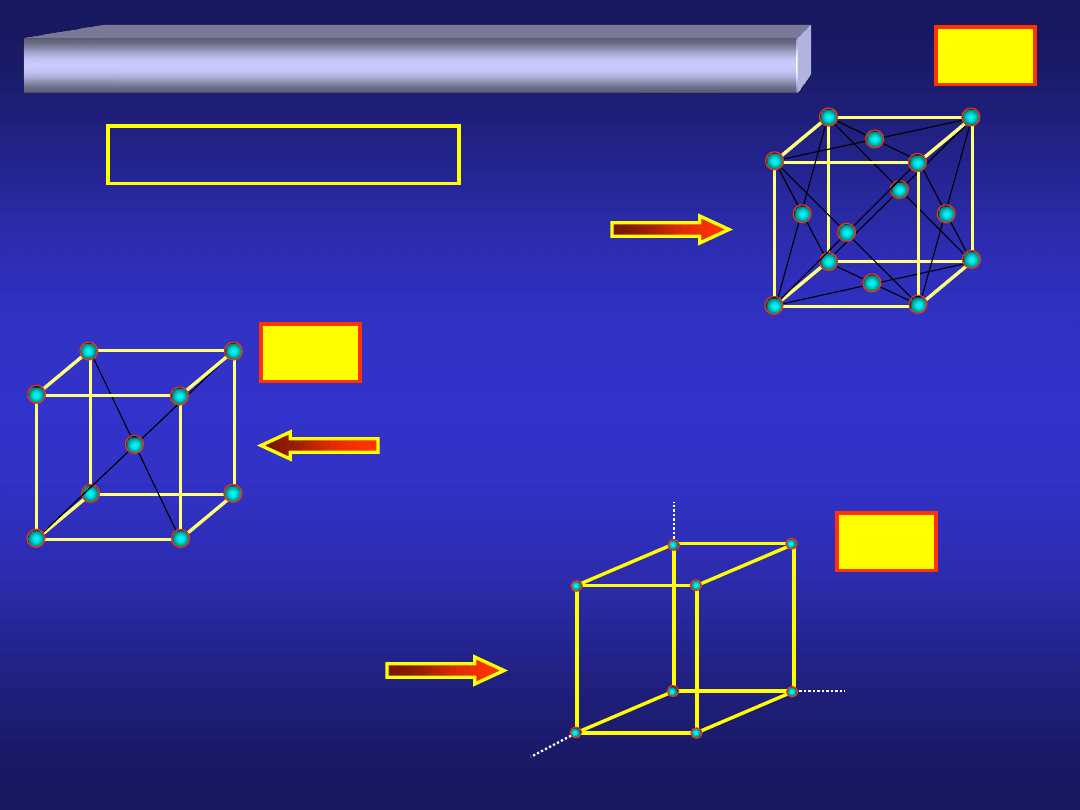
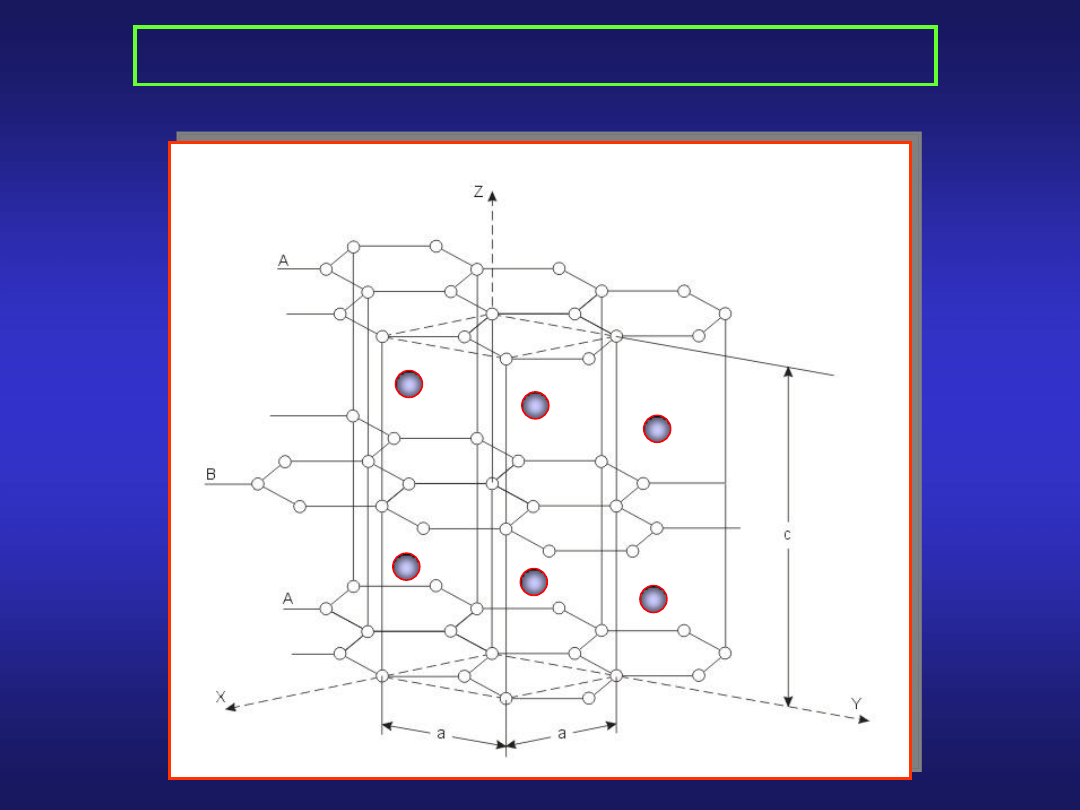
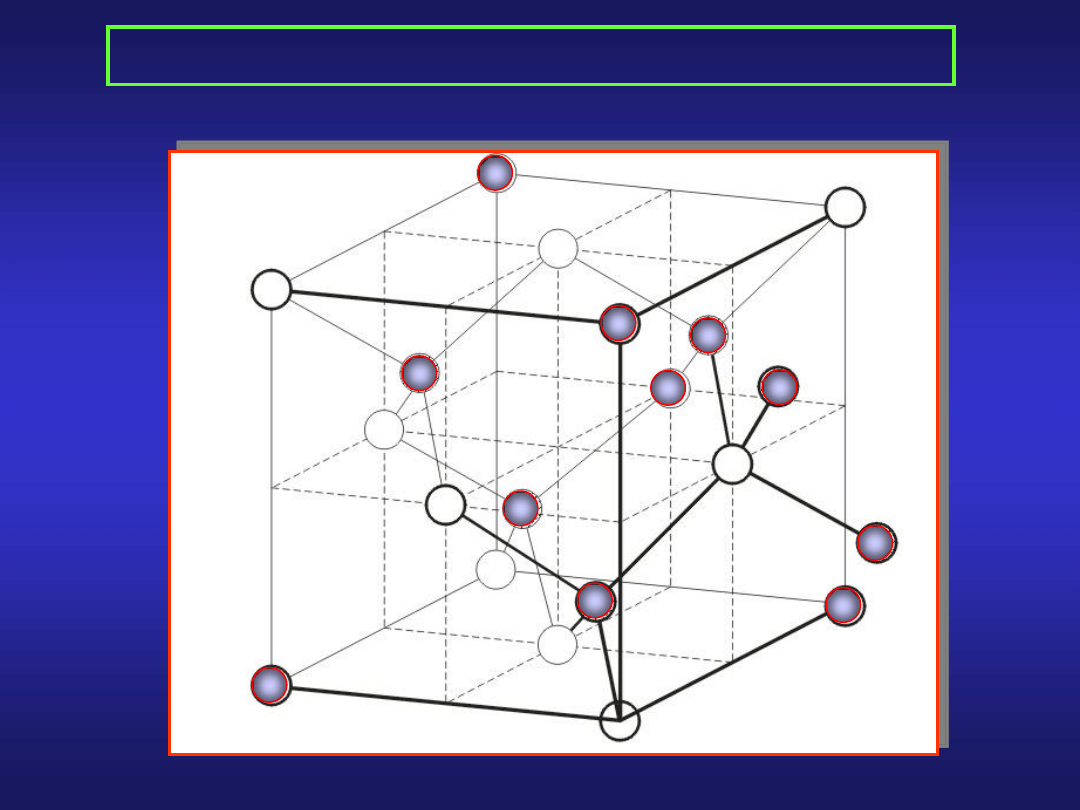
STRUKTURA KRYSTALICZNA METALI (1)
sieć regularna płasko centrowana
sieć regularna przestrzennie centrowana
sieć heksagonalna:
a
b
c
120°
A
1
A
2
A
3
dla 80% metali...

STRUKTURA KRYSTALICZNA METALI (3)
metale, w zależności od temperatury mogą występować w
różnych odmianach:
a
-Fe
g
-Fe
d
-Fe
910°C
1390°C
A
2
A
1
A
2
WŁAŚCIWOŚCI CHEMICZNE METALI
podsumowanie (1)
metale w związkach chemicznych występują na dodatnich
stopniach utlenienia (+1 do +8)
METAL
kwas beztlenowy
kwas tlenowy
sól + wodór
brak reakcji
sól + produkty
redukcji kwasu
WŁAŚCIWOŚCI CHEMICZNE METALI
podsumowanie (2)
METALE
WODORKI
H
2
METALE
tlenki
(O
2-
)
nadtlenki
(O-O)
2-
ponadtlenki
(O-O)
-
O
2
WŁAŚCIWOŚCI CHEMICZNE METALI
reakcje metali z węglem
METALE
WĘGLIKI
C
acetylenki Me
(+)
(C
hC)
2-
(sp)
węgliki o strukturze analogicznej do grafitu (sp
2
)
węgliki o strukturze analogicznej do diamentu (sp
3
)
węgliki o strukturze analogicznej do sieci metalu
węgliki o strukturze analogicznej do grafitu (sp
2
)
węgliki o strukturze analogicznej do diamentu (sp
3
)

WĘGLIKI METALI - przykłady
acetylenki (C
hC)
2-
CaC
2
, MgC
2
węgliki o strukturze grafitu
C
8
Br, C
x
O
y
(„tlenek grafitu”)
węgliki o strukturze diamentu SiC, Al
4
C
3
węgliki o strukturze metalu
TiC, VC

LITOWCE
Reaktywne miękkie metale o niskich temperaturach topnienia,
małej gęstości i silnych właściwościach redukujących, tworzące w
związkach kationy M
+
, otrzymywane drogą elektrolizy stopionych
soli.
Li, Na, K, Rb, Cs,
Fr
reakcje z tlenem:
Li + O
2
200°C
Li
2
O
Na + O
2
100°C
Na
2
O + Na
2
O
2
K + O
2
200°C
K
2
O
2
ns
1
0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
pote
nc
jał
jon
iz
ac
ji
/aJ
Li
Na
K
Rb
Cs
LITOWCE
reaktywność
POTENCJAŁ JONIZACJI
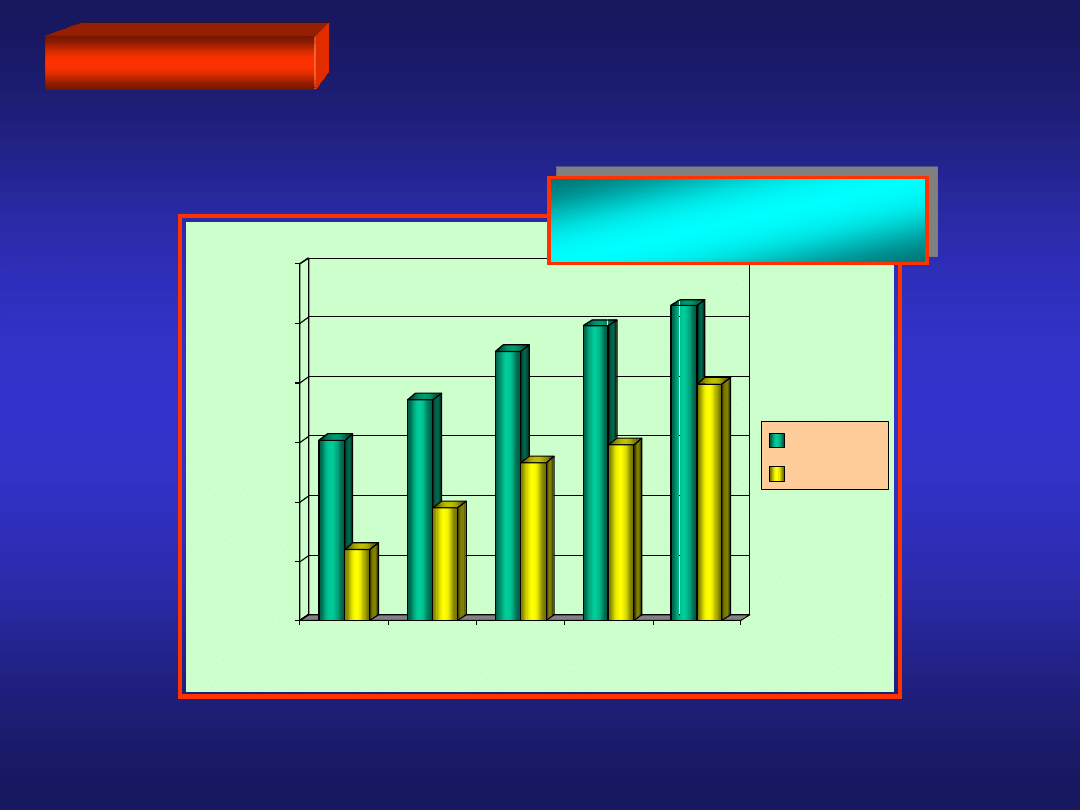
0
50
100
150
200
250
300
r
(at),
r
(jon
)
/
p
m
Li
Na
K
Rb
Cs
atomowe
jonowe
LITOWCE
PROMIENIE ATOMOWE
I JONOWE

LITOWCE - reakcje
Li, Na, K
amalgamaty
Hg
LiN
N
2
LiOH, NaOH, KOH
H
2
O
Li
2
C
2
C
LiCl, NaCl, KCl
Cl
2
LiH, NaH, KH
H
2

BERYLOWCE
Be, Mg, Ca, Sr, Ba,
Ra
Lekkie metale, których reaktywność wzrasta ze wzrostem
liczby atomowej. W związkach najczęściej tworzą jony M
2+
(za wyjątkiem berylu, który nie tworzy takiego jonu
odbiegając
swoimi
właściwościami
od
pozostałych
pierwiastków tej grupy).
Be
Cl
Cl
s
s
Cl
-
Mg
2+
Cl
-
ns
2
0
0.2
0.4
0.6
0.8
1
1.2
1.4
1.6
pote
nc
jał
jon
iz
ac
ji
/aJ
Be
Mg
Ca
Sr
Ba
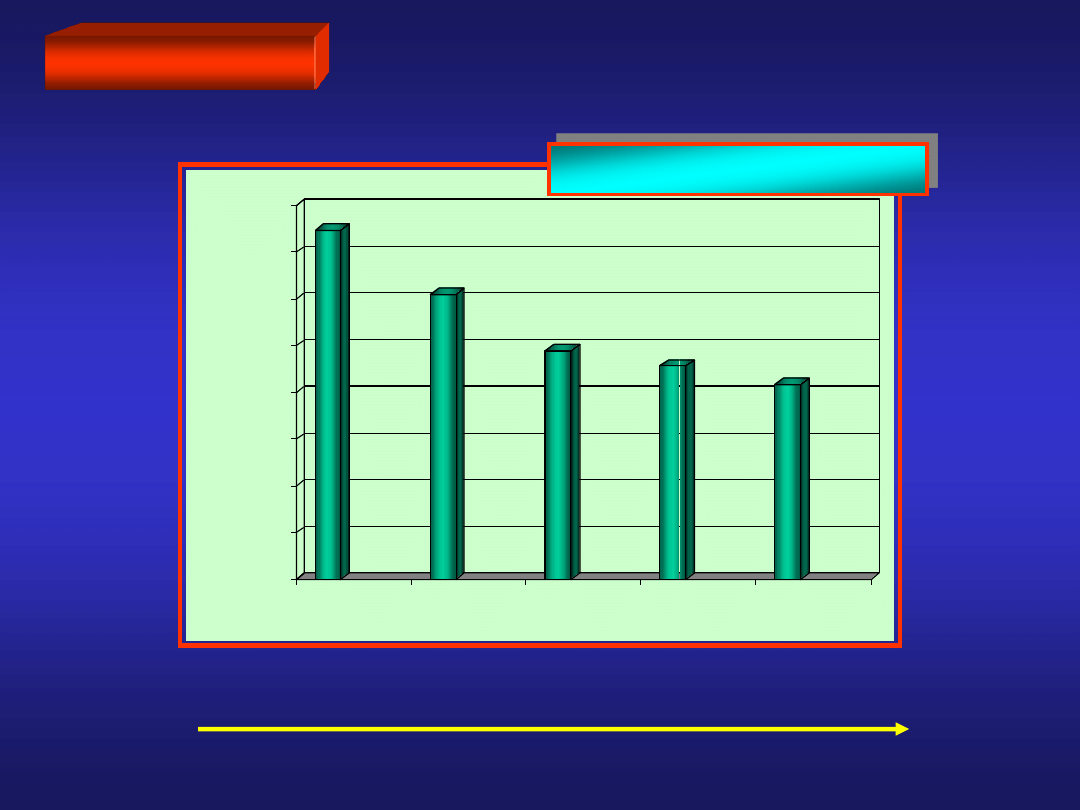
BERYLOWCE
reaktywność
POTENCJAŁ JONIZACJI
0
50
100
150
200
250
p
r
om
ie
n
ie
atom
ow
e
/p
m
Be
Mg
Ca
Sr
Ba
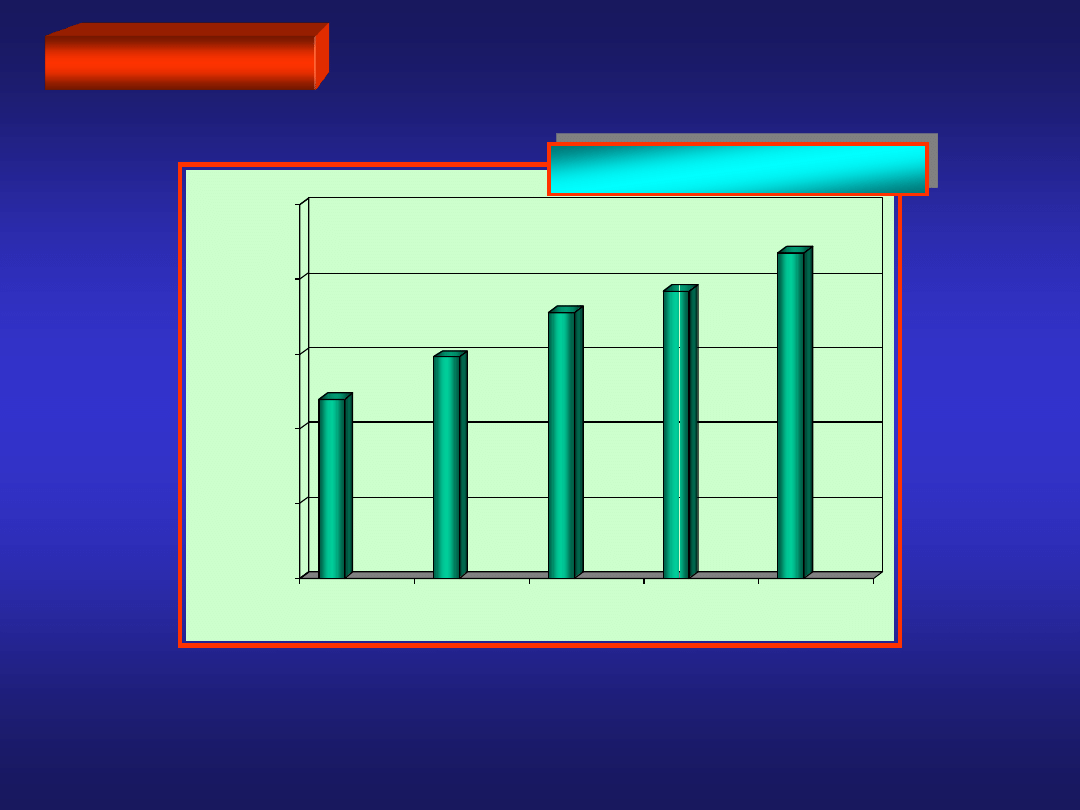
BERYLOWCE
PROMIENIE ATOMOWE

BERYLOWCE - reakcje
Mg, Ca, Ba
Mg(OH)
2
, Ca(OH)
2
,
Ba(OH)
2
(+ H
2
)
H
2
O
MgO, CaO, BaO
O
2
MgH
2
, CaH
2
, BaH
2
H
2
Mg
3
N
2
, Ca
3
N
2
, Ba
3
N
2
N
2
MgC
2
, CaC
2
, BaC
2
C
PIERWIASTKI BLOKU d
Pierwiastki metaliczne,
różniące się na ogół wysokimi
temperaturami topnienia i gęstością, występujące w związkach
na różnych stopniach utlenienia.
konfiguracja elektronowa:
ns
2(1)
(n-1)d
x
(x
g4 lub 9 oraz g ns
2
(n-1)d
10
)
konfiguracja elektronowa:
ns
2
(n-1)d
10
pierwiastki przejściowe
cynk, kadm, rtęć
120
140
160
180
200
0
5
10
15
p
ro
m
ie
n
ie
a
to
m
o
w
e
/p
m
4 okres
5 okres
6 okres
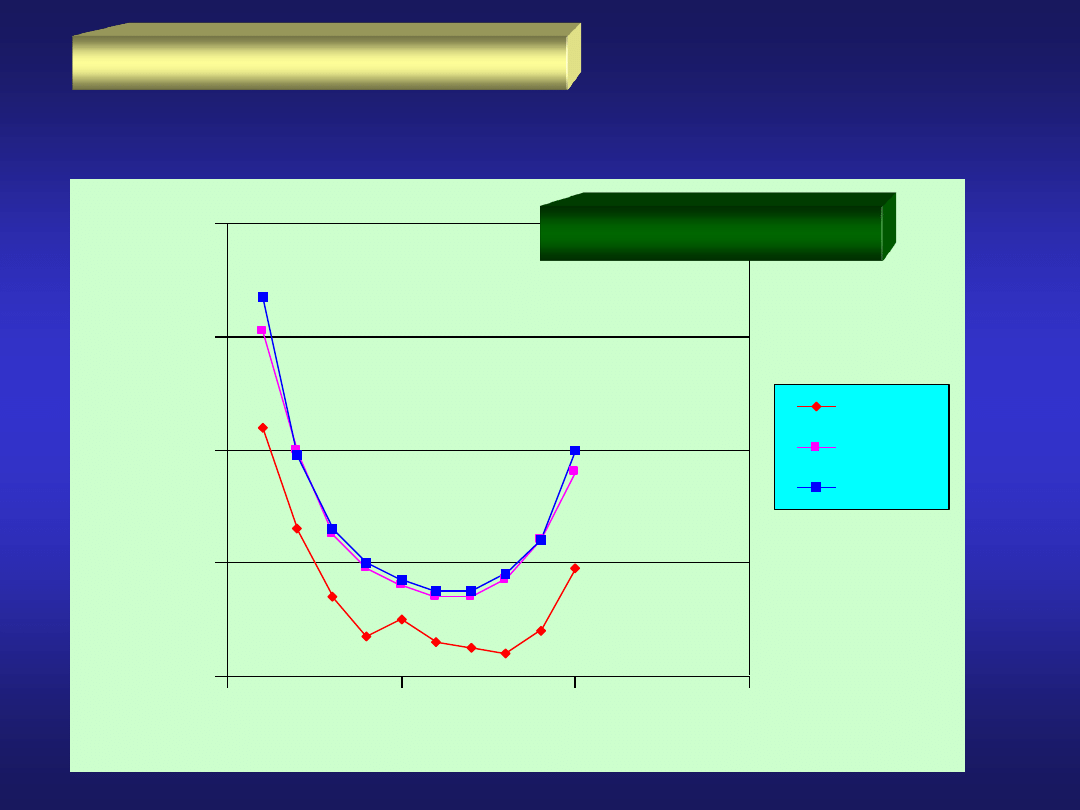
PIERWIASTKI BLOKU d
promienie atomowe

PIERWIASTKI BLOKU d
stopnie utlenienia
Sc
III
Ti
II-IV
V
II-V
Cr
II-VI
Mn
II-VII
Fe
II
III
Co
II
III
Ni
II
III
Cu
I
II
Zn
II
Y
III
Zr
II-IV
Nb
III-V
Mo
II -VI
Tc
Ru
III,IV
VI-VIII
Rh
III,IV
VI
Pd
II
IV
Ag
I
Cd
II
La
III
Hf
IV
Ta
IV
W
II -VI
Re
III-VII
Os
III,IV
VI-VIII
Ir
III,IV
VI
Pt
II
IV
Au
I
III
Hg
I
II

PIERWIASTKI BLOKU d
charakterystyczne właściwości
Tworzenie tzw. związków kompleksowych wynikające z istnienia
niezapełnionych orbitali typu d.
Zmienność stopnia utlenienia przejawiająca się w częstym
udziale jonów tych metali w reakcjach utleniania i redukcji.
Zdolność do tworzenia wielu związków niestechiometrycznych
(wodorki, węgliki, azotki, siarczki, tlenki).
Wzrost właściwości kwasowych ze wzrostem stopnia utlenienia
jonu.
DEFEKTY PUNKTOWE
Zburzenia regularności sieci krystalicznej o rozmiarach rzędu
rozmiarów elementów tworzących kryształ (jonów, atomów
lub cząsteczek) to....
atomowe
elektronowe
dotyczą całego atomu,
jonu lub cząsteczki
dotyczą
wyłącznie
sytuacji
związanych z zachowaniem się
elektronu w sieci krystalicznej
PRZYCZYNY NIESTECHIOMETRYCZNOŚCI
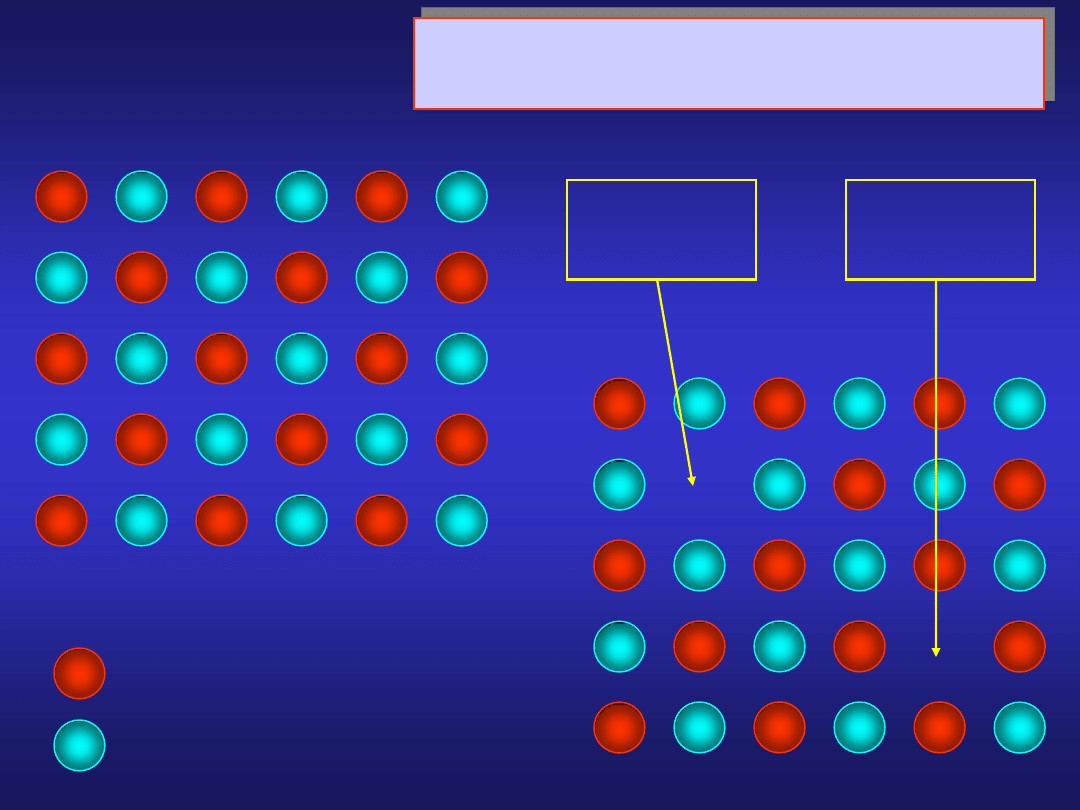
ATOMOWE DEFEKTY PUNKTOWE
defekt Schottky’ego
wakancja
kationowa
wakancja
anionowa
sieć idealna
kation
anion
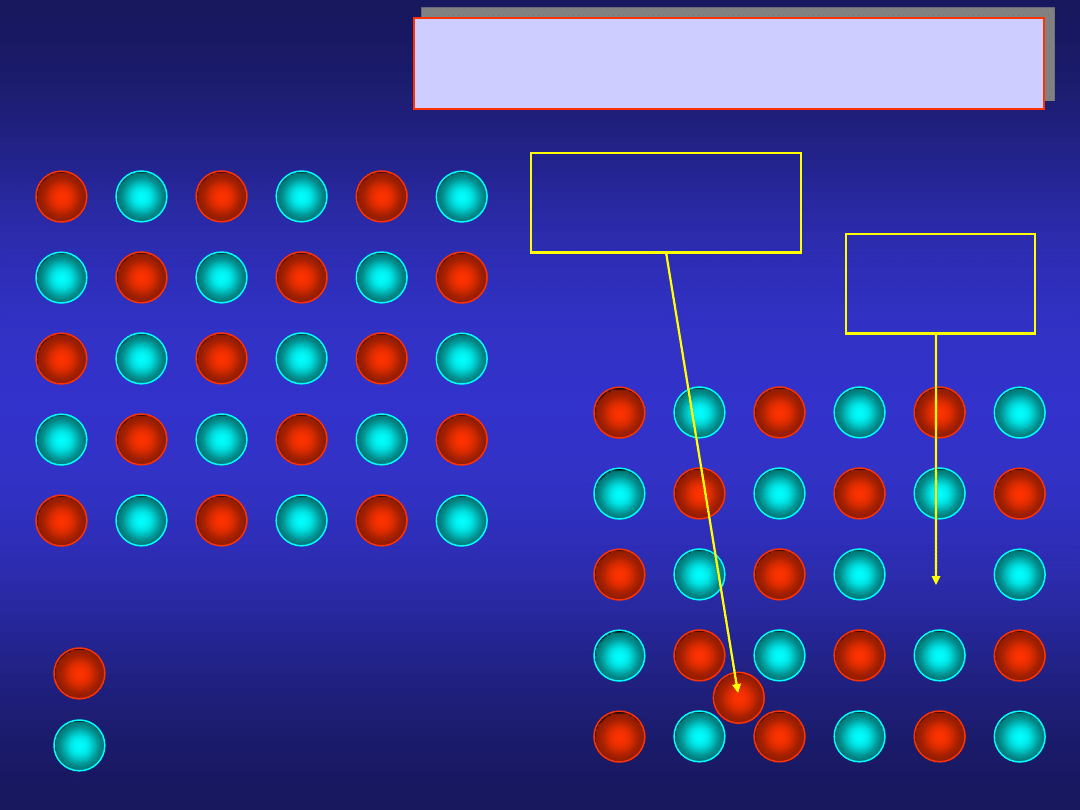
ATOMOWE DEFEKTY PUNKTOWE
defekt Frenkla
sieć idealna
kation
anion
kation
międzywęzłowy
wakancja
kationowa

PIERWIASTKI BLOKU d
właściwości
kwasowe
amfoteryczne i
zasadowe
Sc
III
Ti
II
III
IV
V
II
III
IV
V
Cr
II
III
IV
VI
Mn
II
IV
VII
Fe
II
III
Co
II
Ni
II
Cu
I
II
Zn
II
Zr
IV
Mo
VI
Ru
VII
Ag
I
Cd
II
W
VI
Re
VII
Pt
IV
Hg
II

ŻELAZO Fe
właściwości fizyczne i chemiczne
Żelazo jest srebrzystoszarym, ciągliwym i kowalnym metalem o
gęstości 7,9 g cm
-3
, topiącym się w temperaturze ok. 1540°C.
Występuje w trzech odmianach alotropowych.
Żelazo otrzymuje się w tzw. procesie wielkopiecowym, w którym
tlenki żelaza redukuje się koksem. Użyty węgiel (koks) jest
paliwem potrzebnym do podtrzymania wysokiej temperatury
pieca, reduktorem tlenków żelaza i wchodzi w skład tzw.
surówki.
otrzymywanie:

Fe
2
O
3
koks (C)
koks (C)
powietrze
CO
Fe + C (> 2%)
surówka
CO,CO
2
powietrze
Fe + C (< 2%)
stal
CO,CO
2
Żelazo jest metalem dość aktywnym chemicznie w
temperaturze pokojowej. Reaguje po ogrzaniu z siarką,
fosforem, fluorowcami i parą wodną.
ŻELAZO Fe
właściwości chemiczne
Fe
FeS, Fe
2
S
3
FeP, Fe
3
P
FeX
2
, FeX
3
FeO(OH)F
e(OH)
2
Fe(OH)
3
X=F
2
, Cl
2
, Br
2
, I
2
H
2
O
siarka
fosfor
Żelazo nie reaguje z powietrzem w temperaturze pokojowej,
natomiast po ogrzaniu pokrywa się warstwą tlenków. Rozpuszcza
się w kwasach nieutleniających i rozcieńczonym kwasie
azotowym, Żelazo występuje w związkach na +2 i +3 stopniu
utlenienia.
Żelazo tworzy związki z borem,
węglem, azotem i krzemem.
ŻELAZO Fe
właściwości chemiczne (cd.)
Fe
FeB
bor
Fe
2
N, Fe
4
N
azot
Fe
3
C
węgiel
FeSi
krzem
MIEDŹ Cu
Miedź jest metalem o czerwono-różowej barwie, mało aktywnym
chemicznie. Wykazuje dobrą ciągliwość i kowalność, jest też
bardzo dobrym przewodnikiem elektryczności i ciepła.
siarczki miedzi
(rudy)
tlenki miedzi
miedź czarna
(zanieczyszczona)
miedź Cu
powietrze
redukcja
rafinacja
elektrolityczna
otrzymywanie:
właściwości fizyczne i chemiczne

Miedź z powietrzem w temperaturze pokojowej reaguje
powoli pokrywając się cienką warstwą czerwonego Cu
2
O. W
obecności wilgoci i CO
2
tworzy
się zielona warstwa
hydroksowęglanów (np. Cu
2
(OH)
2
CO
3
), chroniąca miedź
przed dalszym działaniem innych czynników (patyna). Miedź
łatwo reaguje z fluorowcami tworząc odpowiednie halogenki.
Miedź nie rozpuszcza się w kwasach beztlenowych.
Miedź w związkach występuje na +1 i +2 stopniu utlenienia.
MIEDŹ Cu
właściwości chemiczne

BOROWCE
B, Al, Ga, In, Tl
Borowce są pierwiastkami o zróżnicowanych właściwościach
fizycznych i chemicznych.
właściwości metaliczne
B Al Ga In Tl
niemetal
najtrwalsze stopnie utlenienia i tworzone jony:
B(+III) Al
3+
Ga
3+
In
3+ (1+)
Tl
+ (3+)
nie tworzy jonu B
3+
metal
amfoteryczny
ns
2
p
1
BOROWCE
0
0.2
0.4
0.6
0.8
1
1.2
1.4
pote
nc
jał
jon
iz
ac
ji
/
aJ
B
Al
Ga
In
Tl
potencjały jonizacji

GLIN Al
otrzymywanie:
elektroliza stopionego Al
2
O
3
(+Na
3
AlF
6
)
Glin jest srebrzystobiałym, kowalnym i ciągliwym metalem,
o
własnościach
amfoterycznych,
gęstość
2,7
g/cm
3
,
temperatura topnienia 660°C. W związkach chemicznych
występuje przede wszystkim +3 stopniu utlenienia.
podstawowe reakcje:
Al + HCl
t AlCl
3
+ H
2
Al + NaOH + H
2
O
t Na[Al(OH)
4
] + H
2
tetrahydroksoglinian sodu
właściwości fizyczne i chemiczne

GLIN Al
glin łatwo reaguje z fluorowcami:
Al + Br
2
t AlBr
3
...... metoda wydzielania metali i stopów (np. chromu,
manganu, żelaza) z tlenków tych metali, wykorzystująca ich
reakcję z granulowanym lub sproszkowanym glinem. Znaczny
efekt cieplny tej reakcji pozwala na wytopienie wolnego
metalu, na którego powierzchni pływa Al
2
O
3
.
ALUMINOTERMIA
Al + Cr
2
O
3
t Al
2
O
3
+ Cr
Stężone kwasy utleniające (np. HNO
3
) nie reagują z glinem.
właściwości chemiczne
GLIN Al
reakcje
Al
brak reakcji
powietrze, H
2
O
< 800°C
Al
2
O
3
+ AlN
powietrze
> 800°C
Al
2
O
3
O
2
> 800°C
AlP
fosfor
> 400°C
Al
2
S
3
siarka > 400°C
AlCl
3
Cl
2
100°C
AlCl
3
+H
2
HCl
NaAlO
2
+H
2
NaOH
Al(CH
3
O)
3
CH
3
OH
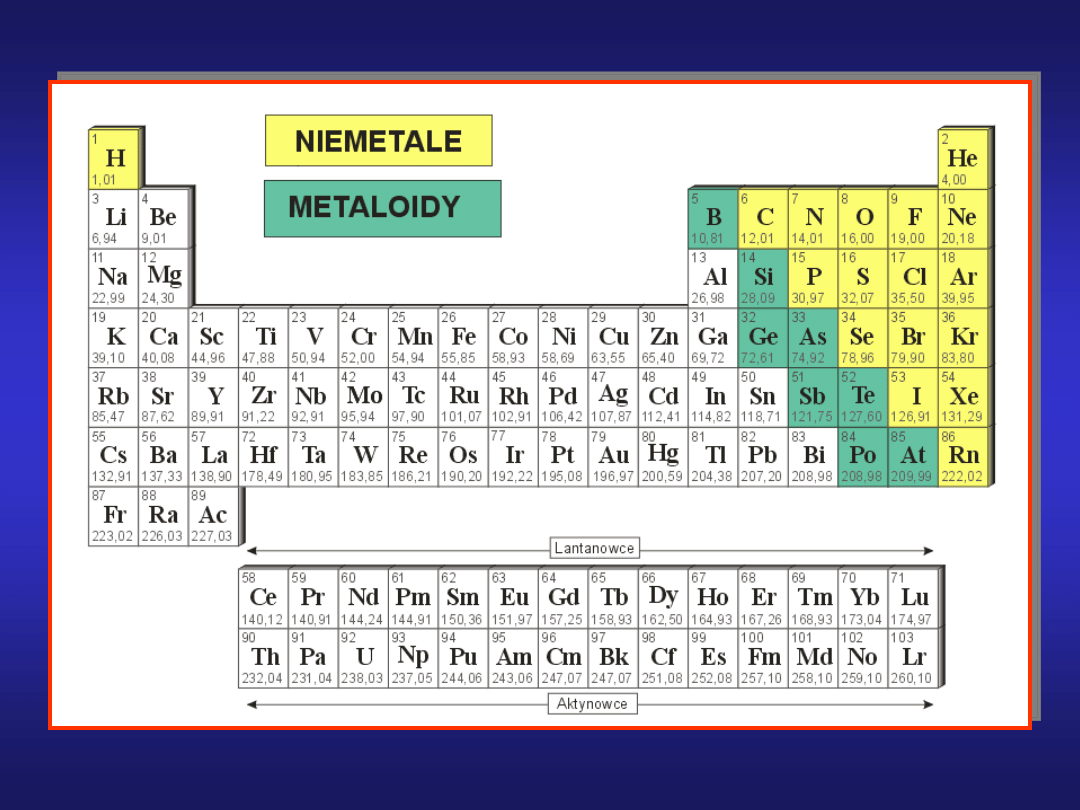

FORMY WYSTĘPOWANIA NIEMETALI
wodór
woda, węglowodory i pochodne
hel
gaz ziemny, atmosfera
bor
boraks Na
2
B
4
O
7
·10H
2
O
węgiel
CO
2
, CH
4
, węglowodory, materia ożywiona,
wapień CaCO
3
, dolomit CaCO
3
·MgCO
3
azot
atmosfera (N
2
), azotany (saletry NaNO
3
,
KNO
3
), materia ożywiona

FORMY WYSTĘPOWANIA NIEMETALI
tlen
O
2
(atmosfera), woda i inne tlenki, sole kwasów
tlenowych, wodorotlenki, materia ożywiona
fluor
fluoryt CaF
2
, apatyty Ca
5
(PO
4
)
3
(OH,F)
neon
Ne (atmosfera)
krzem
SiO
2
(kwarc), krzemiany,
glinokrzemiany
fosfor
fosforyt Ca
3
(PO
4
)
2
, apatyty, materia ożywiona

FORMY WYSTĘPOWANIA NIEMETALI
siarka
S (siarka rodzima), siarczki (piryt FeS
2
, galena
PbS, sfaleryt ZnS), siarczany (gips CaSO
4
·2H
2
O ,
baryt BaSO
4
, anhydryt CaSO
4
, sól gorzka
MgSO
4
), H
2
S, SO
2
(wyziewy wulkaniczne)
chlor
halit NaCl (pokłady i woda morska), sylwin KCl
argon
atmosfera
arsen
realgar As
4
S
4
, aurypigment As
2
S
3
, arsenopiryt
FeAsS
3

FORMY WYSTĘPOWANIA NIEMETALI
brom
woda morska (bromki)
krypton
atmosfera
jod
woda morska (jodki)
ksenon
atmosfera
OTRZYMYWANIE NIEMETALI
wodór
1) elektroliza wody
2) konwersja gazu wodnego:
C + H
2
O = CO + H
2
C
H
2
O
(CO+H
2
) + H
2
O = CO
2
+ 2H
2
CO
2
H
2
H
2
O

OTRZYMYWANIE NIEMETALI
tlen, azot, gazy szlachetne
powietrze
skroplenie
destylacja frakcjonowana
O
2
, N
2
, Ne, Ar, Kr, Xe
CH
4
+ He
gaz ziemny
skroplenie
metanu
CH
4
He

OTRZYMYWANIE NIEMETALI
bor i krzem
otrzymywanie boru:
HBr
B
H
BBr
C
1600
1000
~
2
3
B
MgO
Mg
O
B
C
700
500
~
3
2
otrzymywanie krzemu:
)
O
Al
,
MgO
,
CO
(
Si
SiO
3
2
2
Al
,
Mg
,
C
2
)
AlCl
,
KCl
,
NaCl
(
Si
SiCl
3
Al
,
K
,
Na
4

OTRZYMYWANIE NIEMETALI
fluorowce
fluor
elektroliza stopionych fluorków
chlor
elektroliza stopionych chlorków
elektroliza wodnych roztworów chlorków (NaCl)
brom
elektroliza wodnych roztworów bromków
wypieranie bromu: KBr + Cl
2
d KCl + Br
2
jod
wypieranie jodu: KI + Cl
2
d KCl + I
2

WŁAŚCIWOŚCI FIZYCZNE NIEMETALI
stan skupienia:
gazy, ciecze, ciała stałe
gęstość:
8,8·10
-6
(H
2
) - 4,93 (I
2
) g·cm
-3
temperatura topnienia:
-255 (H
2
) do 217°C (Se)
temperatura wrzenia:
-269 (He) do 685°C (Se)
WODÓR – podstawowe właściwości
Bezbarwny, pozbawiony zapachu gaz, złożony z cząsteczek H
2
.
cząsteczki H
2
występują w dwóch odmianach:
ortowodór
parawodór
izotopy:
)
tryt
(
T
H
),
deuter
(
D
H
),
prot
(
H
3
1
3
1
2
1
2
1
1
1
odmiany alotropowe:
BRAK
b
He
3
2
WODÓR – drogi wchodzenia w reakcje chemiczne
H
2
+ X
H – X wiązanie typu
s
przeniesienie elektronu
H
t X (H
+
X
-
)
przeniesienie elektronu
H
b X (X
+
H
-
)
BOR
Bor jest niemetalem występującym w Przyrodzie w postaci kwasu
borowego H
3
BO
3
i lub jego soli. Posiada 6 odmian alotropowych.
B
Si + B
2
O
3
SiO
2
B
2
O
3
O
2
700°C
BF
3
F
2
20°C
BCl
3
, BBr
3
, BI
3
X
2
>300°C
BN
N
2
>900°C
B
4
C
CO
>900°C
B
2
S
3
S
2
>700°C
H
2
+ H
3
BO
3
H
2
O
WĘGLOWCE
C, Si, Ge, Sn, Pb
Węglowce są pierwiastkami o zróżnicowanych właściwościach
fizycznych
i
chemicznych, których
charakter metaliczny
wzrasta ze wzrostem liczby atomowej.
niemetale
metaloidy (półmetale)
metale
C
Si
Pb
Ge
Sn
trwałość stopnia utlenienia:
+2
+4
C Si Ge Sn Pb
Pb Sn Ge Si C

WĘGLOWCE - połączenia z wodorem
Ge, Sn, Pb
C
Si
węglowodory
aromatyczne
alicykliczne
alifatyczne
(łańcuchowe)
silany
Si
n
H
2n+2
(n
15)
XH
4
C
C
C
nasycone -C-C-
nienasycone –C=C- lub -C
hC-
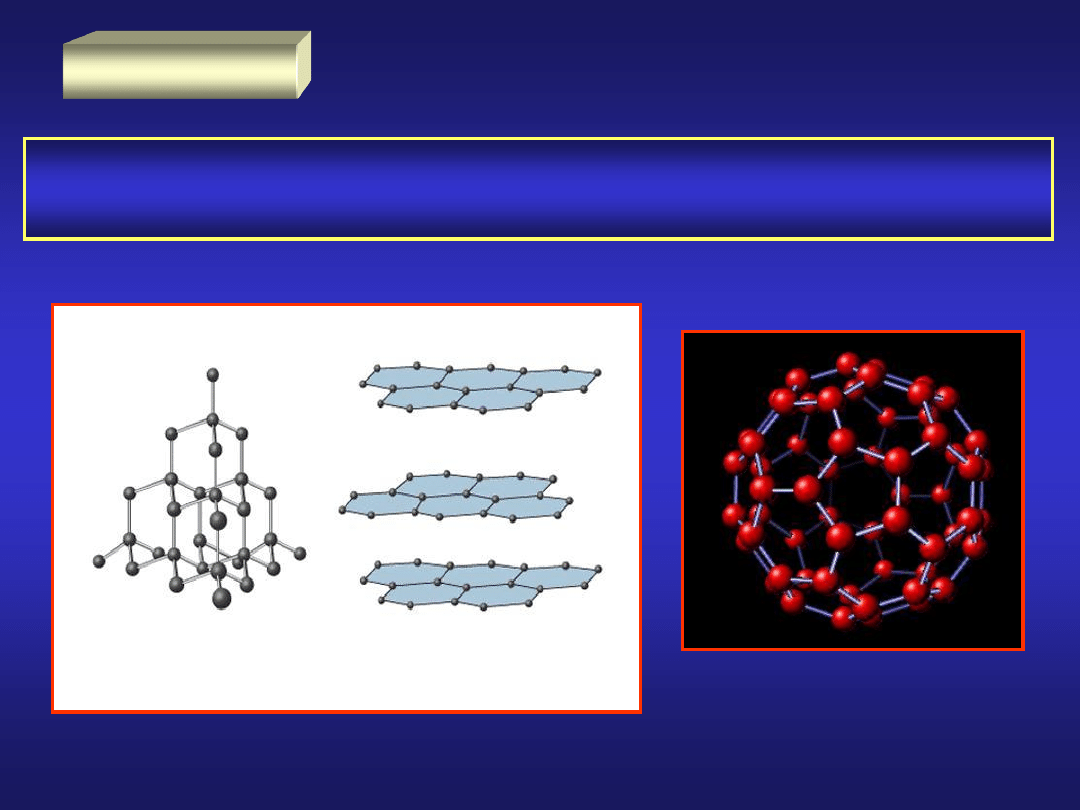
WĘGIEL
Pierwiastek
niemetaliczny
posiadający
różne
odmiany
alotropowe: diament, grafit, węgiel bezpostaciowy i fullereny.
diament grafit
sp
2
sp
3
fulleren C
60
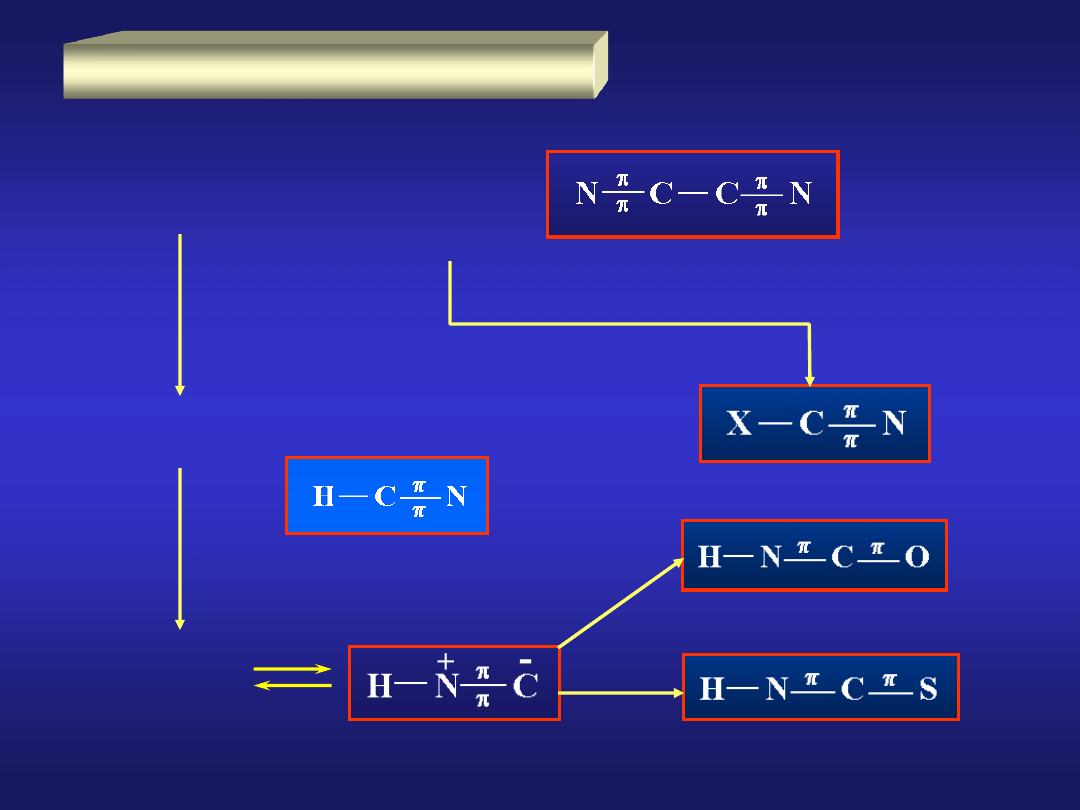
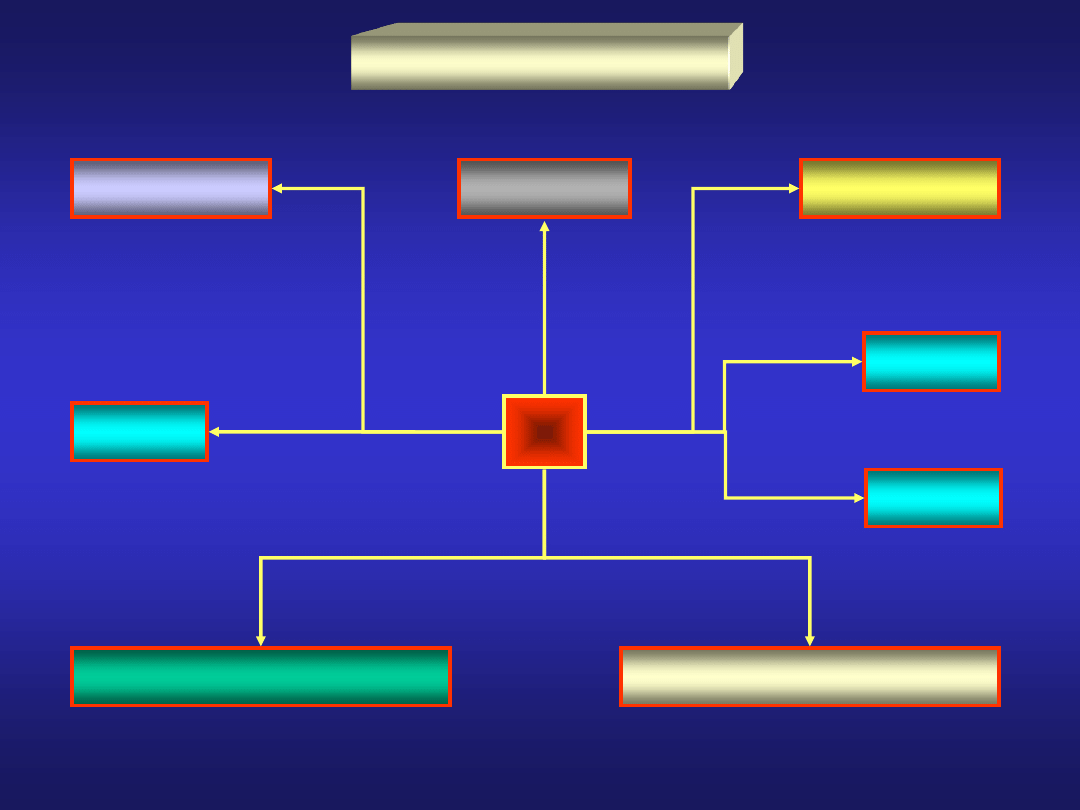
WĘGIEL – podstawowe związki
cyjan
Hg(CN)
2
t Hg + C
2
N
2
HCN
+H
2
S
-HgS
cyjanowodór
+H
2
O
HCN
aq
kwas
cyjanowodorowy
X
2
(X – Cl, Br, I)
kwas izocyjanowy
kwas tiocyjanowy

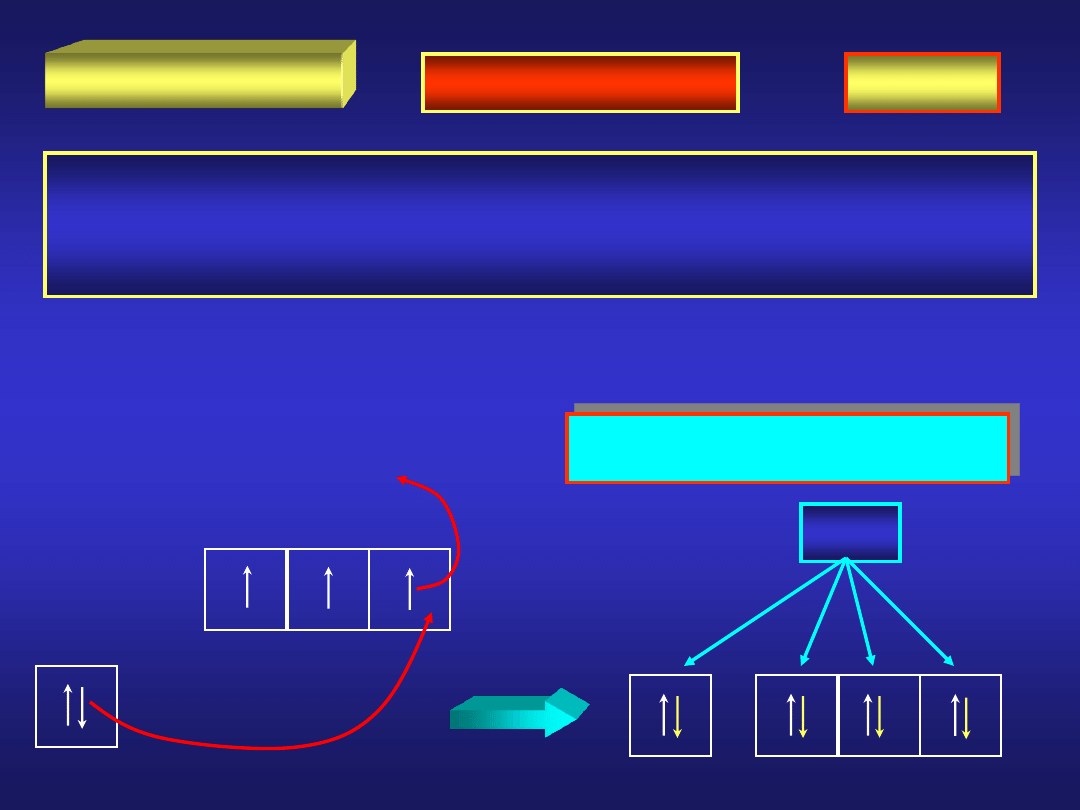
KRZEM
Metaloid mało reaktywny w niskich temperaturach. Drugi co do
rozpowszechnienia pierwiastek na Ziemi (15%), występujący
praktycznie we wszystkich skałach w postaci SiO
2
, krzemianów
i glinokrzemianów.
otrzymywanie:
MgO
Si
SiO
Mg
2
Si
SiF
SiO
Al
,
K
,
Na
4
HF
2
KRZEM - reakcje
Si
MgSi
Mg
SiO
2
, (SiO)
O
2
SiF
4
, SiCl
4
, SiBr
4
, SiI
4
F
2
, Cl
2
, Br
2
, I
2
SiHCl
3
, SiHBr
3
, SiHI
3
HCl, HBr, HI
Si
3
N
4
N
2
Na
2
SiO
3
-H
2
+NaOH
SiS
2
S
2
SiC
C
AZOTOWCE
Pierwiastki
o
umiarkowanej
elektroujemności,
których
charakter metaliczny rośnie ze wzrostem liczby atomowej. Nie
tworzą prostych anionów, a jedynie bizmut tworzy kation Bi
3+
.
N, P, As, Sb, Bi
ns
2
p
3
Cechą charakterystyczną jest tworzenie jonów:
4
4
4
4
SbH
,
AsH
,
PH
,
NH
2s
2p
4 H·

AZOT – podstawowe właściwości
N
N
p
p
Bezbarwny, bezwonny gaz o niskiej reaktywności chemicznej,
która wynika z dużej energii wiązania chemicznego. Jest
podstawowym składnikiem powietrza (ok.78%). Należy do tzw.
biopierwiastków
wchodząc
w
skład
białek
i
kwasów
nukleinowych.
otrzymywanie:
destylacja skroplonego powietrza (skala techniczna)
rozkład termiczny NH
4
NO
2
t N
2
+ H
2
O (skala laboratoryjna)
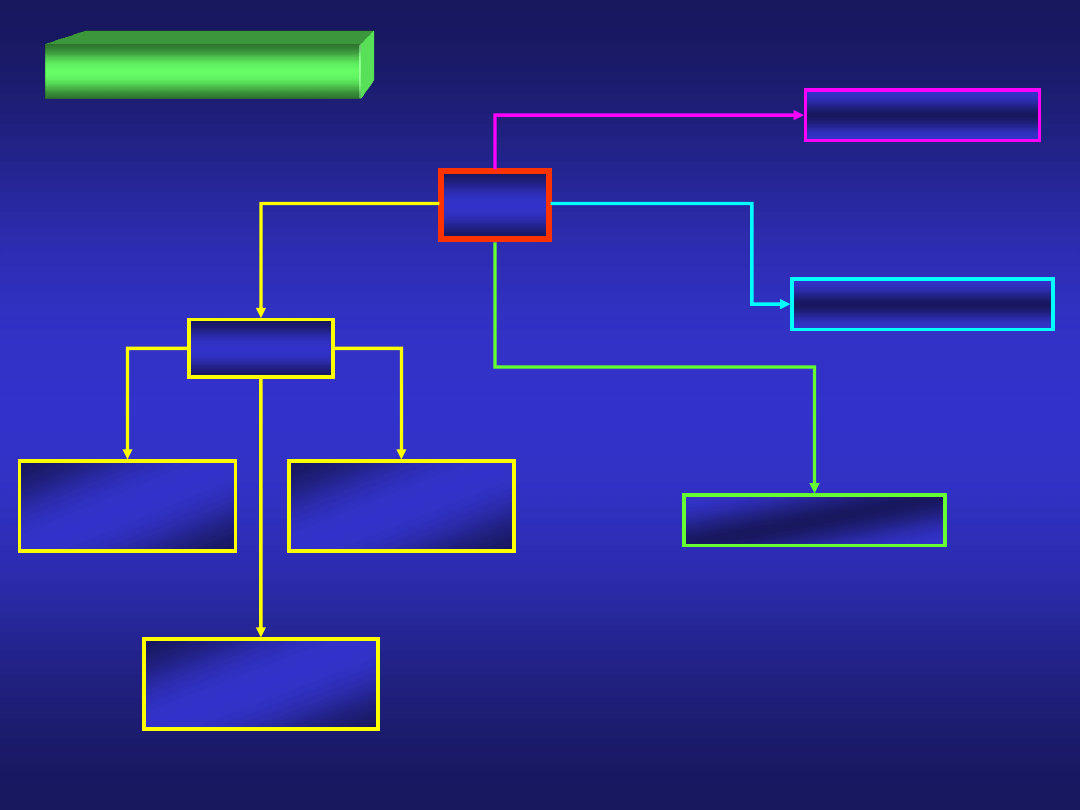
AZOT – reakcje
N
2
azotki
różne
pierwiastki
>200°C
międzywęzłowe
Ti, Zr, W
jonowe (N
3-
)
Li
3
N, Mg
3
N
2
kowalencyjne
Si
3
N
4
, P
3
N
5
NO, NO
2
, N
2
O
4
N
2
O, N
2
O
3
, N
2
O
5
O
2
> 300°C
bezpośrednio
O
2
pośrednio
NH
3
, N
2
H
4
H
2

FOSFOR – podstawowe właściwości
Pierwiastek o średnim rozpowszechnieniu na Ziemi (0,19%),
występujący wyłącznie w postaci związków zawierających
metale i tlen (np. Ca
3
(PO
4
)
3
).
Fosfor posiada cztery odmiany alotropowe, fosfor biały, czerwony,
fioletowy i czarny. Odmiana biała jest bardzo reaktywna chemicznie.
otrzymywanie - prażenie fosforytów z piaskiem i węglem:
Ca
3
(PO
4
)
2
+ SiO
2
t CaSiO
3
+ P
4
O
10
P
4
O
10
+ C
t P
4
+ CO
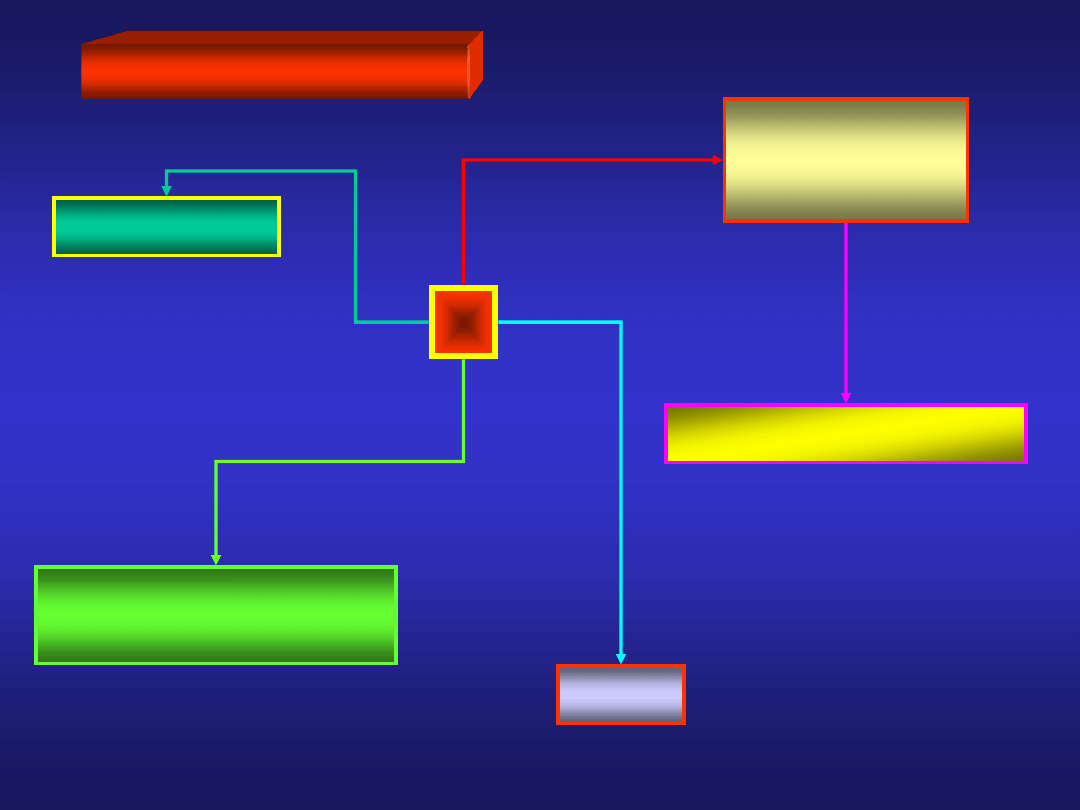
FOSFOR – reakcje
P
P
2
O
3
, P
2
O
5
P
4
O
6
, P
4
O
10
kwasy fosforowe
PH
3
PCl
3
, PBr
3
fosforki
Ca
3
P
2
, Ni
3
P, CoP
3
O
2
H
2
O
Cl
2
, Br
2
metale
H
2

TLENOWCE
O, S, Se, Te,
Po
ns
2
p
4
Aktywne pierwiastki o charakterze niemetalicznym (O,S),
półmetalicznym (Se,Te) lub metalicznym (Po).
Wszystkie tlenowce tworzą
trwałe aniony X
2-
.
Mimo
znacznej
aktywności
chemicznej,
tlen
i
siarka
występują w stanie wolnym, co
jest
wynikiem
procesów
geologicznych
(siarka)
lub
biologicznych (tlen).
0
0.5
1
1.5
2
2.5
3
3.5
tlen
siarka
selen
tellur
polon
elektroujemność
TLEN – podstawowe właściwości
Bezbarwny gaz (temperatura wrzenia: -183°C), bez zapachu,
złożony z cząsteczek O
2
. Jest najbardziej rozpowszechnionym
pierwiastkiem na Ziemi (47,2%).
odmiany alotropowe:
O
2
, O
3
ditlen
tritlen (ozon)
izotopy:
16
O (99,8%),
17
O,
18
O
STRUKTURA OZONU
O
..
.. ..
O
..
.. ..
O
..
.. ..
..
O
..
O
..
.. ..
O
..
..
p
.
O
..
O
..
.. ..
O
..
..
p
.
-
+
O
..
O
..
.. ..
O
..
..
p
-
+
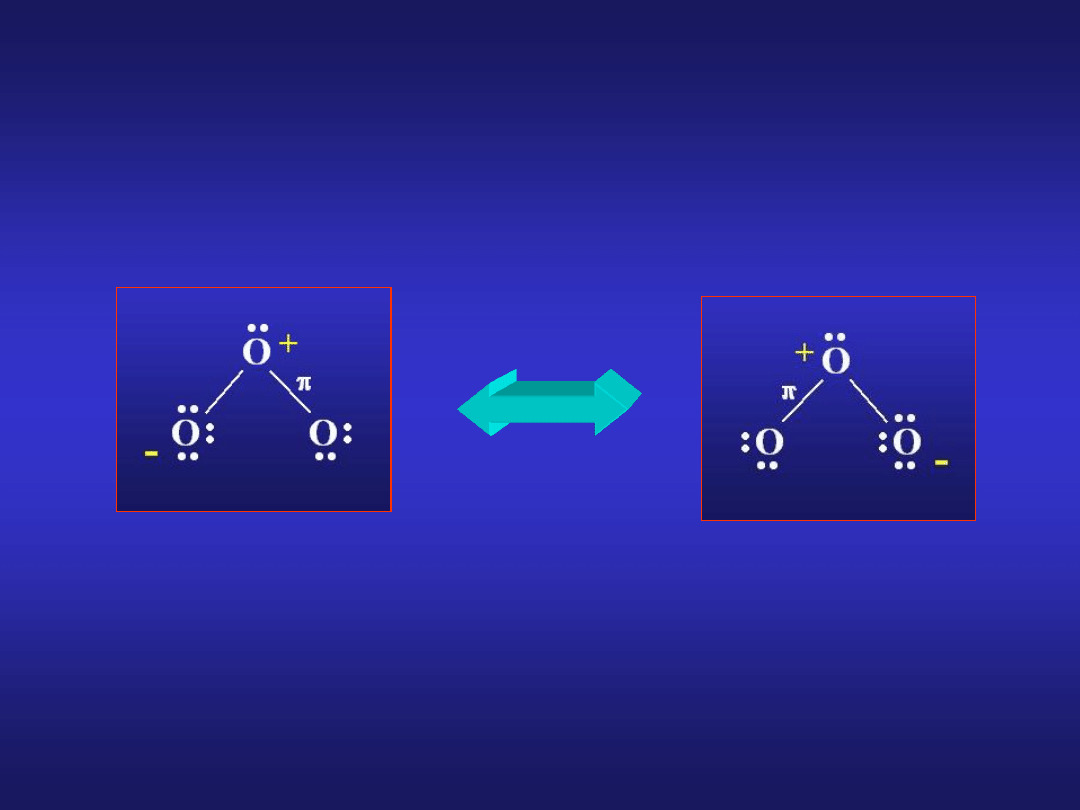
struktury rezonansowe cząsteczki ozonu
DROGI REAKCJI TLENU
tworzenie jonu tlenkowego O
2- *)
tworzenie jonu nadtlenkowego (O-O)
2-
tworzenie jonu ponadtlenkowego (O-O)
-
*)
faktycznie lub formalnie
O + 2e
-
t O
2-
2
2
2
O
e
2
O
2
2
O
e
O
tworzenie jonu tlenowego
O - 2e
-
t O
2+
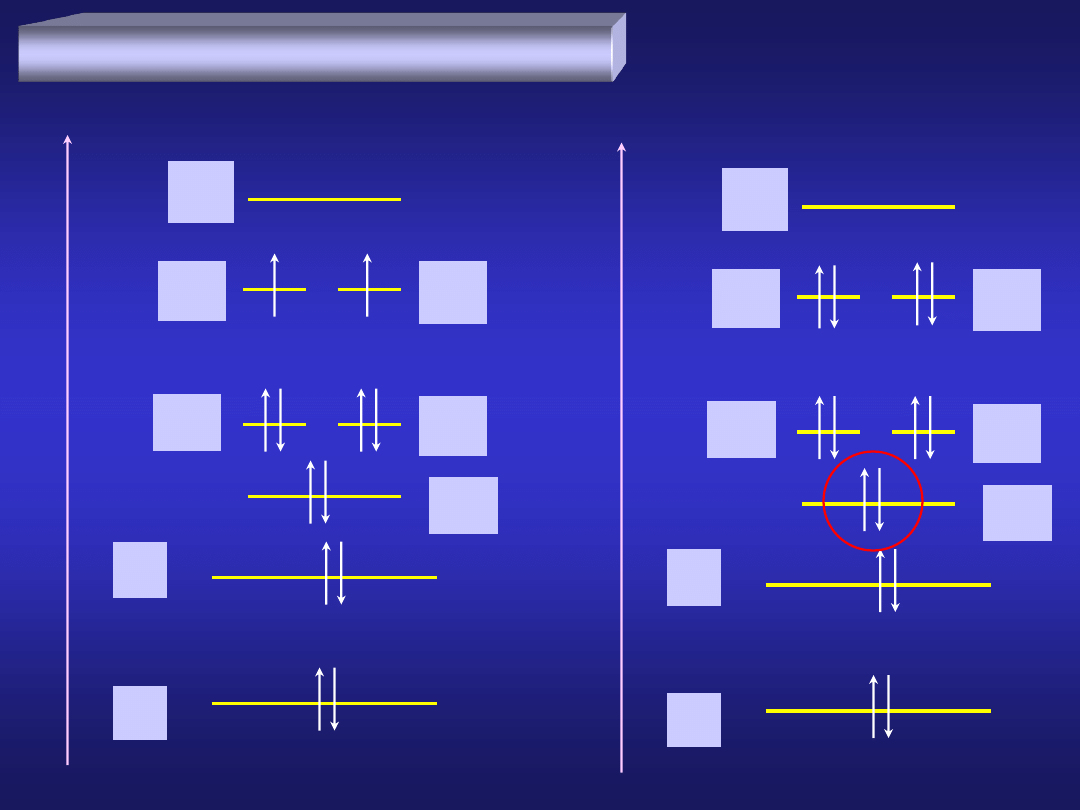
E
1s
2s
2p
1s
2
2s
2
2p
4
Budowa jonu tlenkowego O
2-
atom tlenu
E
1s
2s
2p
1s
2
2s
2
2p
6
jon tlenkowy O
2-
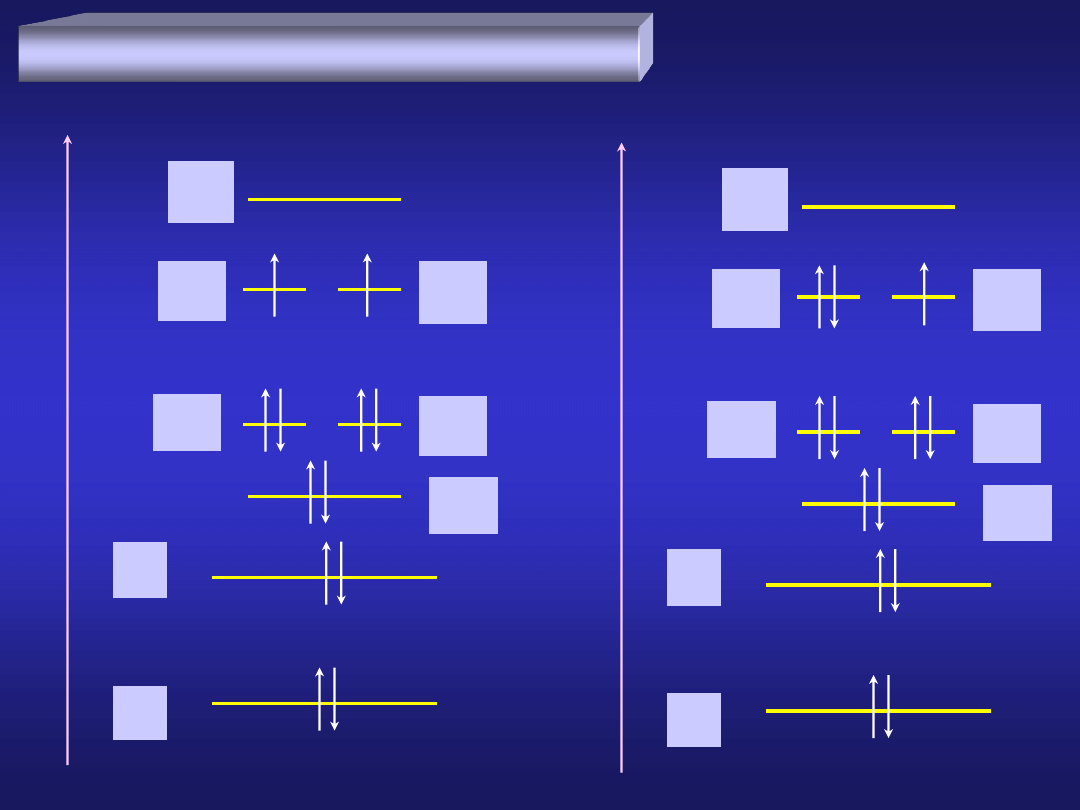
E
s
2
s
*
s
2
s
z
p
2
s
x
p
2
p
y
p
2
p
*
p
x
2
p
*
p
y
2
p
*
z
p
2
s
E
s
2
s
*
s
2
s
z
p
2
s
x
p
2
p
y
p
2
p
*
p
x
2
p
*
p
y
2
p
*
z
p
2
s
cząsteczka O
2
jon nadtlenkowy (O-O)
2-
Budowa jonu nadtlenkowego (O
2
)
2-
E
s
2
s
*
s
2
s
z
p
2
s
x
p
2
p
y
p
2
p
*
p
x
2
p
*
p
y
2
p
*
z
p
2
s
E
s
2
s
*
s
2
s
z
p
2
s
x
p
2
p
y
p
2
p
*
p
x
2
p
*
p
y
2
p
*
z
p
2
s
cząsteczka O
2
jon ponadtlenkowy (O-O)
-
Budowa jonu ponadtlenkowego (O
2
)
-
SIARKA
Niemetal barwy żółtej, nierozpuszczalny
w
wodzie,
występujący
w
kilku
odmianach
alotropowych,
z
których
najważniejszymi są siarka rombowa,
jednoskośna i plastyczna.
Jednostką strukturalną w odmianach
siarki jest cząsteczka S
8
siarka
rombowa
siarka
jednoskośna
96°C
siarka ciekła
113°C
siarka plastyczna
szybkie chłodzenie
ogrzewanie
SIARKA - reakcje
S
SO
2
O
2
SO
3
O
2
halogenki
tionylu SO
2+
SOX
2
X
2
halogenki
sulfurylu
SO
2
X
2
X
2
SF
2
, SCl
2
, S
2
F
2
, S
2
Cl
2
,
SF
4
, SCl
4
, SF
6
, SCl
6
X
2
H
2
S, H
2
S
2
H
2
siarczki M
x
S
y
M
CS
2
C
H
2
SO
3
H
2
O
H
2
SO
4
H
2
O

FLUOROWCE
HALOGENY
F, Cl, Br, I,
At
ns
2
p
5
Niemetaliczne pierwiastki o dużych
elektroujemnościach i wynikającej z
tego znacznej reaktywności.
Wszystkie tworzą jony X
-
. Za
wyjątkiem
fluoru
występują
także na dodatnich stopniach
utlenienia z zakresu +1 do +7.
otrzymywanie:
elektroliza
stopionych
halogenków
lub
wypieranie mniej aktywnych fluorowców przez
bardziej aktywne
KBr + Cl
2
t KCl + Br
2
Reakcje między fluorowcami
Fluorowce X i Y w reakcji tworzą związki typu:
XY
n
anion Y
-
tworzony przez
fluorowiec o większej
elektroujemności
kation X
n+
tworzony przez
fluorowiec o mniejszej
elektroujemności
XY
XY
3
XY
5
XY
7
ClF, BrF
BrCl, ICl
IBr
ClF
3
, BrF
3
ICl
3
BrF
5
, IF
5
IF
7

FLUOR
Praktycznie bezbarwny gaz, o przenikliwym zapachu i dużej
aktywności chemicznej.
Jest najaktywniejszym pierwiastkiem dlatego otrzymać go
można wyłącznie przez elektrolizę w środowisku bezwodnym.
W praktyce prowadzi się elektrolizę mieszaniny HF+KF.
Fluor reaguje z większością substancji organicznych i
nieorganicznych już w temperaturze pokojowej, tworząc
związki typu:
M
+
F
-
F
-
-
-
-
-
-
-
+
+
+
+
+
M
s
CHLOR
Żółto-zielony gaz o gęstości większej ok. 2,5 razy od gęstości
powietrza. Jest pierwiastkiem bardzo aktywnym chemicznie.
otrzymywanie:
elektroliza stopionych chlorków
utlenianie chlorków:
Cl
-
+ MnO
2
+ H
+
t Cl
2
+ Mn
2+
+ H
2
O
W związkach chlor występuje na –1, +1, +4, +6 i +7 stopniu
utlenienia.
W
związkach
o
wiązaniu
kowalencyjnym
występuje w tetraedrycznym stanie walencyjnym (sp
3
).
utleniacz
Najważniejsze pochodne chloru
Cl
HCl
H
2
kwas solny HCl
aq
H
2
O
Cl
2
O, ClO
2
, ClO
3
, Cl
2
O
7
O
2
kwasy tlenowe
HClO, HClO
2
, HClO
3
, HClO
4
H
2
O
chlorki (Cl
-
)
metale

GAZY SZLACHETNE
występowanie:
He – atmosfera, gaz ziemny
Ne, Ar, Kr, Xe - atmosfera
zawartość w atmosferze:
Ar – 0,93%
Ne – 0,0018%
Kr – 0,0011%
He – 0,0005%
Xe – 0,000008%
Rn
Ra
222
86
226
88
a

GAZY SZLACHETNE
reakcje chemiczne
znany jest jeden związek kryptonu KrF
2
:
2
C
180
2
KrF
F
Kr
Ksenon tworzy szereg połączeń w bezpośredniej reakcji z
fluorem:
6
4
2
C
250
2
XeF
XeF
XeF
F
Xe
w XeF
4
i XeF
6
reakcji z wodą tworzą tlenek ksenonu(VI)
będący bezwodnikiem kwasu ksenonowego(VI) H
2
XeO
4
:
3XeF
4
+ 6H
2
O = XeO
3
+ 2Xe + 1,5O
2
+ 12HF
XeF
6
+ 3H
2
O = XeO
3
+ 6HF
Wyszukiwarka
Podobne podstrony:
metale i niemetale
Metale i niemetale
Metale i niemetale nauka
metale i niemetale, dydaktyka, konspekty
Metale i niemetale
metale, niemetale, węgiel ściąga
metale i niemetale
Cechy niemetryczne czaszki
wyklad 11 toksyczno niemetali
metale szlachetne
Leszek wyklad11 metale
Metale poddawane obróbce plastycznej
Detector De Metales
Ćw 3 wytwarzanie powłok metalicznych na podłożu metalicznym i niemetalicznym
Metale Powszechnego Uzytku id 2 Nieznany
metale niezelazne cz2 id 293802 Nieznany
Tytułowa metale 2
Opracowanie pytań MAMET METALE
więcej podobnych podstron