
Metale Powszechnego Użytku
Glin, Miedź, Żelazo
Kamil Janik
kl. III c
Glin
Właściwości Chemiczne :
o
Glin jest trzecim najpowszechniej występującym pierwiastkiem na
powierzchni Ziemi.
o
Jest bardzo lekkim i miękkim metalem, dobrze przewodzącym prąd. Jest
reaktywny i reaguje z wodą/kwasami/zasadami.
Tlenek Glinu Al
2
O
3
jest jednym z najtrwalszych tlenków – jego cienka warstwa
doskonale izoluje metal od wpływu czynników zewnętrznych.
Zjawisko pokrywania się metalu warstwą trwałego tlenku izolującego ten metal
od czynników zewnętrznych nosi nazwę – PASYWACJI.
Znany stop Glinu :
o Duraluminium - zawiera około 2% miedzi , 2 % magnezu oraz domieszki
krzemu i manganu. Wykonujemy z niego ramy okienne , meble , a także
elementy konstrukcji metalowych .
Przedmiot wykonany z tego pierwiastka to – Aluminium.
Surowiec do otrzymywania aluminium to Boksyt – Ruda zawierająca
uwodniony tlenek glinu .
Otrzymywanie Glinu :
o Obecnie glin otrzymujemy elektrolitycznie na drodze elektrolizy
stopionego tlenku glinu.
o
Metoda ta polega na tym, że rozdrobniony tlenek glinu wymieszany z
kriolitem umieszcza się w żelaznych naczyniach i ogrzewa się do
temperatury około 1000
O
C w której następuje stopienie się mieszaniny.
Ogrzany tlenek Glinu ulega dysocjacji termicznej na jony tlenkowe O
2-
i
jony glinu Al
3+
następująco :
Al
2
O
3
2 Al
3+
+ 3O
2-
o
Żelazne naczynie spełnia rolę katody . Jony glinu przemieszcza się w
stronę ścianek naczynia na których następuje redukcja jonów Al
3+
do
metalicznego glinu :
Al
3+
+ 3e
-
Al

o Stopiony glin osadza się na dnie naczynia, natomiast jony tlenkowe
ulegają procesowi utlenienia na wsuniętych od góry anodach grafitowych
.
2 O
2-
O
2
+ 4 e
-
Sumarycznie równanie reakcji elektrolizy możemy zapisać następująco :
2 AL
2
O
3
4 Al + 3 O
2
Zastosowanie aluminium:
o
Aluminium ze względu na swoją lekkość i stosunkowo dobrą
wytrzymałość w porównaniu do ciężaru oraz inne właściwości jest
również powszechnie stosowane w przemyśle. Aluminium jest
wykorzystywane nie tylko w branży budowlanej, ale również w innych
gałęziach przemysłu.
o
Jak się okazuje, aluminium ma szerokie zastosowanie w przemyśle
lotniczym i samochodowym, do wyrobu przewodów elektrycznych i
części maszyn, w budownictwie, a nawet do wyrobu naczyń kuchennych.
Samo aluminium w większej ilości jest szkodliwe dla organizmu, dlatego
też aktualnie do wyrobu naczyń kuchennych aluminium jest już bardzo
rzadko stosowane.
o
Aluminium zaczyna być również stosowane w przemyśle wojskowym,
jako materiał do budowy różnego rodzaju pancerzy i powłok ochronnych
- dzięki lekkości żołnierze mogą takie pancerze bez problemu nosić na
sobie, zwiększając jednocześnie swoje bezpieczeństwo. Oczywiście
powszechną formą zastosowania aluminium w mieszkaniu jest
aluminiowa folia spożywcza.
Miedź
Właściwości chemiczne :
o
Jest metalem półszlachetnym. W przyrodzie występuje w rudach miedzi i
dużo rzadziej w stanie rodzimym to znaczy w postaci czystego
pierwiastka .
o
Ruda miedzi zawiera najczęściej Siarczek miedzi Cu
2
S .
o
Minerałami zawierającymi miedź są także Malachit oraz turkus – oba po
wypolerowaniu wykorzystujemy w jubilerstwie .
Otrzymywanie :
o
Aby otrzymać miedź ogrzewa się rozdrobniony kruszec zawierający
najczęściej siarczek miedzi ( I ) Przy dobrym dostępnie powietrza :
2 Cu
2
S + 3 O
2
2 Cu
2
O + 2 SO
2
o
Powyższy proces przerywa się po pewnym czasie i mieszaninę
powstałego tlenku miedzi i siarczku praży się dalej już bez dostępu
powietrza. Zachodzi wtedy proces redukcji tlenku miedzi. I siarczku
miedzi do metalicznej miedzi.
2 Cu
2
O + Cu
2
S 6 Cu + SO
2
o
Otrzymana w ten sposób surowa miedź zawiera około 1%
zanieczyszczeń i nie nadaje się do celów elektrotechnicznych gdyż
nawet nie wielkie domieszki innych metali znacznie obniżają jej
przewodnictwo .
o
Taką miedź poddaje się dalej oczyszczaniu
Najbardziej powszechną
metodą oczyszczania miedzi jest metoda elektrolityczna . W dużych
wannach wypełnionych roztworem siarczanu VI miedzi II umieszcza się
bloki zanieczyszczonej miedzi i cienkie blachy miedzi elektrolitycznie
oczyszczonej.
Jak wiemy – podczas przeprowadzania elektrolizy z zastosowaniem
anody zbudowanej z metalu który w danym procesie ulega redukcji
katodowej, następuje przechodzenie jonów metalu z anody do roztworu i
równolegle zachodzi redukcja tych jonów na katodzie .
Dla Miedzi proces elektrolizy zapiszemy w następujący sposób :
Katoda : Cu
2+
+2 e
-
Cu
Anod : Cu Cu
2+
+ 2 e
-
Miedź jest składnikiem wielu stopów . Dwa główne to Brąz i Mosiądz.
o
Brąz – Jest stopem zawierającym miedź i cynę zmieszane w różnych
proporcjach, występując w licznych odmianach . Jest bardzo twardy
o
Mosiądz - Stop miedzi i cynku - mający złocistą barwę i jest stosowany
do wyrobu części maszyn armatury oraz przedmiotów ozdobnych .
o Miedzionikle - stopy miedzi i niklu, zawierające przeważnie dodatki
innych pierwiastków (krzem, żelazo, glin, mangan). Cechuje je dobra
wytrzymałość mechaniczna, odporność na korozję oraz dobre własności
oporowe
o
Spiż to stop miedzi z cyną, cynkiem i ołowiem, czasem zaliczany do
brązów. Zawiera więcej cyny (11%) niż brąz cynowy (do 9%).
Zawartości cynku i ołowiu są odpowiednio w granicach 2-7% i 2-6%.
Jest odporny na korozję i ścieranie.
Zastosowanie miedzi:
o
Miedź stosuje się w budownictwie, szczególnie przy pokrywaniu
dachów.
o
Miedź znajduje także zastosowanie w świecie muzyki: w gitarach
elektrycznych, kontrabasach, saksofonach, trąbkach i puzonach.
o
Materiałem jubilerskim złoto i srebro staje się dopiero po stopieniu z
miedzią. Poprawia również własności mechaniczne.
o
Miedź jest najbardziej niezawodnym, oszczędnym oraz
najbezpieczniejszym na świecie materiałem do przesyłania energii
elektrycznej. Dzięki czemu wykorzystywana jest również na dużą skale
w elektronice(Miedź jest najlepszym nośnikiem informacyjnym.)
o
Z powodu dużej przewodności cieplnej, miedź znalazła zastosowanie w
przemyśle chemicznym do wyrobu chłodnic, aparatów chemicznych i
przy produkcji elementów grzejnych i wymienników cieplnych.
Zastosowanie stopów miedzi:
Brąz:
o Obecni brąz stosowany jest na odlewy, do wyrobu części maszyn, na
stalówki do piór, oraz w postaci sproszkowanej jako farba.
o Z brązu produkuje się takie części jak łożyska, panewki, ślizgi i napędy,
osprzęt parowy i wodny, armatura chemiczna, przemysł okrętowy i
papierniczy;
o Z brązu wykonuje się dzwony
o Brąz manganowy używany jest na części precyzyjnych aparatów
wymagających wytłumienia drgań wywołanych pracą silników,
przekładni zębatych itp.
Mosiądz:
o Zastosowanie mosiądzu: rury cienkościenne, szczególnie do produkcji
chłodnic, wyroby emaliowane, elementy wykonywane różnymi
metodami obróbki plastycznej, oraz skrawania, elementy zamków
błyskawicznych, elementy ślizgowe, architektura;
o Mosiądze stosuje się również na wyroby armatury, osprzęt odporny na
wodę morską, śruby okrętowe, okucia budowlane, np. klamki. Na
elementy maszyn w przemyśle maszynowym, samochodowym,
elektrotechnicznym, okrętowym, precyzyjnym, chemicznym.
o Kruchy mosiądz stosowany jest jako forma odlewnicza
Miedzionikiel i Spiż:
o Stop miedzi z niklem(miedzionikiel) wykorzystywany jest w
elektrotechnice
o Stosowany również w produkcji będących w obiegu monetach o
nominałach 10, 20,
50 gr oraz 1, 2,5 zł
o Spiż stosowany jest głównie w rzeźbiarstwie i do wyrobu elementów
ozdobnych.

Żelazo
Właściwości chemiczne :
o
Jest ciężkim metalem
o Nie zbyt twardym
o Posiada formy alotropowe (
zjawisko występowania, w tym samym stanie skupienia, różnych
odmian tego samego pierwiastka chemicznego, różniących się właściwościami fizycznymi i
chemicznymi. Odmiany alotropowe pierwiastka mogą różnić się między sobą strukturą krystaliczną lub
liczbą atomów w cząsteczce
.)
o
Wrażliwy na działanie pola magnetycznego
W niższych temperaturach tworzy odmianę alotropową będącą
Ferromagnetykiem – kryształem zbudowanym z maleńkich domen
magnetycznych.
o
Reaguje z kwasami nieutleniającymi a w kwasach utleniających –
podobnie jak glin ulega pasywacji.
o
Jony Fe wchodzą w skład Hemoglobiny – Dzienne zapotrzebowanie
człowieka na Fe = ~20 miligramów. Najwięcej tego pierwiastka
znajdziemy w mięsie owocach i warzywach .
Zróżnicowane zastosowanie żelaza:
o
Żeliwo – Żelazo z domieszką Węgla służy do wyrobu tanich
odlewów będących korpusami maszyn. Często z niego wyrabiane są
kaloryfery i wanny.
o
Stal – Żelazo zawierające ściśle określoną ilość węgla oraz
domieszki innych uszlachetniających metali jest stosowana zarówno
do produkcji maszyn przemysłowych oraz przedmiotów codziennego
użytku .
o
Stal otrzymujemy w 2 etapach :
1) Przetwarzaniu rudy żelaza w tzw. Surówkę . – ( Stal z dużą
ilością węgla)
2) Przerabianiu surówki w stal.
Powstawanie żelaza i jego stopów
o Powietrze potrzebne do spalenia koksu – mające około 1000
o
C – ułatwia
utrzymanie temperatury wewnątrz pieca.
o
Wielki piec : miejsce wyrobu Surówki przez tzw. Gardziel wprowadza się
koks i rudę. Do rudy dodaje się topniki – obniżające temp. Całej
mieszaniny. Przy okazji usuwają część zanieczyszczonej rudy.
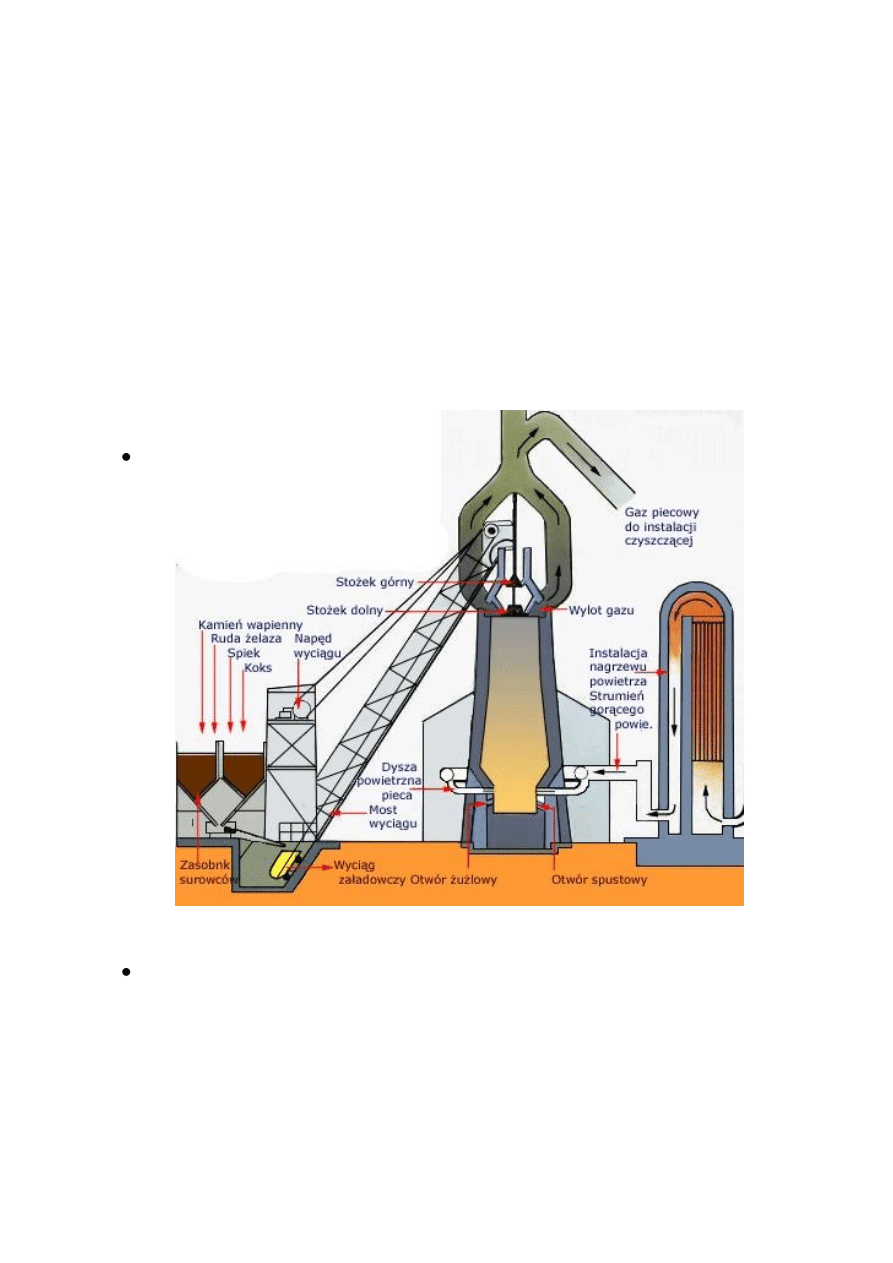
o
Położony niżej koks spala się do tlenku węgla II – CO , który wędruje
wyżej do pieca redukując rudę utleniając do CO
2
.
CO + 3 Fe
2
O
3
2 Fe
3
O
4
+CO
2
CO + Fe
3
O
4
3 FeO + CO
2
CO + FeO Fe + CO
2
o
Wytworzenie Stali z Surówki polega na usunięciu pewnej ilości węgla
i dodaniu metali mających podnieść jakość stali.
Budowa wielkiego pieca
Zastosowanie żelaza i jego stopów
o Stal- żelazo miesza się z węglem, aby nadać mu większą twardość i
wytrzymałość. Tak powstaje stal. Jest to stop żelaza z węglem
zawierający do 2 % węgla, oraz inne składniki np. mangan, krzem, chrom
i molibden.Stal jest głównym materiałem konstrukcyjnym. Buduje się z
niej drapacze chmur, robi zbrojenia w budynkach. Produkuje się z niej
narzędzia, śrubki, łożyska, rury, samochody, broń, i wiele innych rzeczy.

Stal jest jednym z najbardziej rozpowszechnionych i znanych stopów na
świecie.
o
Żeliwo -odlewniczy stop żelaza z węglem (zawartość węgla – ponad 2 do
4,5 %), krzemem, manganem, fosforem, siarką i innymi składnikami.
Żeliwo szare charakteryzujące się dobrą obrabialności, dużą odpornością
na ścieranie. Dzięki tym własnościom jest szeroko stosowane w
przemyśle maszynowym (np. kadłuby maszyn, wały, tuleje cylindrowe).
Żeliwo białe jest twarde i kruche, słabo obrabialne.
Bibliografia
http://www.chemia.dami.pl/gimnazjum/gimnazjum9/pierwiastki11.html
o
http://pl.wikipedia.org/wiki/Alotropia
o
http://www.gimnazjum.zabierzow.org.pl/files/pomoce/technika/zelazo.pdf
o
http://www.sciaga.pl/slowniki-tematyczne/1567/zastosowanie-miedzi-i-jej-zwiazkow/
o
http://www.metale.pl/o_metalach.php?id=miedz&?w
Wyszukiwarka
Podobne podstrony:
Literatura powszechna I rok id Nieznany
metale niezelazne cz2 id 293802 Nieznany
metale niezelazne cz1 id 293801 Nieznany
HISTORIA POWSZECHNA KINA id 204 Nieznany
projekt metale koncepcyjny 1 id Nieznany
metale niezelazne cz2 id 293802 Nieznany
cw 16 odpowiedzi do pytan id 1 Nieznany
Opracowanie FINAL miniaturka id Nieznany
How to read the equine ECG id 2 Nieznany
PNADD523 USAID SARi Report id 3 Nieznany
OPERAT STABLE VERSION ugoda id Nieznany
biuletyn katechetyczny pdf id 8 Nieznany
Finanse publiczne cw 4 E S id 1 Nieznany
7 uklady rownowagi fazowej id 4 Nieznany
Problematyka stresu w pracy id Nieznany
Odpowiedzi calki biegunowe id Nieznany
więcej podobnych podstron