
Chemia produktów
Chemia produktów
Chemia produktów
Chemia produktów naturalnych
naturalnych
naturalnych
naturalnych
Autorzy:
dr hab. Jadwiga Sołoducho
mgr inż. Krzysztof Idzik
Wydział Chemiczny, Politechnika Wrocławska
Politechnika Wrocławska 2004

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
2
Spis treści
1.
Wstęp
2.
Sprzęt laboratoryjny.................................................................................
2.1.
Rodzaje destylacji................................................................................7
2.1.1.
Destylacja prosta..................................................................................8
2.1.2.
Destylacja z parą wodną......................................................................9
2.1.3.
Destylacja frakcyjna.............................................................................10
2.1.4.
Destylacja azeotropowa.......................................................................11
2.1.5.
Destylacja pod zmniejszonym ciśnieniem...........................................12
2.2.
Aparatura do pomiaru temperatury topnienia......................................13
3.
Środki suszące..........................................................................................14
4.
Podstawy chromatografii........................................................................15
5.
Wyodrębnianie, oznaczanie i identyfikacja produktów
naturalnych..............................................................................................20
5.1.
Fermentacja alkoholowa......................................................................20
5.2.
Eugenol z olejku z goździków ............................................................22
5.3.
Wydzielanie anetolu z anyżku.............................................................25
5.4.
Limonen ze skórki owoców cytrusowych............................................27
5.5.
Wydzielanie kofeiny z herbaty.............................................................29
5.6.
Wydzielanie teobrominy z kakao.........................................................31
5.7.
Wydzielanie nikotyny z papierosów....................................................33
5.8.
Trimirystyna z gałki muszkatołowej............................................... 35
5.9.
Próby na obecność cholesterolu...........................................................37
5.10.
Wydzielanie lecytyn – zastosowanie chromatografii...........................42
5.11.
Likopen i beta-karoten z marchwi.......................................................44
5.12.
Wydzielanie i rozdział barwników z papryki......................................46
5.13.
Izolacja piperyny z pieprzu czarnego...................................................48
5.14.
Aldehyd kuminowy z nasion kminku rzymskiego...............................50
5.15.
Wydzielanie i oznaczanie poziomu retinolu........................................52
5.16.
Określanie poziomu witaminy C w sokach owocowych.....................55

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
3
Wstęp
Wprowadzenie
Skrypt ten jest przeznaczony głównie dla studentów Wydziału Chemicznego Politechniki
Wrocławskiej, został opracowany przez dr hab. Jadwigę Sołoducho oraz mgr inż. Krzysztofa
Idzika.
Znaczna część skryptu poświęcona jest metodom i sposobom wydzielania, oznaczania i
identyfikacji związków naturalnych o różnorodnej budowie chemicznej.
W skrypcie szczególną uwagę zwrócono na właściwości i zastosowanie izolowanych z
roślin związków chemicznych, podano ich właściwości chemiczne i aplikacyjne, umożliwiając
studentom poszerzenie wiedzy z zakresu fitochemii.
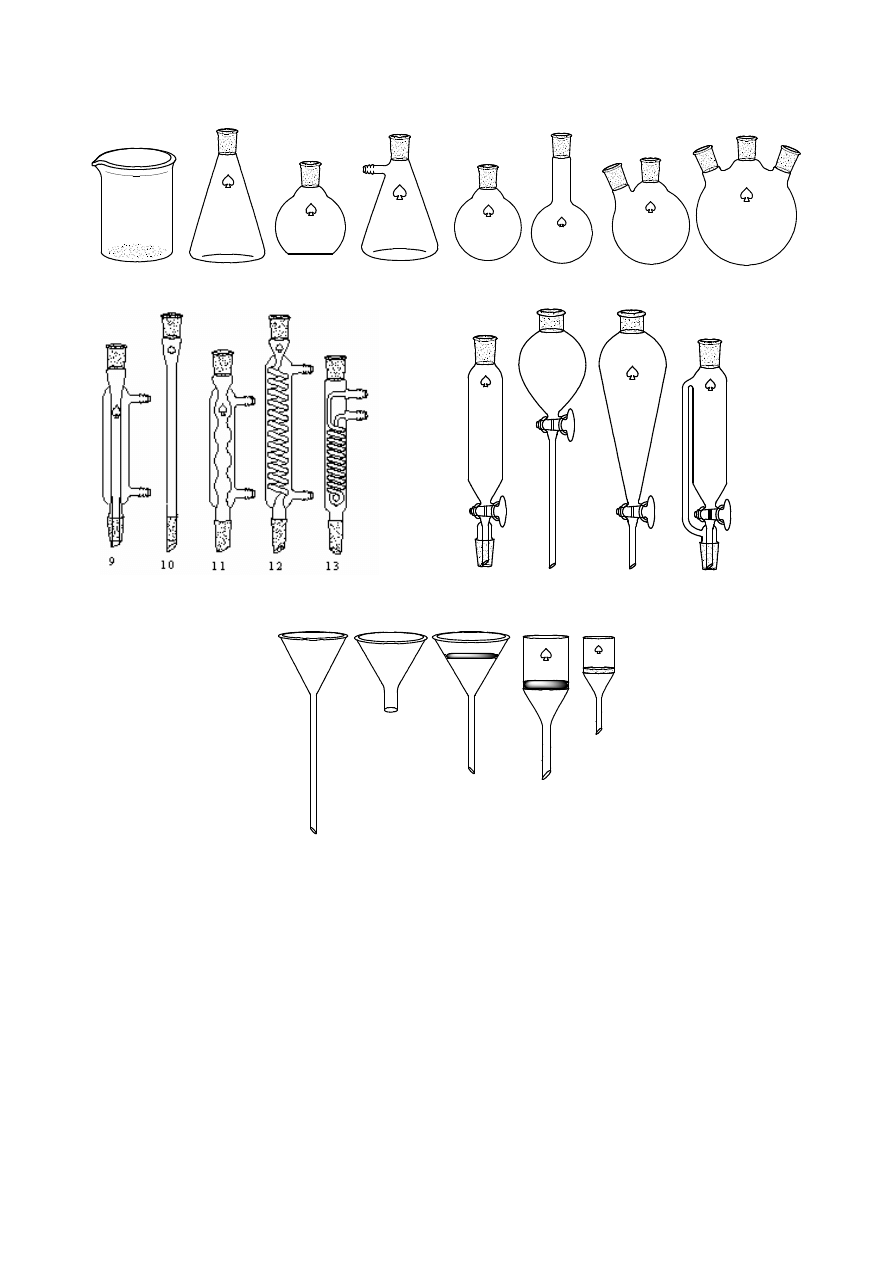
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
4
1. SPRZĘT LABORATORYJNY
1
2
3
4
5
6
7
8
14
15
16
17
18
19
20
21
22
1 – zlewka zwykła
2 – kolba stożkowa
3 – kolba płaskodenna
4 – kolba ssawkowa
5 – kolba kulista z krótką szyjką
6 – kolba kulista z długą szyjką
7 – kolba kulista dwuszyjna
8 – kolba kulista trójszyjna
9 – chłodnica Lebiega
10 – chłodnica powietrzna
11 – chłodnica kulkowa
12 – chłodnica spiralna
13 – chłodnica Dimrotha
14 – wykraplacz
cylindryczny
15 – rozdzielacz kulisty
16 – rozdzielacz gruszkowaty
17 – wykraplacz z
wyrównawczym ciśnieniem
18 – lejek zwykły
19 – lejek zwykły
20 – lejek z wkładką sitową
21 – lejek Büchnera
22 – lejek z płytką ze szkła spiekowego
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
5
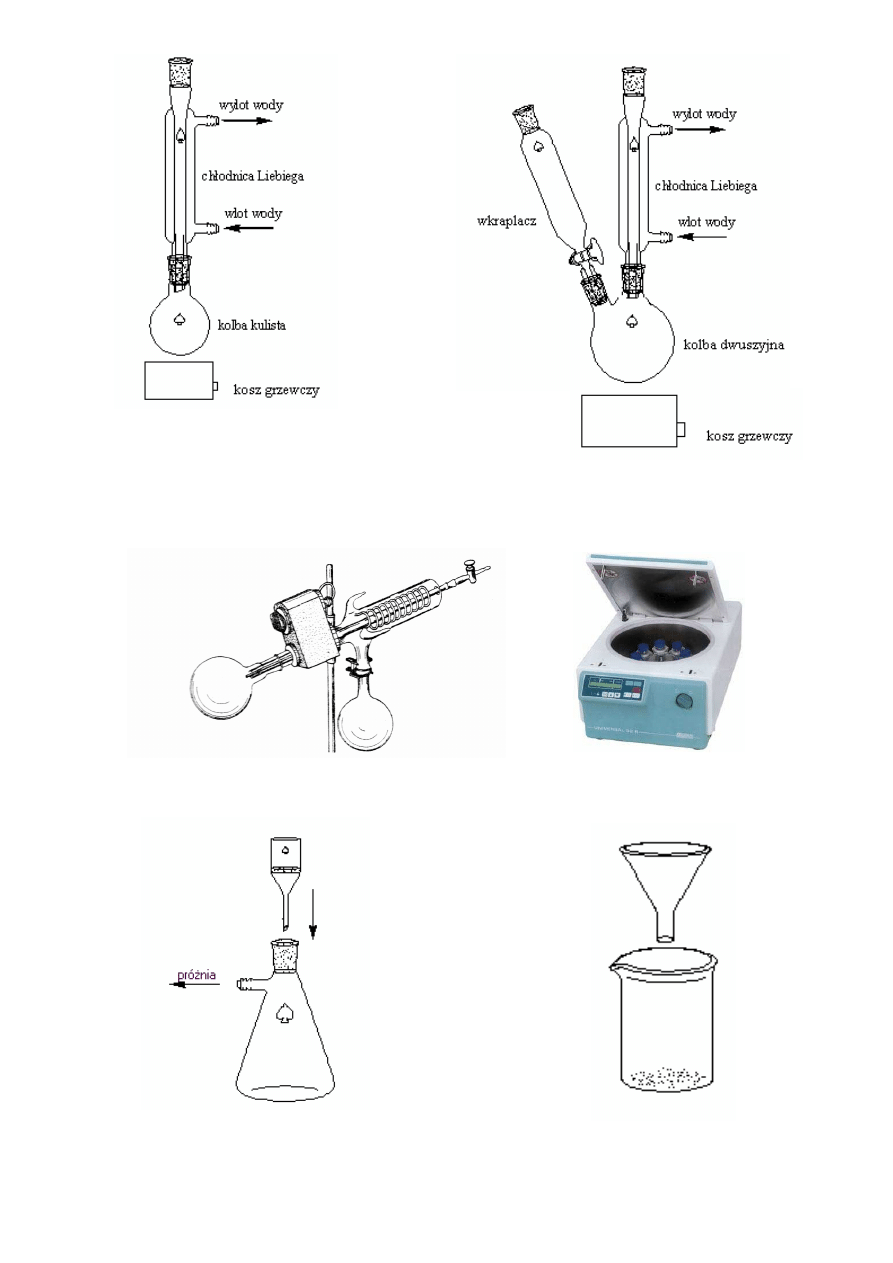
a) b)
OGRZEWANIE POD CHŁODNICĄ ZWROTNĄ
a) bez wkraplania, b) z wkraplaniem
Wyparka obrotowa Wirówka obrotowa
<- lejek ze spiekiem
Lejek szklany ->
<- kolba sawkowa
Zlewka ->
Zestaw do saczenia
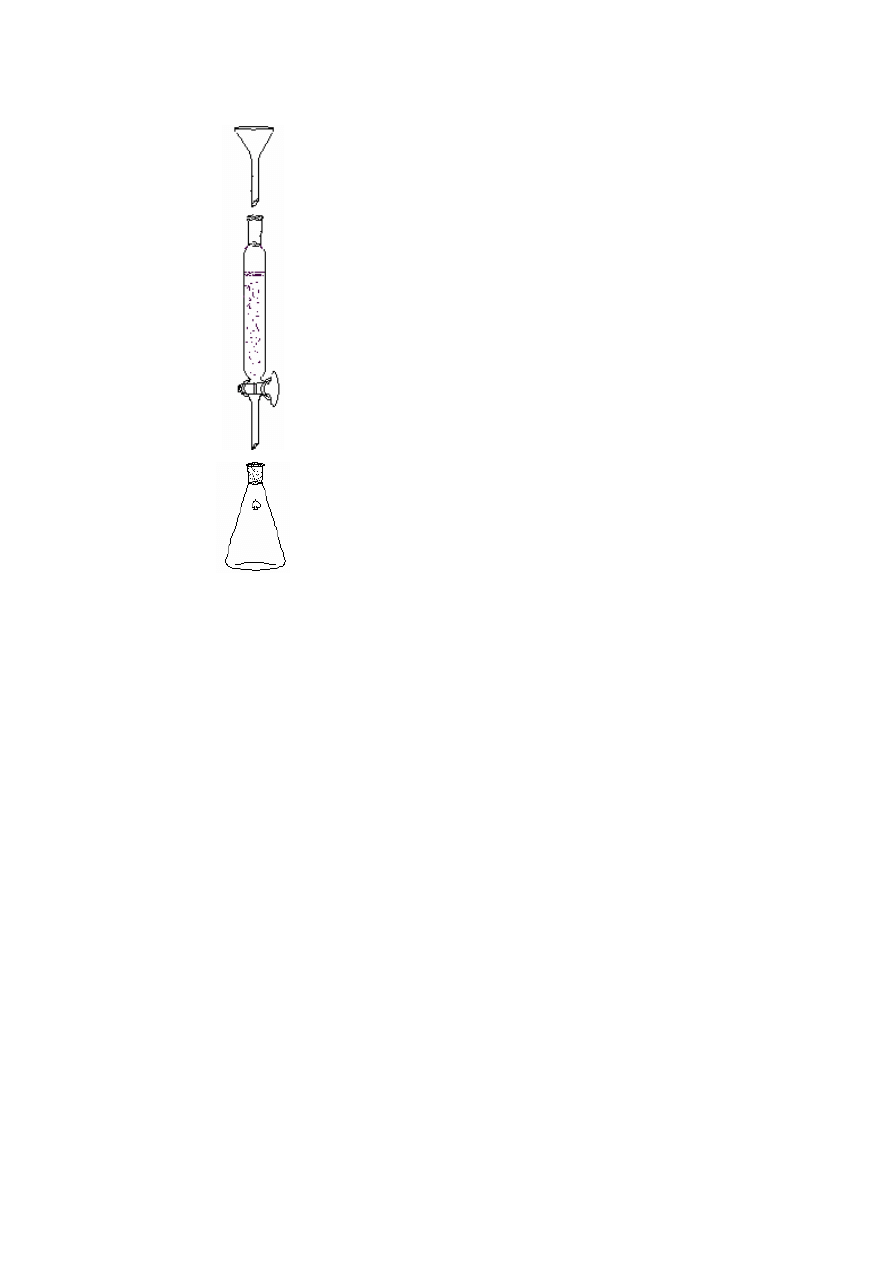
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
6
kolumna
chromatograficzna
wypełniona żelem krzemionkowym
obieralnik
Zestaw do chromatografii kolumnowej
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
7
2.1. RODZAJE DESTYLACJI
Destylacja – metoda rozdzielania ciekłych układów wieloskładnikowych,
wykorzystująca różnice lotności poszczególnych składników. Proces destylacji
polega stopniowym odparowaniu poszczególnych składników począwszy
najbardziej lotnych (w danych warunkach ciśnienia i temperatury), a następnie
jego skropleniu i zebraniu kondensatu (destylatu) w odbieralniku.
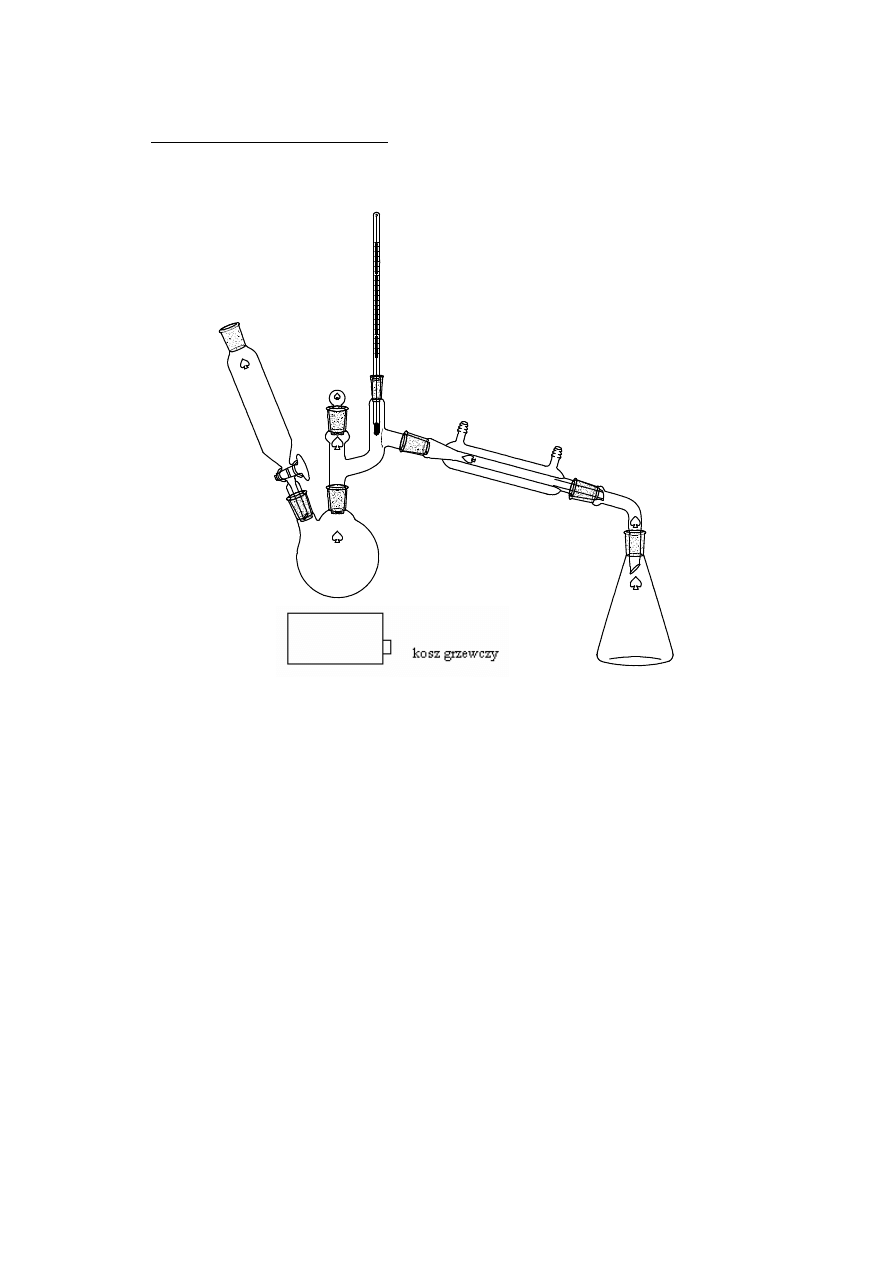
2.1.1. DESTYLACJA PROSTA
termometr
kolba stożkowa
odbiornik frakcji
Destylacja prosta - proces wyodrębnienia substancji polegający na wytworzeniu
par substancji a następnie ich odprowadzeniu, schłodzeniu i odebraniu w
odbieralniku. Zasadą rozdziału składników mieszaniny jest wykorzystanie
różnicy temperatur poszczególnych składników mieszaniny.. Zwykle jest to
proces okresowy i w miarę trwania procesu oddestylowuje się najpierw
składniki nisko wrzące a następnie wyżej wrzące.
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
8
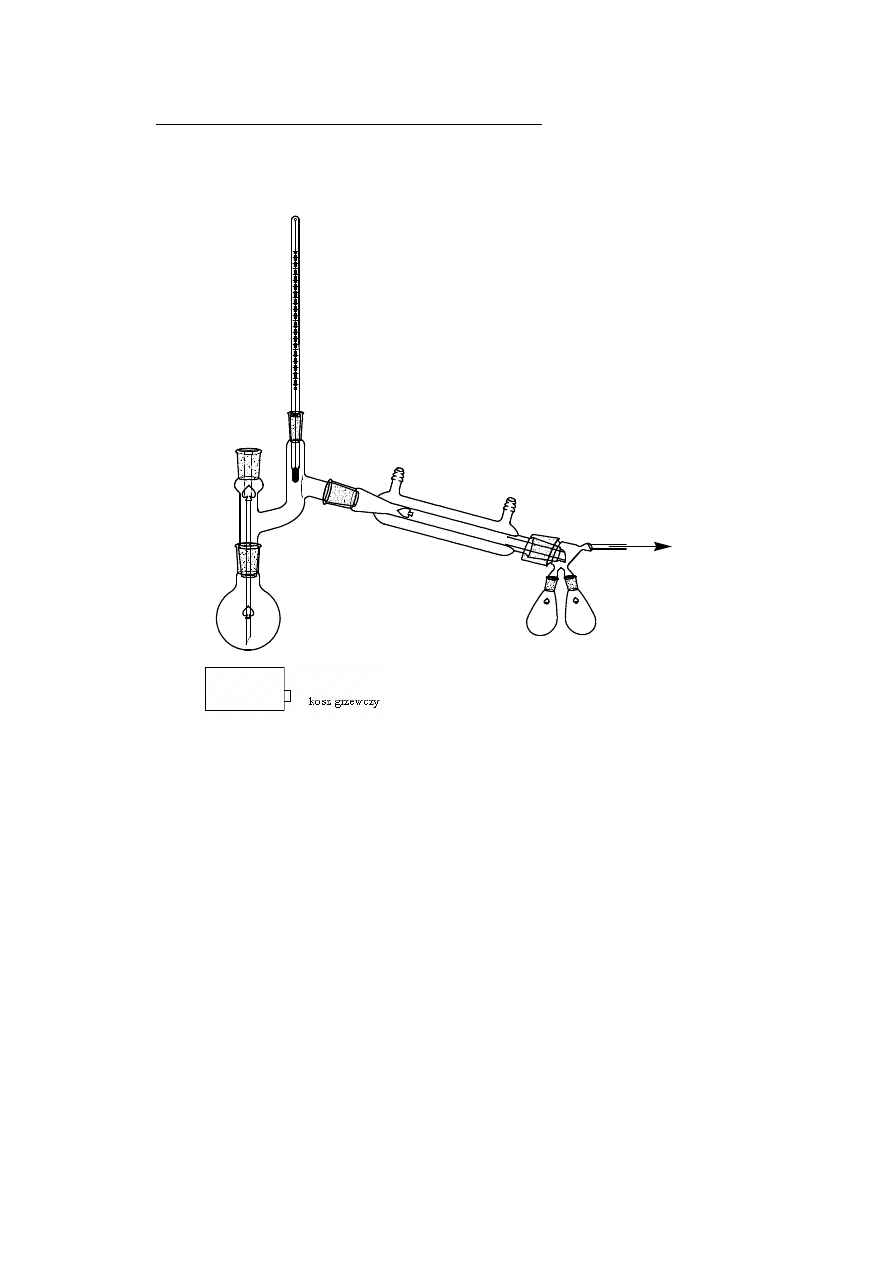
2.1.2 DESTYLACJA Z PARĄ WODNĄ
Destylacja z parą wodną – sposób wydzielania z ciekłej mieszaniny nie
mieszającego się z wodą składnika na drodze destylacji. Polega na
przepuszczeniu przez destylowaną ciecz nasyconej lub przegrzanej pary wodnej.
Ponieważ woda i oddestylowana substancja A nie mieszają się ze sobą, ogólna
prężność par jest sumą prężności cząstkowych p = p
H
2
O
+ p
A
. W rezultacie
temperatura wrzenia takiej mieszaniny jest niższa od temperatury wrzenia
każdego z jej składników pod tym samym ciśnieniem.
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
9
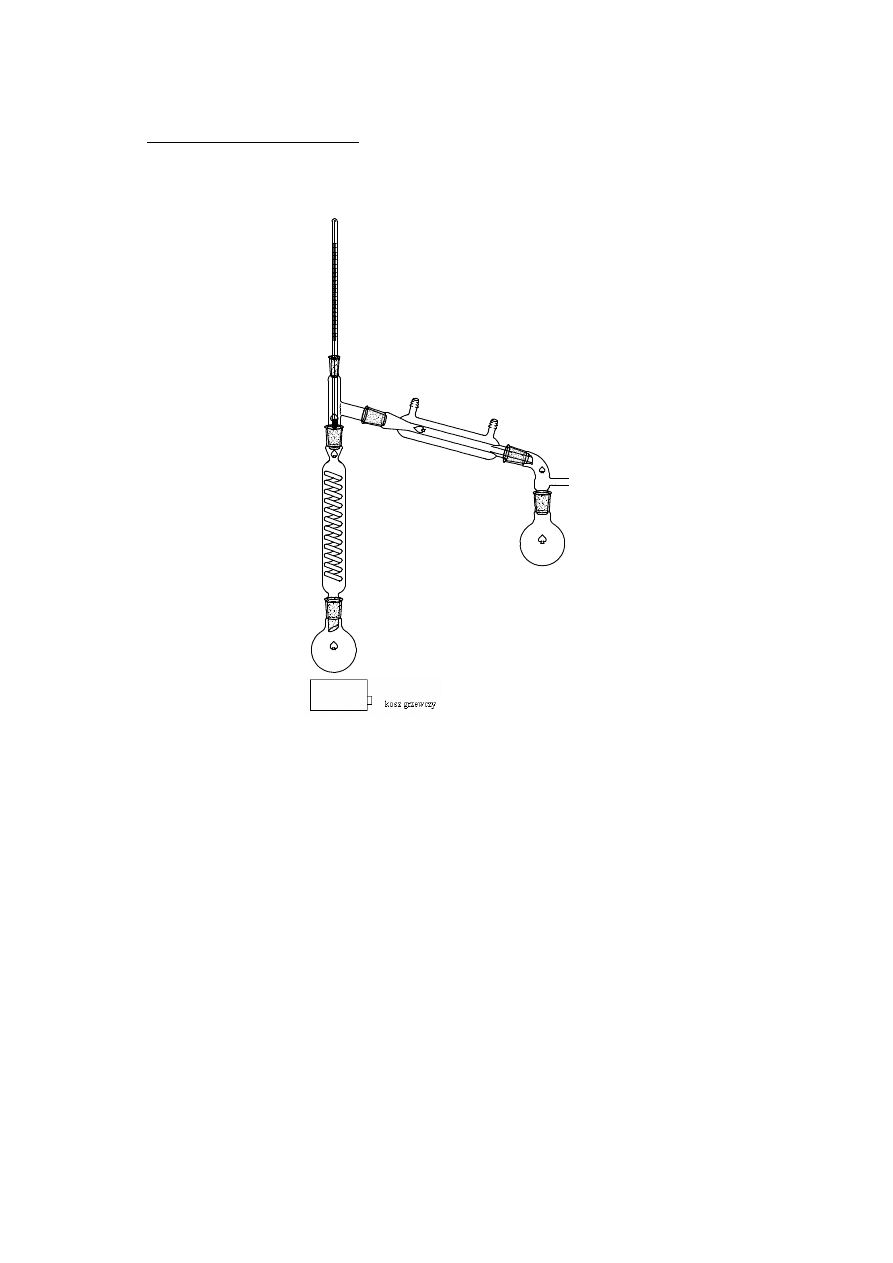
2.1.3 DESTYLACJA FRAKCYJNA
kolumna rektyfikacyjna
Destylacja frakcyjna (rektyfikacja) – proces destylacji lub rektyfikacji, w
którym odbiera się szereg frakcji różniących się składem. W przypadku procesu
okresowego poszczególne frakcje odbiera się kolejno zależnie od zmian
temperatury wrzenia mieszaniny, natomiast w przypadku destylacji frakcyjnej
ciągłej poszczególne frakcje odbiera się na różnych wysokościach kolumny.
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
10
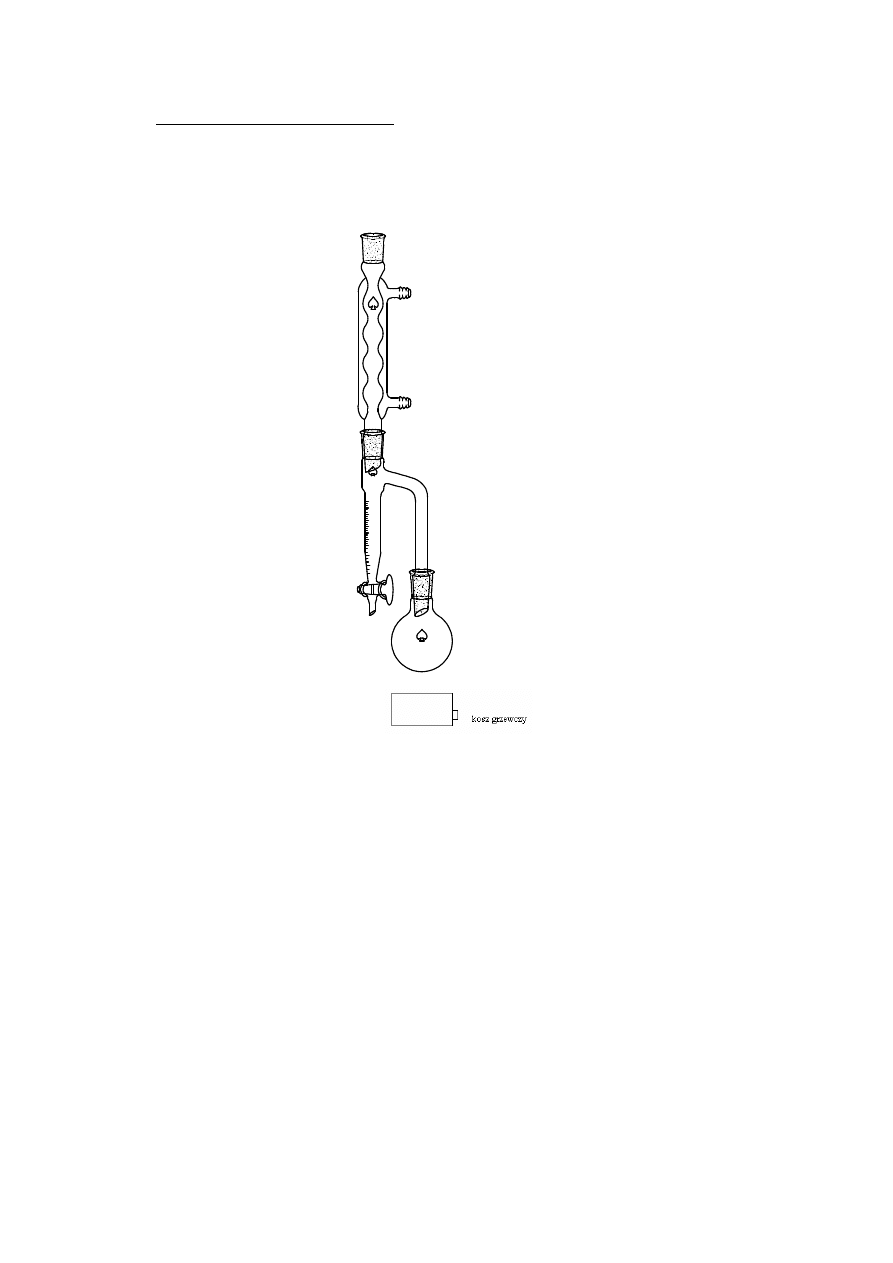
2.1.4. DESTYLACJA AZEOTROPOWA
chłodnica kulkowa
nasadka azeotropowa
Destylacja azeotropowa – metoda rozdzielania mieszaniny azeotropowej lub
mieszaniny składników blisko wrzących polegająca na rozdestylowaniu ich po
uprzednim
wprowadzeniu
dodatkowego
składnika
tzw.
czynnika
azeotropującego, który tworzy z rozdzielanymi substancjami azeotrop
trójskładnikowy wrzący w innej temperaturze i z innym stosunkiem składników
niż mieszanina wyjściowa, np.azeotrop etanol – woda (o zawartości 95,5%
etanolu) można rozdzielić przez dodanie do niego benzenu. Powstaje wówczas
trójskładnikowa mieszanina azeotropowa o składzie 7,5% wody, 18,5% etanolu,
74% benzenu i jej temperatura wrzenia wynosi 64,85
0
C. Po całkowitym
oddestylowaniu takiej mieszaniny pozostałością jest alkohol bezwodny
(absolutny).
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
11
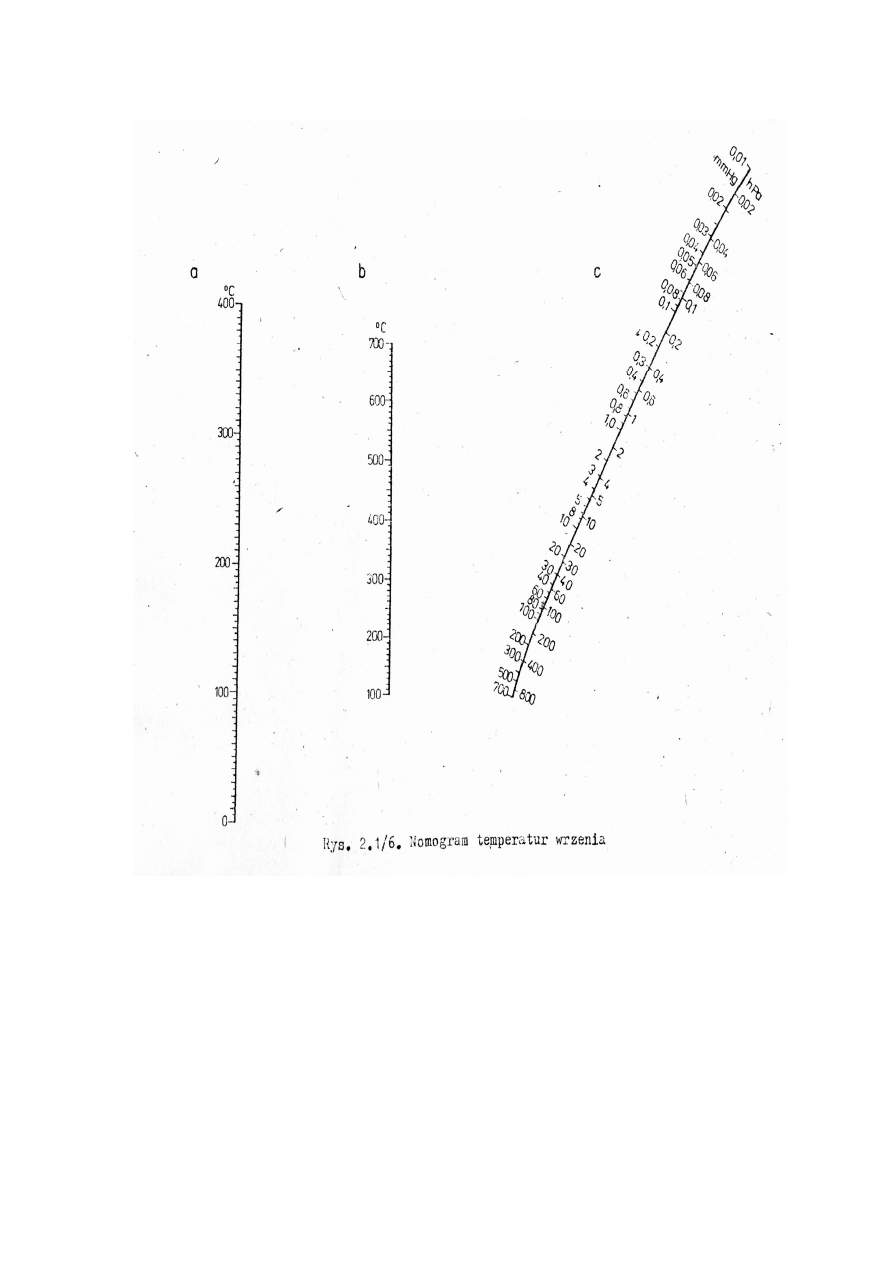
2.1.5. DESTYLACJA POD ZMNIEJSZONYM CIŚNIENIEM
próżnia
Destylacja pod zmniejszonym ciśnieniem – destylacja stosowana do
rozdzielenia cieczy nietrwałych w wyższych temperaturach i rozkładających się
w temperaturze wrzenia pod ciśnieniem normalnym. Podczas destylacji pod
zmniejszonym ciśnieniem ok. 10-20 mm Hg temperatura wrzenia cieczy zostaje
obniżona o ok. 80-100
0
C. Ważnym warunkiem jest stosowanie szczelnej
aparatury, używając smarów próżniowych.
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
12
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
13
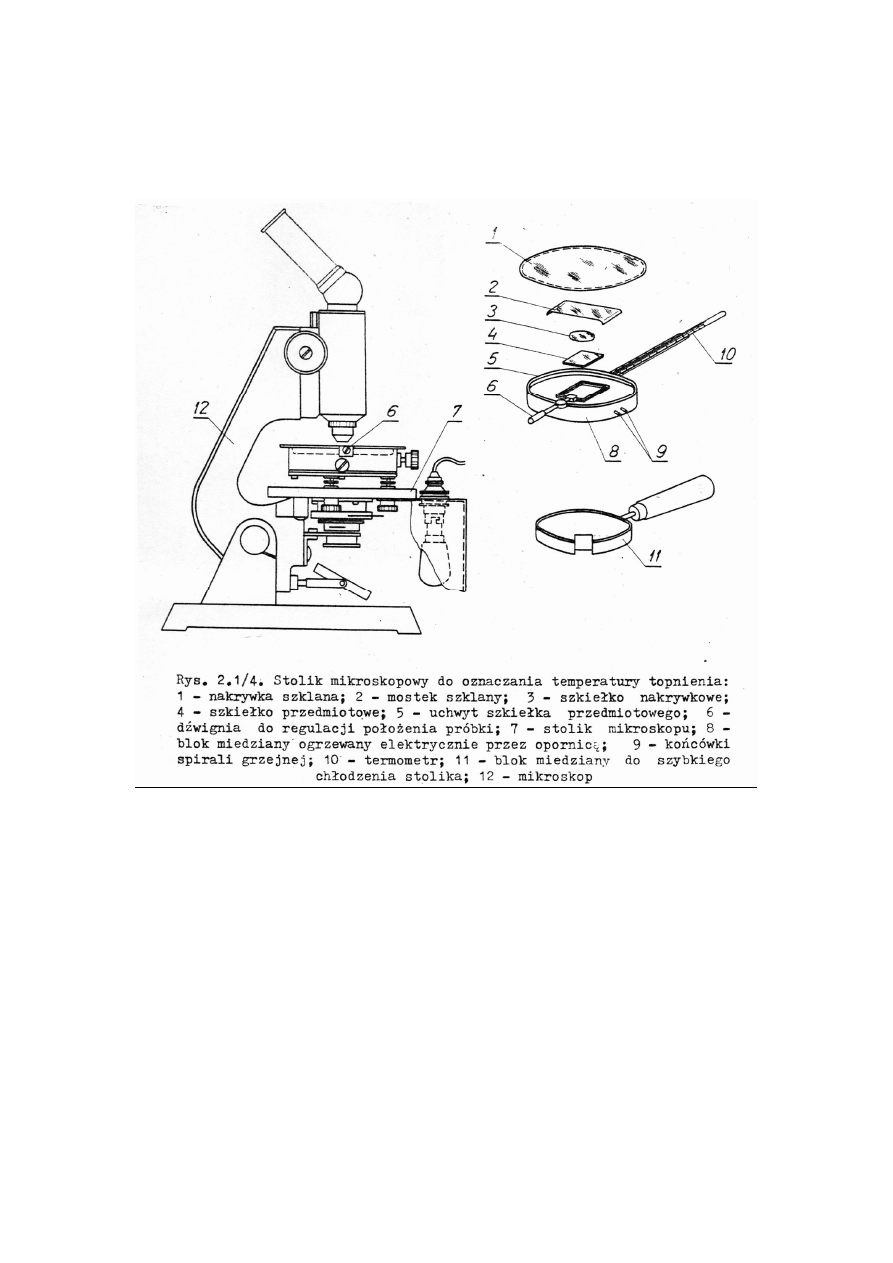
2.2. Aparatura do pomiaru temperatury topnienia
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
14
3. ŚRODKI SUSZĄCE
PRZYKŁADY ŚRODKÓW SUSZĄCYCH
Ś
rodek
osuszający
Stosowany do:
Nie nadaje się do:
Uwagi
P
4
O
10
gazy obojętne i kwaśne,
acetylen, dwusiarczek
węgla, węglowodory,
roztwory kwasów,
chlorowcowęglowodory
(eksykator, pistolet
osuszający)
substancje zasadowe,
alkohole, eter,
HCl, HF
rozpływa się;
podczas suszenia
gazów zmieszać z
substancją stanowiącą
rusztowanie
(wata szklana,
pumeks)
H
2
SO
4
gazy obojętne i kwaśne
(eksykator, płuczka)
związki nienasycone,
alkohole, ketony,
substancje zasadowe,
H
2
S, HJ
nie nadaje się do
suszenia w próżni,
w wysokiej
temperaturze
wapno
sodowane
CaO, BaO
gazy obojętne i
zasadowe,
aminy, alkohole, eter
aldehydy, ketony,
substancje kwaśne
szczególnie dobry do
osuszania gazów
NaOH, KOH
amoniak, aminy, eter,
węglowodory (eksykator)
aldehydy, ketony,
substancje kwaśne
rozpływa się
K
2
CO
3
aceton, aminy
substancje kwaśne
rozpływa się
Na
eter, węglowodory,
aminy trzeciorzędowe
chlorowane
węglowodory
(zagrożenie
wybuchem!),
alkohole i inne
związki
reagujące z sodem
CaCl
2
węglowodory, alkeny,
aceton, eter, gazy
obojętne, HCl (eksykator)
alkohole, aminy,
amoniak
tani,
zanieczyszczenia
zasadowe
Mg(ClO
4
)
2
gazy, amoniak
(eksykator)
łatwo utleniające się
ciecze organiczne
nadaje się szczególnie
do celów
analitycznych
Na
2
SO
4
MgSO
4
estry, roztwory substancji
wrażliwych
sita
molekularne
przepływające gazy
(do 100
0
C),
rozpuszczalniki
organiczne
(eksykator)
węglowodory
nienasycone
żel
krzemionkowy
(eksykator)
HF
pochłania resztki
rozpuszczalnika

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
15
4. PODSTAWY CHROMATOGRAFII
Chromatografia – (gr. chrama – barwa) jest podstawową metoda
wyodrębniania i identyfikacji związków chemicznych w mieszaninie. Ogólnie
opiera się na dwóch "fazach" - ruchomej (roztwór ciekły (chromatografia
cieczowa) lub gazowy (chromatografia gazowa)) i nieruchomej (ciekłej lub
stałej - bibuła filtracyjna, cienka warstwa adsorbentu naniesiona na płytkę,
wypełnienie kolumny). Faza nieruchoma pochłania (absorbuje) dany składnik,
faza ruchoma rozdziela mieszankę. W miarę przesuwania się fazy ruchomej
przez nieruchomą poszczególne składniki są w różnym tempie pochłaniane i
stopniowo rozdzielane. W tym celu wykorzystywana jest:
1.
różnica w zdolności adsorpcyjnej fazy stacjonarnej względem różnych
składników znajdujących się w fazie ruchomej (chromatografia
adsorpcyjna);
2.
różnica wielkości współczynnika podziału składników rozdzielanych
między cieczą umieszczoną na nośniku (w fazie stacjonarnej) a fazą
ruchomą (chromatografia podziałowa);
3.
różnica wielkości cząsteczek separowanych składników (chromatografia
sitowa);
4.
zatrzymywanie
jonów
na
podłożu
jonitowym
(chromatografia
jonowymienna).
Pierwszego
chromatograficznego
rozdziału
mieszaniny
barwników
organicznych dokonał w Warszawie profesor Michaił Cwiet. W oryginalnym
opisie doświadczenia datowanym na 23 kwietnia 1905 r. znajdujemy
informację, że użyto kolumny szklanej wypełnionej sproszkowanym węglanem
wapnia (kredą). Chloroformowy roztwór barwników organicznych, nanoszony
na wierzchołek kolumny, w miarę przechodzenia przez warstwę kredy ulegał
rozdziałowi i poszczególne składniki były widoczne w postaci barwnych stref.
Po wyjęciu słupka kredy z kolumny można było go podzielić i wyodrębnić
poszczególne składniki. Następnie zamiast kredy zaczęto stosować inne,
bardziej efektywne wypełnienia kolumn (adsorbenty), dające lepsze rozdziały
Mimo niewątpliwych zalet, chromatografia kolumnowa była kłopotliwa w
praktyce (nie znano wówczas wydajnych adsorbentów) i dlatego początkowo
stosowano ją w laboratoriach chemicznych.

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
16
Wrócono do niej po latach. Wyciek z kolumny (tzw. eluent) zbierano w
małych porcjach, początkowo ręcznie zmieniając odbieralniki, a później
automatycznie w określonych odstępach czasu. W zebranych porcjach eluentu
różnymi metodami analitycznymi oznaczano zawartość poszczególnych
składników mieszaniny. Na tej podstawie można było wykonać wykres zmian
stężenia interesującego nas w eluencie składnika w funkcji czasu. Im większa
była ilość porcji eluentu, tym wykres był dokładniejszy, ale tym bardziej
wydłużał się całkowity czas oznaczenia, składający się z czasu prowadzenia
chromatografii i czasu analizy składnika. Oczywiście, na czas prowadzenia
chromatografii wpływał także dobór kolumny: jej długość, średnica, rodzaj
wypełnienia i skład cieczy - fazy ruchomej użytej do rozwinięcia
chromatogramu. Jako fazy ruchome stosowano pojedyncze rozpuszczalniki albo
ich mieszaniny w różnych stosunkach objętościowych. Fazy ruchome ułożono w
tak zwany szereg eluotropowy, w zależności od zdolności wymywania
substancji z kolumny. Jako wypełnienia kolumn stosowano najczęściej żele
krzemionkowe lub tlenek glinu w postaci granulek o wymiarach ułamka
milimetra - np. 0,1 mm. W preparatyce organicznej opisywaną powyżej technikę
chromatografii stosuje się do dzisiaj. Powodem renesansu chromatografii
kolumnowej jest fakt, że pozwala ona na efektywny rozdział mieszanin
reakcyjnych i uzyskanie czystych składników w ilościach gramowych.

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
17
Chromatografia bibułowa. Szukając sposobów upraszczania i
przyspieszania rozdziałów chromatograficznych, kolumnę zastąpiono bibułą. Na
pasek bibuły nanosi się mikrostrzykawką plamkę (o średnicy do 2mm) roztworu
rozdzielanej mieszaniny. Koniec paska z naniesioną plamką zanurza się w
zamkniętym naczyniu w takiej ilości fazy ruchomej, aby plamka była nad jej
powierzchnia. Faza ruchoma, podobnie jak w chromatografii kolumnowej, może
składać się z jednego rozpuszczalnika lub być ich mieszaniną. Fazę ruchomą
często określa się mianem układu rozwijającego. Ciecz wznosząc się w bibule
do góry (jest to przykład występowania efektu kapilarnego - bibułę można
rozpatrywać jako zbiór kapilar), zabiera ze sobą składniki mieszaniny, z których
jedne wędrują szybciej, inne wolniej. Różnice w szybkości migracji
poszczególnych składników mieszaniny wynikają z ich odmiennego
oddziaływania z fazą stacjonarną (bibuła). W wyniku występowania efektu
kapilarnego i różnic w oddziaływaniu z fazą stacjonarną, następuje rozdział
mieszaniny i otrzymuje się chromatogram w postaci plamek. Jest to
chromatografia bibułowa wstępująca. Niekiedy stosuje się chromatografię
zstępującą, w której faza ruchoma migruje w bibule do dołu.
Dla danego składnika mieszaniny na tej samej fazie stacjonarnej i w tym samym
układzie rozwijającym, stosunek odległości plamki od punktu startu (a) do
odległości czoła układu rozwijającego (b) określony jest jako: R
f
= a/b
Współczynnik R
f
jest wielkością stałą, charakterystyczną dla danej substancji
organicznej i może posłużyć do jej identyfikacji. Przy analizie mieszanin
zawierających składniki barwne, plamki odpowiadające poszczególnym
związkom chemicznym wchodzącym w skład mieszaniny można zlokalizować
wzrokiem. Gdy plamki nie są barwne (w skład mieszaniny wchodziły związki
bezbarwne), dąży się do ich wizualizacji. Do "wywoływania" chromatogramów
stosuje się pary jodu, pary bromu, roztwór waniliny w kwasie solnym i wiele
innych odczynników w zależności od rodzaju rozdzielanych substancji. Istotą
procesu "wywoływania" chromatogramu są reakcje barwne zachodzące
pomiędzy wyodrębnionymi składnikami (lub tylko jednym z wyodrębnionych
składników) i odczynnikiem użytym do wizualizacji plamek. W przypadku
rozdziału mieszanin substancji "znakowanych" izotopami radioaktywnymi, do
bibuły przykłada się kliszę fotograficzną, na której po wywołaniu otrzymuje się
obraz rozdzielonych składników mieszaniny. Wielkość i zaczernienie plamki,
pozwala również na ilościową ocenę zawartości składnika w mieszaninie.
Jakość rozdziału bardzo zależy od rodzaju użytej bibuły. "Zwykła" bibuła nie
jest najlepszym podłożem do chromatografii, w tym celu produkowane są
specjalne rodzaje bibuły.
Chromatografia cienkowarstwowa. Udoskonaleniem chromatografii
bibułowej jest chromatografia cienkowarstwowa. Zamiast bibuły stosuje się
płytkę szklaną lub folię aluminiową pokrytą warstwą żelu krzemionkowego,
tlenku glinu lub celulozy.

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
18
Do celów analitycznych stosuje się grubości warstw rzędu 0,15 mm.
Chromatografia cienkowarstwowa ma pewne zalety w stosunku do bibułowej.
Rozwijanie chromatogramu jest zwykle szybsze, plamki są mniej rozmyte niż na
bibule i można wykrywać mniejsze ilości substancji. Nanoszenie plamek,
rozwijanie chromatogramu, wywoływanie i ilościowe oznaczanie zawartości
poszczególnych składników wykonuje się podobnie jak w przypadku
chromatografii bibułowej. Chromatografia cienkowarstwowa znalazła również
zastosowanie w preparatyce. W tym celu rozdział mieszaniny prowadzi się na
płytkach o grubszej warstwie adsorbentu - na przykład 3mm. Rozdzielaną
mieszaninę nanosi się nie punktowo, ale w linii na długości kilkunastu
centymetrów. Po rozdziale warstwę adsorbentu zawierającą wyodrębniony
składnik mieszaniny się zeskrobuje, a sam składnik ekstrahuje się (wypłukuje)
rozpuszczalnikiem i po zatężeniu oraz odsączeniu adsorbentu otrzymuje w
stanie czystym.
W ostatnich latach opracowano nowy sposób rozwijania chromatogramów
na cienkich warstwach w pozycji poziomej. Sposób ten wymaga mniejszej ilości
układu rozwijającego i umożliwia wielokrotne użycie płytek.
Jest wiele innych rodzajów chromatografii, np. gazowa czy
wysokosprawna chromatografia cieczowa.
Chromatografia gazowa. GC – (gas chromatography) - Do rozdzielania
zarówno cieczy jak i gazów stosuje się chromatografię gazową. Warstwę
nieruchomą nanosi się na cienką warstwę glinki lub szkła i umieszcza w
stalowej rurze. Mieszaninę gazu przepycha się przez rurę za pomocą obojętnego
gazu np. azotu. Detektory mierzą i rejestrują pojawiające się frakcje.
Kolumna chromatograficzna ma postać długiej i cienkiej rurki (stalowej,
kwarcowej lub szklanej), zwiniętej w zwój. W kolumnie kapilarnej faza
stacjonarna tworzy cienką warstwę na wewnętrznej powierzchni ścianek.
Kolumna jest umieszczona w termostatowanym piecu, wyposażonym w
programator
temperatury.
W
chromatografii
gazowej
najczęściej
wykorzystywane są detektory przewodnictwa cieplnego (TCD, HWD),
detektory płomieniowo-jonizacyjne (FID), detektory wychwytu elektronów
(ECD) oraz detektory masowe (MSD);
Wysokosprawna chromatografia cieczowa. HPLC – (High Performance
Liquid Chromatography). Jest ona uniwersalną metodą analityczną, stosowaną

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
19
głównie do analiz złożonych próbek, zwłaszcza zawierających nielotne,
wielkocząsteczkowe
związki
chemiczne,
w
szczególności
substancje
biologiczne czynne. Podczas analizy związków o bardzo niskim dopuszczalnym
stężeniu, takich jak aminy biogeniczne, węglowodory poliaromatyczne,
hormony czy toksyny, czułość jest najważniejsza, ponieważ przygotowanie
prawidłowych próbek jest niezwykle żmudną procedurą. Metoda HPLC
wykorzystuje efekt rozdziału chromatograficznego z użyciem cieczy jako fazy
ruchomej. Skład fazy ciekłej i rodzaj fazy stacjonarnej jest uzależniony od
składu badanych próbek oraz typu oddziaływań wykorzystywanych do
osiągnięcia separacji ich składników. Charakteryzuje się wysoka sprawnością,
dobrą rozdzielczością, dużą szybkością procesu. Te korzystne parametry
współczesnej chromatografii cieczowej (HPLC) osiągnięto dzięki instrumentacji
metody i wprowadzeniu nowych faz stacjonarnych. Współczesna HPLC,
wprowadzona w 1960 r. okazała się najbardziej prężnie rozwijającą się techniką
chromatograficzną i znalazła szerokie zastosowanie w analizie preparatów
farmaceutycznych, analizie biochemicznej, klinicznej i środowiskowej.
Analizę mieszanin techniką HPLC wykonujemy przy użyciu chromatografów
cieczowych. W urządzeniach tych fazę ruchomą ze zbiornika (lub zbiorników)
pompuje się (po filtracji i odgazowaniu)przez kolumnę chromatograficzną.
Analizowaną próbkę wstrzykuje się na szczyt kolumny. Składniki próbki
rozdzielają się w kolumnie i na wyjściu z niej są wykrywane przez detektor.
Sygnał detektora jest zapisywany na taśmie rejestratora oraz (lub) mierzony
integratorem i przekazywany w postaci zapisu cyfrowego. Jest też komputerowa
obróbka danych.
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
20
5. Wyodrębnianie, oznaczanie i identyfikowan
5. Wyodrębnianie, oznaczanie i identyfikowan
5. Wyodrębnianie, oznaczanie i identyfikowan
5. Wyodrębnianie, oznaczanie i identyfikowanie
ie
ie
ie
produktów naturalnych
produktów naturalnych
produktów naturalnych
produktów naturalnych
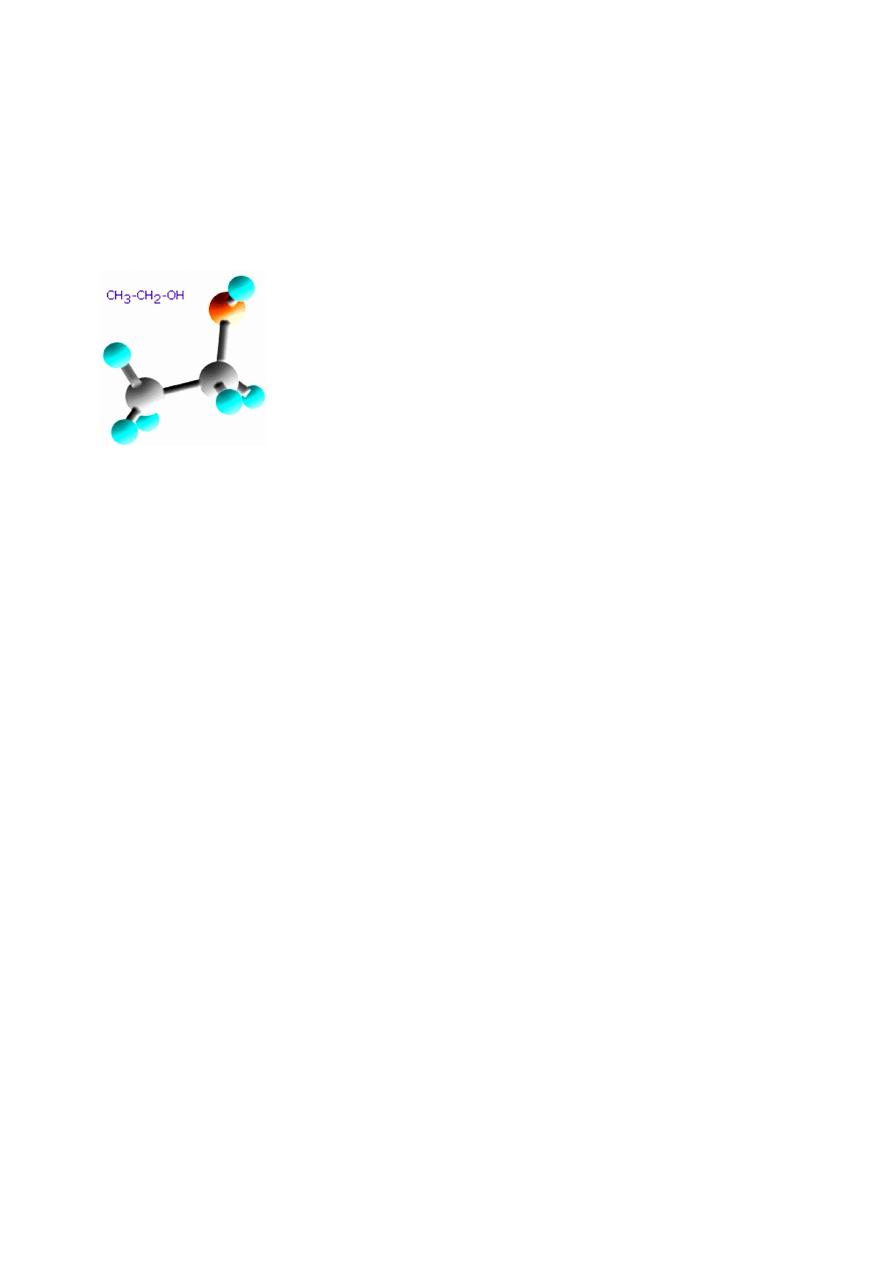
5.1. Ćwiczenie 1. Fermentacja alkoholowa.
1. Wprowadzenie
ALKOHOL ETYLOWY
Słowo alkohol pochodzi najprawdopodobniej od któregoś z
dwóch słów arabskich: al-kuhl (antymon, delikatny, drobny proszek)
lub al-ghoul (zły duch). Nie sposób jest dzisiaj ustalić co było
pierwsze. Znalezione w piaskach Pustyni Sumeryjskiej tabliczki
piktograficzne wspominają o konsumpcji "chmielowego soku", który
był, obok chleba, podstawowym artykułem spożywczym na terenie
Mezopotamii. Uprawę winorośli (a zatem również tłoczenie wina) zapoczątkowano
prawdopodobnie w Azji Środkowej około 6000 lat p.n.e. Nieco później pojawiła się ona w
Mezopotamii, Fenicji i w Egipcie. O winie i piwie wspominają, zarówno znalezione w
Mezopotamii, a pochodzące z ok. 5000 r. p.n.e., teksty pisma klinowego, jak i egipskie
papirusy pochodzące z ok. 3500 r. p.n.e. Warzenie piwa było dość powszechne w
starożytnym Egipcie i zyskało rangę podstawowego napitku mieszkańców tego kraju.
Jednocześnie dbające o swój wygląd Egipcjanki i Egipcjanie stosowali okłady z piany do
odświeżania skóry. Wiadomo też, że wino było popularne na Krecie, a mniej więcej 2400 lat
p.n.e. król Krety wprowadził podatek od produkcji tego trunku. Z kolei, w Babilońskim
Kodeksie Hammurabiego (ok. 1800 r. p.n.e.) można przeczytać, że: "... wszyscy, którzy będą
fałszowali piwo i nie będą przestrzegali reguł jego sprzedaży, będą skazani na śmierć przez
utopienie ... jeżeli kapłanka, która nie mieszka w domu niewiast poświęconych, otworzy
winiarnię albo do niej wstąpi, to się ją spali". W Chinach piwo wytwarzano z ryżu ok. 4000
lat p.n.e. Z innych przekazów historycznych wiadomo, że 1000 lat p.n.e. winorośl uprawiano
już w południowej Grecji i Italii, a ok. IV wieku n.e. trafiła ona do Europy zachodniej i
środkowo-wschodniej. Starożytni Grecy wprowadzenie uprawy winorośli przypisywali
bogowi Dionizosowi. Egipskim bóstwem wina był Ozyrys, a rzymskim - Bachus. W Europie
czysty alkohol pojawił się w VIII w. n.e. W drugiej połowie XIII wieku francuski profesor
Arnold de Villanowa zastosował, po raz pierwszy w medycynie, alkohol jako środek
przeciwrobaczy, przeciwbólowy oraz zapobiegający nudnościom i wymiotom podczas
kołysania statku na morzu.
Działanie: Alkohol etylowy działa oszałamiająco i toksycznie. Dawka
śmiertelna wynosi 5 - 10 g/kg masy ciała. Długotrwałe nadużywanie alkoholu
prowadzi do marskości i raka wątroby. W niewielkich ilościach poprawia apetyt
i samopoczucie.
Zastosowanie:
Używany jest również jako środek dezynfekujący oraz do
produkcji leków m. in. syropów, a także do produktów kosmetycznych.
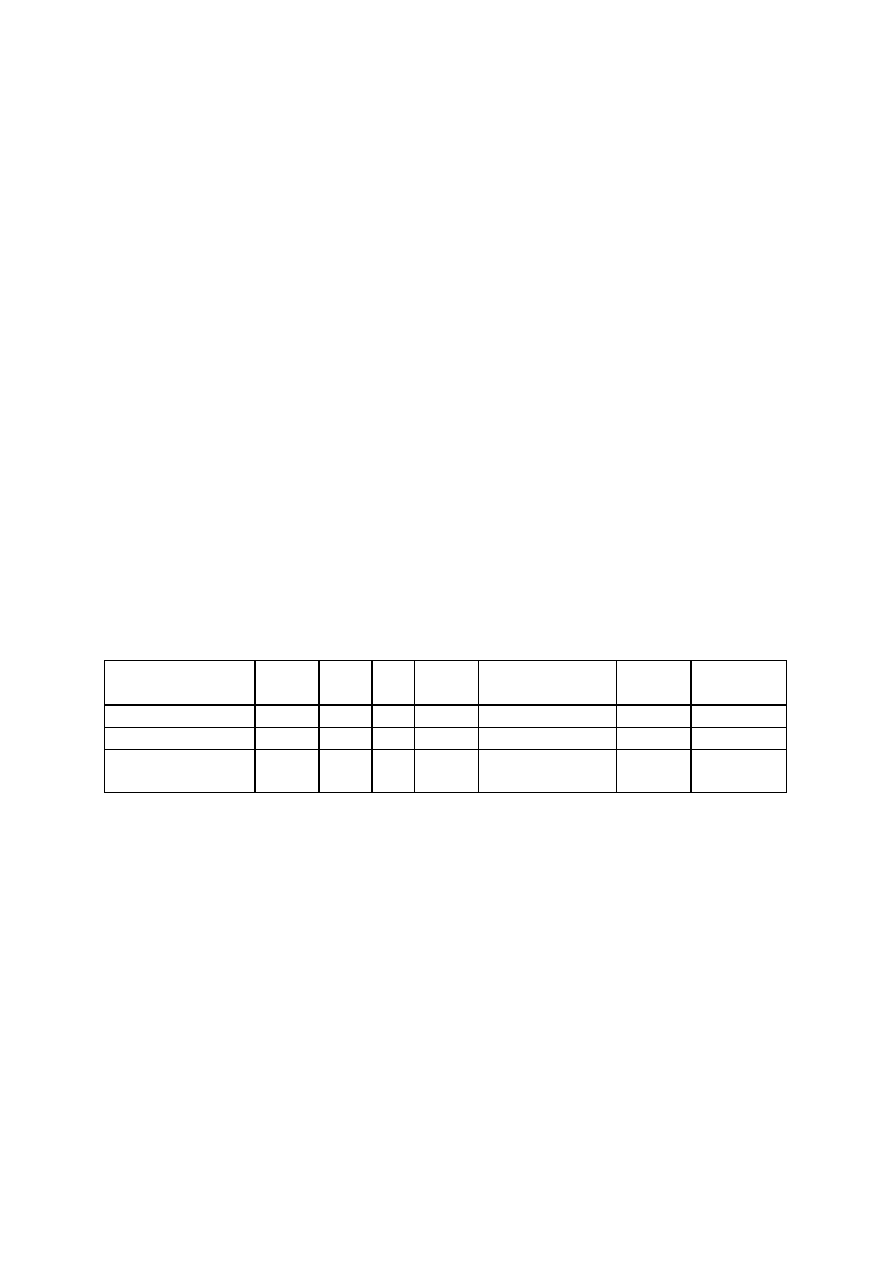
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
21
Fermentacja alkoholowa: Jednym najważniejszych źródeł otrzymywania
alkoholi monohydroksylowych jest fermentacja alkoholowa produktów
naturalnych. Proces fermentacji cukrów i skrobi do wytwarzania napojów
zawierających alkohol stosowano od najdawniejszych czasów. Proces ten
polega
na
biologicznym
utlenianiu
węglowodanów
przez
wysoko
wyspecjalizowane szczepy drożdży, prowadzącym do żądanych produktów
końcowych. Pierwszym etapem syntezy jest dekarboksylacja pirogronianu, w
wyniku której powstaje acetaldehyd i dwutlenek węgla. Redukcja acetaldehydu
daje etanol i regeneruje NAD+.
2. Wykonanie ćwiczenia:
Odczynniki i materiały
sacharoza (cukier)
drożdże piekarskie
węgiel aktywny
wodorofosforan sodu
mleko wapienne
U-rurka (manometr)
Właściwości fizykochemiczne substancji użytych:
Substancja
Mcz.
T.t.
[ºC]
T.w.
[ºC]
D
20
/D
Rozpuszczalność
w H
2
O
Barwa
Zapach
Sacharoza
342,30 170
-
-
rozpuszczalna
biała
bezwonna
Węgiel aktywny
12,01
-
-
1,8-2,1 nierozpuszczalny czarny
bezwonny
Wodorofosforan
sodu
141,96 250
-
-
słabo
rozpuszczalny
biały
bezwonny
W kolbie okrągłodennej (lub stożkowej) o pojemności 500 ml
umieszczono 3g drożdży, 0,35g wodorofosforanu sodu, 50 ml wody
destylowanej i dokładnie wymieszano. Do kolby dodano roztwór 51,5 g
sacharozy (można dodać cukier) w 150 ml wody, wytrząśnięto w celu
całkowitego wymieszania obu roztworów. Kolbę zamknięto korkiem z rurką,
której koniec zanurzono w probówce wypełnionej mlekiem wapiennym.
Mieszaninę pozostawiono na dwa tygodnie w temperaturze pokojowej. Po
dwóch tygodniach dodano 10 g węgla aktywnego, filtrat oddzielono od osadu na
lejku Buchnera (lub lejku ze spiekiem). Filtrat destylowano w układzie do
destylacji frakcjonowanej, czysty etanol zbierano w temperaturze 79 C.
Apararatura:
zestaw do destylacji frakcjonowanej, zlewka (250ml), kolba stożkowa (500ml),
lejek ze spiekiem.

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
22
5.2. Ćwiczenie 2. Eugenol z olejku z goździków
1. Wprowadzenie
Do Europy goździk trafił dopiero około XI wieku, mimo że
najstarsze zapiski o nim znajdują się w chińskich księgach
pochodzących z początku naszej ery. Goździki, jak wiele
innych
egzotycznych
przypraw
pod
portugalskim
i
holenderskim
panowaniem,
podlegały
rygorystycznym
ograniczeniom uprawy. Holendrzy, aby utrzymać wysoką cenę
na rynku i za wszelką cenę obniżyć ich podaż, organizowali niszczycielskie ekspedycje, na
wyspy gdzie znajdowały się nielegalne uprawy. Chociaż za wywóz goździków groziła kara
śmierci, francuski gubernator Pierre Poivre zorganizował wyprawę, żeby wykraść sadzonki
goździkowca korzennego. Miało to miejsce w XVIII wieku, i tylko dwa ze zdobytych w ten
sposób drzew zakwitły na Mauritiusie. Sukcesem zakończyło się natomiast zasadzenie drzew
na wyspach Zanzibar, Pemba i Madagaskar. Sułtan Zanzibaru zarządził, że każdy kto posiada
kawałek ziemi zobowiązany jest uprawiać drzewo goździkowe. Za niewypełnienie rozkazu
karano wywłaszczeniem. Zgodnie z tanzańskim prawem za przemyt goździków z Zanzibaru i
Pemby nadal grozi kara śmierci, a złote goździki zdobią flagę państwową Zanzibaru.
Goździki mają charakterystyczny, bardzo przyjemny korzenny zapach, natomiast w smaku są
piekące. Ale to właśnie ten charakterystyczny smak i aromat sprawiają, że goździki mają
właściwości "odświeżania oddechu", aby pozbyć się nieprzyjemnego zapachu występującego
po zjedzeniu czosnku, należy rozgryźć kilka goździków. Tę właściwość goździków znali już
starożytni Chińczycy: na dworze cesarza panował zwyczaj, że zwracający się do niego
dworzanie musieli trzymać w ustach kilka goździków, aby ich oddech zachowywał świeżość.
Można je również użyć do odświeżenia powietrza - w tym celu należy gęsto powbijać
goździki w pomarańczę i położyć np. na Wielkanocnym stole - świąteczna atmosfera i
przyjemny zapach gwarantowane. Można też powiesić w szafie a ubrania będą przesiąknięte
delikatnym i przyjemnym aromatem.
Olejek goździkowy Oleum Caryophylli jest otrzymywany z goździkowca
korzennego Eugenia caryophyllata Thunberg (Myrtaceae).
Działanie:
rozkurczowe,
odświeżające,
odwaniające,
znieczulające,
przeciwświądowe, ściągające, odkażające na układ pokarmowy, układ
żółciowy, układ oddechowy i drogi moczowe, przeciwkaszlowe, pobudzające
wydzielanie soków trawiennych.
Zastosowanie: na skórę i błony śluzowe najpierw powoduje rozgrzanie, a
następnie znieczulenie. Niszczy bakterie, wirusy, grzyby, roztocze i
pierwotniaki. Olejku tego używa się szeroko w perfumerii i dentystyce.
Skład chemiczny: eugenol (ok. 85-90%), octan eugenolu, alfa-kariofilen, beta-
kariofilen, salicylan metylu.
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
23
OH
OMe
CH
2
OMe
CH
2
O
CH
3
O
EUGENOL OCTAN EUGENOLU
Pozostałe związki wchodzące w skład olejku:
CH
3
C
H
3
CH
3
C
H
3
CH
3
C
H
3
C
H
3
CH
2
OH
O
O
CH
3
α-KARIOFILEN β-KARIOFILEN SALICYLAN METYLU
2. Wykonanie ćwiczenia:
Odczynniki i materiały
goździki chloroform
wodorotlenek sodu eter dietylowy
bezwodny siarczan magnezu jod
zestaw do destylacji z parą wodną
płytki chromatograficzne pokryte żelem
krzemionkowym
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz..
T.t.
[ºC]
T.w.
[ºC]
D
20
/D
Rozpuszczalność
w H
2
O
Barwa
Zapach
Wodorotlenek
sodu
40,00
323
1390 2,130
rozpuszczalny
biały
bezwonny
Siarczan magnezu 120,37
1124
_
2,660
rozpuszczalny
biały
bezwonny
Jod
253,8
113
184
4,930
rozpuszczalny
brunatna
słaby
Chloroform
119,38
-63
61
1,492 nierozpuszczalny
bezbarwn
y
słodki
Eter dietylowy
74
-116,2
34,5 0,708 nierozpuszczalny
bezbarwn
y
słodki

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
24
Goździki ( 30 g) mieli się w moździerzu i otrzymany proszek umieszcza się
w kolbie okrągłodennej o pojemności 500 ml zawierającej 100 ml wody.
Przeprowadza się destylację z parą wodną, ogrzewając również kolbę
(destylacja trwa około 1,5 godz.). Otrzymany destylat ekstrahuje się trzykrotnie
25-mililitrowymi porcjami chloroformu i skład ekstraktów bada się za pomocą
chromatografii cienkowarstwowej (nośnik: żel krzemionkowy; eluent:
chloroform – eter dietylowy 3:1; wywoływacz: pary jodu lub lampa UV-VIS).
W celu rozdzielenia eugenolu od acetyloeugenolu połączone ekstrakty
chloroformowe ekstrahuje się trzykrotnie 25-mililitrowymi porcjami 5-
procentowego roztworu wodorotlenku sodowego. Warstwa chloroformowa
zawiera głównie acetyloeugenol. Suszy się ją nad siarczanem magnezu, usuwa
środek suszący przez sączenie i odparowanie chloroformu. Otrzymany surowy
acetyloeugenol analizuje się spektrofotometrycznie.
Połączone ekstrakty zasadowe zakwasza się do pH 1 i trzykrotnie
ekstrahuje 25-mililitrowymi porcjami chloroformu. Po wysuszeniu nad
siarczanem magnezu i usunięciu chloroformu na wyparce obrotowej otrzymuje
się prawie czysty eugenol. Produkt charakteryzuje się za pomocą technik
spektroskopowych. Bada się temperaturę topnienia.
Aparatura:
zestaw do destylacji z parą wodną, rozdzielacz, wyparka obrotowa, aparatura do
pomiaru temperatury topnienia.

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
25
5.3. Ćwiczenie 3. Wydzielanie anetolu z anyżku.
1. Wprowadzenie
ANYśEK (Anisi vulgaris)
Aromatyczne nasiona baldaszkowatego Pimpinella
anisum, pochodzącego z Egiptu, używane są jako
składnik kadzideł lub, wraz z korzeniem kosaćca
florenckiego wkłada się je do woreczków z ziołami, by
udzieliły swojego zapachu osobie lub buduarowi.
Anyżek był jedną z głównych przypraw stosowanych w
Starożytnym
Rzymie,
podawano
tam
bogato
przyprawiane ciasta, które dały początek naszym tortom
weselnym. Wraz z olejkiem piołunu i innych ziół
anyżek jest składnikiem absyntu, alkoholu, który stał się muzą dziewiętnastowiecznych
poetów i malarzy.
Olejek anyżowy Oleum Anisi jest otrzymywany z owoców (zawartość od 1,5-
2,5%) biedrzeńca anyżu Pimpinella anisum przez destylację z parą wodną.
Działanie: preparaty anyżowe stosuje się w przeziębieniach, chorobach
zakaźnych z objawami nieżytu układu oddechowego, we wzdęciach i kaszlu.
Zastosowanie: Olejek anyżowy podany doustnie dobrze wchłania się z jelita
cienkiego do krwi. Wydalany jest głównie przez płuca. Zwiększa ilość
wydzieliny śluzowej w drogach oddechowych i ułatwia jej wydalanie. Drażniąc
lekko zakończenia nerwowe w nabłonku dróg oddechowych wyzwala odruch
wykrztuśny; upłynnia zalegająca wydzielinę, działa rozkurczowo na mięśnie
gładkie układu oddechowego i pokarmowego. Wzmaga wytwarzanie soków
żołądkowych,
wykazuje
silne
właściwości
przeciwbakteryjne,
przeciwwirusowe, przeciwgrzybicze.
Skład chemiczny:
Zawiera 80-90 % anetolu, kwas anyżowy, keton anyżowy i
metylochawikol (10%).
O
ANETOL
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
26
Reakcja odwracalna bromowania anetolu:
O
Br
2
Zn / CH
3
COOH
O
Br
Br
ANETOL 1,2-dibromo-1-
(p-metoksyfenylo)propan
2. Wykonanie ćwiczenia:
Odczynniki i materiały
anyżek
chloroform
n-pentan
brom
eter dietylowy
roztwór chlorku sodu
kwas octowy
pył cynkowy
wodorotlenek sodu
bezwodny siarczan magnezu
zestaw do destylacji z parą wodną
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
D20/D
Rozpuszczalność
w H
2
O
Barwa
Zapach
n-pentan
72,15 -129,7 36,1
0,630 nierozpuszczalny bezbarwny
benzyny
Eter dietylowy
74
-116,2 34,5
0,708 nierozpuszczalny bezbarwny
słodki
Kwas octowy
r-ru
-10
101
1,035
rozpuszczalny
bezbarwny
ostry
Chloroform
119,38
-63
61
1,492 nierozpuszczalny bezbarwny
słodki
Wodorotlenek
sodu
40,00
323
1390 2,130
rozpuszczalny
biały
bezwonny
Brom
159,81 -7,2
58,8
rozpuszczalny
czerwono-
brązowa
gryzący
Chlorek sodu
58,44
801
1461 2,170
rozpuszczalny
bezbarwny bezwonny
Siarczan
magnezu
120,37 1124
_
2,660
rozpuszczalny
biały
bezwonny
Pył cynkowy
65,37
420
908
7,140 nierozpuszczalny
szary
bezwonny

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
27
15 g zmielonego anyżku umieszcza się w kolbie o pojemności 500 ml,
zawierającej 100 ml wody i przeprowadza destylację z parą wodną. Destylat
ekstrahuje się trzema 25-mililitrowymi porcjami chloroformu i z połączonych
ekstraktów usuwa chloroform na wyparce obrotowej.
0.7 ml surowego anetolu rozpuszcza się w 1 ml n-pentanu, oziębia na
łaźni lodowo-wodnej i wkrapla 10% roztwór bromu w pentanie tak długo aż nie
zabarwi się na różowo. Wówczas roztwór zatęża się do objętości 1 ml, przenosi
do czystej probówki, oziębia i pociera bagietką ścianki probówki w celu
zapoczątkowania krystalizacji. Powstały dibromek przesącza i krystalizuje z
pentanu.
Otrzymany dibromek umieszcza się w kolbie stożkowej o pojemności
100ml, dodając 40 ml eteru dietylowego, 10 ml kwasu octowego i 0.4 g pyłu
cynkowego. Po dokładnym wymieszaniu reagentów obserwuje się wytrącanie
octanu cynku. Mieszanie kontynuuje się jeszcze przez 15 minut, a następnie
dodaje kroplami wodę, aż do całkowitego rozpuszczenia osadu. Otrzymany
roztwór dekantuje się znad cynku, przenosi do rozdzielacza i odbiera warstwę
eterową. Warstwę tę ekstrahuje się dwukrotnie 20-mililitrowymi porcjami wody,
raz 20-mililitrową porcją 10-procentowego roztworu wodorotlenku sodu i 30 ml
solanki. Fazę organiczną suszy się nad bezwodnym siarczanem magnezu, usuwa
eter na wyparce obrotowej.
Aparatura:
zestaw do destylacji z parą wodną, rozdzielacz, wyparka obrotowa.
5.4. Ćwiczenie 4. Limonen ze skórki owoców cytrusowych
1.
Wprowadzenie
POMARAŃCZA SŁODKA (Citrus sinensis)
Już ponad trzy tysiące lat temu pomarańcze były uprawiane
na terenach północno-wschodnich Indii i południowo
zachodnich
Chin.
Do
tej
pory
nie
rozstrzygnięto
definitywnie, skąd pochodzą pomarańcze. Przez całe stulecia
owoce
pomarańczy
skutecznie
zaspokajały
potrzeby
estetyczne, kulinarne i medyczne kolejnych cesarzy i maharajów. Dopiero w drugiej połowie
XV wieku podróżujący kupcy portugalscy przywieźli pomarańcze w rejony basenu Morza
Śródziemnego. I tak zaczęła się ich europejska kariera. Po starym lądzie przyszła kolej na
podbój nowych kolonii: razem z Krzysztofem Kolumbem pomarańcza dotarła w roku 1493 na
skrawku nowego lądu, dziś zwanego Haiti, a stamtąd rozprzestrzeniała się na obszarze
Ameryki Północnej. W obecnej chwili najwięcej serca i czasu poświęca się pielęgnacji i
uprawie "złotych jabłek" w Hiszpanii, zaś za oceanem "pomarańczowe Eldorado" to przede
wszystkim Brazylia, Stany Zjednoczone i Meksyk.
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
28
Działanie: Badania laboratoryjne wykazały, że pomarańcze, dzięki zawartym w
nich terpenom, podobnie jak naturalne antybiotyki działają bakteriobójczo, a
zawarty w nich D-limonen posiada również właściwości przeciwnowotworowe.
Z kolei witamina P pozytywnie wpływa na porost i wzmocnienie włosów oraz
paznokci, a pektyny, znajdujące się w białej warstwie tuż pod skórką, obniżają
poziom cholesterolu.
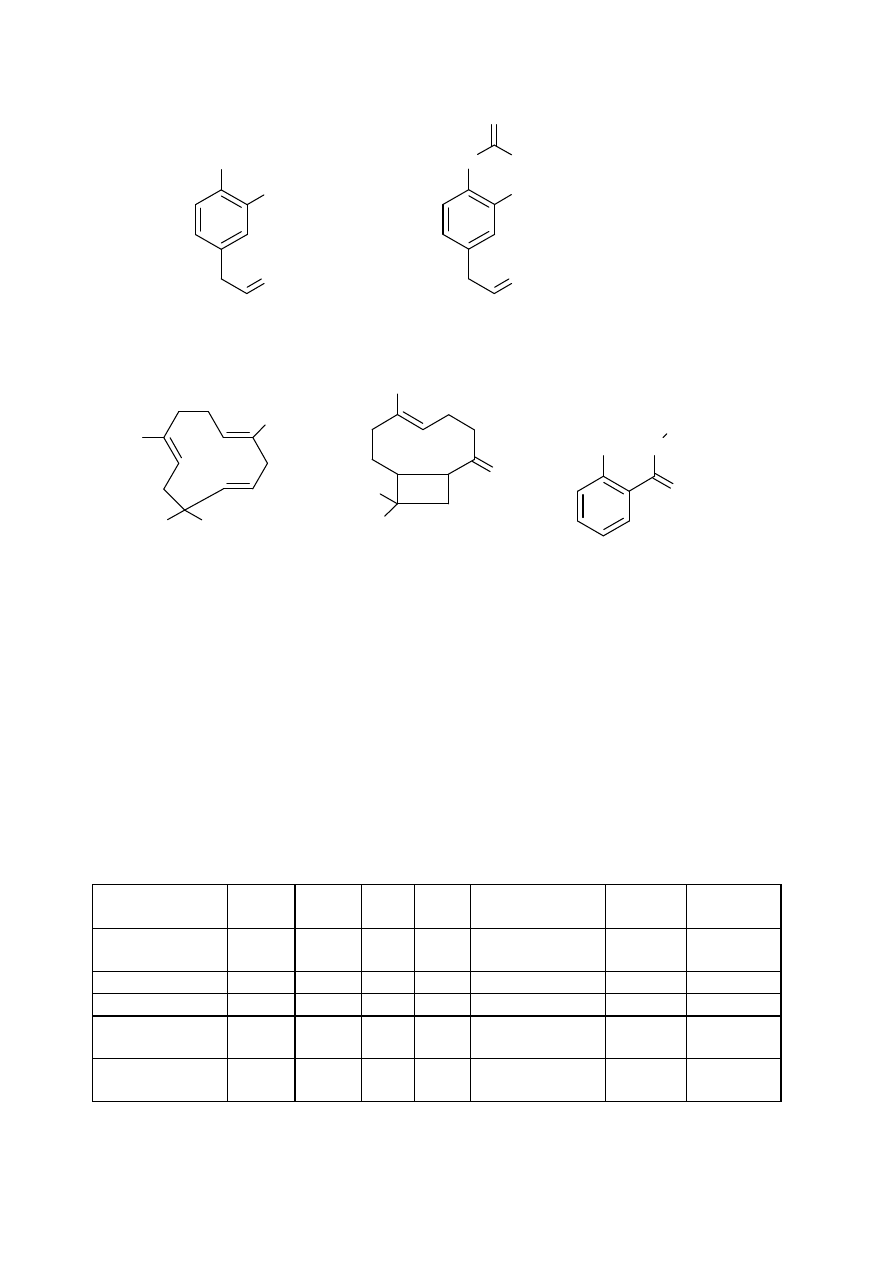
Zastosowanie limonenu: Związek ten ze względu na silny zapach stosowany
jest najczęściej jako dodatek do perfum.
Skład chemiczny:
witamina C (kwas askorbinowy), prowitamina A oraz witaminy z grupy B.
Pomarańcze zaopatrują nas także w wapń, potas oraz fosfor. Pomarańcze,
podobnie jak inne cytrusy, są bardzo bogate w cukry oraz związki mineralne,
pektyny oraz witaminę P. Głównym składnikiem skórki pomarańczy jest
limonen. Zawartość tego związku w olejku pomarańczowym jest niezwykle
wysoka i wynosi około 97%. Innym słowem olejek ten jest chemicznie czystym
limonenem.
CH
3
C
H
3
CH
2
LIMONEN
2 Wykonanie ćwiczenia:
Odczynniki i materiały
skórka pomarańczy lub grejpfruta
pentan
chlorek metylenu
zestaw do destylacji z parą wodną
wyparka obrotowa
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
D20/D
Rozpuszczalność w
H
2
O
Barwa
Zapach
n-pentan
72,15
-129,7
36,1
0,630
nierozpuszczalny
bezbarwny
benzyny
Chlorek
metylenu
84,93
-95
40
1,33
nierozpuszczalny
bezbarwny
słodki

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
29
Dwie, drobno pokrojone skórki pomarańczy (lub jedną skórkę grejpfruta)
umieszcza się w kolbie o pojemności 1000 ml, dodaje 150 ml wody i destyluje z
parą wodną. Po uzyskaniu 50-60 ml destylatu ekstrahuje się go trzykrotnie 15-
mililitrowymi porcjami pentanu lub dichlorometanu. Połączone ekstrakty
przemywa się wodą i suszy nad bezwodnym siarczanem magnezu. Usunięcie
rozpuszczalnika na wyparce obrotowej daje prawie czysty limonen.
Aparatura:
zestaw do destylacji z parą wodną, rozdzielacz, wyparka obrotowa.
5.5. Ćwiczenie 5. Wydzielanie kofeiny z herbaty
1. Wprowadzenie
HERBATA CHIŃSKA (Thea sinesis)
Jak głosi legenda wszystko zaczęło się pewnego pięknego dnia w
2737 roku p.n.e. w Chinach. Tego dnia cesarz chiński - Szen
Nung, zielarz i uczony, który ze względów higienicznych, pił
tylko przegotowaną wodę, wypoczywał pod drzewem dzikiej
herbaty, wiał lekki wiatr, jego podmuch spowodował, że kilka
listków wpadło do dzbana z wodą. Oczywiście cesarz zapatrzony
w piękno natury nie zauważył tego, dopiero pijąc swój napój poznał smak, który go
oczarował. Inna opowieść przypisuje początek herbacie mnichowi o imieniu Bodhidharma,
który postanowił przez 7 lat medytować nie mrużąc oka. Gdy do końca kontemplacji został
mu jeden dzień powieki zaczęły mu się zamykać, zerwał więc kilka liści z drzewa, pod
którym się znajdował i zaczął rzuć. Od razu opuściło go zmęczenie. Tak wyglądał początek
herbaty w Indiach. Japończycy znają inne zakończenie historii tego mnicha. Zmęczenie, które
go opanowało przypisał powiekom, wyrwał je więc i rzucił na ziemię. W tym miejscu
natychmiast wyrósł krzew herbaty, zerwał kilka listków i zaczął rzuć. Jak się można domyślić
zmęczenie ustąpiło
.
Pierwszą wzmiankę pisemną o liściach herbaty znaleziono w
starożytnych rękopisach chińskich sprzed około 5000 lat. Właśnie z Chin herbata
zawędrowała do Japonii i Korei, a później do południowo wschodnich rejonów Azji, do
Europy Południowej, do Afryki i wreszcie do Ameryki Południowej. Obecnie herbata jest
uprawiana w wielu miejscach na kuli ziemskiej.
Działanie:
Reguluje czynności przewodu pokarmowego, korzystnie wpływa na
przyswajanie pokarmów i procesy trawienia, adsorbuje znajdujące się w jelitach
substancje szkodliwe dla organizmu. Olejki lotne i kofeina zawarte w herbacie
działają łagodnie moczopędnie. Herbata stymuluje oddychanie i wytwarzanie
krwi, działa także lekko napotnie. Wpływa również na układ krążenia, reguluje
bowiem ciśnienie i wzmacnia ścianki naczyń wieńcowych. Działa stymulująco
na centralny układ nerwowy oraz reguluje liczne procesy przemiany materii.
Herbata podwyższa sprawność fizyczną i umysłową człowieka.

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
30
Zastosowanie: Herbatę stosuje się przy zakłóceniach przepuszczalności i
zwiększonej kruchości naczyń krwionośnych, także przy skazie krwotocznej, w
terapii choroby popromiennej, nadciśnieniu i innych.
Skład chemiczny: garbniki, olejki lotne, alkaloidy, białka i aminokwasy,
barwniki, związki mineralne, kwasy organiczne (szczawiowy, jabłkowy,
cytrynowy, bursztynowy, pirogronowy, fumarowy), które poprawiają smak
herbaty, substancje żywiczne (utrwalają aromat herbaty) i witaminy, szczególnie
dużo witamin P i PP oraz witamin A, B, C, E, K. Herbata zawiera wiele
ważnych dla organizmu związków mineralnych - potasu, wapnia, sodu, cynku,
magnezu, żelaza, fosforu, jodu, miedzi, fluoru, krzemu i manganu. Alkaloidy
herbaty, wśród których najważniejsza jest kofeina, mają na organizm działanie
tonizujące. Kofeina herbaty działa łagodniej niż kofeina zawarta w kawie,
ponieważ jest związana z taniną.
N
N
N
N
O
O
CH
3
CH
3
C
H
3
KOFEINA
2. Wykonanie ćwiczenia:
Odczynniki i materiały
Herbata
wyparka obrotowa
Chlorek metylenu
kolba Erlenmeyera o poj. 150 ml
Siarczan dimetylowy
probówki
Bezwodny siarczan sodu
rozdzielacz
Octan etylu
W kolbie Erlenmeyera umieszcza się około 10 g (dwie torebki) herbaty, dodaje
się ok. 40 ml wody i szybko zagotowuje się. Herbatę parzy się przez 2-3 minuty,
po czym usuwa się torebki, a roztwór chłodzi w mieszaninie wody z lodem lub
pod bieżącą wodą. Zimny roztwór wodny ekstrahuje się dwiema 10-
mililitrowymi porcjami chlorku metylenu. Połączone ekstrakty suszy się nad
bezwodnym siarczanem sodu, usuwa środek suszący przez sączenie i ekstrakt
zatęża się do obj. 5-10 ml na wyparce obrotowej. Aby otrzymać czystą kofeinę
zatężony ekstrakt herbaciany należy oczyścić za pomocą chromatografii
kolumnowej.
Aparatura:
Kolba Erlenmeyera, lejek szklany, zlewka, rozdzielacz, wyparka obrotowa.

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
31
5.6. Ćwiczenie 6. Wydzielanie teobrominy z kakao.
1. Wprowadzenie
KAKAO (Theobroma cacao)
Historia kakao sięga czasów Majów i Azteków. Pili oni
oszałamiający napój kakaowy (zwany chocolatl) podczas
obrzędów i świąt religijnych. W tamtejszych kręgach kulturowych
ziarna kakowca były niezwykle cenne i służyły nawet jako środek
płatniczy. Ziarno kakaowca przywiózł do Europy Krzysztof
Kolumb. Napój warzony wedle przepisu azteckiego króla
Montezumy zdobył najpierw uznanie na dworze hiszpańskim.
Często próbowano tworzyć napoje według własnych receptur, jednak nie przynosiło to
oczekiwanego rezultatu, gdyż Hiszpanie uszlachetniali ten napój za pomocą wanilii i cukru.
Dopiero w XVII wieku napój kakaowy upowszechnił się na innych dworach europejskich.
Obecnie istnieje na świecie tylko jedno miejsce, gdzie można spróbować oryginalnego napoju
kakaowego. Jest to muzeum czekolady firmy Cadbury w Birmingham, w Anglii.
Działanie:
Kakao dzięki zawartości teobrominy i kofeiny działa pobudzająco na
układ oddechowy i naczyniowo-ruchowy.
Zastosowanie: kakao oczywiście największe zastosowanie znajduje w
produkcji czekolady i galanterii czekoladowej.
Skład chemiczny: tłuszcz 52%, skrobia 10%, białko 20%, woda 6%, cukry
1,5%, włóknik 2%, składniki mineralne 3%, teobromina 1,5-2%, kofeina 0,2-
0,7%.
N
H
N
N
N
O
O
CH
3
CH
3
N
N
N
N
O
O
CH
3
CH
3
C
H
3
TEOBROMINA
KOFEINA
2. Wykonanie ćwiczenia:
Odczynniki i materiały
Kakao Tlenek magnezu
Siarczan dimetylowy Metanol
Chloroform Eter dietylowy
Wodorotlenek sodu Benzen
Eter naftowy Bezwodny siarczan sodu
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
32
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
D
20
/D
Rozpuszczalność
w H
2
O
Barwa
Zapach
Tlenek magnezu
40,30
2800
3600
3,58
nierozpuszczalny
biały
bezwonny
Metanol
32,04
-98
64,5
0,79
rozpuszczalny
bezbarwny alkoholowy
Eter
dietylowy
74
-116,2
34,5
0,708 nierozpuszczalny bezbarwny
słodki
Chloroform
119,38
-63
61
1,492 nierozpuszczalny bezbarwny
słodki
Benzen
78,11
5,5
80,1
0,88
nierozpuszczalny bezbarwny
charakterysty
czny
Wodorotlenek
sodu
40,00
323
1390
2,130
rozpuszczalny
biały
bezwonny
Siarczan sodu
142,04
888
-
2,70
rozpuszczalny
biały
bezwonny
Siarczan
dimetylowy
126,13
-31,8
188,5
1,33
nierozpuszczalny bezbarwny
słodki
Eter naftowy
miesz.
-100
50-70
0,655-
0,67
nierozpuszczalny bezbarwny
benzyny
Zmieszano 20 g kakao i 6 g tlenku magnezu w zlewce o pojemności 250 ml
zawierającej 40 ml wody i 20 ml metanolu. Mieszaninę ogrzewano pod
wyciągiem tak długo, aż masa stała się sucha (45-50 minut). Otrzymaną masę
przeniesiono do 500-mililitroiwej kolby i dodano 350 ml chloroformu.
Otrzymaną mieszaninę ogrzewano do temperatury wrzenia pod chłodnicą
zwrotną przez 30 minut, po czym przesączono na gorąco. Osad rozkruszono,
przeniesiono do kolby i ponownie ekstrahowano chloroformem. Roztwory
chloroformowe połączono, ekstrakt zatężano do obj. 10 ml na wyparce
obrotowej. Następnie do zatężonego ekstraktu, w temperaturze pokojowej,
dodano 60 ml eteru dietylowego i pozostawiono do następnych ćwiczeń.
Otrzymany mikrokrystaliczny osad przemywano parokrotnie 10 ml porcjami
eteru dietylowego, otrzymując około 0,3 g teobrominy.
Metylowanie teobrominy. Surową teobrominę rozpuszczono w 5 ml
10%-towego roztworu wodorotlenku sodu. Wówczas dodano 1 ml siarczanu
dimetylowego i mieszaninę wytrząsano przez 20 minut w temperaturze
pokojowej. Produkt ekstrahowano dwoma porcjami chloroformu (po 20 ml) i
suszono nad bezwodnym siarczanem magnezu lub sodu. Chloroform usunięto na
wyparce obrotowej, a surową kofeinę wysuszono na powietrzu.
Aparatura:
zestaw do ogrzewania pod chłodnicą zwrotną, lejek szklany, zlewka,
rozdzielacz, wyparka obrotowa.

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
33
5.7. Ćwiczenie 7. Wydzielanie nikotyny z papierosów.
1. Wprowadzenie
TYTOŃ SZLACHETNY (Nicotiana tabaca)
Tytoń szlachetny, pochodzący ze zwrotnikowych obszarów
Ameryki Środkowej, znany był Indianom od dawna. Największe
plantacje powstały w Ameryce Północnej, w posiadłościach
angielskich (Wirginia). Tytoń był źródłem zysków, motorem
pierwszego przemysłu i oczywiście powodem sprowadzania
niewolników z Afryki. Do Portugalii przywieziony został w drugiej
połowie XVI wieku, skąd dotarł do Francji dzięki francuskiemu
posłowi Janowi Nicot (stąd nazwa łacińska gatunku). W Europie został pierwotnie
rozpowszechniony jako roślina ozdobna i lecznicza. Tytoń dla Anglii odkrył Walter Raleigh.
Działanie: Nikotyna ma działanie gangliplegiczne - poraża receptory
cholinergiczne N w zwojach autonomicznych. W małych dawkach powoduje
krótkotrwałe przyspieszenie czynności serca i wzrost ciśnienia krwi. Zwiększa
zużycie tlenu i powoduje zwężenie naczyń wieńcowych. Takie działanie jest
niebezpieczne dla osób cierpiących na chorobę wieńcową. Zwiększa się
zawartość dwutlenku węgla we krwi.
Zastosowanie:
Nikotyna jest stosowana w medycynie, w czasie terapii przy
rzucaniu palenia. Ostre zatrucie nikotyną powoduje przejściowy wzrost
ciśnienia krwi i przyspieszenie oddechu, a następnie spadek ciśnienia krwi i
bezdech. Dawka śmiertelna dla osoby niepalącej wynosi od 50 do 100 mg. Dla
osoby palącej w wyniku zjawiska tolerancji jest ona większa.
Skład chemiczny liścia tytoniu szlachetnego: nikotyna około 10%, oprócz
nikotyny występują również: nikoteina, nikotelina, nornikotyna, nikotymina,
nikotoina, nikokotyrrina, anatalbina, anabazyna.
Utlenienie nikotyny stężonym kwasem siarkowym daje kwas nikotynowy,
będący witaminą i składnikiem koenzymu nikotynoamidowego.
N
N
CH
3
N
COOH
NIKOTYNA KWAS NIKOTYNOWY
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
34
2. Wykonanie ćwiczenia:
Odczynniki i materiały
Tytoń lub tabaka
3-molowa zasada sodowa
eter dietylowy
metanol
chlorek sodu
siarczan sodu
węgiel aktywny
kwas pikrynowy
płytki chromatograficzne
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
d
20
/D
Rozpuszczalność w
H
2
O
Barwa
Zapach
Metanol
32,04
-98
64,5
0,79
rozpuszczalny
bezbarwna alkoholowy
Chlorek
Sodu
58,44
801
1461
2,170
rozpuszczalny
bezbarwny
bezwonny
Eter
dietylowy
74
-116,2
34,5
0,708
nierozpuszczalny
bezbarwny
słodki
Siarczan
Sodu
142,04
888
-
2,70
rozpuszczalny
biały
bezwonny
Kwas
pikrynowy
229,11
-
>300
1,800
nierozpuszczalny
żółty
bezwonny
Wodorotlenek
sodu 3,0 M
-
-
-
1,090
rozpuszczalny
bezbarwny
bezwonny
Węgiel
aktywny
12,01
_
_
1,8-2,1
nierozpuszczalny
czarny
bezwonny
Do 3 g tytoniu lub tabaki dodano 50 ml 3-molowego roztworu
wodorotlenku sodu i prowadzono destylację z parą wodną do chwili otrzymania
100-150 ml destylatu. Po oziębieniu do ekstraktu dodano 10-20 g stałego
chlorku sodu i ekstrahowano mieszaninę trzema 15-mililitrowymi porcjami
eteru dietylowego. Ekstrakty eterowe przemyto wodą, wysuszono bezwodnym
siarczanem sodu i oddestylowano nadmiar rozpuszczalnika. Otrzymano surową
nikotynę w postaci oleju. Następnie produkt ogrzewano do rozpuszczenia w
mieszaninie 1 ml wody i 4 ml metanolu, dodano węgiel aktywny i sączono na
ciepło. Do przesączu dodano 10 ml nasyconego roztworu kwasu pikrynowego w
metanolu. Po 5-10 minutach odsączono sól – dipikrynian nikotyny, którą
następnie krystalizowano z minimalnej ilości wody (8-10 ml).
Aparatura:
zestaw do destylacji z parą wodną, rozdzielacz, wyparka obrotowa, lejek
Biichnera z kolbą próżniową.

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
35
5.8. Ćwiczenie 8. Trimirystyna z gałki muszkatołowej.
1. Wprowadzenie
GAŁKA MUSZKATOŁOWA
( Myristica fragrans)
Ojczyzną drzewa muszkatołowego są wyspy Moluki, gdzie
uprawiano
je
od
niepamiętnych
czasów.
Nasiona
muszkatołowca wymienia staroindyjska Ayurveda jako
działające narkotycznie i halucynogennie. W niektórych regionach południowo-wschodniej
Azji te właściwości gałki muszkatołowej wykorzystuje się do obecnych czasów, znano je
również w średniowiecznej Europie, w kręgach wtajemniczonych. Należy tu dodać, że
również przedstawiciele innych rodzajów rodziny Myristicaceae wytwarzają substancje
narkotyczne. Niektóre szczepy południowo-amerykańskich Indian narkotyzują się żywicą z
kory pewnych gatunków rodzaju Virola, którą po sproszkowaniu zażywają, podobnie jak
tabakę, podczas różnych uroczystości plemiennych. Przyprawa muszkatołowa trafiła do
Europy stosunkowo późno, bo dopiero w VI-VII w. za pośrednictwem Arabów. Grecy i
Rzymianie okresu klasycznego nie znali gałki muszkatołowej. Od chwili pojawienia się na
rynkach europejskich stanowiła zawsze jedną z najbardziej pożądanych i najdroższych
przypraw, której pochodzenie owiane było mgłą tajemnicy. Tajemnicę wyjaśnili dopiero
portugalscy żeglarze, którzy w 1512 r. napotkali plantację drzew muszkatołowych na
wyspach Banda i Amboina w archipelagu Moluków. Portugalczycy przez prawie 100 lat
uzyskiwali ogromne zyski ze swego odkrycia, dzierżąc światowy monopol na handel gałką.
Dopiero w 1605 r. musieli ustąpić Holendrom, którzy siłą wyparli ich z wysp Banda,
przejmując monopol w swoje ręce. Monopol holenderski trwał do 1772 r.
Działanie: Gałka muszkatołowa znalazła zastosowanie również w medycynie.
Jest ona bardziej popularna w medycynie Wschodu niż Zachodu. Stosuje się ją
dla łagodzenia zaburzeń oskrzelowych, bezsenności, reumatyzmu, wzdęć, w
stanach nadpobudliwości. W większych ilościach (5 do 30 g) może powodować
senność, halucynacje lub euforię, nie należy jej nadużywać. Jedno nasionko
waży około 2 g. Po upływie 2-5 godzin od spożycia kilku nasion mogą wystąpić
lekkie zaburzenia świadomości, aż do silnych halucynacji, zapalenia jelita
cienkiego i bezsenności. Zazwyczaj objawy te ustępują po 24 godzinach.
Zastosowanie: Gałkę muszkatołową stosuje się głównie do przyprawiania ciast.
Jednakże dodana do mięsa (wołowina, cielęcina, jagnięcina, drób), czy
produktów mlecznych doskonale zmienia smak potrawy. Gałka jest używana do
aromatyzowania napojów takich jak grzane piwo angielskie, poncz, wino
zaprawione korzeniami czy posset (napój z gorącego mleka z winem i
korzeniami). Gałka muszkatołowa znakomicie poprawia smak pierników i
innych ciast, deserów owocowych.
Skład chemiczny gałki muszkatołowej: zawiera do 16% olejku lotnego z
licznymi komponentami, m.in. alfa-pinenem, kamfenem, limonenem, p-
cymenem, linalolem, borneolem, terpineolem, geraniolem. Około 8% olejku
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
36
stanowi trimistryna (metoksysafrol), o właściwościach toksycznych i
halucynogennych. Podstawowym składnikiem gałki (do 40%) jest tłuszcz, tzw.
masło lub balsam muszkatołowy, W skład tłuszczu wchodzi przede wszystkim
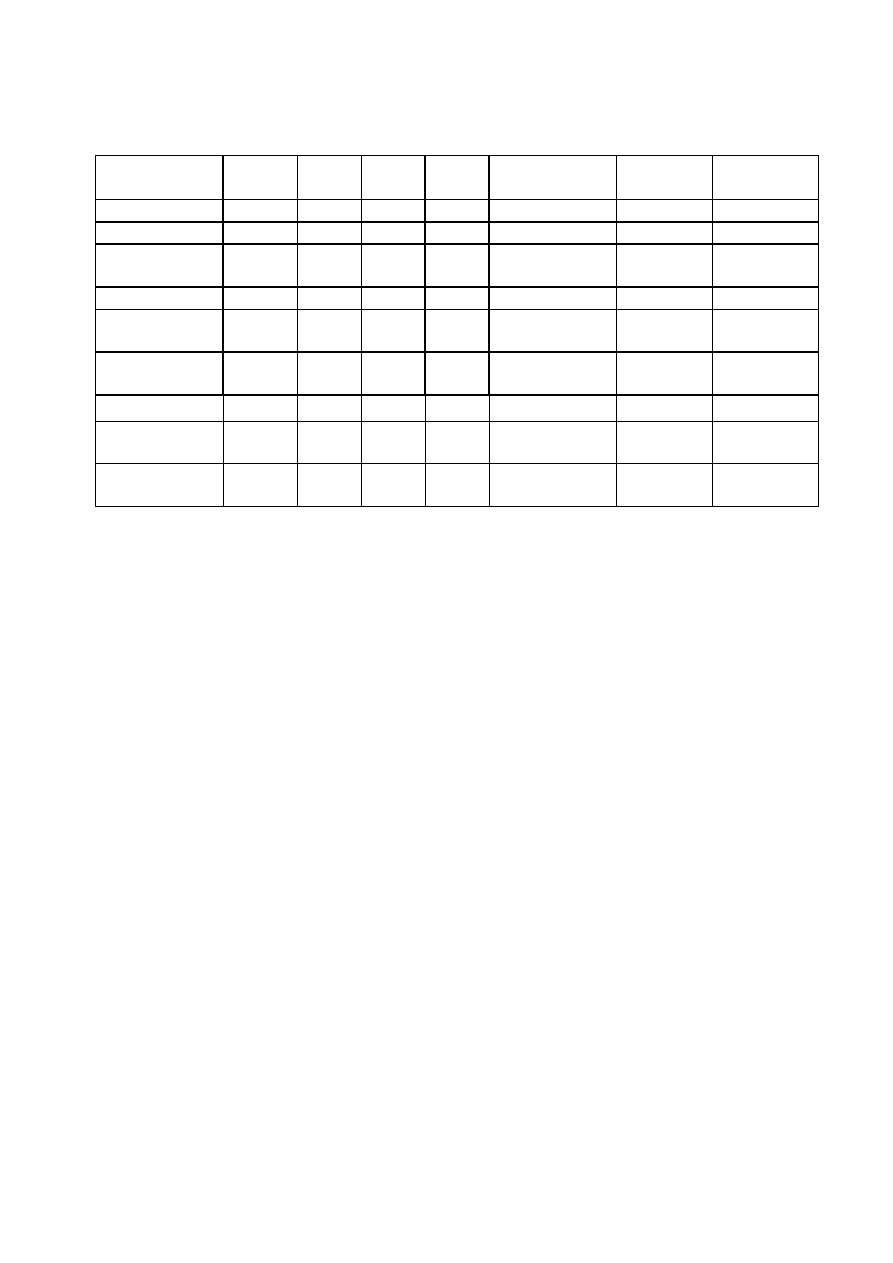
trójgliceryd kwasu trimirystynowego, czyli trimirystyna. Ponadto gałka zawiera
pewne ilości skrobi, cukrów, pektyn, barwników i innych substancji
organicznych.
TRIMIRYSTYNA
2. Wykonanie ćwiczenia:
Odczynniki i materiały
Gałka muszkatołowa
Aceton
Wodorotlenek sodu
Eter etylowy
Etanol
Stężony kwas solny
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz
.
T.t [
o
C]
T.w.[
o
C]
d
20/4
Rozpuszczalnoś
ć w H
2
O
Barwa
Zapach
Trimirystyna
723,16
56-57
-
-
nierozpuszczaln
a
biała
bezzapac
howy
Aceton
58
-94,7
56,3
0,785
rozpuszczalny
bezbarwna
Ostry
Wodorotlenek
Sodu
40
323
1390
2,13
rozpuszczalny
bezbarwna
bezzapac
howy
Eter etylowy
74
-116,2
34,5
0,708
nierozpuszczaln
y
bezbarwna
owocow
y
Etanol
46
-114,1
78,3
0,785
rozpuszczalny
bezbarwna
ostry
Kwas solny
36,46
-114,24
-85
1,187
rozpuszczalny
bezbarwna
ostry

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
37
40 g drobno zmielonej gałki muszkatołowej oraz 32 ml eteru etylowego
umieszczono w kolbie okrągłodennej o pojemności 250 ml i ogrzewano pod
chłodnicą zwrotną przez godzinę. W czasie tego procesu cały czas regulowano
temperaturę i ciśnienie wody dopływającej do chłodnicy, tak aby eter delikatnie
wrzał. Następnie schłodzono do temperatury pokojowej, odsączono na lejku nie
rozpuszczone produkty. Przesącz wlano do kolby i umieszczono w wyparce
obrotowej w celu usunięcia eteru. Następnie rozpuszczono w 50 ml acetonu i
ponownie ogrzewano pod chłodnicą zwrotną. Mieszaninę schłodzono, a
następnie umieszczono w lodówce do następnych ćwiczeń. Wytrącony związek
odsączono, wysuszono na powietrzu i zważono (trimirystyna). Hydroliza
trimirystyny: całość otrzymanego związku około 0,9 g. rozpuszczono w 15 ml
alkoholu etylowego. Dodano 20 ml mieszaniny woda- alkohol ( w stosunku
objętościowym 1:9), która zawiera dodatkowo 0,2 g. wodorotlenku sodu. Tak
otrzymaną mieszaninę z kamyczkiem wrzennym ogrzewano pod chłodnicą
zwrotną do wrzenia przez półtorej godziny. Całość ochłodzono do temperatury
pokojowej i otrzymaną maź przeniesiono do około 50 ml wody z lodem, która
zawierała kilka kropel stężonego kwasu solnego. Po wykrystalizowaniu
odsączono i wysuszono produkt. Otrzymano w ten sposób kwas mirystynowy.
Aparatura:
zestaw do ogrzewania pod chłodnicą zwrotną, wyparka obrotowa, lejek
Biichnera z kolbą próżniową.
5.9. Ćwiczenie 9. Próby na obecność cholesterolu.
1. Wprowadzenie CHOLESTEROL z żółtka jaja
Już na początku XX wieku odkryto związek między schorzeniami
układu krążenia, a cholesterolem. Zwiększone stężenie "złego" cholesterolu
i wolnych trójacylogliceroli w osoczu krwi należy do najważniejszych
czynników ryzyka miażdżycy. Kiedy krew swobodnie przepływa przez
naczynia krwionośne, wraz z nią do każdej komórki dostarczane są
substancje odżywcze i niezbędny do życia tlen. We krwi krążą również
związki, które mogą od wewnątrz uszkadzać nasze tętnice (np. wolne
rodniki). Powstające w ten sposób uszkodzenia sprawiają, że w miejscach tych zaczynają
osadzać się substancje tłuszczowe (głównie cholesterol) oraz płytki krwi. Tworzą się złogi,
które utrudniają dopływ krwi do wielu narządów. Tym samym, dociera do nich coraz mniej
tlenu, a postępujące niedotlenienie narządów prowadzi do ich niewydolności. Zwykle
zwężenie nie obejmuje wszystkich tętnic, pojawia się jedynie na pewnych odcinkach.
Najczęściej dotyczy to tętnic wieńcowych, które doprowadzają krew do serca. Należy jednak
pamiętać, że cholesterol jest również prekursorem wielu ważnych, niezbędnych dla
prawidłowego funkcjonowania organizmu związków tj. hormony płciowe, hormony kory
nadnercza, witamina D, kwasy żółciowe.
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
38
Działanie: wysokie poziomy cholesterolu w surowicy zwiększają zagrożenie
zawałem serca, jest czynnikiem ryzyka choroby wieńcowej, powoduje
miażdżycę tętnic wieńcowych i powstającego na jej tle zawału serca.
Skład chemiczny żółtka jaja kurzego: zawiera 15,5% białka, 28,2% tłuszczy,
0,3% węglowodanów, a także cholesterol, sód, wapń, fosfor, żelazo, magnez,
beta-karoten, witaminę A, B1, B2, D, E, PP.
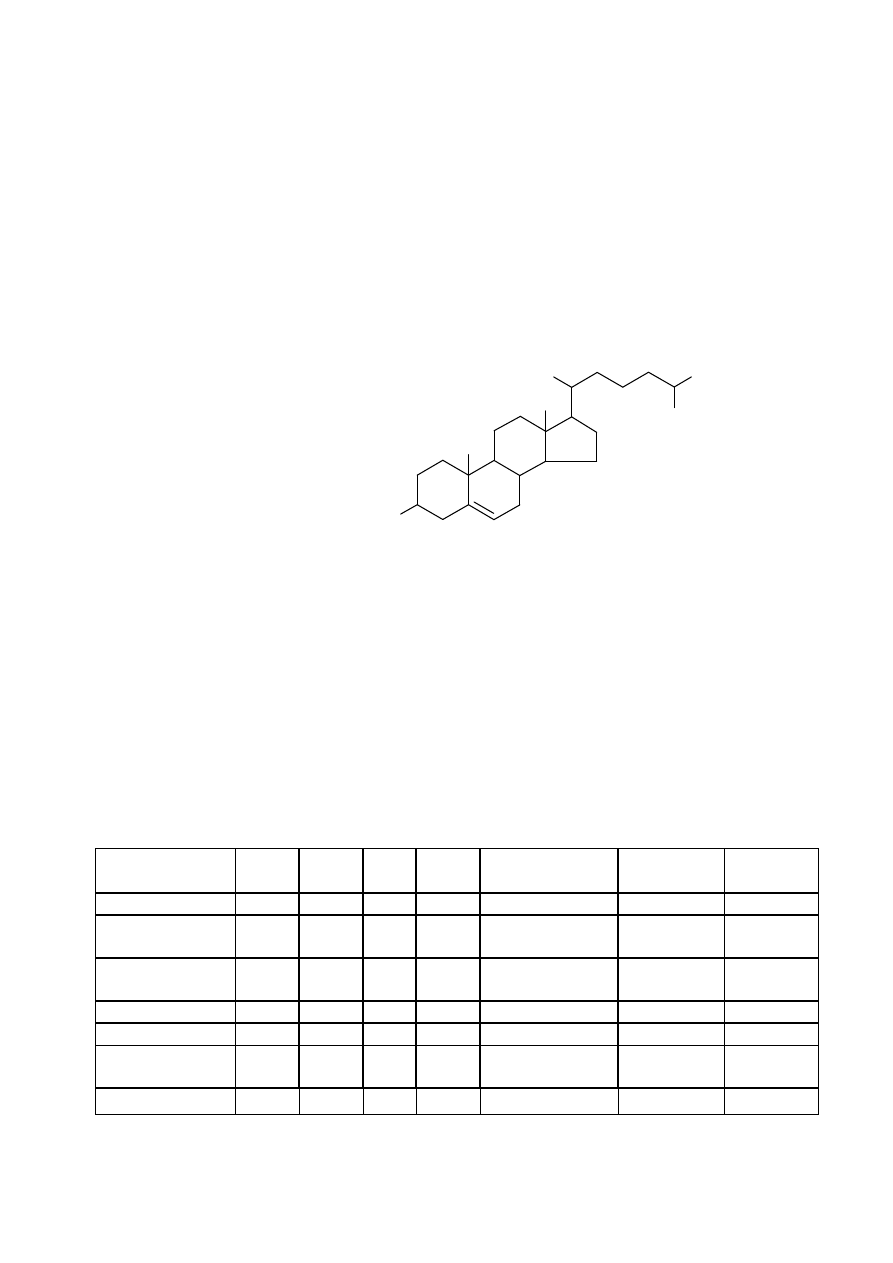
CH
3
CH
3
C
H
3
CH
3
O
H
CH
3
CHOLESTEROL
2. Wykonanie ćwiczenia:
Odczynniki i materiały
żółtko jaja kurzego eter dietylowy
etanol kwas siarkowy
chloroform bezwodnik octowy
brom lodowaty kwas octowy
wirówka
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
D
20
/D
Rozpuszczalność
w H
2
O
Barwa
Zapach
Etanol
46,07 -114,5 78,3
0,790
rozpuszczalny
bezbarwny alkoholowy
Bezwodnik
octowy
102,09
-73
138-
140,5
1,080
hydrolizuje(ener.r
eakcja0
bezbarwny
ostry
Lodowaty kwas
octowy
60,05
17
117
1,050
rozpuszczalny
bezbarwny
ostry
Chloroform
119,38
-63
61
1,492 nierozpuszczalny bezbarwny
słodki
Eter dietylowy
74
-116,2 34,5
0,708 nierozpuszczalny bezbarwny
słodki
Brom
159,81
-7,2
58,8
rozpuszczalny
czerwono-
brązowa
gryzący
Kwas siarkowy
98,08
-15
310
1,840
rozpuszczalny
bezbarwny
bezwonny

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
39
Dokładnie oddzielono żółtko jaja kurzego od białka i umieszczono je w
zlewce o pojemności 150 ml, do której dodano 35 ml eteru, 35 ml etanolu.
Mieszaninę odstawiono na 10 minut, co jakiś czas mieszając, następnie
przsączono przez sączek zwilżony mieszaniną eterowo – etanolową do suchej
zlewki. Z otrzymanego przesączu usunięto rozpuszczalnik na wyparce
obrotowej i dodano 5 ml gorącego etanolu. Gorący roztwór przeniesiono pipetą
do probówki wirowej, a do pozostałości dodano ponownie 5 ml gorącego
etanolu. Ekstrakty połączono, odwirowano i klarowny roztwór alkoholowy
odpipetowano do czystej probówki. Dodawano kroplami wodę tak długo, aż nie
wypadł osad. Następnie mieszaninę pozostawiono na 30 minut. Odwirowano,
odrzucono roztwór znad osadu, a osad rozpuszczono w niewielkiej ilości
gorącego etanolu, pozostawiając do wystygnięcia. Kryształki cholesterolu
odsączono, wysuszono na powietrzu i zważono.
Próba Salkowskiego. Do suchej probówki wlano około 2 ml roztworu
cholesterolu w chloroformie i powoli, po ściance probówki dodano 1 ml
stężonego kwasu siarkowego. Roztwór kwasu fluoryzuje na zielono, a warstwa
chloroformowa barwi się na czerwono.
Próba Liebermana-Burcharda. Do suchej probówki zawierającej 1 ml
roztworu cholesterolu w chloroformie dodano 10 kropli bezwodnika octowego i
1 kroplę stężonego kwasu siarkowego. Pojawiło się czerwone zabarwienie, które
przechodzi poprzez niebieskie w zielone.
Próba Windausa. Do 1 ml chloroformowego roztworu cholesterolu
dodawano kroplami roztwór bromu w kwasie octowym. Wypadający żółto-biały
osad dibromocholesterolu zbadano technikami spektroskopowymi.
(studenci wykonują dwie pierwsze próby).
Aparatura:
wyparka obrotowa, wirówka obrotowa, lejek szklany, zlewka.
5.10. Ćwiczenie 10. Wydzielanie lecytyn – zastosowanie chromatografii.
1. Wprowadzenia
Lipidami
nazywamy
grupę
produktów
naturalnych
izolowanych ze źródeł naturalnych za pomocą ekstrakcji
niepolarnymi rozpuszczalnikami organicznymi. Do tej grupy należą:
tłuszcze, woski, fosfo- i sfingolipidy, terpeny, sterydy. Fosfolipidy
są środkami powierzchniowo czynnymi składającymi się z gliceryny
lub sfingozyny, kwasów tłuszczowych, kwasu fosforowego i
alkoholi takich jak: etanoloamina, cholina i seryna. Inaczej
fosfolipidy są niesymetrycznymi estrami kwasu fosforowego
zestryfikowanego
diacyloglicerolem
i
hydrofilowym
alkoholem.
Najważniejszymi
fosfolipidami, pochodnymi gliceryny, są lecytyny, cefaliny, fosfatidyloseryny i
plazmalogeny
.
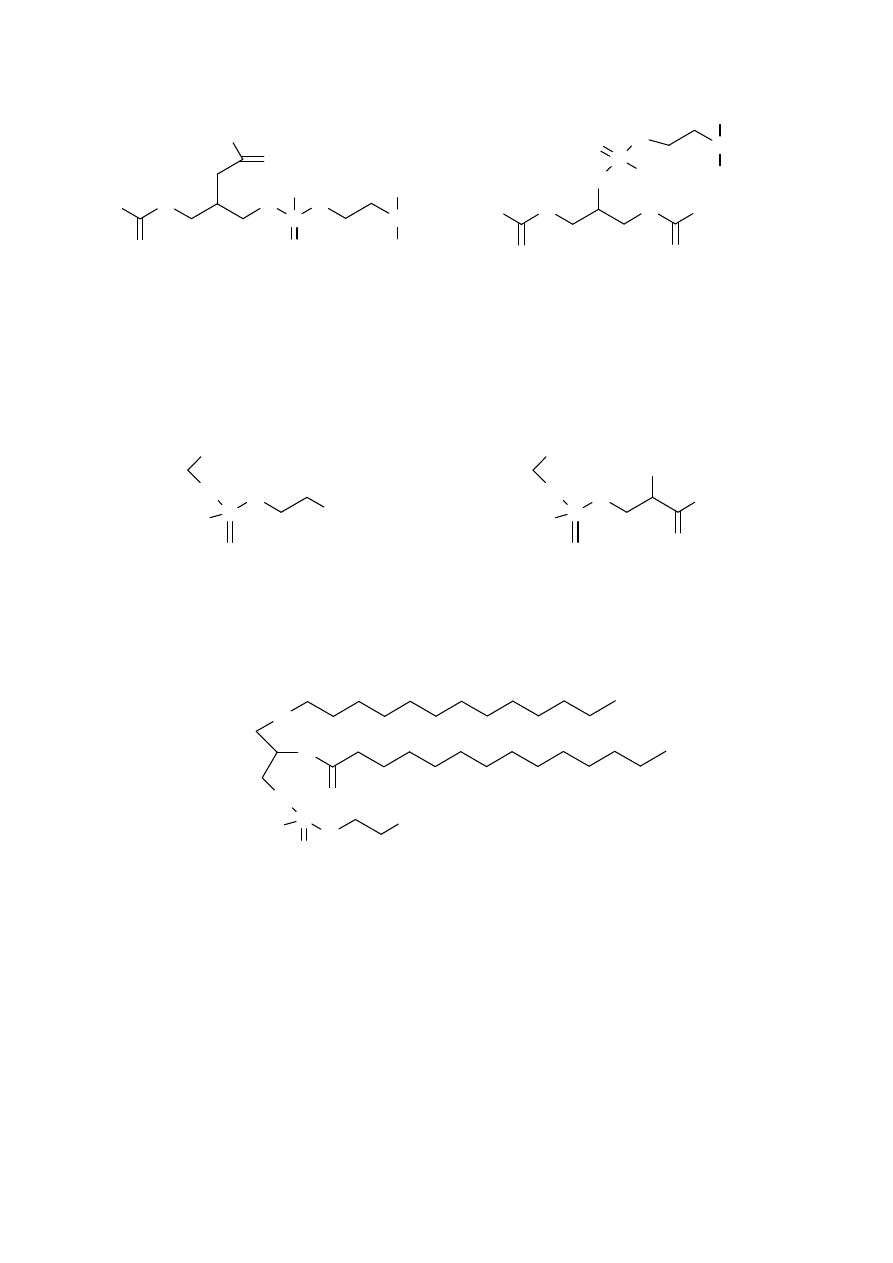
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
40
R
O
O
O
R
O
P
O
N
CH
3
CH
3
CH
3
O
O
+
-
R
O
O
O
O
R
O
P
O
O
O
N
CH
3
CH
3
CH
3
+
-
Alfa - LECYTYNY Beta - LECYTYNY
O
P
O
O
NH
3
R
O
+
_
O
P
O
O
R
NH
3
O
O
O
+
_
_
CEFALINY FOSFATIDYLOSERYNY
O
O
O
O
P
O
O
O
NH
3
_
+
PLAZMALOGENY
Drugą ważną grupą lipidów są pochodne sfingozyny – sfingolipidy.
Typowymi przykładami tych lipidów są: sfingomielina i cerebrozyd. Ten drugi
jest przykładem glikolipidu.
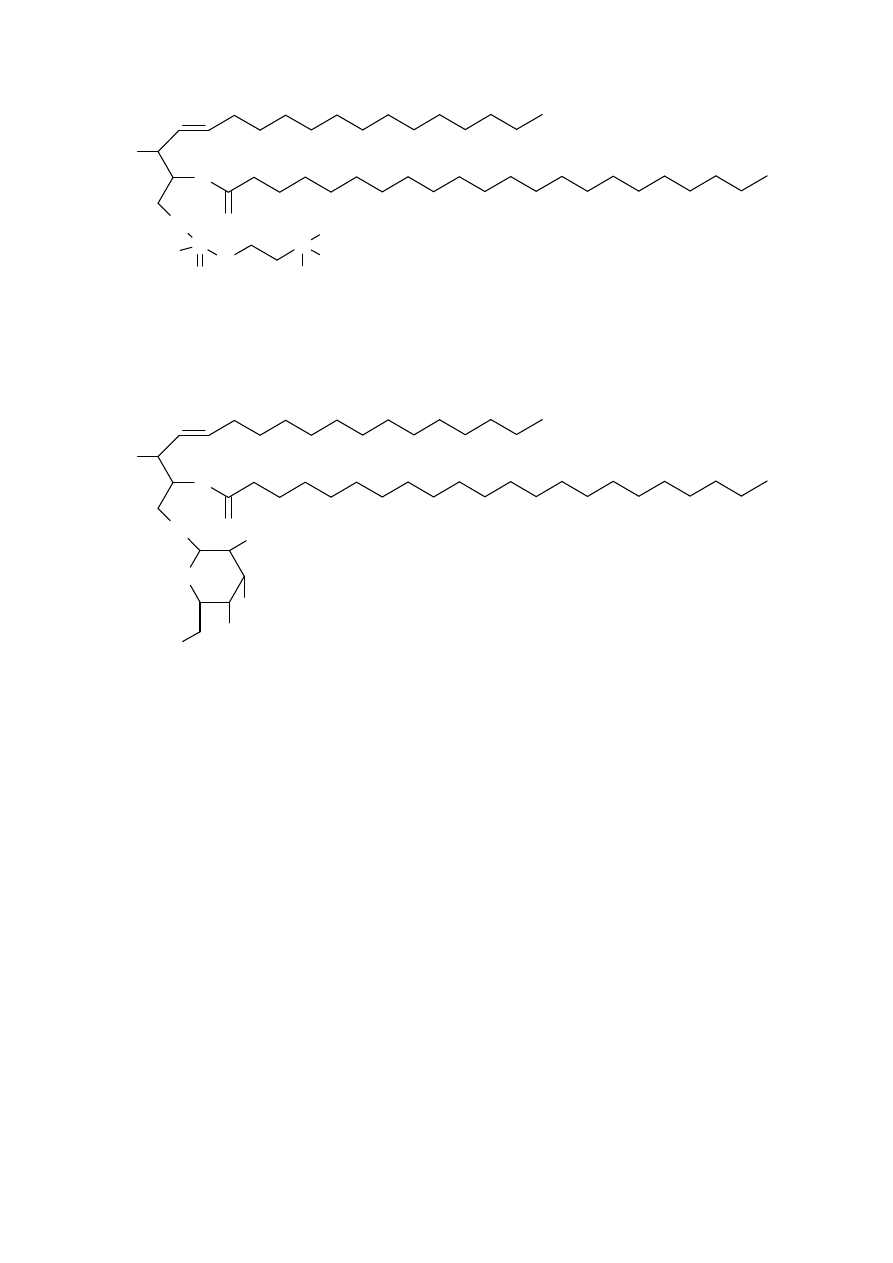
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
41
O
P
O
O
O
N
CH
3
CH
3
CH
3
N
H
O
O
H
_
+
SFINGOMIELINA
O
O
N
H
O
O
H
O
H
OH
OH
OH
CEREBROZYD
Działanie:
Zapasy tłuszczu chronią narządy wewnętrzne przed uciskiem i
uszkodzeniem przez wstrząsy mechaniczne. U wielu zwierząt, a zwłaszcza
ssaków morskich (np. u fok), stanowią izolację termiczną ustroju. U człowieka
tłuszcz zgromadzony w tkance tłuszczowej stanowi ok. 17% ciężaru ciała.
Kompleksy
tłuszczowo-białkowe
zapewniają
utrzymanie
prawidłowej
sprężystości pęcherzyków płucnych. Tłuszcze są także niezbędnym składnikiem
struktur komórkowych oraz zapewniają równowagę koloidową cytoplazmy.
Ułatwiają również wchłanianie rozpuszczalnych w tłuszczach witamin: A, D, E,
K i cholesterolu pokarmowego. Przemiany tłuszczy są regulowane hormonalnie
(insulina, hormon wzrostu, kortykotropina, hormon lipotropowy i tyroksyna).
2. Wykonanie ćwiczenia:
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
42
Odczynniki i materiały
żółtko jaja kwas siarkowy
etanol dipikryloamina
eter dietylowy molibdenian amonu
chloroform jod
metanol ninhydryna
benzen aceton
eter naftowy płytki chromatograficzne
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
D
20
/D
Rozpuszczalność
w H
2
O
Barwa
Zapach
Etanol
46,07
-114,5 78,3 0,790 rozpuszczalny
bezbarwny alkoholowy
Metanol
32,04
-98
64,5
0,79
rozpuszczalny
bezbarwna alkoholowy
Eter dietylowy 74
-116,2 34,5 0,708 nierozpuszczalny bezbarwny słodki
Chloroform
119,38
-63
61
1,492
nierozpuszczalny bezbarwny słodki
Benzen
78,11
5,5
80,1
0,88
nierozpuszczalny bezbarwna charakterysty
czny
Eter naftowy
miesz. -100
50-70 0,655-
0,67
nierozpuszczalny bezbarwna benzyny
Kwas
siarkowy
98,08
-15
310
1,840
rozpuszczalny
bezbarwn
y
bezwonny
Aceton
58,08
-95,4
56,2
0,79
rozpuszczalny
bezbarwn
a
owocowy
Jod
253,81 113
184
4,930 rozpuszczalny
brunatna
słaby
Ninhydryna
178,15
-
-
-
trudno
rozpuszczalna
jasnożółta słaby
śółtko jaja kurzego dokładnie oddzielono od białka i wrzucono do zlewki
o pojemności 150 ml. Ciągle mieszając, dodano 75 ml mieszaniny eteru
dietylowego z etanolem w stosunku 5:2. Zlewkę odstawiono na 10 minut, a
następnie mieszając co jakiś czas, przesączano przez sączek zwilżony
mieszaniną etanolowo – eterową do suchej zlewki. Pozostałość przemyto na
sączku 20 ml tej mieszaniny. Połączone przesącze przeniesiono do kolbki
okrągłodennej i nadmiar rozpuszczalnika usunięto na wyparce obrotowej.
Pozostałość rozpuszczono w 10 ml eteru dietylowego. Produkt zanalizowano za
pomocą chromatografii cienkowarstwowej.
Na 5 płytek pokrytych żelem krzemionkowym naniesiono ekstrakt
lipidowy. Chromatogramy rozwijano w układzie chloroform – metanol – woda
(65:25:4), aż do przebycia przez czoło rozpuszczalnika drogi 15 cm. Po
wysuszeniu płytek:

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
43
-
chromatogram pierwszy wywoływano roztworem kwasu siarkowego w
etanolu,
-
chromatogram drugi wywoływano parami jodu,
-
chromatogram
trzeci
wywoływano
roztworem
dipikryloaminy
(odczynnik wykrywający cholinę),
-
chromatogram czwarty wywoływano roztworem molibdenianu amonu
(odczynnik wykrywający fosfor),
-
chromatogram piąty wywoływano roztworem ninhydryny.
Na podstawie reakcji barwnych określono do jakiej grupy lipidów należą
rozdzielane związki.
Wywoływanie
roztworem
kwasu
siarkowego.
Chromatogramy
spryskiwano 50% roztworem kwasu siarkowego w etanolu i umieszczono na 20
minut w suszarce, w temperaturze 220ºC. Pojawiły się plamy pochodzące od
sterydów.
Wywoływanie parami jodu. Wysuszoną płytkę chromatograficzną
umieszczono w komorze jodowej. Po kilku minutach związki posiadające
nienasycone kwasy tłuszczowe zabarwiły się na brunatno.
Wywoływanie dipikryloaminą. Chromatogram spryskano roztworem
dipikryloaminy w acetonie. Cholina i jej pochodne zabarwiły się na czerwono.
Wywoływanie molibdenianem amonu. Chromatogram spryskano świeżo
przygotowanym molibdenianem amonu. Po wysuszeniu w temperaturze
pokojowej pozostawiono go na 24 godziny. Związki zawierające ugrupowania
fosforanowe dają niebieskie plamy.
Wywoływanie roztworem ninhydryny. Chromatogram spryskano świeżo
przygotowanym 0,5% roztworem ninhydryny w etanolu. Po ogrzaniu w
temperaturze 120ºC przez 20 minut lipidy zawierające etanoloaminę lub serynę
dają ciemnofioletowe zabarwienie.
Aparatura:
wyparka obrotowa, kolumna chromatograficzna z wypełnieniem żelowym, lejek
szklany, zlewka.
5.11. Ćwiczenie 11. Likopen i beta-karoten z marchwii
1.
Wprowadzenie
MARCHEW ZWYCZAJNA (Daucus carota)
Marchew pochodzi z Azji, znana już w starożytności, lecz
wówczas nie miała większego znaczenia w żywieniu, gdyż jej smak
daleko odbiegał od smaku dzisiejszej marchwi. Dopiero w XVI
wieku wprowadzona została do wykwintnej kuchni, bowiem wtedy
właśnie po długoletnich doświadczeniach wyhodowano odmianę
charakteryzującą się lepszym smakiem. Od tego czasu marchew jest podstawową jarzyną we
wszystkich kuchniach świata.
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
44
Działanie:
Korzenie marchwi znajdują zastosowanie w leczeniu zaburzeń
czynności układu pokarmowego (szczególnie u niemowląt i małych dzieci),
Substancje zawarte w korzeniu marchwi wykazują także działanie pobudzające
przemianę materii i moczopędne. Korzeń marchwi jest cennym źródłem witamin
przez co zapobiega anemiom i awitaminozom, poprawia widzenie (prowitamina
A), zwiększa ogólną odporność organizmu.
Zastosowanie: Największe znaczenie ma marchew jako smaczna jarzyna o
dużej zawartości witamin i soli mineralnych. W kosmetyce jest szeroko
wykorzystywana jako składnik maseczek regenerujących skórę, do pielęgnacji
włosów. Marchew jest używana w przemyśle kosmetycznym jako składnik
kremów.
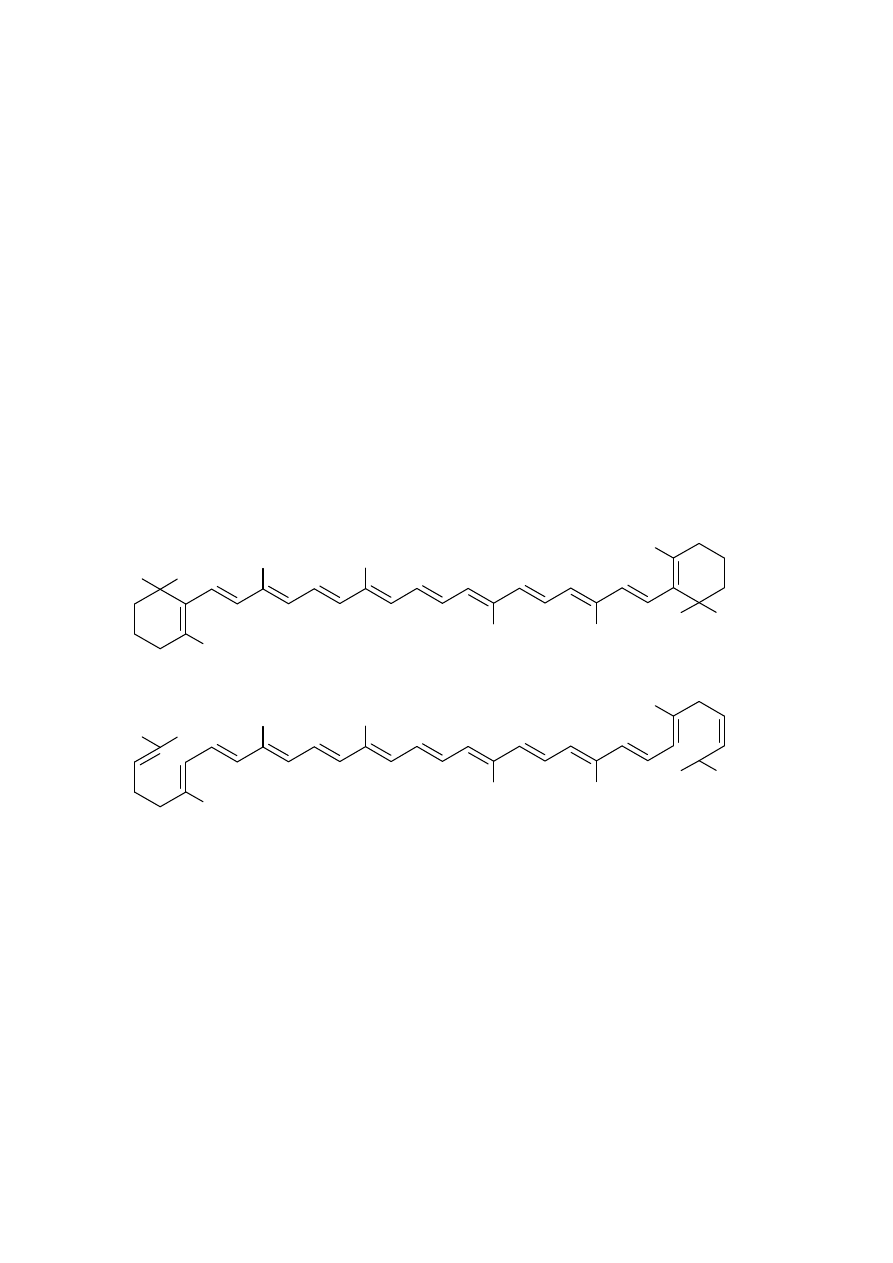
Skład chemiczny korzenia marchwi: Korzeń marchwi zawiera węglowodany,
flawonoidy, likopen, beta-karoten (prowitamina A), witaminy (B1, B2, B6, D,
H, E, K i PP), pektyny, niewielkie ilości olejku oraz sole mineralne (wapnia,
manganu, miedzi itp.).
CH
3
C
H
3
CH
3
CH
3
C
H
3
CH
3
CH
3
CH
3
CH
3
C
H
3
beta-KAROTEN
CH
3
C
H
3
CH
3
CH
3
C
H
3
CH
3
CH
3
CH
3
CH
3
C
H
3
LIKOPEN
2. Wykonanie ćwiczenia:
Odczynniki i materiały
pasta z marchwi lub pomidorów chlorek metylnu
jod tlenek glinu
etanol chlorek sodu
eter naftowy cykloheksan
folia aluminiowa kolumna chromatograficzna
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
45
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
D
20
/D
Rozpuszczalność
w H
2
O
Barwa
Zapach
Chlorek
metylenu
84,93
-95
40
1,33
nierozpuszczalny bezbarwny
słodki
Tlenek glinu
101,94
2050
2980
3,940 nierozpuszczalny
biały
bezwonny
Jod
253,81
113
184
4,930
rozpuszczalny
brunatna
słaby
Etanol
46,07 -114,5
78,3
0,790
rozpuszczalny
bezbarwny alkoholowy
Chlorek sodu
58,44
801
1461
2,170
rozpuszczalny
bezbarwny
bezwonny
Eter naftowy
miesz.
-100
50-70
0,655-
0,67
nierozpuszczalny
bezbarwna
benzyny
Cykloheksan
84,16
6
80,7-81
0,78
nierozpuszczalny
bezbarwna
charakterys
tyczny
5 g Pasty z marchwi (lub pomidorów) umieszczono w kolbie okrągłodennej
o pojemności 100 ml, owiniętej folią aluminiową w celu uchronienia
karotenoidów przed reakcją fotochemicznego utleniania. Do kolby dodano 10
ml 95% etanolu i ogrzewano, pod chłodnicą zwrotną, utrzymując temperaturę
wrzenia przez 5 minut. Gorącą mieszaninę sączono przez lejek ze spiekiem, a
żółty filtrat przelano do kolby Erlenmayera o pojemności 100 ml, owiniętej folią
aluminiową. Pozostały na sączku osad przeniesiono z powrotem do kolbki,
dodając 10 ml chlorku metylenu i ogrzewano pod chłodnicą zwrotną utrzymując
stan wrzenia przez kolejne 3-4 minuty. Ponownie sączono na gorąco i przesącz
przeniesiono do kolby zawierającej ekstrakt etanolowy. Ekstrakcję chlorkiem
metylenu powtarzano jeszcze trzykrotnie, zbierając ekstrakty w kolbie
Erlenmeyera.
Połączone ekstrakty przeniesiono do rozdzielacza, dodano wody i
nasyconego roztworu chlorku sodu ( w celu ułatwienia rozdzielenia warstw),
dolną warstwę sączono przez lejek wypełniony środkiem suszącym do suchej
kolby. Z otrzymanego ekstraktu usunięto rozpuszczalnik na wyparce obrotowej.
Surowy karotenoid rozpuszczono w 5 ml cykloheksanu. Produkty oczyszczano
za pomocą chromatografii kolumnowej, stosując jako eluent – eter naftowy.
Zebrano poszczególne frakcje, które zcharakteryzowano za pomocą
chromatografii cienkowarstwowej.
Aparatura:
zestaw do ogrzewania pod chłodnicą zwrotną, wyparka obrotowa, rozdzielacz,
lejek Biichnera z kolbą próżniową.
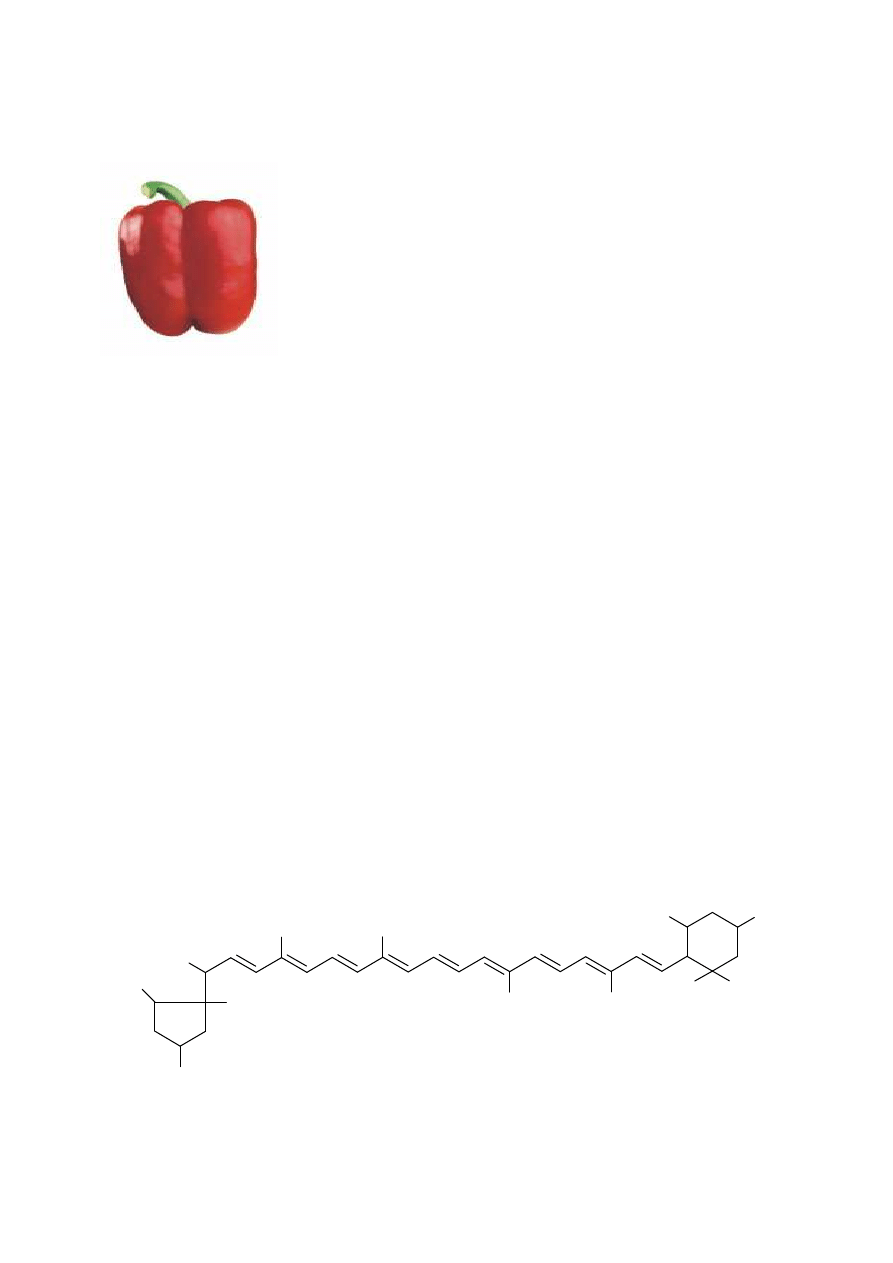
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
46
5.12. Ćwiczenie 12. Wydzielanie i rozdział barwników z papryki.
1. Wprowadzenie
W Ameryce Południowej i Środkowej paprykę uprawiano
na długo przed przybyciem podróżników hiszpańskich. Podczas
swojej pierwszej wyprawy Krzysztof Kolumb natknął się na nią na
Haiti. Hiszpanie poszukujący krótszej drogi do Indii, skąd
sprowadzano do Europy drogocenny wówczas pieprz, zauważyli
roślinę dodawaną na Antylach do potraw w celu zaostrzenia smaku.
W XVI wieku zaczęto uprawiać paprykę na południu Europy. Na
terenach podbitych przez Turków, czyli także w Bułgarii, hodowla
papryki bardzo się rozwinęła, dlatego też, w wielu krajach ostra
papryka nazywana była "pieprzem tureckim". W Bułgarii po dziś dzień paprykę w proszku
nazywa się "czerwen piper", czyli czerwony pieprz. W 1525 roku Portugalczycy rozpoczęli
uprawę papryki w Indiach. Wkrótce potem ostra papryka stała się nieodzownym składnikiem
wielu kuchni. Obecnie uprawianych jest około 200 odmian papryki słodkiej i ostrej o
przeróżnych kształtach, rozmiarach i kolorach.
Działanie:. Papryka pomaga w leczeniu zaburzeń krążenia, zapobiega
tworzeniu się skrzepów krwi i zawrotom głowy, łagodzi bóle migrenowe.
Naukowcy twierdzą, iż papryka ma korzystny wpływ na nasze samopoczucie,
działa jak afrodyzjak i podnosi koncentrację. Jednak jak wszystko w nadmiarze
może nam zaszkodzić.
Zastosowanie: Paprykę wykorzystuje się głównie jako przyprawę do dań, jest
też źródłem wielu witamin.
Skład chemiczny papryki: W latach dwudziestych naszego stulecia węgierski
biochemik Albert Szent - Gyorgi rozpoczął badania nad papryką. Wkrótce też
wyodrębnił z niej kwas askorbinowy - popularną witaminę C. W 1937 roku
został za to odkrycie wraz z papryką nagrodzony Nagrodą Nobla. Papryka
zyskała sławę, okazało się, że oprócz witaminy C ma jeszcze A, P, B1, B2.
Owoce papryki zawierają także wiele barwnych substancji, głównie: beta-
karoten, kapsantynę, kapsombinę, zaś za ostry smak odpowiada kapsycyna.
CH
3
OH
O
C
H
3
CH
3
C
H
3
CH
3
CH
3
CH
3
CH
3
OH
C
H
3
KAPSANTYNA
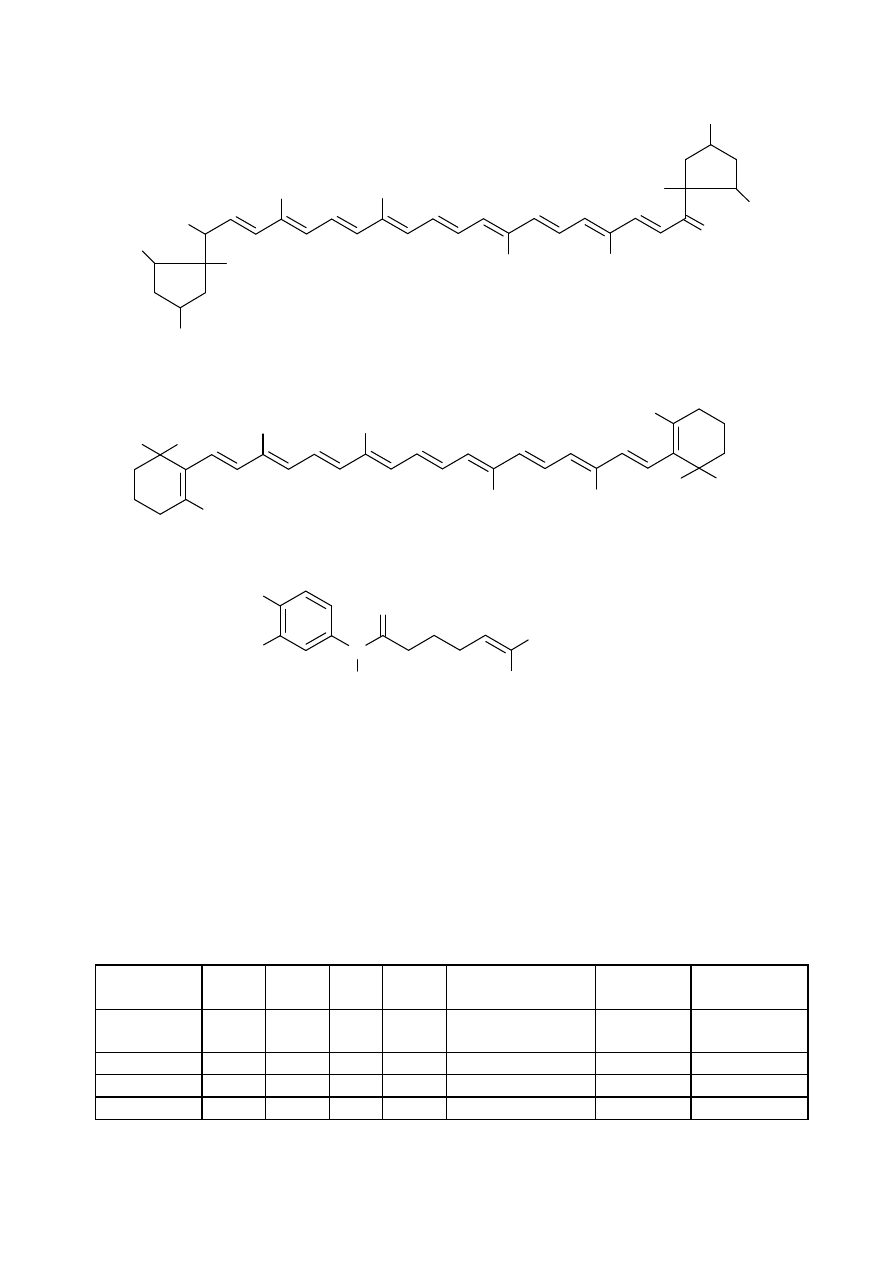
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
47
CH
3
OH
O
CH
3
CH
3
CH
3
CH
3
C
H
3
O
C
H
3
CH
3
OH
KAPSOMBINA
CH
3
C
H
3
CH
3
CH
3
C
H
3
CH
3
CH
3
CH
3
CH
3
C
H
3
beta-KAROTEN
O
H
O
H
N
O
CH
3
CH
3
H
KAPSYCYNA
2. Wykonanie ćwiczenia:
Odczynniki i materiały:
suszona papryka chlorek metylenu
chloroform etanol jod
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
D
20
/D
Rozpuszczalność w
H
2
O
Barwa
Zapach
Chlorek
metylenu
84,93
-95
40
1,33
nierozpuszczalny bezbarwny
słodki
Chloroform 119,38
-63
61
1,492
nierozpuszczalny bezbarwny
słodki
Etanol
46,07 -114,5 78,3
0,790
rozpuszczalny
bezbarwny
alkoholowy
Jod
253,81
113
184
4,930
rozpuszczalny
brunatna
słaby

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
48
W kolbie okrągłodennej o pojemności 250 ml umieszczono 5 g
sproszkowanej papryki i 100 ml chlorku metylenu, tak powstałą mieszaninę
silnie wytrząsano przez 15 minut. Mieszaninę przesączono, a z przesączu
usunięto nadmiar rozpuszczalnika na wyparce obrotowej. Zatężony przesącz
analizowano za pomocą chromatografii cienkowarstwowej, używając płytek
pokrytych żelem krzemionkowym i układu chloroform-etanol (1:20) jako
eluenta. (studenci sami dobierają skład eluentu). Chromatogramy wywołano za
pomocą par jodu.
Po przygotowaniu kolumny wypełnionej żelem krzemionkowym, na jej
szczyt naniesiono mieszaninę barwników papryki w 1 ml chloroformu, a
następnie kolumnę eluowano. Po zebraniu barwnych frakcji, zbadano ich
czystość za pomocą chromatografii cienkowarstwowej.
Aparatura:
Kolumna chromatograficzna z wypełnieniem żelowym, wyparka obrotową.
5.13. Ćwiczenie 13. Izolacja piperyny z pieprzu czarnego
1. Wprowadzenie:
PIEPRZ CZARNY (PIPER NIGRUM)
`Niekwestionowanym królem egzotycznych przypraw od
wieków jest pieprz. Jego ojczyzną jest Azja, "kraina, gdzie
pieprz rośnie" jak ją dawniej określano i do której w
życzeniach wysyłano osoby, których obecność była nie
pożądana przez rozmówców. W czasach gdy Arabowie
handlowali przyprawami, a także w późniejszych stuleciach słowem "pieprz" określano
wszystkie egzotyczne przyprawy. Owoc pieprzu jest prastarą przyprawą dietetyczną i lekiem
ludów Dalekiego Wschodu. Pierwsze plantacje pieprzu założono przypuszczalnie już 1000 lat
p.n.e. w zachodnich Indiach, na terenach obecnego stanu Bombaj. Stamtąd już jako roślina
uprawna pieprz został przeniesiony do innych części Indii, a później wraz z wędrówkami
ludności na Wyspy Archipelagu Malajskiego. Pierwsze informacje i próbki tej przyprawy
przynieśli do Europy żołnierze Aleksandra Wielkiego. W czasach Cesarstwa Rzymskiego
przyprawa była już znana w całym basenie Morza Śródziemnego. W okresie Średniowiecza to
właśnie pieprz był najważniejszym powodem, dla którego hiszpańscy i portugalscy odkrywcy
organizowali wyprawy morskie. W tamtych też czasach pieprz znajdował się często wśród
kosztownych i bardzo mile widzianych prezentów dla panujących książąt, papieży, biskupów
oraz innych wysoko postawionych osobistości. Ze względu na swoją wartość odgrywał
bardzo ważną rolę w handlu całego okresu średniowiecza. Pieprz był tak drogi, że Anglicy do
aromatyzowania potraw ziołowych zaczęli używać substytutów tej przyprawy. Służył często
jako środek płatniczy, a niekiedy ustalano nawet wysokość zobowiązań stron umowy według
wartości odpowiadającej ilości tego surowca. Przez wieki pieprz był "walutą wymienialną"
zarówno na Wschodzie, jak i Zachodzie. Był symbolem kupców, którzy handlowali
przyprawami a równocześnie świadectwem ich zamożności. Chińczycy nazywali go "fagarą",
to znaczy pieprzem żółtodrzewem ludzi Zachodu i uważali za egzotyczny substytut ich
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
49
własnej przyprawy przypominającej pieprz. Ojczyzną niekwestionowanego króla
egzotycznych przypraw jakim jest pieprz są Indie. Już w średniowieczu doceniono jego
wartość, która szybko sięgnęła cen szlachetnych kruszców i stała się powodem morskich
wypraw Portugalczyków i Hiszpanów, a następnie Holendrów i Anglików. Pieprz służył
często jako środek płatniczy, a niekiedy ustalano nawet wysokość zobowiązań stron umowy
według wartości odpowiadającej ilości tego surowca. Pieprz był tak drogi, że Anglicy do
aromatyzowania potraw zaczęli używać substytutów tej przyprawy. Hindusi zaś do tego
stopnia zachwycili się pieprzem, że nazwali go „klejnotem kuchni Indii”.
Działanie: Dodatek pieprzu sprzyja trawieniu, działa też lekko moczopędnie,
jest jednak niewskazany przy wszelkich dietach i dla osób ze skłonnościami do
podrażnień przewodu pokarmowego.
Zastosowanie: Pieprz czarny mielony jest powszechnie używaną przyprawą.
Dodaje się go do mięs, wędlin, pasztetów i ryb. Przyprawia się nim sałatki,
dania z warzyw, jaj i serów, a także ciepłe i zimne sosy.
Skład chemiczny: Ostry smak pieprzu czarnego pochodzi od zawartej głównie
w wierzchniej warstwie owocu - piperyny. Czarny pieprz zawiera: białko,
tłuszcz, błonnik, wapń, żelazo, magnez.
N
O
O
O
PIPERYNA
2. Wykonanie ćwiczenia:
Odczynniki i materiały:
Pieprz czarny Chlorek metylenu
Eter dietylowy Aceton
heksan Jod
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
d
20
/D
Rozpuszczalność w
H
2
O
Barwa
Zapach
Chlorek
metylenu
84,93
-97
40
1,325
nierozpuszczalny
bezbarwny
Słodki
Eter
dietylowy
74
-116,2
34,5
0,708
nierozpuszczalny
bezbarwny
Słodki
Heksan
86,18
-95
69
0,659
nierozpuszczalny
bezbarwny
Ostry
Aceton
58,08
-94
56
0,791
rozpuszczalny
bezbarwny
ostry
Jod
253,81
113
184
4,930
rozpuszczalny
brunatno-
ciemny
słaby

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
50
W kolbie okrągłodennej o pojemności 100 ml umieszczono 20 g zmielonego
pieprzu czarnego i zalano 40 ml chlorku metylenu. Mieszaninę ogrzewano pod
chłodnicą zwrotną przez 20 minut, następnie ochłodzono, a osad odsączono i
przemyto20 ml chlorku metylenu. Wykonano TLC. Przesącz odparowano na
wyparce obrotowej, a do oleistej cieczy dodano 12 ml eteru dietylowego,
mieszano 10 minut i odparowano eter na wyparce. Dodano kolejną porcję eteru i
delikatnie mieszano, zawartość kolby umieszczono w lodówce na 20 minut, po
czym osad odsączono i przemyto dwukrotnie 8 ml zimnego eteru. Suchy osad
przeniesiono do kolki stożkowej i rozpuszczono w 4 ml gorącej mieszaniny
heksan : aceton (2:3). Pozostawiono w temperaturze pokojowej, a następnie
chłodzono przez 30 minut. Osad odsączono, przemyto 8 ml zimnego eteru i
osuszono. Wykonano TLC.
Aparatura:
zestaw do ogrzewania pod chłodnicą zwrotną, wyparka obrotowa, rozdzielacz,
lejek Biichnera z kolbą próżniową.
5.14. Ćwiczenie 14. Aldehyd kuminowy z nasion kminku rzymskiego
1.
Wprowadzenie
KMIN RZYMSKI (Cuminum cyminum)
Kminek został znaleziony podczas wykopalisk z młodszej epoki
kamiennej sprzed 3000 lat p.n.e. Starożytni Grecy i Rzymianie
stosowali go jako środek ułatwiający trawienie ciężkostrawnych
potraw z fasoli i grochu. Od czasów panowania Karola Wielkiego
kminek uprawiano w przyklasztornych ogrodach. Kminek zwyczajny
był doskonale znany starożytnym Egipcjanom. Zachowane angielskie
rękopisy kulinarne świadczą, iż XIII wieczni mieszkańcy Albionu dodawali kminek do
zawijanych w słoninę i pieczonych kur.
Działanie:
Kminek zmniejsza lub usuwa całkowicie stany skurczowe w
przewodzie
pokarmowym,
przywraca
normalną
amplitudę
ruchów
perystaltycznych jelit, nieznacznie pobudza wydzielanie soków trawiennych,
ułatwia przyswajanie składników pokarmu oraz zapobiega wzdęciom,
szczególnie u małych dzieci i młodzieży, jest więc typowym środkiem
wiatropędnym. Ponadto wywiera słabe działanie moczopędne
Zastosowanie:
Kminek
jest
cenioną
przyprawa
ze
względu
na
charakterystyczny gorzko ostry smak i intensywny aromat
Skład chemiczny: Głównym składnikiem nasion kminu rzymskiego jest
aldehyd kuminowy.
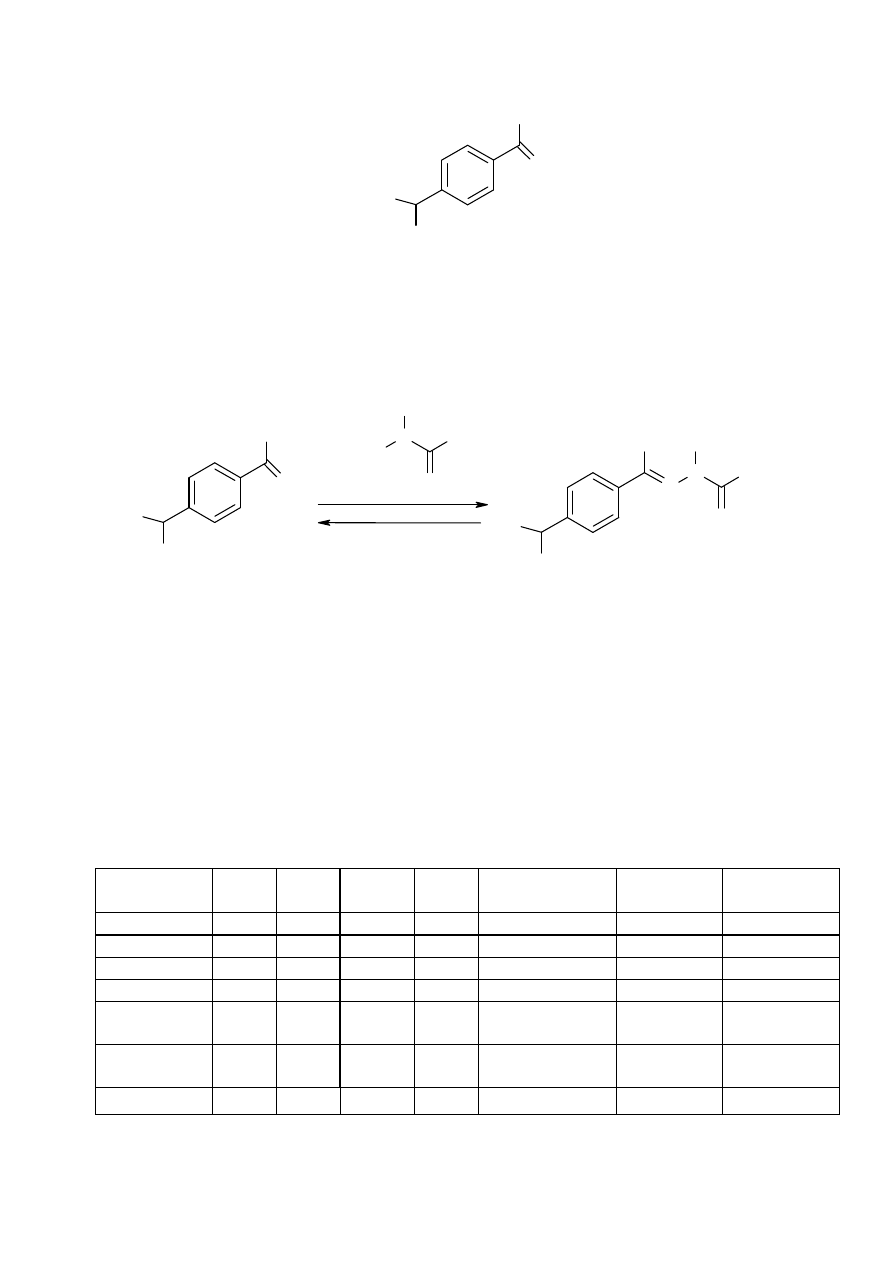
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
51
CH
3
C
H
3
H
O
ALDEHYD KUMINOWY
Wydziela się go poprzez ekstrakcję owoców i oddziela od pozostałych
składników ekstraktu na drodze chemicznej – przeprowadzając go w
semikarbazon:
CH
3
C
H
3
H
O
CH
3
C
H
3
H
N
N
NH
2
O
H
NH
2
N
N
H
2
H
O
2. Wykonanie ćwiczenia:
Odczynniki i materiały:
kmin rzymski
chloroform
metanol
kwas solny
bezwodny siarczan magnezu
chlorowodorek semikarbazydu
chlorek sodowy
etanol
octan sodu
zestaw do destylacji z parą wodną
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
D
20
/D
Rozpuszczalność
w H
2
O
Barwa
Zapach
Etanol
46,07 -114,5
78,3
0,790
rozpuszczalny
bezbarwny
alkoholowy
Metanol
32,04
-98
64,5
0,79
rozpuszczalny
bezbarwna
alkoholowy
Octan sodu
82,03
324
>400
1,52
rozpuszczalny
bezbarwna
bezwonny
Chloroform
119,38
-63
61
1,492 nierozpuszczalny bezbarwny
słodki
Chlorek
sodowy
58,44
801
1461
2,170
rozpuszczalny
bezbarwny
bezwonny
Siarczan
magnezu
120,37
1124
_
2,660
rozpuszczalny
biały
bezwonny
Kwas solny
36,45
-30
_
1,190
rozpuszczalny
bezbarwny
ostry

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
52
W kolbie okrągłodennej o pojemności 250 ml umieszczono 5 g zmielonych
owoców kminu rzymskiego i dodano 20 ml wody destylowanej.
Przeprowadzono destylację z parą wodną. Destylat ekstrahowano trzema 5
mililitrowymi porcjami chloroformu. Połączone ekstrakty chloroformowe
przemyto 4 mililitrowymi porcjami wody destylowanej i osuszono bezwodnym
siarczanem magnezu. Rozpuszczalnik odparowano na wyparce obrotowej.
Rozpuszczono 0,2g chlorowodorku semikarbazydu, 0,3g octanu sodu w
2ml wody i 3ml etanolu. Tak otrzymany roztwór dodano do otrzymanego olejku
eterycznego, ogrzewano przez 10 minut na łaźni wodnej, oziębiono i
pozostawiono do krystalizacji. Kryształy przesączono i otrzymany produkt
przekrystalizowano z metanolu.
Otrzymany semikarbazon wytrząsano przez godzinę z 5 ml 10% kwasu
solnego. Po przesączeniu roztwór ekstrahowano trzema 10 mililitrowymi
porcjami chloroformu. Połączone ekstrakty chloroformowe ekstrahowano wodą
nasyconą solanką i usunięto chloroform na wyparce obrotowej.
Aparatura:
zestaw do destylacji z parą wodną, wyparka obrotowa, rozdzielacz, lejek
Biichnera z kolbą próżniową.
5.15. Ćwiczenie 15. Wydzielanie i oznaczanie poziomu retinolu.
1. Wprowadzenie
Witamina A jest jedną z najwcześniej odkrytych witamin (stąd jej
oznaczenie pierwszą literą alfabetu). Głównym objawem niedoboru
witaminy A jest tzw. kurza ślepota, która polega na pogorszeniu się
zdolności widzenia o zmierzchu. Schorzenie to było znane już w
starożytności, kiedy to ludzie zdążyli odkryć, że spożywanie gotowanej
wątroby prowadzi do wyleczenia ślepoty zmierzchowej. Jednak dopiero
na początku XX wieku udało się ustalić związek między sposobem
odżywiania a pogorszeniem wzroku przy słabym oświetleniu. Dzięki
pracom m. in. F. Hopkinsa, W. Steppa i M. Davisa, wykazano, że mleko, masło czy żółtka jaj
zawierają rozpuszczalny w tłuszczach czynnik niezbędny do wzrostu zwierząt
doświadczalnych. W 1915 r. substancję tą nazwano - rozpuszczalny w tłuszczach czynnik A.
Od tego czasu poznano wiele innych doniosłych faktów, które krok po kroku, doprowadziły
do odkrycia witaminy A. Nieco później odkryto prowitaminę witaminy A czyli beta-karoten.
Stwierdzono, że beta-karoten będący barwnikiem roślinnym rozpuszczalnym w tłuszczach,
przekształca się w wątrobie w bezbarwny związek o aktywności witaminy A.
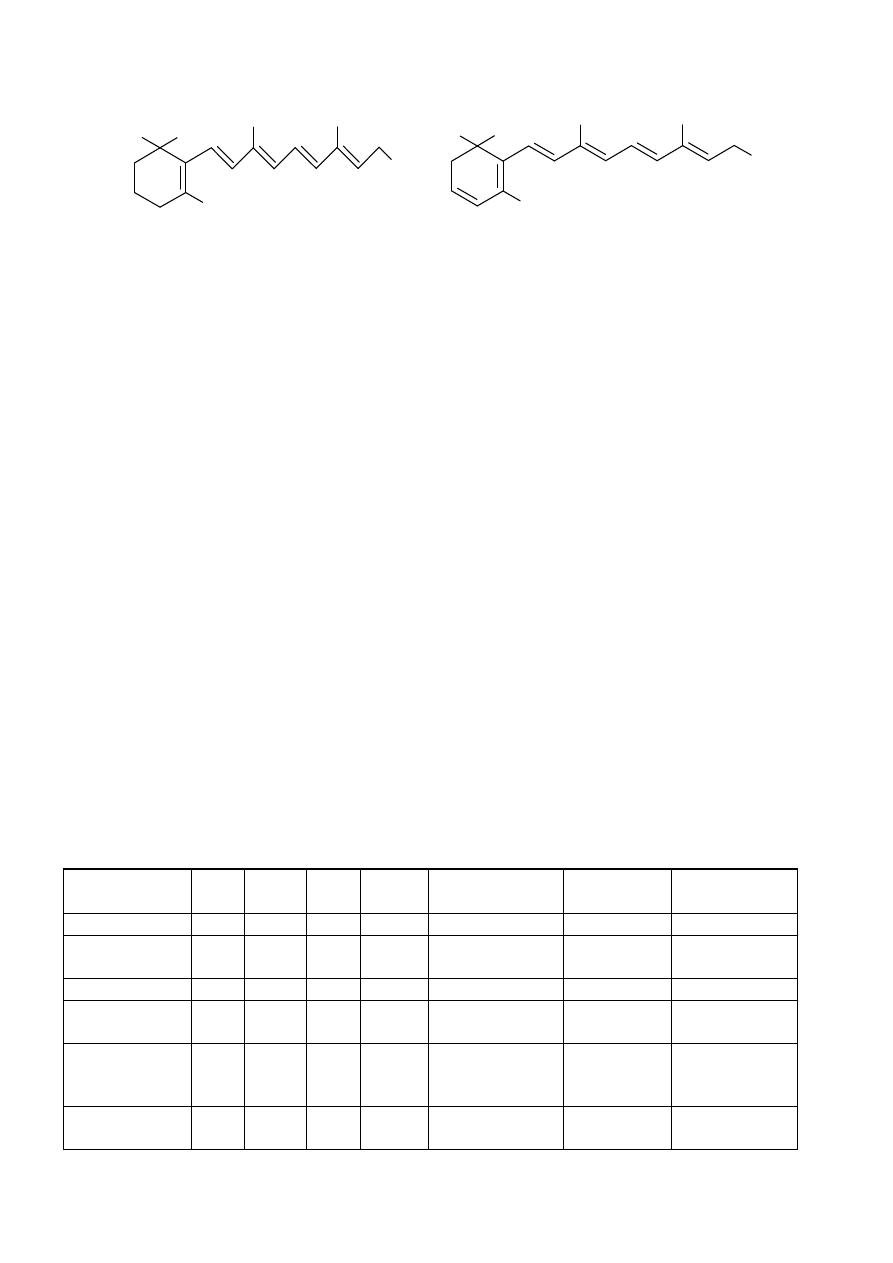
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
53
CH
3
C
H
3
CH
3
OH
CH
3
CH
3
C
H
3
CH
3
CH
3
OH
CH
3
CH
3
WITAMINA A1 WITAMINA A2
Retinol został wyizolowany po raz pierwszy z oleju otrzymanego z wątroby ryb
(tranu). Ciekawostką jest fakt, że wątroba ryb słodkowodnych zawiera retinol i dehydroretinol
(witaminę A2), zaś wątroba ryb morskich tylko retinol. Witamina A jest dostarczana
człowiekowi z pożywieniem. Dzienne zapotrzebowanie na retinol u dorosłego człowieka
wynosi około 0.67 mg. Niedobór tej witaminy powoduje tak zwaną kurza ślepotę.
Zapotrzebowanie na tę witaminę jest szczególnie wysokie u niemowląt. Dlatego tez retinol
jest standardowym dodatkiem do odżywki dla niemowląt.
Witamina A jest niezbędna dla prawidłowego rozwoju i funkcjonowania nie tylko
skóry, ale również dla wzrostu i zdrowia zębów, paznokci oraz włosów. Właściwie dozowana
w kosmetykach wykazuje korzystne oddziaływanie na skórę, włosy i paznokcie. Często
nazywana jest "czynnikiem normalizującym". Jest dobrze wchłaniana przez skórę, sprzyja
zachowaniu jej miękkości, gładkości, jędrności i młodego wyglądu. Pomaga również
zatrzymywać w skórze wodę, ta właściwość sprawia, że witamina A jest bardzo użyteczna w
radzeniu sobie z problemami związanymi z niekorzystnymi warunkami środowiska i porą
roku (suche powietrze, wysoka temperatura, zanieczyszczenia, promieniowanie słoneczne).
2. Wykonanie ćwiczenia:
Odczynniki i materiały:
askorbinian sodu
retinol (lub octan retinolu)
50% roztwór wodorotlenku potasu
etanol
0.5 molowy roztwór wodorotlenku potasu
heksan
0.1 molowy roztwór wodorotlenku sodu
metanol
odżywka dla niemowląt
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
D
20
/D
Rozpuszczalność
w H
2
O
Barwa
Zapach
Heksan
86,18
-95
69
0,661 nierozpuszczalny bezbarwny
benzyny
Metanol
32,04
-98
64,5
0,79
rozpuszczalny
bezbarwna
Charakterystycz
ny
Etanol
46,0 -114,5 78,3
0,790
rozpuszczalny
bezbarwny
alkoholowy
Retinol
r-ru
-
-
1,04
częściowo
Brązowa do
żółtej
charakterystyczn
y
Wodorotlenek
potasu 0,5
molowy
r-ru.
-
-
1,020
rozpuszczalny
bezbarwny
bezwonny
Wodorotlenek
sodu
r-ru.
-
-
1,050
rozpuszczalny
bezbarwny
bezwonny

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
54
Ekstrakcja retinolu z próbki żywności. W dwóch 250-mililitrowych
kolbach okrągłodennych, z których każda zaopatrzona jest w chłodnicę zwrotną
i mieszadło magnetyczne, umieszcza się po 10 g odżywki dla niemowląt, 1 g
askorbinianu sodu i 40 ml etanolu. Do jednej kolby dodaje się znaną ilość
retinolu (około 0.05 mg). Do tak przygotowanych roztworów wkrapla się po10
ml 50% roztworu wodorotlenku sodu i mieszaniny ogrzewa do wrzenia przez 30
minut, ciągle mieszając. Wówczas do hydrolizatu powoli dodaje się 60 ml
etanolu (przez szczyt chłodnicy zwrotnej) i mieszaninę chłodzi do temperatury
pokojowej. Mieszaninę przenosi się do rozdzielacza, dodaje 100 ml heksanu i
200ml 1–molowego roztworu wodorotlenku sodu. Po ekstrakcji zbiera się
warstwę heksanową. Ekstrakcję powtarza się jeszcze dwukrotnie. Warstwy
heksanowe łączy się i ekstrahuje kolejno 40-mililitrowymi porcjami: 0.5-
molowego wodorotlenku potasu i solanką. Ekstrakcję solanką prowadzi się tak
długo, aż faza wodna stanie się neutralna. Z fazy organicznej usuwa się heksan
na wyparce obrotowej w temperaturze niższej niż 40
°
C, celem uniknięcia
izomeryzacji retinolu. Do otrzymanego oleju dodaje się 5 ml heksanu i
ponownie odparowuje rozpuszczalnik. Procedurę tę powtarza się jeszcze
dwukrotnie. Ma to na celu usunięcie resztek wody z ekstraktu. Wysuszony
ekstrakt przenosi się za pomocą małych ilości do 5-mililitrowej kolby miarowej
i uzupełnia do kreski metanolem.
Pomiar stężenia retinolu w próbce. 25 µl otrzymanego ekstraktu poddaje
się na kolumnę chromatografu wysokorozdzielczego za pomocą strzykawki.
Używa się kolumny wypełnionej żelem krzemionkowym z oktadekasilanem.
Eluentem jest metanol w wodzie (85:15). Wyciek z kolumny bada się
spektrofotometrycznie przy 325 nm. W tych warunkach wszystkie izomery
retinolu wypływają z kolumny w czasie 10 minut. Niekiedy po 30 minutach
obserwuje się pik pochodzący od niewielkich ilości alfa-tokoferolu.
Ilość retinolu w próbce odżywki dla niemowląt oblicza się ze stosunku
wysokości bądź powierzchni pików tego związku w ekstraktach, zakładając, że
jeden ekstrakt zawiera X mg retinolu, zaś drugi (X + 0.05 mg) tego związku.
Aparatura:
zestaw do ogrzewania pod chłodnicą zwrotną, wyparka obrotowa, rozdzielacz,
kolumna chromatograficzna z wypełnieniem żelowym.

www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
55
5.16. Ćwiczenie 16. Określanie poziomu witaminy C w sokach owocowych.
1. Wprowadzenie
Witamina C - znana głównie pod nazwą kwasu askorbinowego.
Obejmuje
również
jego
pochodne
jak
np.
kwas
dehydroaskorbinowy, które wykazują takie samo działanie
biologiczne. Przed poznaniem jej budowy chemicznej była
nazywana czynnikiem przeciwgnilcowym. Zapobiegała, bowiem
gnilcowi, który znali już Wikingowie i zwalczali za pomocą
cebuli. W średniowieczu choroba ta dziesiątkowała rycerzy
krzyżowych, a na początku czasów nowożytnych stała się plagą
marynarzy. W końcu XV wieku Vasco da Gama podczas swej
podróży dookoła przylądka Dobrej Nadziei stracił 2/3 załogi z powodu gnilca. W miarę
rozwoju żeglugi dalekomorskiej masowe zachorowania na statkach zdarzały się coraz
częściej. Prowiant zabierany na statki (przetwory zbożowe, konserwowane mięso, tłuszcz)
miał dużą wartość kaloryczną lecz nie zawierał witaminy C. Gnilec nękał pierwszych
kolonizatorów Ameryki Północnej, występował wśród żołnierzy na wszystkich frontach w
czasie I wojny światowej. W 1928 roku Szent-György uzyskał z wyciągów z nadnerczy,
kapusty i pomarańczy związek, który wykazywał właściwości oksydoredukcyjne. Szent-
György nie zdawał sobie sprawy, że związek ten to witamina C nazwana przez niego kwasem
heksuronowym. W 1932 roku Wang i King otrzymali witaminę C z cytryny. W rok później
Haworth, Hirst i współpracownicy ustalili budowę chemiczną witaminy C. W latach 1933-34
Reichstein i współpracownicy dokonali syntezy kwasu askorbinowego.
O
O
OH
O
H
OH
O
H
WITAMINA C
Głównym źródłem witaminy C są świeże oraz właściwie przetworzone owoce i warzywa.
W świecie zwierzęcym znajduje się bardzo mało witaminy C. Wyjątek stanowią nadnercza,
grasica, przysadka mózgowa, ciałko żółte, ciałko rzęskowe, ciecze śródoczne, tęczówka i
soczewka oka. Mleko krowie zawiera jej około 2 mg%.
Dzienne zapotrzebowanie człowieka na tę witaminę wynosi 70-100 mg i dlatego w wielu
krajach jej zawartość w sokach uzyskiwanych z owoców cytrusowych regulowana jest
specjalnymi normami.
2. Wykonanie ćwiczenia:
Odczynniki i materiały
kwas askorbinowy
jodek potasu
celit
bromoimid kwasu bursztynowego
kwas octowy
skrobia
kwas szczawiowy
sok z cytrusów
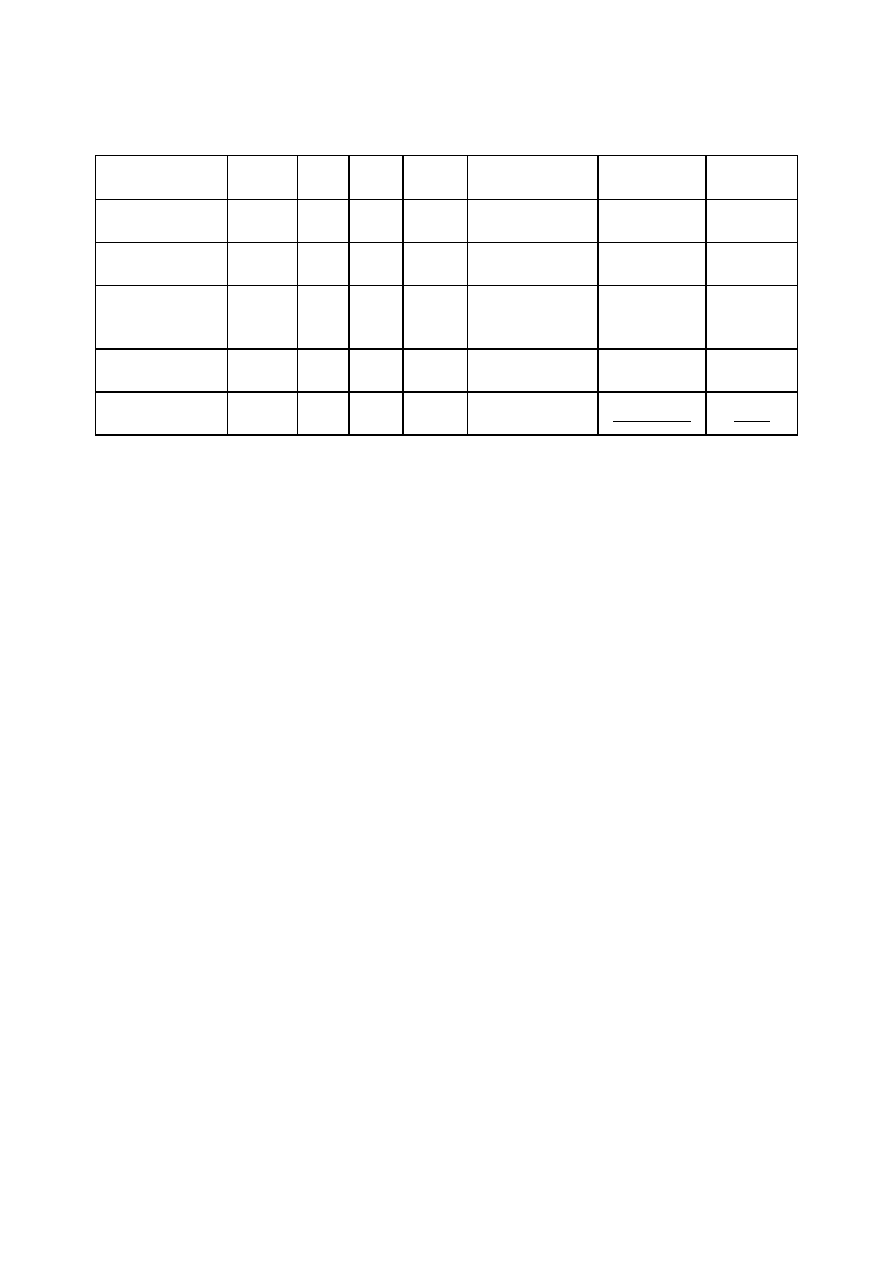
www.smmb.ch.pwr.wroc.pl/dydaktyka.htm
56
Właściwości fizykochemiczne substancji użytych:
Substancja
M. cz.
T.t.
[ºC]
T.w.
[ºC]
D20/D
Rozpuszczalność
w H
2
O
Barwa
Zapach
Kwas
askorbinowy
176,13
192 >192
-
rozpuszczalny
biały
bezwonny
Jodek potasu
166,01
686
1330
3,13
rozpuszczalny
bezbarwna do
białej
bezwonny
N-bromoimid
kwasu
bursztynowego
177,99
174-
179
-
-
rozpuszczalny
biała
charakteryst
yczny
Kwas
szczawiowy 5%
r-ru
-
-
1,020
rozpuszczalny
bezbarwny
bezwonny
Kwas octowy
25%
r-ru
-10
101
1,035
rozpuszczalny
bezbarwny
ostry
Przygotowanie roztworu do miareczkowania. Do 40 ml soku z
cytrusów dodaje się 0.2 g kwasu szczawiowego i roztwór miesza do momentu
rozpuszczenia kwasu (kwas szczawiowy jest stabilizatorem i zapobiega
utlenianiu witaminy C tlenem z powietrza). Następnie do tak przygotowanego
soku dodaje się celitu, tak aby utworzyła się rzadka pasta i całość sączy się
przez lejek Buchnera lu lejek ze szklanym spiekiem. Sączenie powinno być
procesem szybkim i jeśli zachodzi wolno, to do mieszaniny należy dodać
dodatkową porcję celitu.
Miareczkowanie roztworem N-bromoimidu kwasu bursztynowego.
Miareczkowanie to polega na utlenianiu kwasu askorbinowego (witaminy C) w
poniższej reakcji:
Utleniacz standaryzuje się roztworem mieszaniny kwasu szczawiowego i
askorbinowego. W tym celu przyrządza się 250 ml roztworu zawierającego 2 g
kwasu szczawiowego i 25 g kwasu askorbinowego w wodzie destylowanej.
W kolbie stożkowej o pojemności 100 ml umieszcza się 5 ml 4%
roztworu jodku potasu, 2 ml 10 % roztworu kwasu octowego oraz trzy krople
indykatora skrobiowego. Do tak przygotowanego roztworu dodaje się 25 ml
standardowego roztworu kwasów askorbinowego i szawiowego i mieszaninę
miareczkuje 0.01-molowym wodnym roztworem N-bromoimidu kwasu
bursztynowego. Trwałe, niebieskie zabarwienie mieszaniny świadczy o
zakończeniu miareczkowania. Miareczkowanie powtarza się, używając 5 ml
próbek soku z owoców cytrusowych. Zawartość witaminy C w roztworze
oblicza się, porównując ilości zużytych roztworów na zmiareczkowanie soku i
roztworu wzorcowego.
Aparatura:
Biureta z kolbą stożkową, lejek Biichnera z kolbą próżniową.
---Koniec---
Wyszukiwarka
Podobne podstrony:
Piperyna sprawko PŁ, chemia produktów naturalnych, ćw. 5 PIPERYNA
analiza NMR, chemia produktów naturalnych
cw-8 EKSTRAKCJA-KOFEINY, chemia produktów naturalnych, ćw. 1 KOFEINA
Chemia produktów naturalnych
03 Otrzymywanie estrów zapachowych, Biotechnologia, chemia produktów naturalnych
06 Synteza Indygo, Biotechnologia, chemia produktów naturalnych
Sprawozdanie z PŁ, chemia produktów naturalnych, ćw. 1 KOFEINA
Co wpływa na przesunięcie w widmach NMR, chemia produktów naturalnych
05 Barwniki w papryce, Biotechnologia, chemia produktów naturalnych
02 Wiskoza - Włókno celulozowe, Biotechnologia, chemia produktów naturalnych
TLC podstawy, chemia produktów naturalnych, ćw. 1 KOFEINA
04 Olejki eteryczne, Biotechnologia, chemia produktów naturalnych
Piperyna sprawko PŁ, chemia produktów naturalnych, ćw. 5 PIPERYNA
Chemia żywnosci Cwiczenie laboratoryjne nr 1 wyodrebnianie i badanie własciwosci fizykochemicznych b
7, Technologia chemiczna, Chemia fizyczna, 3 semestr, laboratorium
Pomiar napięcia powierzchniowego cieczy metodą stalagmomet, Technologia chemiczna, Chemia fizyczna
więcej podobnych podstron