
1 |
S t r o n a
WERONIKA ADAMCZYK 185765 AGNIESZKA BOMBAŁA 185799
LABORATORIUM BIOFIZYKA. DWICZENIE
NR 7
WYZNACZANIE STAŁEJ DYSOCJACJI PKA SŁABEGO KWASU METODĄ
KONDUKTOMETRYCZNĄ.
WSTĘP TEORETYCZNY:
Elektrolitami nazywamy substancje, które w roztworze wodnym ulegają procesowi rozpadu na jony, czyli
dysocjacji elektrolitycznej proces ten zachodzi pod wpływem działania rozpuszczalnika na związek chemiczny
stanowiący elektrolit. Do elektrolitów zalicza się kwasy, zasady i sole.
Za przewodnictwo elektrolitów są odpowiedzialne jony które możemy podzielid na dodatnie (kationy) i ujemne
(aniony). Kationy przemieszczają się w kierunku bieguna ujemnego, a aniony w kierunku bieguna dodatniego
(anody).
Miarą przewodnictwa elektrolitu jest przewodnictwo właściwe, które definiujemy jako przewodnictwo 1cm
3
roztworu. Przewodnictwo właściwe κ
można obliczyd ze wzoru:
gdzie R *Ω] jest oporem warstewki elektrolitu o przekroju S [cm
2
+ i długości l [cm].
Przewodnictwem równoważnikowym nazywamy przewodnictwo właściwe odniesione do przewodnictwa
centymetrowej warstewki roztworu zawierającej jeden gramorównoważnik substancji.
Przewodnictwo równoważnikowe można zatem wyrazid wzorem:
gdzie c oznacza stężenie normalne roztworu.

2 |
S t r o n a
Do wyznaczania stałej dysocjacji wykorzystałyśmy metodę konduktometryczną jest to metoda
elektroanalityczna oparta na pomiarze przewodności elektrolitów, która zmienia się wraz ze zmianą stężenia
jonów. Pomiarów przewodności roztworu dokonuje się za pomocą konduktometrów. Na podstawie tych
wyników określa się stężenie badanego roztworu w odniesieniu do danych wzorcowych.
CEL:
Celem dwiczenia jest wyznaczenie stałej dysocjacji pK
a
słabych kwasów metodą konduktometryczną.
SPRZĘT :
Konduktometr
Zlewka 100ml
Zlewka 50ml
Cylinder miarowy 50ml (o błędzie ±0,5ml)
Biureta 25ml (o błędzie ±0,1ml)
ODCZYNNIKI:
CH
3
COOH o stężeniu 0,0005 M
CH
3
COONa o stężeniu 0,0005 M
NaOH o stężeniu 0,0005 M
HCl o stężeniu 0,0005 M
PRZEBIEG DOŚWIADCZENIA:
Na początku sporządziłyśmy 75 ml roztworu NaCl o stężeniu 0,005 mol/dm
3
. W tym celu dodałyśmy do 75 ml
wody destylowanej 7,5 ml roztworu NaCl o stężeniu 50 mM.
Następnie do zlewki o pojemności 100 ml wlałyśmy 75 ml kwasu octowego i zmierzyłyśmy jego przewodnictwo
właściwe. Przy pomocy pipety usuwałyśmy 5 ml roztworu i dodawałyśmy 5 ml wody destylowanej.
Zmierzyłyśmy przewodnictwo. Czynności te powtarzałyśmy do momentu uzyskania 6 pomiarów ( czynności te
powtarzałyśmy także dla CH
3
COONa, NaOH, HCl).
WYNIKI POMIARÓW:
Przewodnictwo wody destylowanej:
3 |
S t r o n a
CH
3
COOH
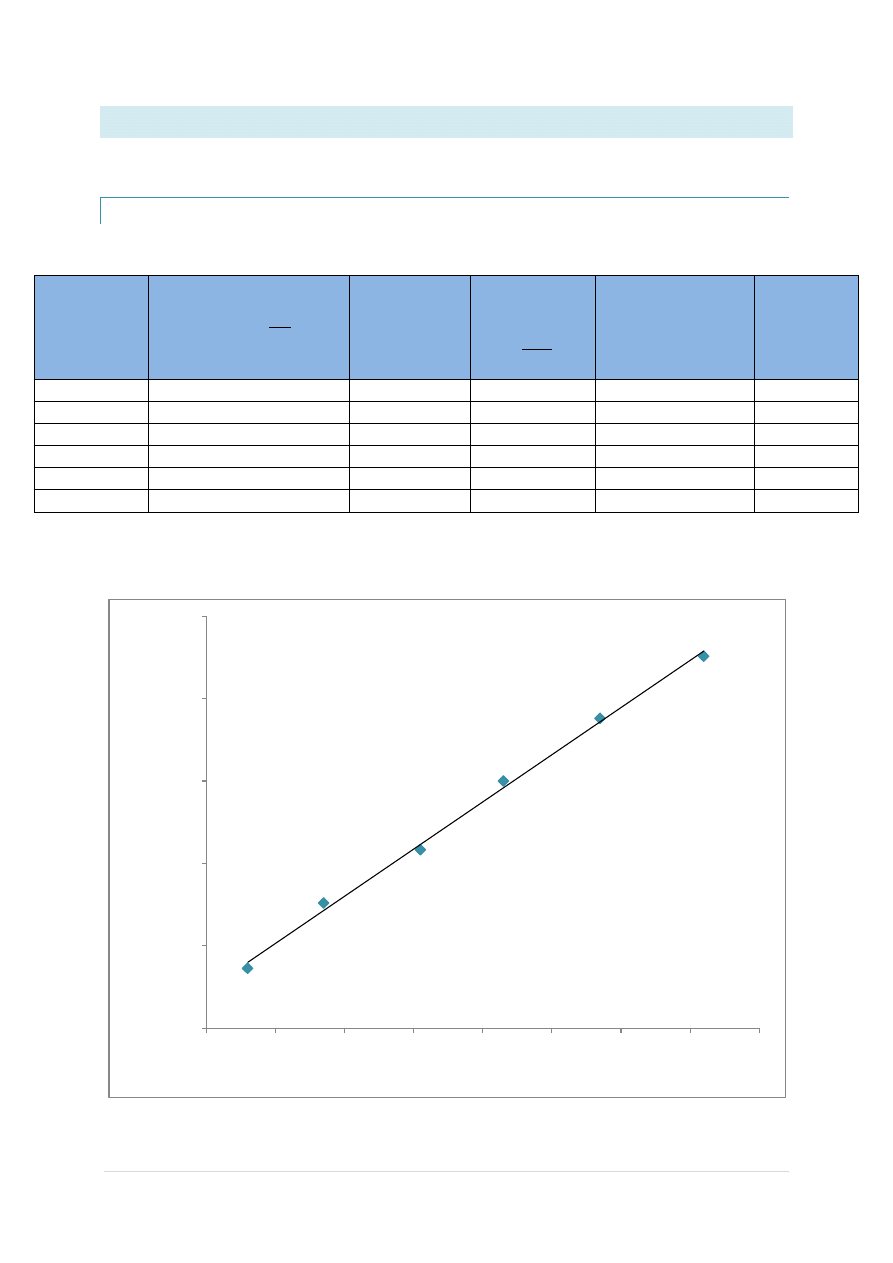
METODA I
Nr pomiaru
stężenie
przewodnictwo[S]
Przewodnictwo
równoważnikowe
Ω
1/λ
c*λ
1
(50,0000
(392
78,400
0,01276
0,392
2
(377
80,79
0,01238
0,377
3
(363
83,34
0,011999
0,363
4
(351
86,34
0,011582
0,351
5
(337
88,8
0,011259
0,337
6
(326
92,1
0,010863
0,326
0,0105
0,0110
0,0115
0,0120
0,0125
0,0130
0,32
0,33
0,34
0,35
0,36
0,37
0,38
0,39
0,4
1/
λ
c*λ

4 |
S t r o n a
P
1
=(0,33 ; 0,0110)
P
2
=(0,34 ; 0,0113)
P
1
: 0,011=a*0,33+b
P
2
:0,0113=a*0,34+b
Wyznaczamy równanie prostej:
y = 0,03a + 0,0011
Wartośd przecięcia się prostej z osią y wyliczamy z równania prostej:
y = 0,03a + 0,0011
232,7
Obliczamy wartośd stałej dysocjacji K
a
za pomocą wzoru:
±0,25
5 |
S t r o n a
CH
3
COONA
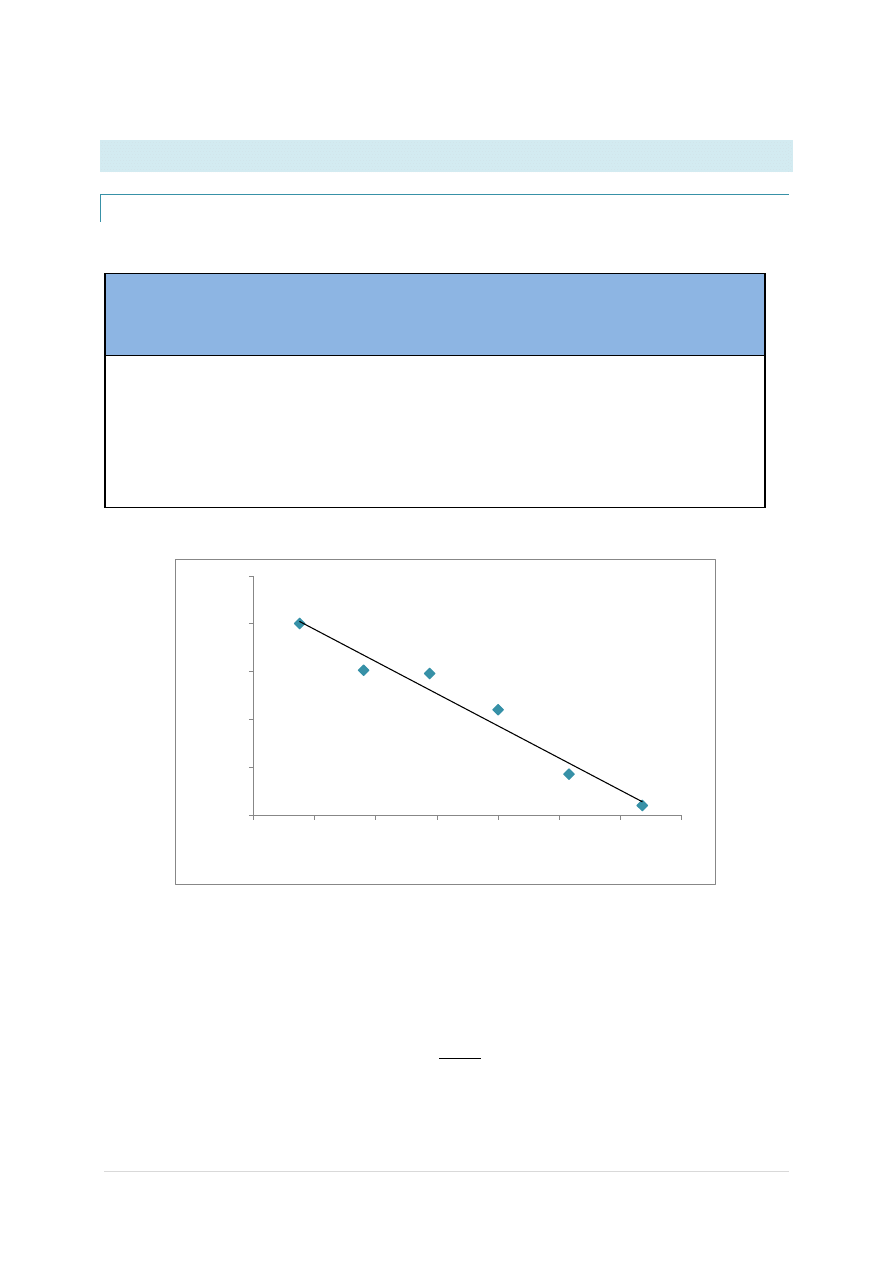
METODA II
numer
roztworu
stężenie c
√c
przewwodnictwo
κ
przewodnictwo
równoważnikowe
λ
mol*dm^-3
1/
Ω*cm
cm^2/Ω*mol
1
0,005
0,070710678
0,00383
766
2
0,004666667
0,068313005
0,00359
769,2857143
3
0,004355556
0,065996633
0,00338
776,0204082
4
0,004065185
0,063758805
0,00317
779,7922741
5
0,003794173
0,061596857
0,00296
780,1436901
6
0,003541228
0,059508218
0,00278
785,0384141
Wyznaczamy równanie prostej:
y = -1681,9x+885,34
Przewodnictwo równoważnikowe zaś ze wzoru:
Wartośd przecięcia się prostej z osią y wyliczamy z równania prostej:
765
770
775
780
785
790
0,058
0,06
0,062
0,064
0,066
0,068
0,07
0,072
λ
√c
6 |
S t r o n a
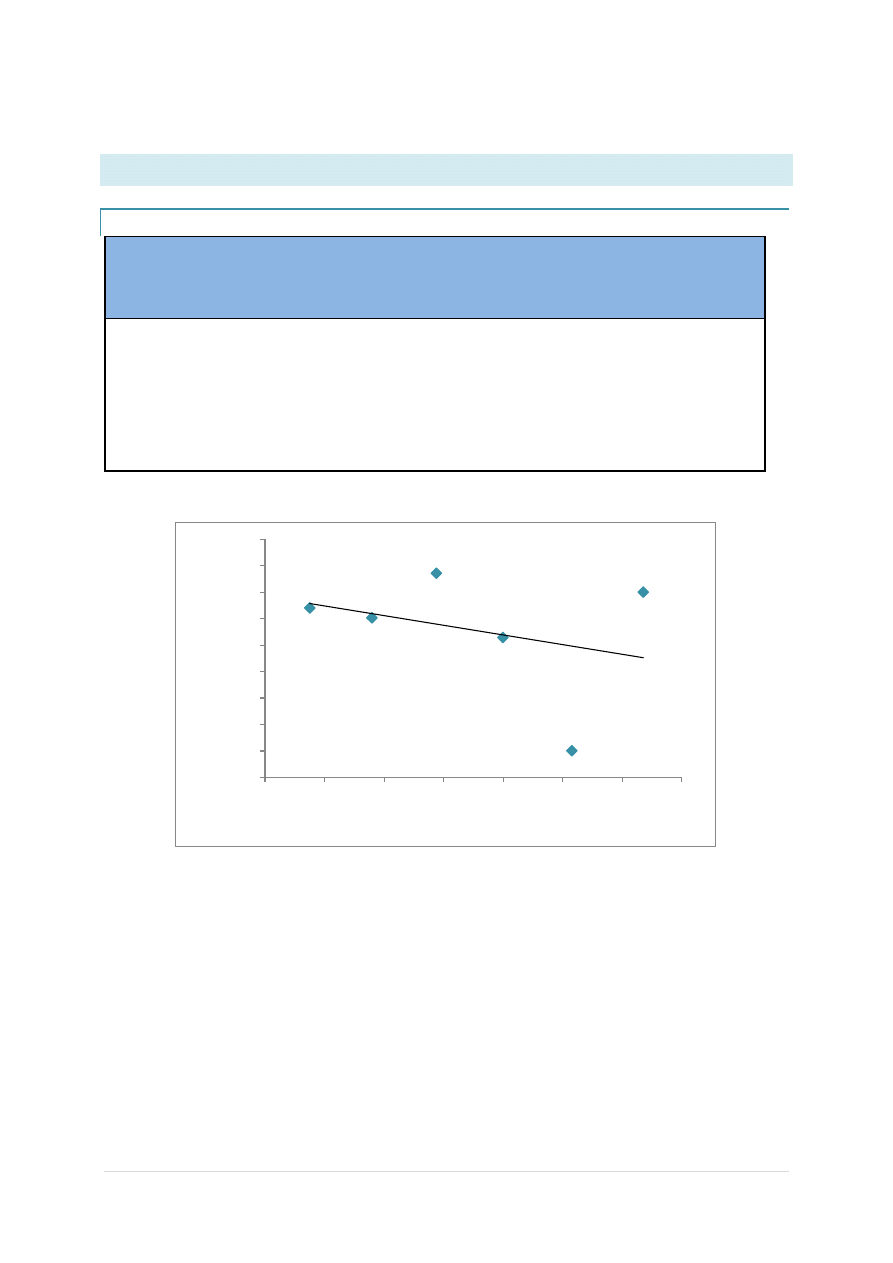
NACL
METODA II
numer
roztworu
stężenie c
√c
przewwodnictwo
κ
przewodnictwo
równoważnikowe
λ
mol*dm^-3
1/
Ω*cm
cm^2/Ω*mol
1
0,005
0,070710678
0,00219
438
2
0,004666667
0,068313005
0,00203
435
3
0,004355556
0,065996633
0,001904
437,1428571
4
0,004065185
0,063758805
0,001782
438,356414
5
0,003794173
0,061596857
0,00166
437,5130154
6
0,003541228
0,059508218
0,00155
437,701274
Wyznaczamy równanie prostej:
y = -91,288+443,22
Wartośd przecięcia się prostej z osią y wyliczamy z równania prostej:
y = -91,288x + 443,22
R² = 0,1027
434,5
435
435,5
436
436,5
437
437,5
438
438,5
439
0,058
0,06
0,062
0,064
0,066
0,068
0,07
0,072
λ
√c
7 |
S t r o n a
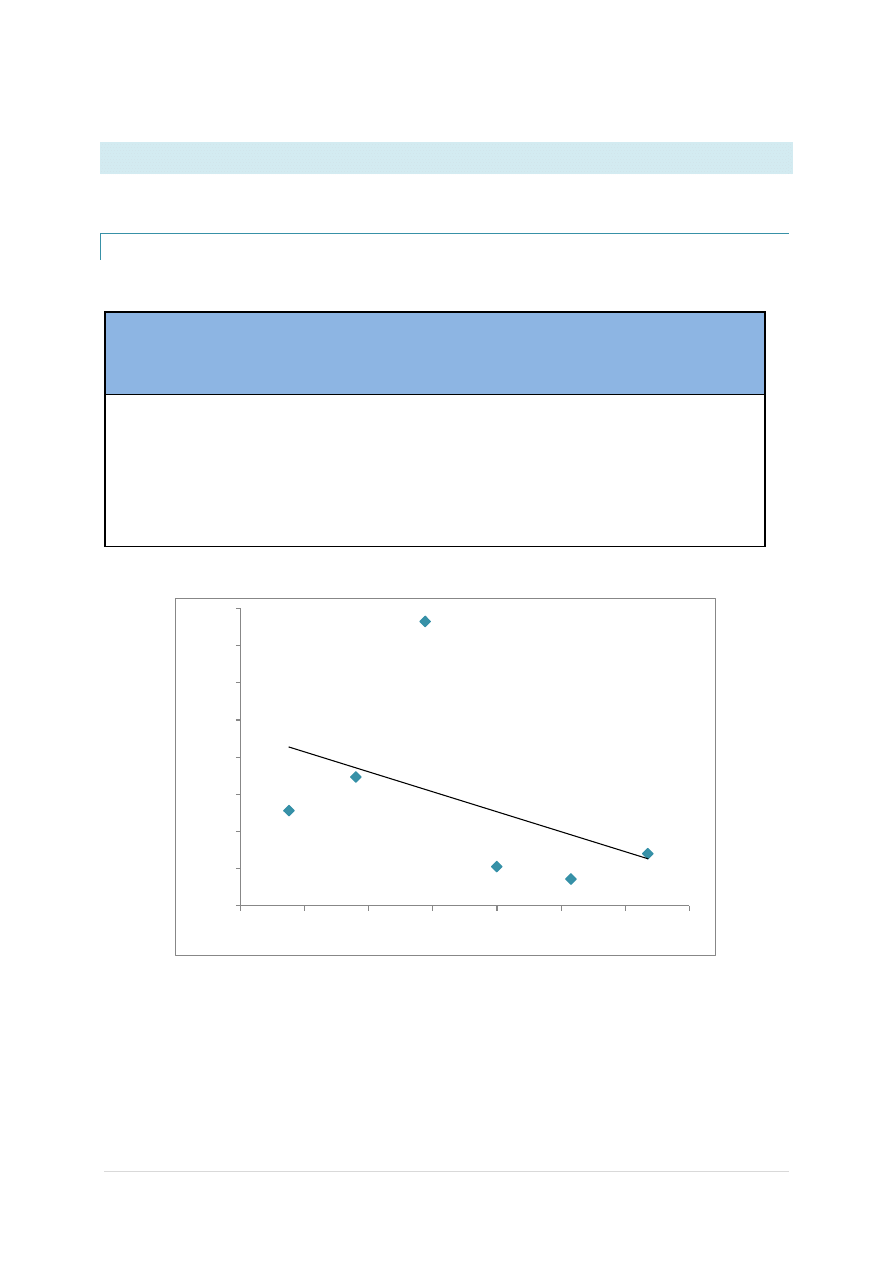
HCL
METODA II
numer
roztworu
stężenie c
√c
przewwodnictwo
κ
przewodnictwo
równoważnikowe
λ
mol*dm^-3
1/
Ω*cm
cm^2/Ω*mol
1
0,005
0,070710678
0,000576
115,2
2
0,004666667
0,068313005
0,000536
114,8571429
3
0,004355556
0,065996633
0,000501
115,0255102
4
0,004065185
0,063758805
0,000481
118,321793
5
0,003794173
0,061596857
0,000441
116,2308673
6
0,003541228
0,059508218
0,00041
115,7790467
Wyznaczamy równanie prostej:
y = -134,21x+124,62
Wartośd przecięcia się prostej z osią y wyliczamy z równania prostej:
114,5
115
115,5
116
116,5
117
117,5
118
118,5
0,058
0,06
0,062
0,064
0,066
0,068
0,07
0,072
λ
√c
8 |
S t r o n a
PKA
Graniczne przewodnictwo równoważnikowe obliczamy ze wzoru:
numer
roztworu
stężenie c
√c
przewwodnictwo
κ
przewodnictwo
równoważnikowe
λ
α
Ka
pKa
mol*dm^-
3
1/Ω*cm
cm^2/Ω*mol
1
0,005
0,070711
0,000392
78,4
0,138335
0,000111
9,105582
2
0,004667
0,068313
0,000377
80,78571429
0,142545
0,000111
9,109725
3
0,004356
0,065997
0,000363
83,34183673
0,147055
0,00011
9,111143
4
0,004065
0,063759
0,000351
86,34293003
0,15235
0,000111
9,103156
5
0,003794
0,061597
0,000337
88,82041337
0,156722
0,000111
9,110399
6
0,003541
0,059508
0,000326
92,0584615
0,162435
0,000112
9,100979
Obliczamy wartośd stałej dysocjacji K
a
i stopnia dysocjacji α za pomocą wzoru:
⁄
Zaś pKa obliczamy:
PRZYKŁADOWE OBLICZENIA
|
|
|
|
|
|
|
|

9 |
S t r o n a
WNIOSKI
Wartośd tablicowa pKa dla CH
3
COOH wynosi 4,80 w temperaturze 25°C. Wynik uzyskany metodą I jest
bliższy tej wartości (4,39±0,25). Wynik z metody II dwukrotnie tablicową wartośd przewyższa. Sama
wartośd tablicowa jest nieadekwatna do warunków w jakich było przeprowadzane doświadczenie
(temperatura wynosiła 22.2°C) zatem stąd mogą wynikad nieścisłości wyników. Co do samych metod:
Metoda I jest niejako bezpośrednia, co wpływa na jej dokładnośd wyznaczenia szukanej wielkośdi.
Metoda II jest pośrednia i same wyniki pomiarów nie są zgodne z tym, na co byśmy liczyli, gdyż
pomiary się często wahają (dla HCl lub NaCl), zamiast przebiegad według zależności liniowej.
Na te wyniki ma również wpływ błąd wynikający z rozcieoczania roztworów kilkukrotnie,
niedokładności sprzętu laboratoryjnego i samych przeprowadzających doświadczenie. Konduktometr
też wpływa na błędny pomiar, poprzez chociażby przeoczone bąble powietrza czy też resztki substancji
mierzonej wcześniej, co zmienia wyniki.
Wyszukiwarka
Podobne podstrony:
ADA wyjatki przerw3
BOM calki
bom simple
Ada Styk Projekt4
ADA wspolbiezn 24
Ada Opala
FCZ-KT by Ada, Psychologia, testy
APIS-Z by Ada(2), diagnostyka
Ada czy to wypada, Przedszkole 3 latki
Ada Styk Projekt1
ADA wyjatki przerw6
ada polrola
testy z administ odp-Ada[1], UAM administracja, P. Administracyjne, Nowy folder
ada
microstep bom
Ada Styk Projekt3
bom
więcej podobnych podstron