
PODSTAWY OBLICZEŃ CHEMICZNYCH

S
TECHIOMETRIA
to dział chemii zajmujący się stosunkami ilościowymi
przemian związków chemicznych zachodzących w czasie
reakcji chemicznych. Jest to zatem dziedzina zajmująca się
ustaleniem w jakich proporcjach ilościowych reagują ze sobą
związki chemiczne i jakie są proporcje substratów do
produktów. Proporcje te wylicza się na podstawie równań
chemicznych analizowanych reakcji oraz znajomości mas
cząsteczkowych substratów i produktów.
Stechiometria umożliwia interpretację
ilościową zjawisk chemicznych.

S
TECHIOMETRIA
Do obliczeń stechiometrycznych niezbędne są:
znajomość wzorów chemicznych,
umiejętność uzgadniania reakcji chemicznych,
znajomość chemicznych jednostek masy,
znajomość podstawowych praw chemicznych i fizycznych
Obliczenia oparte o prawa chemiczne, wzory sumaryczne oraz
zbilansowane równania reakcji chemicznych nazywamy
obliczeniami stechiometrycznymi.
Na ich podstawie można rozwiązać wiele zagadnień takich jak:
•
obliczenia składu procentowego związku chemicznego,
•
obliczenia niezbędnej ilości substratów do przeprowadzenia reakcji
chemicznej,
•
obliczenia ilości produktów otrzymanych w wyniku reakcji,
•
obliczenia wydajności reakcji chemicznej

M
ASA
ATOMOWA
I
CZĄSTECZKOWA
1u = 1,66057×10
-27
kg = 1,66057×10
-24
g
Bezwzględna masa atomu
(cząsteczki) to masa wyrażona w gramach
W obliczeniach chemicznych używa się z reguły dwóch jednostek masy:
gram (g) i międzynarodowej atomowej jednostki masy unit (u).
Wzorcem dla określenia unitu stał się w 1961 roku izotop węgla
12
C.
Za atomową jednostkę masy (u) przyjęto 1/12 masy izotopu węgla
12
C.
u /unit/ = 1/12 masy izotopu węgla
12
C
Masę atomu wyrażoną w unitach nazywamy masą atomową.
Jest to liczba określająca ile razy masa jednego reprezentatywnego
atomu danego pierwiastka chemicznego jest większa od 1/12 masy
atomu izotopu węgla
12
C, (pod pojęciem „reprezentatywnego atomu”
rozumie się atom o średniej masie wyliczonej proporcjonalnie ze
wszystkich stabilnych izotopów danego pierwiastka, ze względu na ich
występowanie na Ziemi).
Masę cząsteczki wyrażoną w unitach nazywamy masą
cząsteczkową.

M
OL
I
MASA
MOLOWA
MOL
– jest to ilość materii zawierająca liczbę atomów,
cząsteczek, jonów równą liczbie atomów zawartych w 0,012 kg
nuklidu węgla
12
C. Mol należy do podstawowych jednostek
układu SI.
Liczba moli (n)= masa (m)/ masa molowa (M)
Liczba moli (n)= liczna czasteczek (N)/ liczba Avogadra (N
A
)
Avogadra
liczba
10
6,02
N
10
6,02
mol
1
23
A
23
drobin
Masa molowa, to masa jednego mola atomów, bądź
cząsteczek, bądź jonów.
Masę molową wyrażamy w gramach/mol.
Masa molowa odpowiada liczbowo masie atomowej (masie
cząsteczkowej)

P
ODSTAWOWE
P
RAWA
C
HEMICZNE
Prawo zachowania masy (Łomonosow, Lavoisier
– XVIII w)
Prawo stałości składu (prawo stałych stosunków
wagowych, Proust – 1799)
Prawo wielokrotnych stosunków wagowych
(Dalton 1803)
Prawo Avogadra (Avogadro – 1811)
Prawo prostych stosunków objętościowych (Gay
– Lussac 1808)
P
RAWO
Z
ACHOWANIA
M
ASY
W świetle prawa równoważności masy i energii (E = mc
2
) prawo
zachowania masy nie jest ściśle spełnione. Jednakże podczas reakcji
chemicznych wymieniane ilości energii są na tyle małe, że zmiana masy
układu nie jest wykrywalna standardowymi metodami, stąd przyjmuje się
stałość masy układu reakcyjnego.
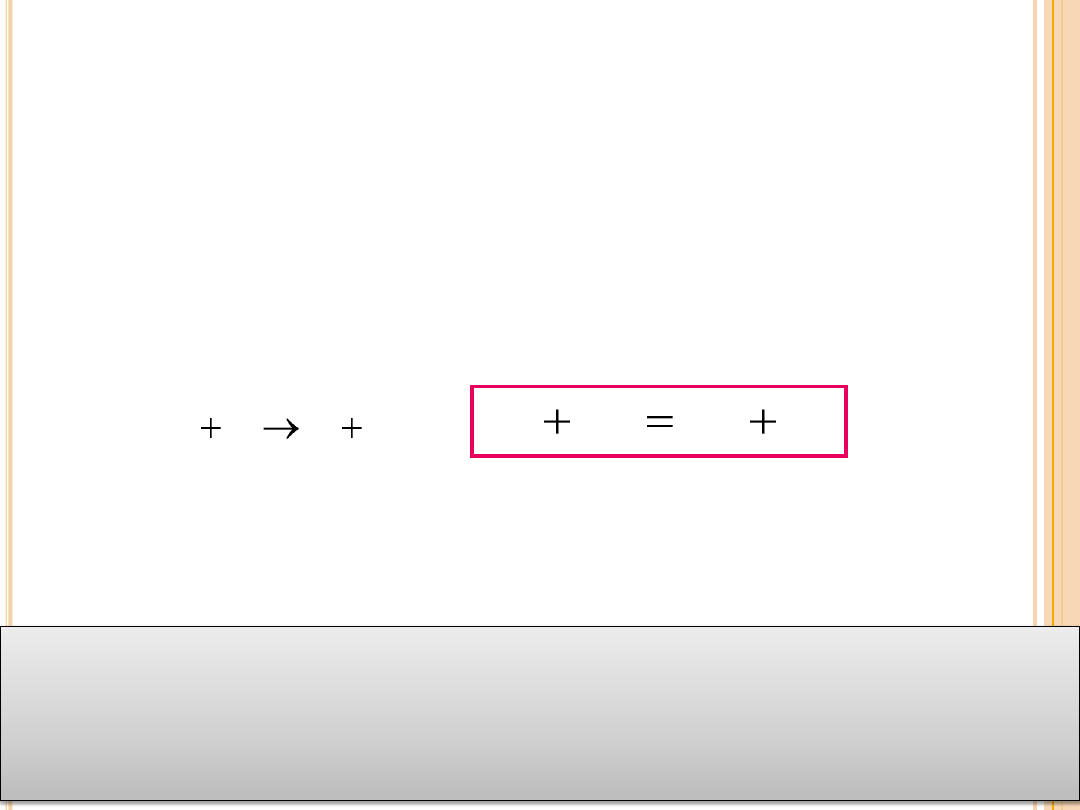
W układzie zamkniętym masa substratów wchodzących w
reakcję chemiczną równa jest masie jej produktów, czyli
masa substancji biorących udział w reakcji chemicznej nie
zmienia się.
Jeżeli masy substratów A i B oznaczymy jako m
A
i m
B,
zaś masy
produktów C i D jako m
C
i m
D
, to zachodzi równość:
Z prawem zachowania masy wiąże się konieczność bilansowania równań
reakcji
chemicznych,
czyli
dobierania
współczynników
stechiometrycznych w taki sposób, aby liczba (ilość moli) atomów danego
pierwiastka po obu stronach równania była taka sama.
D
C
B
A
D
C
B
A
m
m
m
m

P
RAWO
S
TAŁOŚCI
SKŁADU
Stosunek
ilości
wagowych
(mas)
pierwiastków
wchodzących w skład danego związku chemicznego jest
zawsze stały i charakterystyczny dla tego związku.
Wynika z niego że:
każdy związek chemiczny ma ściśle określony i zawsze stały skład
chemiczny.
pierwiastki reagują ze sobą w ściśle określonych stosunkach mas
(stosunku wagowym).
Gdy dwa pierwiastki tworzą ze sobą więcej niż jeden
związek
chemiczny,
to
ilości
wagowe
jednego
pierwiastka przypadające na tę samą ilość wagową
drugiego pierwiastka można wyrazić przy pomocy
stosunku (najczęściej niewielkich) liczb całkowitych.
P
RAWO
WIELOKROTNYCH
STOSUNKÓW
WAGOWYCH

P
RAWO
A
VOGADRA
Jednakowe objętości gazów zawierają w tej samej
temperaturze i pod tym samym ciśnieniem jednakową
liczbę cząsteczek.
Oznacza, że w warunkach normalnych V = 22,4 dm
3
gazu zawiera
6,02 ×10
23
cząsteczek lub atomów
P
RAWO
P
ROSTYCH
STOSUNKÓW
OBJĘTOŚCIOWYCH
Jeżeli reagujące ze sobą substancje znajdują się w
stanie gazowym, to objętości poszczególnych gazów
zarówno substratów jak i gazowych produktów reakcji,
pozostają do siebie w stosunku niewielkich liczb
całkowitych.
Wyszukiwarka
Podobne podstrony:
Jadro atomu, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Zasada rozbudowy powłok elektronowych, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Obliczenia na podstawie równań chemicznych, Notatki i materiały dodatkowe, Chemia, materiały dodatko
Podstawowe pojęcia i prawa chemiczne, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
funckja stanu, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Liczby kwantowe, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Naturalne i sztuczne przemiany atomowe, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Kwantowa teoria budowy powlok elektronowych, Notatki i materiały dodatkowe, Chemia, materiały dodatk
Strukturalne składniki materii, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
zadania - stężenia, Notatki i materiały dodatkowe, Chemia, materiały od Romka
03.10.20011, Notatki i materiały dodatkowe, Chemia, Wykłady
10.10.2011, Notatki i materiały dodatkowe, Chemia, Wykłady
zadania - stężenia, Notatki i materiały dodatkowe, Chemia, materiały od Romka
Chemia materiałów V
materiały dodatkowe leśna
PRZYSZLOSC KOMPUTEROW, ^v^ UCZELNIA ^v^, ^v^ Pedagogika, promocja zdrowia z arteterapią i socjoterap
Procedura Dopuszczenia Do Obrotu, STUDIA - Kierunek Transport, STOPIEŃ I, MATERIAŁY DODATKOWE
więcej podobnych podstron