Funkcje termodynamiczne. Elementy termochemii
Energia wewnętrzna U układu to całkowita energia układu, czyli suma energii kinetycznej i potencjalnej wszystkich drobin w układzie, ale i np. energia ruchów elektronów i atomów, energia oddziaływań między elektronami, między nukleonami w jądrach, między elektronami a jądrami atomów. Energia wewnętrzna U jest funkcją stanu.
Funkcja stanu charakteryzuje się tym, że jej zmiany nie zależą od sposobu prowadzenia przemiany, czyli nie zależą od drogi, po której układ przeszedł od stanu początkowego do stanu końcowego. Zmiany funkcji są równe różnicy jej wartości w stanie końcowym (U2) i początkowym układu (U1):
W wyniku dowolnej izobarycznej przemiany (p = const.) zachodzącej w układzie zamkniętym (brak wymiany masy z otoczeniem) jego energia wewnętrzna zmienia się o wartość ΔU:
gdzie:
Q - energia wymieniania między układem a otoczeniem w postaci ciepła,
W - energia wymieniania między układem a otoczeniem w postaci pracy.
Funkcją stanu jest również entalpia H i entropia S. Entalpia H, czyli efekt cieplny reakcji w warunkach izotermiczno-izobarycznych:
gdzie:
ΔH - zmiana entalpii,
ΔU - zmiana energii wewnętrznej,
ΔV - zmiana objętości, p - ciśnienie.
Entropia S określana często (ujęcie statystyczne) jako miara liczby sposobów podziału zasobu energii układu makroskopowego między wszystkie elementy układu, czyli tzw. „miara nieuporządkowania układu” (ujęcie klasyczne). Ze wzrostem liczby tych sposobów wzrasta nieuporządkowanie układu.
gdzie:
ΔS - zmiana entropii,
Q - energia wymieniania między układem a otoczeniem w postaci ciepła,
T - temperatura.
Wzrost entropii jest warunkiem samorzutności procesów zachodzących w układzie izolowanym. Dla układu w stanie równowagi: ΔS = 0, przy procesach samorzutnych: ΔS > 0; gdy ΔS < 0 proces samorzutny nie zachodzi, możliwy jest tylko proces wymuszony. Entropia rośnie jeżeli w układzie pojawiają się nowe sposoby podziału zmagazynowanej w nim energii, np.
• wzrasta objętość układu,
• wzrasta temperatura,
• maleje ciśnienie,
• rozerwaniu ulegają wiązania chemiczne.
Każdej przemianie chemicznej towarzyszy określony efekt cieplny. Efekt cieplny można określić jako ilość energii wymienionej w postaci ciepła między układem a otoczeniem. W przemianie izochorycznej (tzn. w stałej objętości) i przemianie izobarycznej (tzn. pod stałym ciśnieniem) efekt cieplny jest równy zmianie funkcji stanu (odpowiednio energii wewnętrznej reakcji i entalpii reakcji). Efekt cieplny jest więc niezależny od „drogi” przemiany, a jedynie od stanu początkowego i końcowego układu.
W przemianie izotermiczno-izobarycznej efekt cieplny jest równy zmianie entalpii układu ΔH. Entalpię reakcji podaje się w kJ/mol. Umownie przyjęto, że gdy ΔH < 0 to przemianie towarzyszy przepływ energii (ciepła) od reagentów do otoczenia (przemiana egzoenergetyczna), a gdy ΔH > 0, to energia (ciepło) z otoczenia jest pochłaniana przez reagenty (przemiana endoenergetyczna).
Efekt cieplny przemiany zależy od temperatury i ciśnienia w jakich zachodzi reakcja. Jako indywidualna cecha przemiany ΔH zależy również od ilości substratów i produktów i ich stanu skupienia. Tzw. równanie termochemiczne zawiera informację o stanach skupienia wszystkich substratów i produktów, ich odmianach krystalograficznych oraz efekt cieplny, np.
W tablicach termochemicznych podaje się zwykle standardowe efekty cieplne ΔH0 reakcji, czyli dla warunków określonych temperaturą 25oC = 298,15 K i ciśnieniem 1,013·105 Pa. Zazwyczaj dotyczą one procesu spalania i reakcji tworzenia:
Standardowa molowa entalpia spalania ΔH0sp - entalpia reakcji całkowitego spalania 1 mola związku chemicznego, przebiegająca w warunkach standardowych. Produktami reakcji są gazowy CO2, ciekła H2O i ewentualnie SO2 lub substancje proste (np. N2, Cl2).
Standardowa molowa entalpia tworzenia ΔH0tw - entalpia reakcji syntezy 1 mola związku chemicznego z pierwiastków w postaci trwałej w warunkach standardowych. Standardowe entalpie tworzenia pierwiastków w stanie wolnym są równe zero.
Prawo Hessa:
Niezależnie od tego, czy reakcja chemiczna przebiega od stanu początkowego do stanu końcowego bezpośrednio czy przez reakcje pośrednie, całkowity efekt cieplny reakcji jest w obu przypadkach taki sam. Założono, że wszystkie procesy muszą zachodzić w ustalonych warunkach izotermiczno-izobarycznych lub izotermiczno-izochorycznych.
Efekty cieplne reakcji można obliczyć korzystając z prawa Lavoisiera-Laplace'a oraz prawa Hessa. Prawa te wykorzystuje się do wyznaczenia nieznanych efektów cieplnych reakcji chemicznych na podstawie innych reakcji, dla których znane są efekty cieplne. W obliczeniach można również wykorzystać stabelaryzowane wartości standardowych molowych entalpii tworzenia lub standardowych molowych entalpii spalania (dla substancji organicznych) oraz - w przypadku gdy wszystkie substancje są gazami - energii wiązań chemicznych zgodnie z poniższymi wzorami:
a)
b)
c)
gdzie:
Σ (sigma) - symbol sumy (dodawania) określonych składników,
ni - współczynniki stechiometryczne występujące w równaniu termochemicznym,
x - liczba wiązań danego typu w cząsteczce substratu,
y - liczba wiązań danego typu w cząsteczce produktu,
Ewiąz.- energia wiązania chemicznego, czyli energia potrzebna do rozerwania wiązania, i tym samym energia uwalniania przy jego tworzeniu.
Funkcja stanu to w termodynamice funkcja zależna wyłącznie od stanu układu, czyli od aktualnych wartości jego parametrów, takich jak masa, liczność materii, temperatura, ciśnienie, objętość i inne.
Wartość funkcji stanu z definicji nie zależy od jego historii, tzn. tego co działo się z nim wcześniej. Wynika z tego bezpośrednio inna podstawowa własność funkcji stanu:
Zmiana wartości funkcji stanu zależy tylko od stanu początkowego i końcowego układu, a nie od sposobu w jaki ta zmiana została zrealizowana.
Funkcja termodynamiczna zależna od historii (drogi) układu jest nazywana funkcją procesu.
Całka oznaczona różniczki zupełnej funkcji stanu przedstawia różnicę wartości funkcji w stanach odpowiadających granicom całkowania. Z zasady, że wartość funkcji stanu nie zależy od historii układu wynika, że całka oznaczona tej funkcji obliczona dla dowolnego zbioru przemian, które tworzą powtarzalny cykl jest równa 0.
W praktyce stosuje się zwykle następujące funkcje stanu:
objętość właściwa, (v),
energia wewnętrzna (U),
entropia (S),
energia swobodna A = U - TS,
entalpia H = U + pV,
entalpia swobodna G = U - TS + pV,
egzergia, (b),
wielki potencjał kanoniczny Ω = F − μN
Funkcje stanu są najczęściej wielkościami konceptualnymi, tj. takimi których nie możemy bezpośrednio zmierzyć i dla których określenia konieczna jest pewna procedura zawierająca różne założenia i konwencje.
Pierwsza zasada termodynamiki - jedno z podstawowych praw termodynamiki, jest sformułowaniem zasady zachowania energii dla układów termodynamicznych. Zasada stanowi podsumowanie równoważności ciepła i pracy oraz stałości energii układu izolowanego[1].
Dla układu zamkniętego (nie wymienia masy z otoczeniem, może wymieniać energię) zasadę można sformułować w postaci:
Zmiana energii wewnętrznej układu zamkniętego jest równa energii, która przepływa przez jego granice na sposób ciepła lub pracy[2].
gdzie:
ΔU - zmiana energii wewnętrznej układu,
Q - energia przekazana do układu jako ciepło,
W - praca wykonana na układzie.
W powyższym sformułowaniu przyjmuje się konwencję, że gdy:
W > 0 - do układu przepływa energia na sposób pracy,
W < 0 - układ traci energię na sposób pracy,
Q > 0 - do układu przepływa energia na sposób ciepła,
Q < 0 - układ traci energię na sposób ciepła.
W przypadku układu termodynamicznie izolowanego układ nie wymienia energii z otoczeniem na sposób pracy (W = 0) ani na sposób ciepła (Q = 0), wówczas:
Energia wewnętrzna jako funkcja stanu
Pierwsza zasada termodynamiki pozwala na zdefiniowanie energii wewnętrznej jako funkcji stanu:
Dla wszystkich procesów prowadzących od pewnego określonego stanu do drugiego zmiana ΔU ma zawsze tę samą wartość, choć ilości dostarczanego ciepła i pracy wykonanej przez układ są na ogół różne dla różnych procesów.
Często wygodniej jest skupić się na rozpatrywanym układzie; energii wewnętrznej (U), energii cieplnej dopływającej do układu (Q) i pracy wykonanej przez układ (W). W warunkach nieskończenie małych przyrostów pierwsza zasada termodynamiki jest wyrażona następująco:
gdzie δQ i δW są różniczkami niezupełnymi, tj. zależnymi od drogi; dU zaś jest różniczką zupełną, tj. niezależną od sposobu przebiegu procesu.
Praca w termodynamice, czyli energia przekazywana makroskopowo
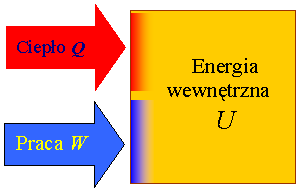
Pierwsza zasada termodynamiki precyzuje zależność zmiany energii wewnętrznej od dostarczonego ciepła i pracy.
Wzór I zasady termodynamiki
Pierwsza zasada termodynamiki wyraża się następującym wzorem:
∆U = Q + W
∆U - zmiana energii wewnętrznej ciała/układu - jednostka w układzie SI: dżul J
Q - ciepło dostarczone do ciała/układu - jednostka w układzie SI: dżul J
W - praca wykonana nad ciałem/układem - jednostka w układzie SI: dżul J
Treść tego wzoru (a więc i I zasady termodynamiki) można przedstawić w postaci sformułowania:
Zmiana energii wewnętrznej ciała, lub układu ciał jest równa sumie dostarczonego ciepła i pracy wykonanej nad ciałem /układem ciał.
Umowa dotycząca znaku
Aby prawidłowo obliczać zmianę energii wewnętrznej należy trzymać się następującej konwencji dotyczącej znaku pracy, lub ciepła:
|
Jeśli praca lub ciepło są dostarczane do ciała (układu ciał), to są one liczone ze znakiem plus - są dodatnie. |
|
Jeżeli są odbierane od ciała (układu ciał) , czyli jeśli to ciało/układ wykonuje jakąś pracę, to odpowiednie wartości będą ujemne. |
Przykłady:
1. Proste zastosowanie wzoru
Podczas prasowania żelazko podgrzało tkaninę energią 200 J, a w wyniku tarcia została do niego dodatkowo dostarczona energia 10 J (zakładamy, że nie było ubytków ciepła). W rezultacie energia wewnętrzna tkaniny wzrosła o:
∆U = Q + W = 200 J + 10 J = 210 J
2. Podgrzewanie ciała, bez wykonywania pracy
Podczas podgrzewania ciała bez wykonywania pracy (np. podczas podgrzewania wody na herbatę) mamy:
Q > 0 (bo ciepło jest dostarczane do ciała / układu)
W = 0 (bo praca nie jest wykonywana ani przez siły zewnętrzne, ani przez układ)
∆U = Q + 0 = Q > 0 - energia wewnętrzna układu wzrasta (czyli najczęściej także wzrasta temperatura).
3. Oziębianie ciała, bez wykonywania pracy
Podczas oziębiania ciała bez wykonywania pracy (np. podczas chłodzenia masła w lodówce) mamy:
Q < 0 (bo ciepło jest odbierane od ciała / układu)
W = 0 (bo praca nie jest wykonywana ani przez siły zewnętrzne, ani przez układ)
∆U = Q + 0 = Q < 0 - energia wewnętrzna układu maleje (czyli najczęściej także maleje temperatura).
4. Podgrzewanie ciała z wykonywaniem pracy przez siły zewnętrzne
Podczas podgrzewania ciała wraz z wykonywaniem pracy (np. podczas uderzania młotem kowalskim w kawał żelaza ogrzewany w palenisku w kuźni) mamy:
Q > 0 (bo ciepło jest dostarczane do ciała / układu)
W > 0 (praca jest wykonywana siły zewnętrzne - kowala)
∆U = Q + W > 0 - energia wewnętrzna układu rośnie (w opisanym przykładzie rośnie temperatura żelaza).
Wyszukiwarka
Podobne podstrony:
zadania - stężenia, Notatki i materiały dodatkowe, Chemia, materiały od Romka
Jadro atomu, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
03.10.20011, Notatki i materiały dodatkowe, Chemia, Wykłady
Zasada rozbudowy powłok elektronowych, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Obliczenia na podstawie równań chemicznych, Notatki i materiały dodatkowe, Chemia, materiały dodatko
Podstawowe pojęcia i prawa chemiczne, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Liczby kwantowe, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Naturalne i sztuczne przemiany atomowe, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
10.10.2011, Notatki i materiały dodatkowe, Chemia, Wykłady
Kwantowa teoria budowy powlok elektronowych, Notatki i materiały dodatkowe, Chemia, materiały dodatk
Strukturalne składniki materii, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
zadania - stężenia, Notatki i materiały dodatkowe, Chemia, materiały od Romka
12.10.2001, Notatki i materiały dodatkowe, Biologia, Wykłady
Pino- i fagocytoza, Notatki i materiały dodatkowe, Biologia, Materiały dodatkowe
05.10.2011, Notatki i materiały dodatkowe, Biologia, Wykłady
CYKL KOMÓRKOWY, Notatki i materiały dodatkowe, Biologia, Materiały dodatkowe
07.10.2011, Notatki i materiały dodatkowe, Zagrożenia cywilizacyjne i zrównoważony rozwój, Ćwiczenia
03.10.2011, Notatki i materiały dodatkowe, Zagrożenia cywilizacyjne i zrównoważony rozwój, Wykłady
Tkanki roślinne, Notatki i materiały dodatkowe, Biologia, Materiały dodatkowe
więcej podobnych podstron