2010-01-22
1
CHEMIA IX
Równowaga chemiczna
Reakcje odwracalne
aA + bB cC + dD
wszystkie reakcje chemiczne sa odwracalne
tzn.
z substratów tworzą się produkty, a
jednocześnie produkty reakcji ulegaja
rozkładowi na substraty
Premiana substratów v
1
= k
1
• c
A
a
• c
B
b
Premiana produktów v
2
= k
2
• c
E
e
• c
D
d
2010-01-22
2
Gdy temperatura T reagującego
układu jest stała w czasie procesu
zmiany szybkości reakcji v
1
i v
2
spowodowane są
jedynie
zmianami stężeń reagujących substancji.
Po pewnym czasie trwania reakcji ustali się stan
równowagi chemicznej, w którym szybkości reakcji
w obu kierunkach będą równe.
• v
1
= k
1
• c
A
a
• c
B
b
= k
2
• c
E
e
• c
D
d
• Po przekształceniu równania otrzymamy.
• k
1
/k
2
= c
E
e
• c
D
d
/c
A
a
• c
B
b
= K
c
• Iloraz dwóch stałych szybkości reakcji k
1
i k
2
jest w
danej temperaturze stały.
Stała równowagi reakcji
• Stała K
c
w równaniu nazywa się stałą
równowagi chemicznej, odniesioną do stężeń
molowych reagentów
• K
c
= k
1
/k
2
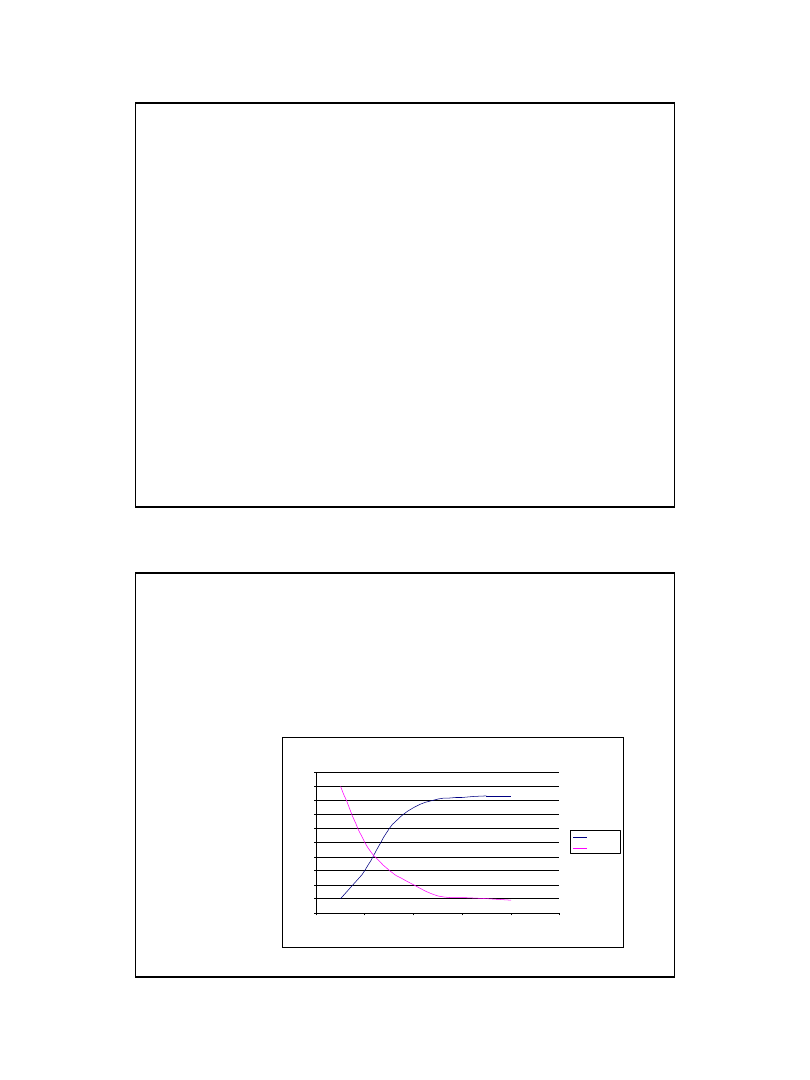
Zmiana stężenia produktów i substratów reakcji
0
1
2
3
4
5
6
7
8
9
10
0
2
4
6
8
10
czas
st
ęż
eni
e
produkty
substraty
2010-01-22
3
Prawo działania mas Guldberga-Waagego
• W stanie równowagi chemicznej, w stałej temperaturze,
stosunek iloczynu stężeń molowych produktów do
iloczynu stężeń molowych substratów, podniesionych
do
odpowiednich
potęg
odpowiadających
współczynnikom
stechiometrycznym
reagujących
substancji, jest wielkością stałą, charakterystyczną dla
reakcji i określonej temperatury.
•
Duża wartość stałej równowagi K świadczy o tym, że w
stanie równowagi w danym układzie jest znaczne więcej
produktów niż substratów, czyli reakcja przebiega z
dużą
wydajnością
produktów.
Równowaga chemiczna
• w odróżnieniu od statycznego charakteru
równowagi mechanicznej, jest równowagą
dynamiczną – tyle, ile powstaje w
jednostce czasu produktów, tyle samo
produktów, w tym samym czasie
przekształca się w substraty
2010-01-22
4
Stała równowagi K
c
N
ie zależy od
• stężenia wyjściowego substratów
• ani od zastosowania katalizatora
Zależy od
-
rodzaju reagujących substancji
- temperatury.
Przykład
CaCO
3
+ 2HCl
CaCl
2
+ H
2
O + CO
2
K
c
= C
CaCl2
xC
H2O
/C
CaCO3
x C
HCl
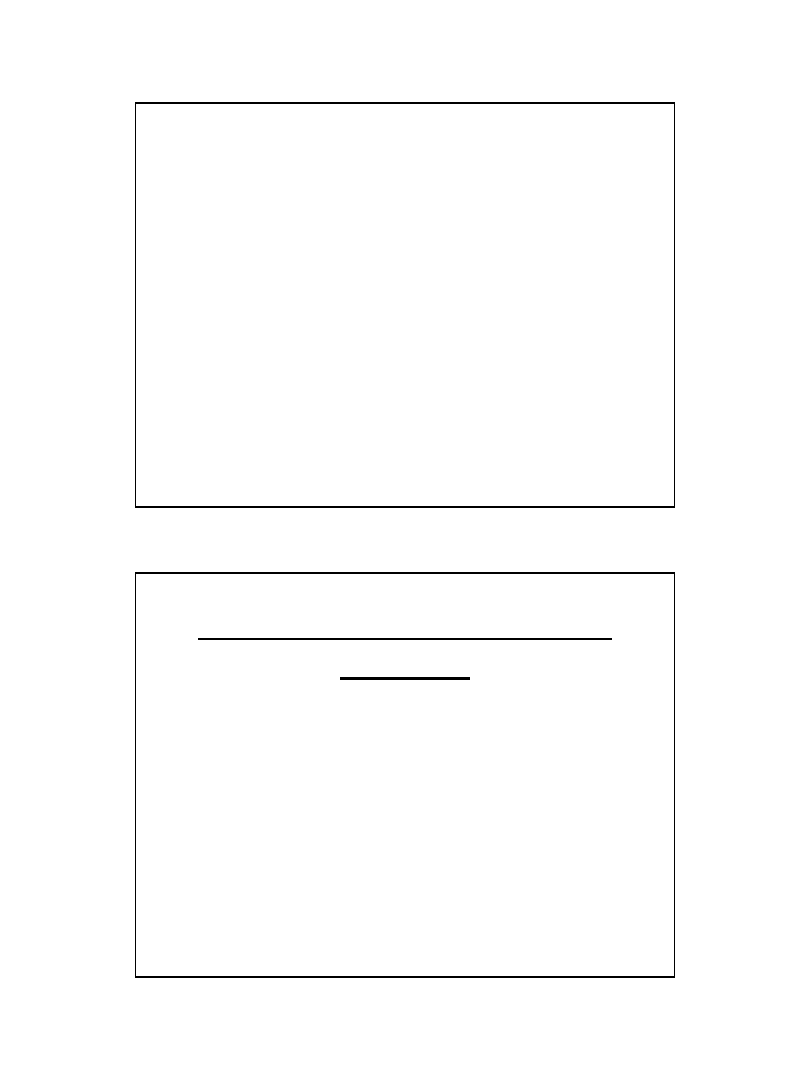
Stała stężeniowa
3H
2
+ N
2
= 2 NH
3
K
p
= p
2
NH3
/ p
N2
• p
3
H2
Stała ciśnieniowa
2010-01-22
5
Reguła przekory Le Chateliera-
Brauna.
Jeżeli na układ w stanie równowagi działa jakiś
czynnik zewnętrzny, to w układzie zajdą takie
zmiany, które będą dążyły do zniesienia
wpływu tego czynnika.
Zmiany zmniejszające skutki działania bodźca
zewnętrznego doprowadzą w efekcie do
ponownego ustalenia się stanu równowagi.
Wprowadzenie pewnej ilości
reagenta
• Jeżeli do układu w stanie równowagi
dodatkowo wprowadzimy pewną ilość
reagentu (substratu lub produktu) to stan
równowagi przesunie się w kierunku
zmniejszenia jego wartości w układzie.
Podobnie, jeżeli z układu usuniemy pewną
ilość jednego składnika, to zajdą przemiany,
które zmniejszą jego ubytek.
2010-01-22
6
Wpływ temperatury
• Jeżeli czynnikiem naruszającym równowagę
chemiczną jest zmiana temperatury, to w zależności
od efektu cieplnego danej reakcji należy oczekiwać
dwojakiego rodzaju skutków.
• Podwyższenie temperatury w układzie przesunie stan
równowagi na korzyść reakcji endotermicznej,
której towarzyszy pochłanianie ciepła,
• obniżenie temperatury układu przesunie równowagę
w kierunku reakcji egzotermicznej, której towarzyszy
wydzielanie ciepła
.
Należy jednak podkreślić, że podwyższenie
temperatury zawsze wywiera korzystny wpływ na
szybkość reakcji, a więc i na szybkość ustalania się
równowagi, co nie jest sprzeczne z regułą przekory.
Wpływ ciśnienia
• Zmiany ciśnienia wpływają na położenie
stanu równowagi dla reakcji chemicznych
przebiegających w
fazie gazowej -
następuje zmiana objętości.
2010-01-22
7
Wpływ dodatku gazu obojętnego
na położenie stanu równowagi
• Wprowadzenie do środowiska reakcji, przebiegającej
w fazie gazowej, dodatkowego obojętnego gazu,
przyczynia się do "rozcieńczenia" reagentów. W
wyniku rozcieńczenia maleją ciśnienia cząstkowe.
Dlatego dodanie gazu obojętnego wywiera taki sam
wpływ na położenie równowagi, jak obniżenie
ciśnienia ogólnego.
• korzystny dla reakcji rozkładu
• niekorzystny dla reakcji syntezy.
reakcja syntezy-
z kilku substaratów
powstaje jeden produkt
• N
2(g)
+ 3H
2(g)
<=> 2NH
3(g)
• p,T = const, V
p
< V
s
• - przemiana substratów w produkty powoduje
zmniejszenie sumarycznej ilości reagentów.
• Jeżeli zakłócimy stan równowagi układu
zwiększając ciśnienie, to nastąpi przemiana
dodatkowej ilości substratów w produkty, w
wyniku czego zmniejszy się sumaryczna
ilość reagentów w układzie, a tym samym
ciśnienie.
2010-01-22
8
z jednego substratu powstaje
kilka produktów
• CH
3
-CH
2
-CH
3(g)
<=> CH
2
=CH-CH
3(g)
+ H
2(g)
• Efekt wzrostu ciśnienia jest odwrotny niż w
reakcji I typu -
stan równowagi zostaje
przesuni
ęty na korzyść substratów.
nie następuje zmiana objętości
• CO
(g)
+ H
2
O
(g)
<=> CO
2(g)
+ H
2(g)
• Zmiany ciśnienia nie wywierają żadnego
wpływu na położenie stanu równowagi.
• Dla roztworów ciekłych - umiarkowane
zmiany ciśnienia nie wpływają na położenie
stanu równowagi reakcji.
Wyszukiwarka
Podobne podstrony:
Walkowiak, chemia ogólna, równowaga chemiczna i prawo działania mas
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
Rownowaznik chemiczny, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
7.Prawo działania mas - równowaga chemiczna, Chemia ogólna ćwiczenia
Rownowaga Chemiczna Zadania, Nauka, Szkoła, Matura, Chemia - notatki, Notatki CHEMIA
Wykład 10.Równowaga chemiczna. Prawo działania mas, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DO
11.RÓWNOWAGI CHEMICZNE, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV,
''Stan równowagi chemicznej'' (''Chemia w szkole'' 4 2007 r )
Równowaga chemiczna, CHEMIA, semestr 1, chemia ogólna, wykłady
dr Wawrzyniak, chemia nieorganiczna, sprawodzanie Szybkość reakcji chemicznych i równowaga chemiczna
7 uklady rownowagi fazowej id 4 Nieznany
BHP Laboratorium Chemiczne id 84325
chemia 3 etap gim 2012 id 11187 Nieznany
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
chemia kliniczna cw 1 2011 id Nieznany
więcej podobnych podstron