RÓWNOWAGA CHEMICZNA
Obliczyć, ile razy zmieni się szybkość reakcji prostej i odwrotnej, jeżeli zwiększy się pięciokrotnie ciśnienie w układzie, w którym przebiega reakcja N2 + 3 H2 = 2 NH3 (rysunek ze zmianą objętości pod wpływem zwiększenia ciśnienia !)
I. v1 = k1 [ N2 ] [ H2 ]3, v2 = k2 5 [ N2 ] 53 [ H2 ]3
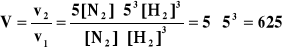
II. v1 = k1 [ NH3 ]2, v2 = k2 = 52 [ NH3 ]2
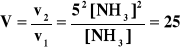
czyli szybkość reakcji zwiększy się 525 : 25 = 25 razy, w kierunku tworzenia amoniaku.
Ogrzano 0.5 mola azotu i 1.5 mola wodoru, w naczyniu o objętości 1 dm3. W stanie
równowagi otrzymano 0.4 mola amoniaku. Obliczyć wartość stałej równowagi
reakcji:
N2 + 3 H2 = 2 NH3
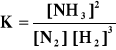
Obliczamy stężenia reagentów w stanie równowagi:
z 1 mola N2 powstają 2 mole NH3
to z x ” —— 0.4 ” stąd x = 0.2 mola a zatem
w stanie równowagi znajduje się wolny azot w ilości 0.5 - 0.2 = 0.3 mola,
zaś wodór: z 3 moli H2 powstają 2 mole NH3
to z x ” —— 0.4 ” stąd x = 0.6 mola wodoru
i w stanie równowagi znajduje się wolny wodór w ilości 1.5 - 0.6 = 0.9 mola
a po podstawieniu do równania na stałą równowagi, otrzymujemy:
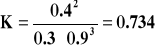
W naczyniu o objętości 1 dm3 ogrzano w temp. 800 K , 854 g I2 i 20 g H2. W stanie równowagi otrzymano 800 g jodowodoru. Obliczyć stałą równowagi reakcji H2 + I2 = 2 HI
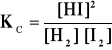
W stanie równowagi mamy 800 g HJ / 128 g·mol-1 = 6.25 mola jodowodoru,
Stężenia wyjściowe substratów: I2: 854 g / 254 g·mol-1 = 3.36 mola J2
H2: 20 g / 2 g·mol-1 = 10 moli H2
W stanie równowagi:
H2: z 1 mola wodoru otrz. 2 mole HJ
z x ” —— 6.25 mola HJ ; x = 3.125 m
tj. nie przereagowało wodoru 10 - 3.125 = 6.875 mola
J2: z 1 mola jodu otrz. 2 mole HJ
z x ” —— 6.25 mola HJ ; x = 3.125 m
tj. nie przereagowało jodu 3.36 - 3.125 = 0.235 mola
po podstawieniu do wzoru K = 24.18
Obliczyć stałą równowagi reakcji C + O2 = CO2, jeżeli z 1 mola C i 1.5 mola O2
powstanie 0.25 mola CO2.
![]()
Stała równowagi reakcji:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
wynosi 4. Podać stężenia substratów i produktów w stanie równowagi, jeżeli do
reakcji wzięto 1 mol kwasu i 2 mole alkoholu.
Tablica:
|
CH3COOH |
C2H5OH |
Ester |
H2O |
Przed reakcją |
1 |
2 |
0 |
0 |
W stanie równowagi |
1 - x |
2 - x |
x |
x |
Odpowiedź |
1 - 0.85 = 0.15 |
2 - 0.85 = 1.15 |
0.85 |
0.85 |
Rozwiązanie:
![]()
tj. po podstawieniu z tabeli
![]()
a stąd:
3 x2 - 12 x + 8 = 0
ponieważ dla równania kwadratowego:
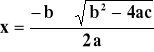
to wiedząc, że ![]()
otrzymujemy dwa wyniki: x1 = 3.16 (nie ma sensu fizycznego)
i x2 = 0.85, co daje wyniki dla ostatniej rubryki w tabeli.
W naczyniu o pojemności 1 dm3 ogrzano do temp. 7210K 73,66g I2 i 1,62g H2. W stanie
równowagi otrzymano 71,68g HI. Proszę wyliczyć stała równowagi KC.
Odp. Kc = 59.17
4 mole PCl5 umieszczono w naczyniu o pojemności 2 litry. Kiedy ustalił się stan
równowagi PCl5 ↔ PCl3 + Cl2 w naczyniu stwierdzono obecność 0,8 mola Cl2. Proszę
wyliczyć stałą KC.
Odp. Kc = 0.1
W naczyniu o pojemności 1 dm3 znajdowało się 0,2 mola N2 i 0,8 mola H2. Stwierdzono,
że momencie ustalenia się równowagi przereagowało 60 % azotu. Proszę obliczyć stałą
równowagi KC.
Odp. Kc = 8.45
Reakcja syntezy amoniaku osiągnęła stan równowagi, w którym stężenie poszczególnych reagentów wyniosło:
C [N2] = 0,60 mola/dm3
C [H2] = 1,80 mola/dm3
C [NH3] = 0,80 mola/dm3
Proszę obliczyć stężenie początkowe.
Odp. C [N2] = 1.0 mol/dm3
C [H2] = 3.0 mole/dm3
W pewnej temperaturze dla reakcji 3CH≡CH ↔ C6H6 stała równowagi KC = 4. Jakie jest
stężenie BENZENU w stanie równowagi jeżeli stężenie ACETYLENU (ETINU) =
0,5 mola/dm3.
Odp. C [C6H6] = 0.5 mola/dm3
Po ustaleniu się stanu równowagi w reakcji syntezy amoniaku:
ciśnienie NH3 = 0,39x105 Pa
" N2 = 2,43x105 Pa
" H2 = 7,3x105 Pa
Proszę policzyć stałą ciśnieniową KP.
Odp. 1.61 x 10-14
CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O
Stała równowagi dla tego procesu estryfikacji = 4. Ile estru będzie w mieszaninie
w momencie ustalenia się stanu równowagi jeżeli do reakcji weźmiemy:
A) 1mol kwasu + 1 mol etanolu,
1 mol kwasu + 2 mole etanolu,
1 mol kwasu + 3 mole etanolu.
Odp. A) 0.67 mola/dm3; B) 0.84 mola/dm3 ; C) 0.90 mola/dm3
Reakcja przebiega wg równania: A + B ↔ C + D i stała równowagi w pewnej temperaturze wynosi 3x10-2.
Obliczyć stężenie B w stanie równowagi jeżeli pozostałe równowagowe stężenia mają wartość [A] = 0,5 mol/dm3.
Ile wynosiłoby stężenie B w podanych warunkach gdyby reakcja przebiegała wg równania A + 2B ↔ C + D oraz
2A + B ↔ C + D
Odp. A) 16.67 mola/dm3; b) 4.07 moladm3; 33.2 mola/dm3
Badano reakcję H2 + I2 wychodząc z mieszaniny H2 i I2. Po osiągnięciu stanu równowagi
stwierdzono, że stężenia poszczególnych reagentów wynoszą [H2] = 3,841 mmol/dm3,
[I2] = 1,524 mmol/dm3 i [HI] = 16,870 mmol/dm3. Obliczyć stałą równowagi tej reakcji.
Odp. Kc = 48.62
Po ustaleniu się równowagi w układzie, w którym przebiega reakcja syntezy NH3
(N2 + 3H2 ↔ 2NH3) w temp. 4000C pod ciśnieniem 10,13x105 Pa cząstkowe ciśnienia
poszczególnych reagentów w stanie równowagi wynoszą:
ciśnienie NH3 = 0.385 atm.
" N2 = 2.404 atm.
" H2 = 7.211 atm.
Obliczyć:
stałe równowagi KP, KC, KX,,
stałą równowagi KP gdy równanie tej reakcji podane jest w postaci 1/2 N2 + 3/2 H2 ↔ NH3.
Odp. Kp = 1.64 x 10-4; Kc = 0.5; KX = 1.64 x 10-2
Stała równowagi reakcji 2 SO2 (g) + O2 (g) ↔ 2 SO3 (g) wynosi KP = 3,42x10-5 w temp. 7270C. Obliczyć stałą równowagi KC w tej temp.
Odp. Kc = 284.4
Reakcja otrzymywania fosgenu przebiega następująco: Cl2 (g) + CO (g) ↔ COCl2 (g). Obliczyć stałą równowagi KP tej reakcji jeżeli w stanie równowagi w temp. 3950C ciśnienie całkowite wynosi 58,6 kPa, a ciśnienie cząstkowe pozostałych substratów odpowiednio:
P (Cl2) = 13,0 kPa oraz P (CO) = 11,7 kPa
Odp. Kp = 0.22
Zmieszano 1 mol CH3OH z 1 molem CH3COOH w temp. 250C. Po dojściu układu do stanu równowagi wytworzyło się 0,72 mola estru. Obliczyć stałą równowagi tej reakcji.
Odp. Kc = 6.61
Obliczyć stałą równowagi reakcji estryfikacji C2H5OH + CH3COOH ↔ CH3COOC2H5 + H2O jeżeli po zmieszaniu:
1 mol C2H5OH z 1 molem CH3COOH otrzymano 0,665 mola estru
1,5 mola C2H5OH z 1 molem CH3COOH otrzymano 0,781 mola estru.
Odp. Kc = 3.94; Kc = 3.87.
Żelazo reaguje z para wodną wg równania: Fe (c.st.) + H2O(g) ↔ FeO (c.st.) + H2 (g).
W temp. 10000K i pod ciśnieniem 10,333x104 N/m2 (1 atmosfera) ciśnienie cząstkowe wodoru
p (H2) = 6,526x104 N/m2 (0,644 atm.). Obliczyć wartość stałej równowagi KP.
Odp. Kc = 1.81
W naczyniu o objętości 10 dm3 ogrzano 746,7 g jodu i 16,2 g wodoru. Po ustaleniu się stanu równowagi w temperaturze 448ºC oznaczono, że powstało 721,9 g jodowodoru. Oblicz stałą równowagi. (MJ = 127).
Odp. Kc = 59.17
Amylen reagując z kwasem octowym daje ester wg. równania:
C5H10 + CH3COOH ↔ CH3COOC5H11
Obliczyć stałą równowagi Kc tej reakcji, jeżeli zmieszano 6,450 mmola amylenu z 1,00 mmola
kwasu octowego w obojętnym rozpuszczalniku i po ustaleniu się równowagi otrzymano
0,784 mmola estru. Objętość roztworu wynosi 845 cm3.
Odp. Kc = 541
Po zmieszaniu 1 mola alkoholu etylowego, 2 moli kwasu octowego i 3 moli wody ustaliła się równowaga chemiczna w układzie, w którym powstało 0,6 mola estru. Obliczyć stałą równowagi przy założeniu, że objętość reagującego układu wynosi 1 dm3.
Odp. Kc = 3.86
Stała równowagi dla procesu estryfikacji etanolu kwasem octowym w temp. 298 K wynosi 4,00. Obliczyć skład mieszaniny w stanie równowagi, jeżeli wyjściowy roztwór zawierał
1 mol alkoholu etylowego, 2 mole kwasu octowego i 3 mole wody.
Odp. C [alkohol] = 0.4 mola/dm3; C [kwas] = 1.4 mola/dm3; C [ester] = 0.6 mola/dm3; C [woda] = 3.6 mola/dm3
Reakcja rozpadu wodorosiarczku amonowego na amoniak i siarkowodór przebiega według równania:
NH4HS(s) = NH3(g) + H2S(g)
W naczyniu, z którego usunięto powietrze umieszczono pewną ilość stałego wodorsiarczku
i mierzono ciśnienie wydzielających się gazów. W temp. 20ºC ciśnienie całkowite wynosiło
47,4 kPa (0.468 atm). Obliczyć stałą równowagi Kp tej reakcji (p0 = 1,013 105 N/m2).
Odp. Kp = 561.69
Wyszukiwarka
Podobne podstrony:
Przegląd zadań z odpowiedziami, Nauka, Szkoła, Matura, Chemia - notatki, Notatki CHEMIA
ekologia2k, Nauka, Szkoła, Matura, Biologia - testy liceum, Testy
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
reakcje chemicznew roztworach wodnych, Matura Chemia Rozszerzona, Podręczniki, Notatki
Zadania alkohole i estry, Szkoła średnia matura, Chemia
ToiZ wykład- notatki, nauka - szkola, hasło integracja, rok I, Teoria organizacji i zarządania
alkohole - zadania, Matura, Chemia, zadania z organicznej
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
Chemia IX Rownowagi Chemiczne id 112320
Rownowaznik chemiczny, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
NOTATKA czynniki chemiczne, BHP Moje, SZKOLA, Semestr II
8. budowa atomu pow+éoki i elektrony zadania maturalne, Chemia
Matura z matematyki 2010 - przykładowe zadania na poziomie rozszerzonym, szkoła, Matura, Matura - Ma
Związki nieorganiczne - zadania, Matura, Chemia, Zadania
7.Prawo działania mas - równowaga chemiczna, Chemia ogólna ćwiczenia
Aminy, MATURA !!!, CHEMIA, Chemia R, Różne zadania i testy
Wykład 10.Równowaga chemiczna. Prawo działania mas, chemia, CHEMIA OGÓLNA -Walkowiak- (WPC 1002w) DO
więcej podobnych podstron