Rozwiązanie zadań
Wybrane z wcześniejszy lat
Mając do dyspozycji następujące substancje, zaproponuj sześć równań reakcji, w wyniku których powstaną sole (podaj nazwy powstałych soli) : tlenek wapnia, wodorotlenek sodu, cynk, tlenek siarki(IV), kwas solny, siarka.
Rozwiązanie; Jeszcze raz wymieńmy dane substancje: CaO; NaOH; Zn; SO2, HCl; S
Aby ułatwić zestawienie reagujących substancji dokonujemy ich podziału na substancje o charakterze zasadowym i kwasowym.
Substancje zasadowe - CaO; NaOH; Zn
Substancje kwasowe - SO2; HCl; S
Kolejno rozważamy wszelkie kombinacje: czynnik kwasowy - czynnik zasadowy, określając prawdopodobieństwo zajścia reakcji
CaO + SO2 = CaSO3 - siarczan(IV) wapnia
CaO + 2HCl = CaCl2 + H2O - chlorek wapnia
CaO + S - reakcja nie zachodzi
NaOH + SO2 = NaHSO3 - wodorosiarczan(IV) sodu
2NaOH + SO2 = Na2SO3 + H2O - siarczan(IV) sodu
NaOH + HCl = NaCl + H2O - chlorek sodu
NaOH + S - reakcja nie zachodzi
Zn + SO2 - reakcja nie zachodzi
Zn + 2HCl = ZnCl2 + H2 - chlorek cynku
Zn + S = ZnS - siarczek cynku
Do 50 g 30% roztworu dodano 300 g wody. Oblicz skład procentowy otrzymanego roztworu.
Obliczyć procentową zawartość NaOH w roztworze o stężeniu 8 mol/dm3 Gęstość roztworu wynosi d = 1,275 g/cm3
W stanie równowagi reakcji N2 + 3H2 ↔ 2NH3 znaleziono następujące stężenia reagentów: [H2] = 0,9 mol/dm3; [N2] = 0,3 mol/dm3; [NH3] = 0,4 mol/dm3. Obliczyć stała równowagi i stężenie początkowe azotu.
Stopień dysocjacji w 0,57% roztworze kwasu octowego wynosi α = 1,53%. Obliczyć wartość stałej dysocjacji kwasu octowego zakładając, że gęstość roztworu równa się 1 g/cm3 Masa molowa CH3COOH = 60,05 g/mol.
Jak długo należy przepuszczać prąd o natężeniu 5A przez roztwór dowolnego kwasu, aby otrzymać 2,8 dm3 wodoru w warunkach normalnych.
7 g pewnego alkenu przyłącza 16,0 g bromu. Ustal wzór sumaryczny tego alkenu, narysuj wzory strukturalne dwóch jego izomerów i podaj ich nazwy.
Ile atomów węgla znajduje się w 1 dm3 wody mineralnej, która zawiera 300 cm3 rozpuszczonego gazowego CO2 w przeliczeniu na warunki normalne.
52,10 g pewnego alkanu w temperaturze 1000C i pod ciśnieniem 1000 hPa zajmuje objętość 22,41 dm3 Podaj wzory i nazwy związków, które spełniają podane warunki.
Tal występuje w przyrodzie w postaci dwóch izotopów: Tl - 203 w ilości 29,5% oraz Tl - 205 w ilości 70,5%. Jaka jest średnia masa atomowa talu ?
Połączono szeregowo trzy elektrolizery składające się z anody węglowej i katody stalowej zanurzonych w roztworach - rozcieńczonego kwasu siarkowego, II - siarczanu miedzi(II), III - siarczanu niklu (II). Po przeprowadzeniu elektrolizy stwierdzono, że w elektrolizerze I wydzieliło się po przeliczeniu na warunki normalne 112 cm3 wodoru. Obliczyć ile miedzi oraz niklu wydzieliło się w pozostałych elektrolizerach.
Ułożyć dwanaście równań reakcji chemicznych otrzymywania soli dobierając substraty spośród następujących związków: K2O; CaO; Fe2O3; P2O5; CO2; HCl; HNO3; H2SO4.
3K2O + P2O5 = 2K3PO4
K2O + CO2 = K2CO3
K2O + 2HCl = 2KCl + H2O
K2O + 2HNO3 = 2KNO3 + H2
K2O + H2SO4 = K2SO4 + H2O
3CaO +P2O5 = Ca3(PO4)2
CaO + CO2 = CaCO3
CaO + 2HCl = CaCl2 + H2O
CaO + 2HNO3 = Ca(NO3)2 + H2O
CaO + H2SO4= CaSO4 + H2O
Fe2O3 + 6HCl =2FeCl3 + 3H2O
Fe2O3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Podczas działania azotu na rozżarzony metaliczny magnez powstaje azotek magnezu.Mg3N2 Napisz równanie chemiczne reakcji, jaka objętość azotu sprowadzona do warunków normalnych przereaguje z 36 g magnezu.
Do wody wprowadzono 233,3 g 27% roztworu HNO3 o gęstości d = 1,16 g/cm3 i dopełniono do 1 dm3 wodą. Oblicz stężenie molowe otrzymanego roztworu. Następnie pobrano 100 cm3 tego roztworu i dodano do niego 2 g NaOH. Określić odczyn roztworu po reakcji.
Stała równowagi reakcji: 2N2 + O2↔2N2O wynosi 1,21. Stężenie równowago [N2] = 0,72 mol/dm3 i [N2O] = 0,84 mol/dm3Jakie jest stężenie początkowe i równowagowe tlenu ?
Podaj wzory i nazwy dwóch izomerycznych związków o M = 45 g/mol i zawierających 53,3% C; 15,6% H i 31,1% N.
Podaj po dwa przykłady izomerów: konstytucyjnych, geometrycznych i optycznych o wzorze : C4H8O2.
Wodny roztwór fenolu zmiareczkowano ługiem sodowym zużywając na 10 g roztworu 4,25 cm3 0,1 molowego NaOH. Oblicz procentową zawartość fenolu w tym roztworze.
Jaki jest stopień dysocjacji fenolu w wodnym roztworze o stężeniu 0,01 mol/dm3, jeżeli wiadomo, że stała dysocjacji fenolu w wodzie K = 1•10-10
W audiometrze zmieszano 20 cm3 powietrza z 10 cm3 wodoru. Po spaleniu mieszaniny objętość gazów wynosiła 17,44 cm3. Oblicz zawartość procentową objętości tlenu w analizowanym powietrzu.
Naturalna miedź składa się z dwóch izotopów, Cu - 63 i Cu - 65 a jej średnia masa atomowa wynosi 63,54. Oblicz zawartość procentową wymienionych izotopów w naturalnej miedzi.
Stopień dysocjacji 0,1 molowego roztworu HCOOH wynosi 4,2%. Oblicz stężenie jonów wodorowych w tym roztworze.
Oblicz masę molową substancji wiedząc, że jej 12% roztwór o gęstości d = 1,0594 g/cm3 jest zarazem roztworem 3,48 molowym.
Ile gramów wody należy dodać do 750 g 10% roztworu cukru chcąc otrzymać roztwór 7% ?
Na karbid zawierający 80% węgliku wapnia podziałano wodą otrzymując lotny związek A, który w obecności katalizatora przekształca się w ciekły związek B. Związek B ulega reakcji ze stężonym kwasem azotowym wobec stężonego kwasu siarkowego w wyniku której jeden atom wodoru zostaje zastąpiony grupą nitrową związek C. Podaj ile należy wziąć karbidu aby otrzymać 81,5 g związku C jeżeli związek A otrzymuje się z wydajnością 95,5%, B 80%, C 75%. Napisz odpowiednie równania reakcji.
3CaC2 + 6H2O = 3Ca(OH)2 + 3C2H2 - potrojona ilość ze względu na ilość produktu
3C2H2 = C6H6
C6H6 + HNO3 = C6H5NO2 + H2O
6,9 g alkoholu utleniono do kwasu octowego. Na zobojętnienie powstałego kwasu zużyto 80 cm3 1,5 - molowego ługu sodowego. Oblicz wydajność reakcji utlenienia.
Ile gramów NaCl należy rozpuścić w 200 cm3 2 molowego NaCl o gęstości 1,08 g/cm3 aby otrzymać roztwór 24% o gęstości 1,18 g/cm3. Jaka będzie jego masa, objętość oraz stężenie molowe ?
Do dwóch zlewek dodano po 200 cm3 roztworów azotanów miedzi(II) i srebra. Do jednej z nich włożono płytkę kadmową o masie m1 = 10,000 g. Po zakończonej reakcji płytkę opłukano, osuszono i zważono. Jej masa wynosiła m2 = 12,239 g. Do drugiej zlewki włożono płytkę miedzianą o masie m3 = 10,000 g. Po wyjęciu, opłukaniu i wysuszeniu płytka ważyła m4 = 17,612 g. Jakie było stężeni molowe roztworów azotanu miedzi(II) i azotanu srebra ?
Jakie procesy zachodzą na powierzchni elektrod platynowych podczas elektrolizy wodnego roztworu wodorotlenku potasu.
Ile srebra i miedzi występuje w 1 tonie rudy, jeżeli zawartość chalkopirytu FeCuS2 wynosi 5,4% zaś Ag2S 0,003%
Liczba atomowa kobaltu wynosi 27 a liczba masowa jednego z izotopów 59. Ile protonów, neutronów i elektronów zawiera jon Co2+ powstały w wyniku utlenienia tego nuklidu ?
Rozwiązanie:
Dane:
mr = 50 g
cp = 30%
mwoda 300 g
Szukane:
cp = ?
Rozwiązanie: podano propozycję jednego ze sposobów rozwiązania
Krok I - obliczy ilość substancji w roztworze przed rozcieńczeniem ms = 30% z 50 g = 15g
Krok II - obliczamy masę roztworu po rozcieńczeniu mr = 50g + 300g = 350g
Krok II - obliczamy stężenie roztworu po rozcieńczeniu
350 g roztworu stanowi 100%
15 g substancji rozpuszczonej stanowi cp cp= 4,3%
Odpowiedź: Stężenie roztworu po rozcieńczeniu wyniesie 4,3%
Dane:
cm = 8 mol/dm3
d = 1,275 g/cm3
Szukana:
cp = ?
Rozwiązanie
Krok I - do przeliczania stężeń niezbędna jest znajomość masy molowej substancji rozpuszczonej, czyli NaOH MNaOH = 40 g/mol
Krok II - obliczenia prowadzimy dla objętości roztworu, zgodnie z definicją stężenia molowego, 1 dm3. Tak więc masa roztworu, 1 dm3 - m = 1000 cm3•1,275 g/cm3 = 1275 g
Krok III - obliczamy masę substancji rozpuszczonej, czyli zgodnie z treścią zadania 8 moli NaOH. ms = 8 moli•40 g/mol = 320 g
Krok IV - Obliczamy stężenie procentowe roztworu
1275 g roztworu stanowi 100%
320 g NaOH stanowi cp% cp = 25,1%
Krok IV - Odpowiedź: 8 molowy roztwór NaOH jest jednocześnie roztworem 25,1 %
Dane:
[H2] = 0,9 mol/dm3
[N2] = 0,3 mol/dm3
[NH3] = 0,4 mo/dm3
Szukane:
K = ?; stężenia początkowe [H2]; [N2]
Rozwiązanie:
Krok I - ułożenie wyrażenia na stała równowagi na podstawie równania reakcji

Krok II - obliczenie stężeń początkowych wodoru i azotu
Na podstawie równania reakcji ustalamy ilości azotu i wodoru niezbędne do otrzymania równowagowej ilości amoniaku czyli 0,4 mola, z równania reakcji syntezy amoniaku wynikają stosunki molowe: ![]()
Do otrzymania równowagowej ilości amoniaku potrzeba więc 0,2 mola azotu i 0,6 mola wodoru
Stężenia początkowe wynoszą więc: [N2] = 0,3 + 0,2 = 0,5 mol/dm3; [H2] = 0,9 + 0,6 = 1,5 mol/dm3
Dane:
α = 0,57%
cp = 0,5%
d =1 g/cm3
M = 60,05 g/mol
Szukane:
Kdys. = ?
Rozwiązanie:
Krok I obliczymy stężenie molowe kwasu
1 dm3 roztworu czyli 1000 g stanowi 100%
x g kwasu stanowi 0,5% x = 5 g
40 g kwasu stanowi 1 mol
5 g kwasu stanowi n moli n = 0,125 mol/dm3
Krok II korzystając z informacji zawartych w zadaniu policzymy ilość cząsteczek zdysocjowanych cz i cząsteczek, które nie uległy dysocjacji ![]()
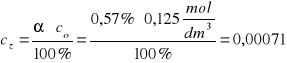
mol/dm3
Krok III Obliczamy ilość cząsteczek, które w stanie równowagi nie uległy dysocjacji
[CH3COOH] = 0,125 mol/dm3 - 0,00071 mol/dm3 = 0,12429 mol/dm3
Krok IV wyrażenie na stałą równowagi 
Krok V Odpowiedź: Stała równowagi kwasu w podanym roztworze wynosi 4,1•10-6
Dane:
Natężenie prądu I = 5A
Vwodoru = 2,8 dm3
Szukane:
Czas elektrolizy t - ?
Rozwiązanie:
Krok I równanie reakcji elektrodowej na katodzie - 2H+ + 2e- = H2
Krok II na podstawie równania reakcji elektrodowej obliczamy niezbędny czas elektrolizy:
Dla uzyskania 1 mola czyli 22,4 dm3 H2 niezbędny jest ładunek 2F czyli 187000 [A•s]
2,8 dm3 H2 niezbędny jest ładunek 5 [A]• x [s]
x = 4675 s = 1,3 h
Dane
malk = 7g
mbrom = 16,0 g
Szukane - wzór i nawy alkenu
Rozwiązanie:
Krok I Obliczamy masę molową alkenu - Jako, że alkeny mają jedno podwójne wiązanie, na jeden mol alkenu przypada 1 mol, czyli 160 g bromu
7 g alkenu przypada 16 g bromu
M alkenu przypada 160 g bromu M = 70 g/mol
Krok II na podstawie wzoru ogólnego alkenów ustalamy jego wzór sumaryczny CnH2n, uwzględniając masy molowe węgla i wodoru można napisać: 12n + 2n = 70 n = 5
Krok III szukanym węglowodorem jest penten, izomery mogą się różnić położeniem podwójnego wiązania, i tak:
I izomer CH3-CH2-CH=CH-CH3 pent - 2 - en
II izomer CH2=CH-CH2-CH2-CH3 pent - 1 - en
Uwaga - warto pamiętać, że izomerami alkenów są cykloalkany. Tak więc w tym wypadku izomerem będzie również cyklopentan
Dane:
V dwutlenku = 300 cm3
Szukane:
n at. węgla = ?
Rozwiązanie: informacja o objętości roztworu jest nieistotna, ważna jest objętość dwutlenku węgla
1 mol CO2 czyli 22,4 dm3 zawiera 6,02•1023 cząsteczek CO2 a tym samym atomów węgla
0,3 dm3 zawiera x at. węgla x = 0,08•1023 atomów węgla
Dane:
malk. = 52,10 g
temp. = 1000C
V = 22,41 dm3
Szukane:
Wzory i nazwy związków ?
Krok I Przeliczenie podanej objętości próbki na warunki normalne, korzystając z równania stanu: 
Krok II po przeliczeniu objętości na warunki normalne można obliczyć masę molową węglowodoru: 16,18 dm3 - 52,10 g
22,4 dm3 - Malk. M = 72,13 g/mol
Krok III za pomocą wzoru ogólnego ustalimy wzór ogólny węglowodoru i jego możliwych izomerów
12n + 2n+2 = 72 n = 5
Krok IV Wzór ogólny odpowiada pentanowi lub np. 2 - metylobutanowi
Dane:
Tl-203 = 29,5%
Tl-205 = 70,5%
Szukane:
MTl = ?
Rozwiązanie: Masa atomowa pierwiastka jest równa średniej ważonej liczb masowych izotopów występujących w przyrodzie. W podanym przykładzie postępujemy więc następująco: MTl=203u•0,295 + 205u•0,705 = 59,89+144,53 = 204,42 u
Odpowiedź: Średnia masa atomowa talu wynosi 204,42 u
Dane i szukane:
Roztwory: H2SO4; CuSO4; NiSO4
Szeregowo połączone elektrolizery
Rozwiązanie:
Przez elektrolizery przepłynęły więc takie same ładunki, co pozwala stwierdzić, że identyczne ładunki niezbędne są do wydzielenia mola wodoru, miedzi i niklu
Krok I obliczymy jaką część mola stanowi wydzielona objętość wodoru
n = 0,112 dm3/22,4 dm3 = 0,005 mola
Krok II obliczamy masy wydzielonych metali
a) ilość miedzi mCu = 64 g/mol•0,005 mola = 0,32 g miedzi
b) ilość niklu mNi = 58,69 g/mol•0,005 mola = 0,29 g niklu
Odpowiedź: Na elektrodach wydzieli się o,32 g miedzi oraz 0,29 g niklu
Rozwiązanie: substancje są ugrupowane na zasadowe i kwasowe. Pozostaje więc jedynie ułożyć odpowiednie równania reakcji:
Dane i szukane:
mMg = 36 g
Vazot = ?
Rozwiązanie: równanie reakcji: 3Mg + N2 = Mg3N2
Z równania reakcji wyliczymy objętość azotu
3 mole magnezu czyli 72 g Mg reagują z z 1 molem czyli 22,4 dm3 azotu
36 g Mg reagują z V dm3 azotu
V = 11,2 dm3 azotu
Dane i szukane:
mr= 233,3 g
cp = 27%
d = 1,16 g/cm3
V = 1dm3
V1 = 0,1 dm3
mNaOH = 2g
odczyn po reakcji =?
Rozwiązanie
Krok I - obliczenie stężenia molowego
Obliczenia dla 1000 cm3 mr = 1000 cm3 • 1,16 g/cm3 = 1160 g
Masa kwasu azotowego, czyli ms = 27% z 1160g = 313,2 g HNO3
Ilość moli kwasu HNO3 (M = 63 g/mol) n = 313.2/63 = 5 moli w 1 dm3 czyli cm = 5 mol/dm3
Krok II
Obliczenie masy kwasu azotowego w objętości 100 cm3 pobranej do reakcji w 0,1 dm3 znajduje się więc 0,5 mola HNO3 czyli 63g/2 = 31,5 g
Krok III
Obliczymy ilość NaOH niezbędną do przereagowania z obliczoną ilością HNO3
Z równania reakcji tych substancji wynika, że reagują w stosunku molowym 1:1 tak więc:
1 mol HNO3 czyli 63 g przereagują z 1 molem NaOH czyli 40 g NaOH
31,5 g przereaguje z x g NaOH
mNaOH = 20 g,
czyli wzięte 2 g to za mało w związku z czym odczyn roztworu będzie kwaśny
Dane i szukane :
K = 1,21
[N2] = 0,72 mol/dm3 - równowagowe
[N2O] = 0,84 mol/dm3 - równowagowe
[O2] = równowagowe i początkowe ?
Rozwiązanie:
Krok I na podstawie równania reakcji ułożyć wzór na stałą równowagi K
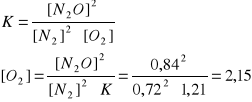
Krok II obliczenie stężenia początkowego tlenu [O2] jako sumy stężenia równowagowego 2,15 g/mol powiększonego o ilość niezbędną do otrzymania równowagowej ilości tlenku azotu(I), czyli 0,42 mola (wyliczona z stosunków molowych równania reakcji). Tak więc stężenie początkowe tlenu [O2] = 2,57 mol/dm3
Dane i szukane:
Węgiel = 53,3%
Wodór =15,6%
Azot=31,3%
M = 45 g/mol
Wzór i dwa izomery ?
Rozwiązanie:
Ustalenie wzoru będzie polegało na wyliczeniu masy poszczególnych pierwiastków w molu substancji
Węgiel = 53,3% z 45g = 24g co odpowiada 2 atomom węgla
Wodór = 15,6% z 45 g = 7g co odpowiada 7 atomom wodoru
Azot = 31,3% z 45g = 14 g co odpowiada 1 atomowo azotu
Wzór sumaryczny związku - C2H7N wzór taki odpowiada aminom alifatycznym np.
C2H5NH2 - etyloamina. Przykład aminy I-rzędowej, lub
HN(NH2)2 dimetylo aminie. Przykład aminy drugorzędowej
Izomery konstytucyjne:
Podany wzór sumaryczny odpowiada kwasom karboksylowym oraz estrom, tak więc:
CH3-CH2 - CH2 - COOH (kwas butanowy) CH3-COO - CH2- CH3 (octan etylu)
Izomery geometryczne: związane są z występowaniem w cząsteczce dwóch atomów węgla o hybrydyzacji sp2 czyli jednego podwójnego wiązania
HO OH HO C2H5
\ / \ /
C = C C = C
/ \ / \
H C2H5 HO H
Izomery optyczna: konieczność wystąpienia asymetrycznego atomu węgla
CHO CHO
| |
H - C*- OH HO - C*-- H
| |
H - C - H H - C -- H
| |
H - C - H H - C - H
| |
H H
Dane i szukane
mr = 10 g
V = 4,25 cm3
cm = 0,1 mol/dm
cp = ?
Rozwiązanie:
Krok I równanie reakcji fenolu z wodorotlenkiem sodu C6H5OH + NaOH = C6H5ONa + H2O
Krok II ilość moli NaOH wziętych do reakcji: n = cm•V[dm3] = 0,0045 dm3•0,1 mol/dm3 = 0,00045 mol NaOH czyli również moli fenolu
Krok III obliczenie masy fenolu Mfenolu = 94 g/mol m = 0,00045 mol•94 g/mol = 0,042g
Krok IV obliczenie stężenia procentowego
10 g roztworu odpowiada 100%
0,042 g fenolu odpowiada x % x = 0,42%
Krok IV Odpowiedź: procentowa zawartość fenolu w badanym roztworze wynosi 0,42%
Dane i szukane:
Cm= 0,01 mol/dm3
K = 10-10
Stopień dysocjacji α ?
Rozwiązanie: zawarte w zadaniu informacje sugerują zastosowanie wzoru na prawo rozcieńczeń Ostwalda 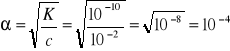
Odpowiedź: Stopień dysocjacji fenolu w roztworze wynosi 10-4
Dane i szukane
Vpow. = 20 cm3
Vwodór = 10 cm3
Vgazów = 17,44 cm3
C%vol tlenu = ?
Rozwiązanie
Krok I obliczenie objętości gazów, które uległy spaleniu V = (20 + 10) - 17,44 = 12,56 cm3
Krok II obliczenie ilości tlenu w spalonej mieszaninie gazów. Wiadomo, że wodór z tlenem reaguje w stosunku objętościowym 2:1, tak więc jedną z trzech przereagowanych objętości stanowił tlen, czyli 12,56: 3 = 4,2 cm3
Krok III obliczenie zawartości procentowej tlenu w mieszaninie gazów
20 cm3 powietrza stanowi 100%
4,2 cm3 tlenu stanowi cp cp = 21%
Krok IV odpowiedź: w badanej próbce powietrza tlen stanowił 21%
Dane i szukane:
Cu-63
Cu - 65
MCu = 63,54 u
Skład procentowy izotopów ?
Rozwiązanie
Krok I średnia masa atomowa jest średnia ważoną składu izotopowego. Zakładamy, że Cu-63 stanowi x%, zaś Cu-65 stanowi (100% - x). Stosując ułamki procentowe będzie to odpowiednio x oraz (1-x)
Krok II obliczenia średniej 63 x + 65(1-x) = 63,54 2x = 1,46 x = 0,73
Krok III izotop Cu-63 stanowi 73% zaś izotop Cu - 65 stanowi 27%
Dane i szukane:
Stopień dysocjacji α = 4,2% = 0,042
cm = 0,1 mol/dm3
[H+] = ?
Rozwiązanie
Krok I
Pisząc równanie reakcji dysocjacji kwasu mrówkowego widzimy, że stężenie jonów wodorowych odpowiada ilości cząsteczek zdysocjowanych cz HCOOH ↔ HCOO- + H+
Krok II przekształcając wzór na stopień dysocjacji obliczymy stężenie cząsteczek zdysocjowanych cz cz = α • cm = 0,042 • 0,1 mol/dm3 = 0,0042 mol/dm3 co odpowiada stężeniu jonów wodorowych w roztworze kwasu mrówkowego
Krok III Odpowiedź: Stężenie jonów wodorowych w roztworze kwasu mrówkowego wynosi 0,0042 mol/dm3
Dane i szukane:
cp = 12%
cm = 3,48 mol/dm3
d = 1,0594 g/cm3
M = ?
Rozwiązanie - zamiast korzystać z gotowego wzoru, którego na ogół się nie pamięta rozwiążemy zadanie na „logikę”, krok po kroku. Zgodnie z definicją stężenia molowego obliczenia będziemy prowadzili dla 1 dm3 roztworu.
Krok I masa 1 dm3 roztworu mr = 1000 cm3•1,0594 g/cm3 = 1059,4 g
Krok II masa substancji rozpuszczonej będzie wynosiła ms = 12% z 1059,4 g = 127,13 g
Krok III zgodnie z podanym stężeniem molowym na masę 127,13 g składa się 3,48 mola, czyli masa molowa M substancji rozpuszczonej wynosi M = 36,5 g/mol
Krok IV masa molowa substancji rozpuszczonej wynosi 36,5 g/mol. Substancją tą mógł być przykładowo chlorowodór.
Dane i szukane:
mr = 750 g
cp1 = 10%
cp2 = 7%
mwoda = ?
Rozwiązanie: jedno z możliwych, drugim może być przykładowo zastosowanie krzyża stężeniowego
Krok I substancja rozpuszczona w roztworze stanowi ms = 10% z 750 g = 75 g
Krok II wyliczoną ilość substancji rozpuszczonej przeliczymy na objętość roztworu rozcieńczonego 75 g stanowi 7%
X g stanowi 100% x = 1070 g
Krok III masę roztworu pierwotnego do końcowego uzupełnimy wodą, czyli 1070g - 750g = 320 g wody
Krok IV Do roztworu pierwotnego należy dodać 320 g wody
Dane i szukane
80% zawartość węgliku glinu w karbidzie
mC = 81,5 g
W1 = 95,5%
W2 = 80%
W3 = 75%
mkarbid = ?
Rozwiązanie
W pierwszej kolejności można zapisać ciąg reakcji opisanych w zadaniu
Krok II wyliczymy ilość węgliku wapnia niezbędną do otrzymania 81,5 g nitrobenzenu przy założonej 100% wydajności
3 mole CaC2 czyli `192 g dają 1 mol czyli 123 g nitrobenzenu
x g 81,5 g nitrobenzenu x= 127,2 g
jeżeli proces technologiczny jest wieloetapowy, wówczas łączną wydajność równa się iloczynowi wydajności jednostkowych. Do trzech wydajności procesów jednostkowych można dodać dodatkową określającą zawartość węgliku wapnia w technicznym karbidzie. Tak więc łączna wydajność W = 0,8•0,8•0,955•0,75 = 0,456
Krok III mając wyliczoną wydajność całkowitą obliczymy ilość karbidu
127,2 g węgliku wapnia stanowi 45,6%
x g karbidu stanowi 100% x= 279 g karbidu
Krok IV odpowiedź: do reakcji trzeba użyć 279 g karbidu
Dane i szukane
malk = 6,9 g
V = 80 cm3 = 0,08 dm3
cm = 1,5 mol/dm3
W - wydajność reakcji - ?
Rozwiązanie
Krok I ilość kwasu, która powstanie przy 100% wydajności
Z 1 mola alkoholu czyli 46 g powstaje 1 mol kwasu czyli 60 g
6,9 g powstaje x g x = 9 g kwasu
Krok II ilość moli kwasu, która przereagowała z roztworem zasady
nzas. = 0,08 dm3•1,5 mol/dm3 = 0,12 zasady a tym samym i kwasu
Krok III ilość moli kwasu zastaje przeliczona na gramy
1 mol kwasu octowego to 60 g
0,12 mola kwasu to x g x = 7,2 g kwasu
Krok IV obliczenie wydajności reakcji;
9 g kwasu octowego odpowiada 100% wydajności
7,2 g kwasu odpowiada W % wydajności W = 80%
Krok V odpowiedź: reakcja utlenienia alkoholu biegnie z wydajnością 80 %
Dane i szukane
V1 = 200 cm3
c1 = 2 mol/dm3
d1 = 1,08 g/cm3
cp = 24%
d2 = 1,18 g/cm3
mr = ?
Vr = ?
cm = ?
Rozwiązanie
Krok I obliczyć stężenie procentowe rozcieńczanego roztworu - tradycyjnie przeliczenia stężeń dokonujemy przy założeniu, że mamy 1000 cm3 roztworu
mr = 1000 cm3•1,08 g/cm3 = 1080 g
masa substancji rozpuszczonej ms = 2mole • 58,5 g/mol = 117 g
obliczenie stężenia procentowego 1080g roztworu stanowi 100%
117 g NaCl stanowi cp
cp = 10,83 %
Krok II za pomocą krzyża stężeniowego obliczymy ilość NaCl, którą należy dodać
100% x g
\ /
24%
/ \
11% 216 g
![]()
x = 37 g NaCl
Krok III masa roztworu masa roztworu jest sumą mas roztworu rozcieńczanego 200 cm3•1,08g/cm3 = 216 g i dodanego chlorku sodu, czyli 37 g = 253 g
Krok IV przeliczenie stężenia procentowego cp = 24% roztworu chlorku sodu o gęstości 1,18 g/cm3. Jak zwykle proponuję obliczanie „krok po kroku” dla objętości 1 dm3
mr =1000 cm3• 1,18 g/cm3 = 1180 g
Krok V obliczenie masy rozpuszczonego chlorku sodu ms = 24% z masy 1180 g =283,2 g
Krok VI przeliczenie masy chlorku sodu na ilość moli n = 283,g/58,5g = 4,84 mol/dm3
Krok VII Masa roztworu po rozcieńczeniu wyniesie 253 g, jego stężenie molowe 4,84 mol/dm3
Dane i szukane:
Vroztw. = 200 cm3 = 0,2 dm3
Przyrosty mas płytek w:
- roztwór Cu(NO3)2 = 2,239 g (12,239g - 10,0 g )
- roztwór AgNO3 = 7,612 g (17,612g - 10,000 g)
cm Cu(NO3)2 - ?
cm AgNO3 - ?
Rozwiązanie:
Krok I równanie reakcji Cd + CuSO4 = CdSO4 + Cu
Krok II obliczymy ilu molom CuSO4 odpowiada stwierdzony przyrost masy płytki
1 mol CuSO4 powoduje wydzielenie 1 mola, (64 g Cu) i roztw. 1 mola (112,4 g Cd) = 48,4g
x moli CuSO4 spowoduje przyrost masy płytki 2,239g
x = 0,046 mola
Krok III obliczamy stężenie molowe CuSO4 cm = n/V = 0,046/0,2 = 0,23 mol/dm3
Krok IV obliczamy ilu molom AgNO3 odpowiada podany w zadaniu przyrost masy
Cd + 2AgNO3 = Cd(NO3)2 + 2Ag
2 mole AgNO3 spowoduje zmianę masy płytki 216 g Ag - 112,41 g Cd = 103,6 g
x moli AgNO3 spowodują zmianę masy płytki 7,612 g
x = 0,15 mola AgNO3
Krok V obliczamy stężenie molowe AgNO3 cm = n/V = 0,15 mol/0,2 dm3 = 0,75 mol/dm3
Dane:
Elektroliza wodnego roztworu KOH
Równanie reakcji dysocjacji: KOH ↔ K+ + OH-
Równania reakcji elektrodowych
Na anodzie: 2OH- - 2e- = ½O2 + H2O
Na katodzie: H2O + 2e- = H2 + 2OH-
Dane i szukane:
mrudy =1 t =1000 kg
Zawartość FeCuS2 = 5,4%
Zawartość Ag2S = 0,003%
Ilość Ag i Cu ?
Rozwiązanie
Krok I obliczenie ilości siarczków w 1 t rudy
m FeCuS2 = 5,4% z 1000 kg = 54 kg
Krok II obliczenie ilości siarczku srebra m Ag2S = 0,003% z 1000kg = 0,03 kg
Krok III obliczenie ilości miedzi na podstawie podanego wzoru rudy
1 kilomol FeCuS2 czyli 184 kg CuFeS2 zawiera 1 mol, czyli 64 kg miedzi
54 kg CuFeS2 zawiera mCu = 18,8 kg Cu
Krok IV obliczenie ilości srebra na podstawie podanego wzoru rudy
1 kilomol czyli 248 kg Ag2S zawiera 2 kmol czyli 216 kg Ag
0,03 kg Ag2S zawiera mAg kg
mAg = 0,026 kg srebra
Dane i szukane
Liczba atomowa Co - 27
Liczba masowa Co - 59
Ilość cząstek elementarnych w nuklidzie ?
Ilość cząstek elementarnych w jonie Co2+ ?
Rozwiązanie:
Obliczenie cząstek elementarnych w nuklidzie: liczba atomowa określa ilość elektronów i protonów, czyli nuklid zawiera 27 elektronów i 27 protonów. Ilość neutronów jest różnicą liczby masowej i atomowej, czyli 59 - 27 = 32 neutrony
W jonie Co2+ mamy niedomiar dwóch elektronów, które oddał atom tworząc dwu dodatni jon. Tak więc w jonie znajduje się 25 elektronów
17
Wyszukiwarka
Podobne podstrony:
Rownowaga Chemiczna Zadania, Nauka, Szkoła, Matura, Chemia - notatki, Notatki CHEMIA
ekologia2k, Nauka, Szkoła, Matura, Biologia - testy liceum, Testy
ToiZ wykład- notatki, nauka - szkola, hasło integracja, rok I, Teoria organizacji i zarządania
reakcje chemicznew roztworach wodnych, Matura Chemia Rozszerzona, Podręczniki, Notatki
Chemia - Zbiór i testy - Odpowiedzi, Nauka, Chemia
Zadania alkohole i estry, Szkoła średnia matura, Chemia
Węglowodory not, Matura Chemia Rozszerzona, Podręczniki, Notatki
ToiZ wykład- notatki, nauka - szkola, hasło integracja, rok I, Teoria organizacji i zarządania
matura chemia 2015 odpowiedzi interia
Praktyczna Nauka Języka Rosyjskiego Moje notatki (leksyka)2
Praktyczna Nauka Języka Rosyjskiego Moje notatki (gramatyka)4
5 Chem2 Zbiór zadań Odpowiedzi i wskazówki
Praktyczna Nauka Języka Rosyjskiego Moje notatki (leksyka)35
2004-12-01 - odp, Matura, matura, Chemia - Matura, Chemia - matura testy
więcej podobnych podstron