TERMODYNAMIKA
TERMODYNAMIKA
Kinetyczna teoria gaz
Kinetyczna teoria gaz
ó
ó
w
w
→
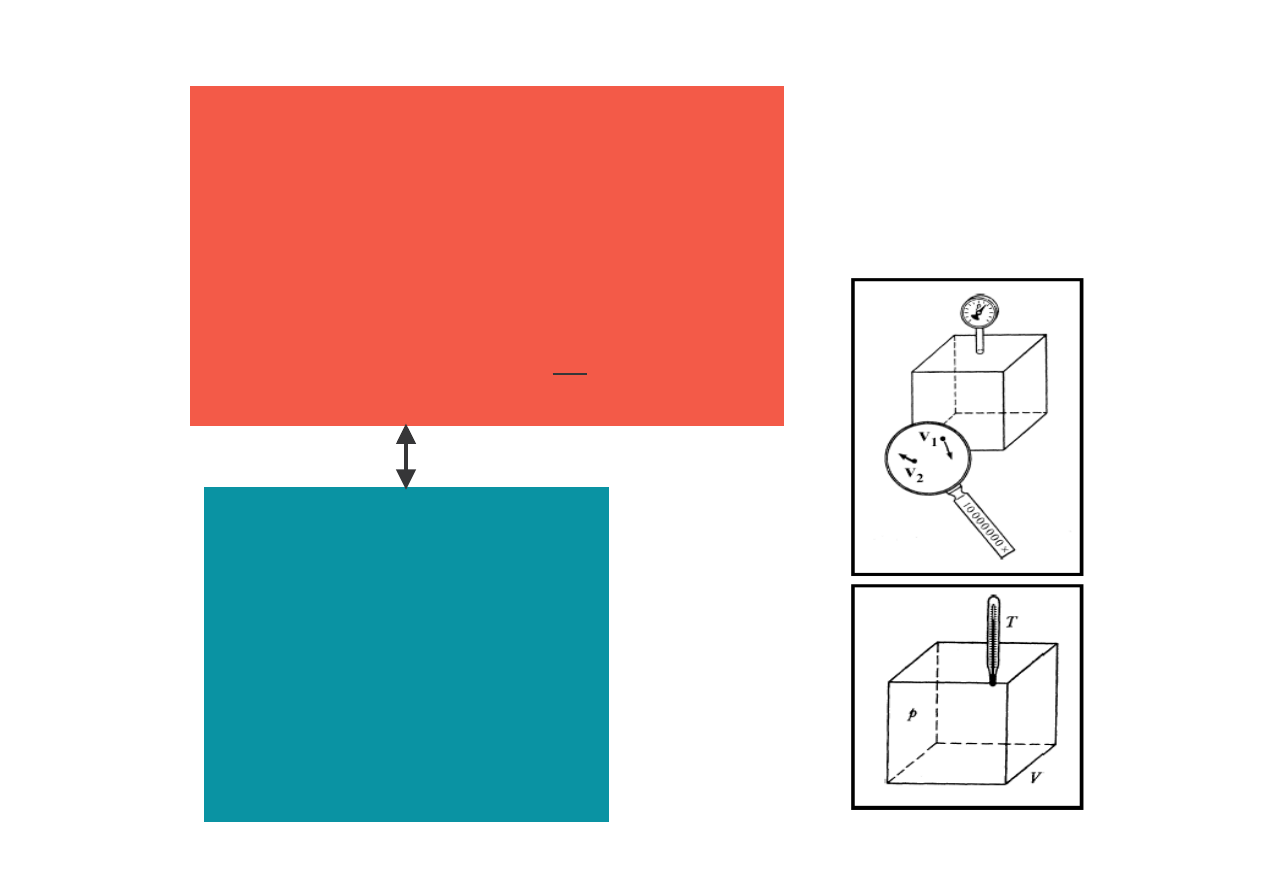
1 cm
3
około 10
19
cz steczek
powietrza !

Jednostka ci nienia – 1 Torr
Jednostka ci nienia – 1 paskal
→
→
!
Prawo gaz
Prawo gaz
ó
ó
w doskona
w doskona
ł
ł
ych
ych
Gaz doskona
Gaz doskona
ł
ł
y
y
– zało enia modelu
:
• Obj to
cz steczek gazu jest o wiele mniejsza ni
obj to
zajmowana przez gaz (cz steczki gazu – punkty materialne)
• Zasi g sił działaj cych mi dzy dwiema cz stkami jest o wiele mniejszy
ni
rednia odległo
mi dzycz steczkowa
(oddziaływania mi dzycz steczkowe – pomijane)
• Zderzenia cz steczek s idealnie spr yste
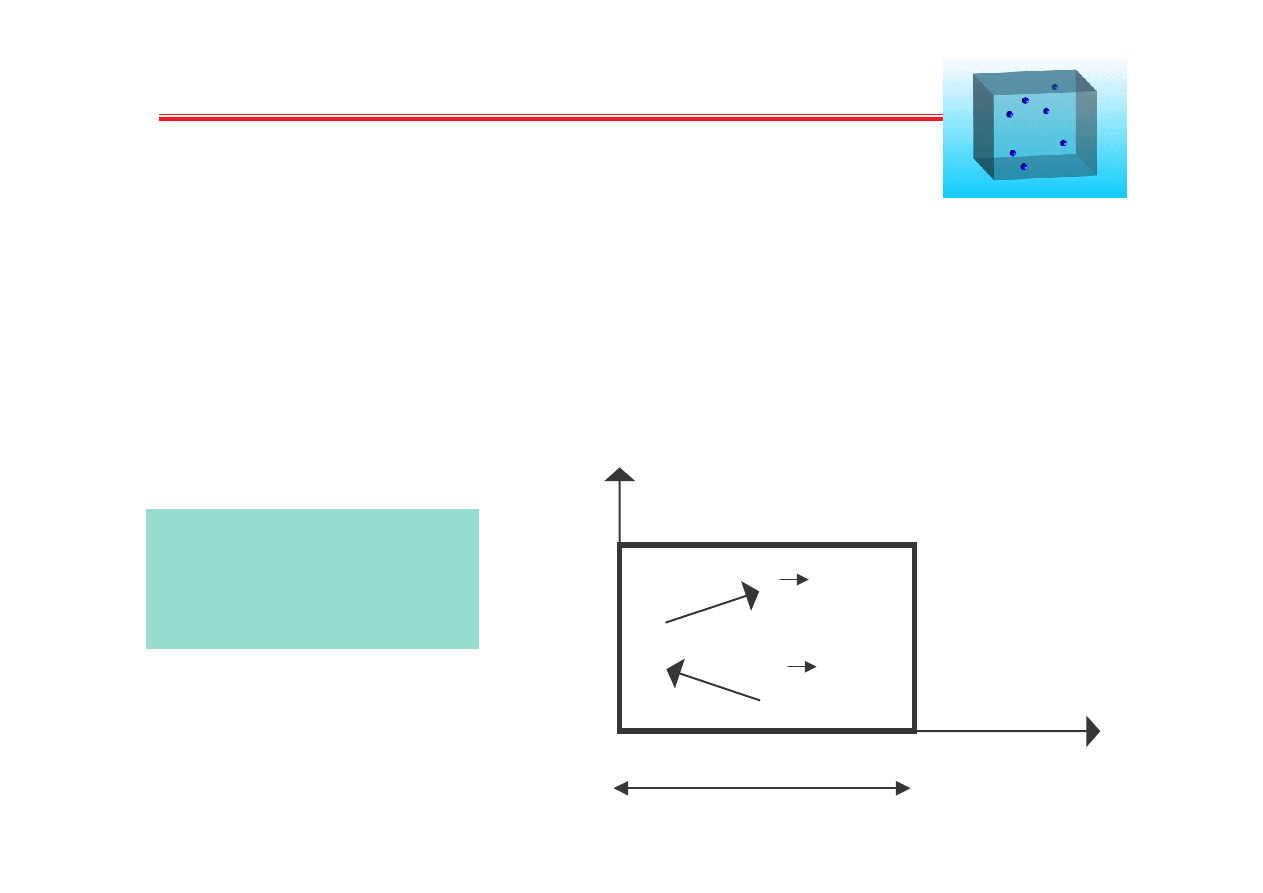
Rozwa amy 1 cz steczk
Cz steczki gazu:
N kulek w naczyniu
o obj to ci V
x
y
-v
x
v
x
l
v
1
v
2
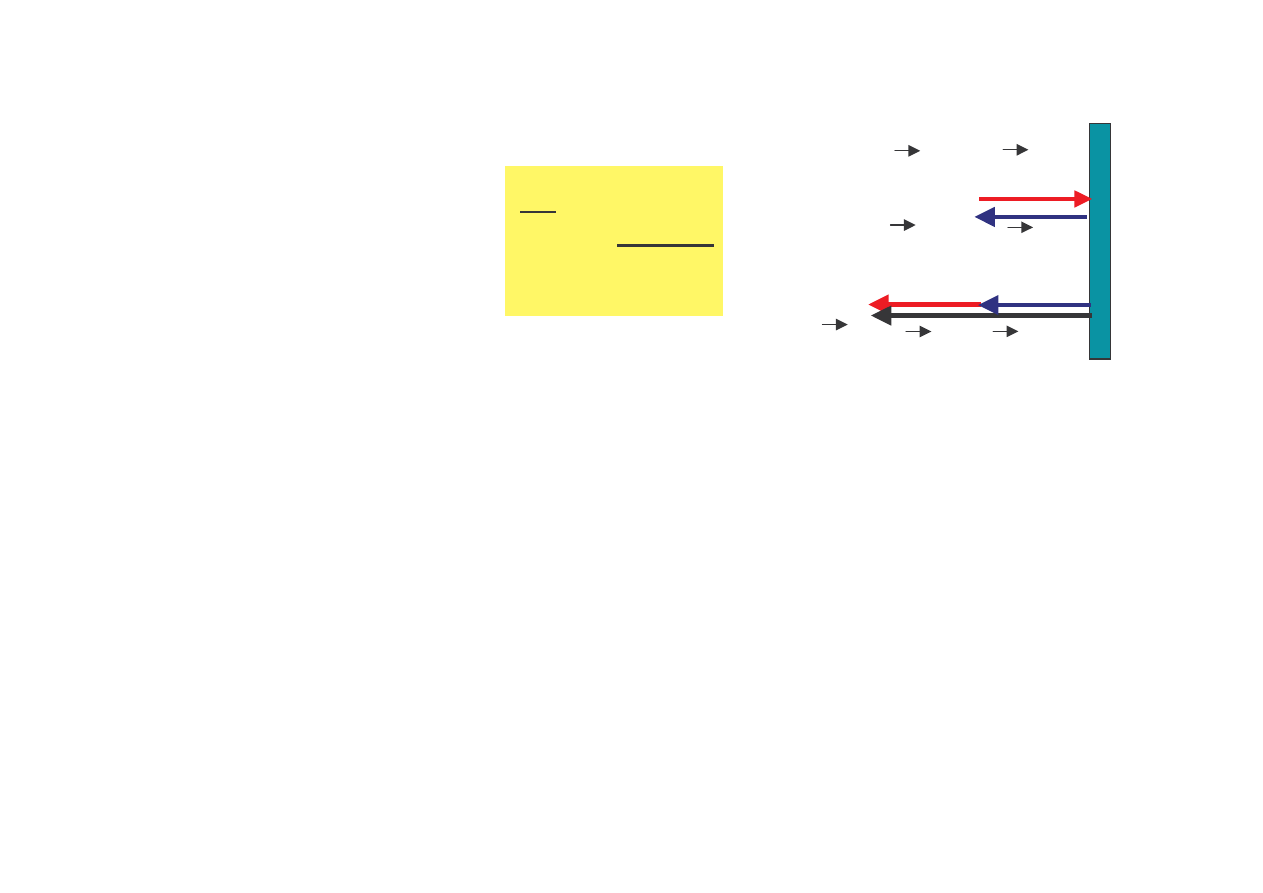
rednia siła
jak cz steczka wywiera na ciank w
czasie
∆∆∆∆
t wynosi
t
p
F
x
∆
∆
=
Zmiana p du
cz steczki:
∆∆∆∆p
x
= m
v
x
- ( - m
v
x
) = 2m
v
x
Czas
pomi dzy kolejnymi zderzeniami z t sam
ciank :
∆∆∆∆t = 2l/
v
x
gdzie
l
- odległo
mi dzy ciankami
Z II zasady
dynamiki:
1
1
v
m
p
=
2
2
v
m
p
=
1
2
p
p
p
−
=
∆
Całkowita siła działaj ca na ciank od
N cz steczek
:
l
m
N
F
2
x
v
=
gdzie
jest to
u rednione po wszystkich
cz steczkach ( rednia kwadratu pr dko ci).
2
v
x
2
v
x
l
m
l
m
F
x
x
x
2
v
v
2
)
v
2
(
=
=
St d:
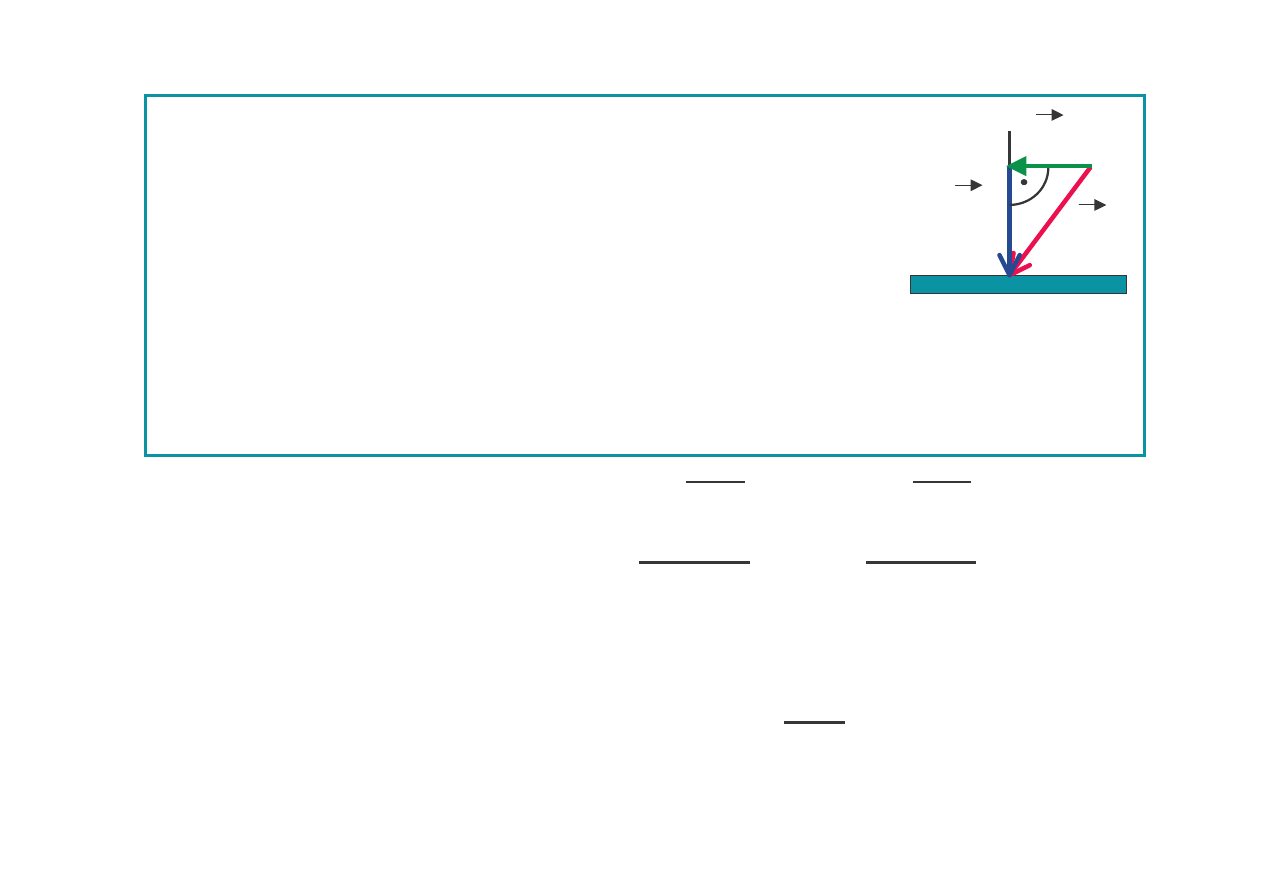
V
m
N
Sl
m
N
p
x
x
2
2
v
v =
=
Ci nienie
gdzie: S – pole powierzchni cianki
2
v
x
Nm
pV
=
lub:
Ci
Ci
nieniem
nieniem
p
p
nazywamy wielko
fizyczn
liczbowo równ sile działaj cej na powierzchni
ciała wzdłu normalnej do tej powierzchni:
p = dF
n
/ dS
normalna siły działaj cej na
ds
Jednostka: paskal 1 Pa = 1N / 1m
2
n
F
F
n
d
S
F
S
2
z
2
y
2
x
2
v
v
v
v
+
+
=
2
z
2
y
2
x
v
v
v
=
=
Poniewa
oraz
wi c:
3
v
v
czyli
,
v
3
v
2
2
x
2
x
2
=
=
oraz
3
v
Nm
pV
2
=
Poniewa N·m = M (masa gazu) oraz M/V =
ρρρρ
(g sto )
wi c:
ρ
ρ
p
p
kw
sr
3
v
v
,
3
v
2
.
.
2
=
=
=
czyli
p = (2/3)n
0
E
gdzie
n
0
= N/V

Temperatura
Temperatura
Temperatur
bezwzgl dn
definiujemy
jako
wielko
wprost proporcjonaln
do
redniej energii
kinetycznej cz steczek:
2
v
3
2
2
m
k
T
=
gdzie
k = 1.38·10
-23
J/K - stała Boltzmanna
Jednostka: kelvin (K)
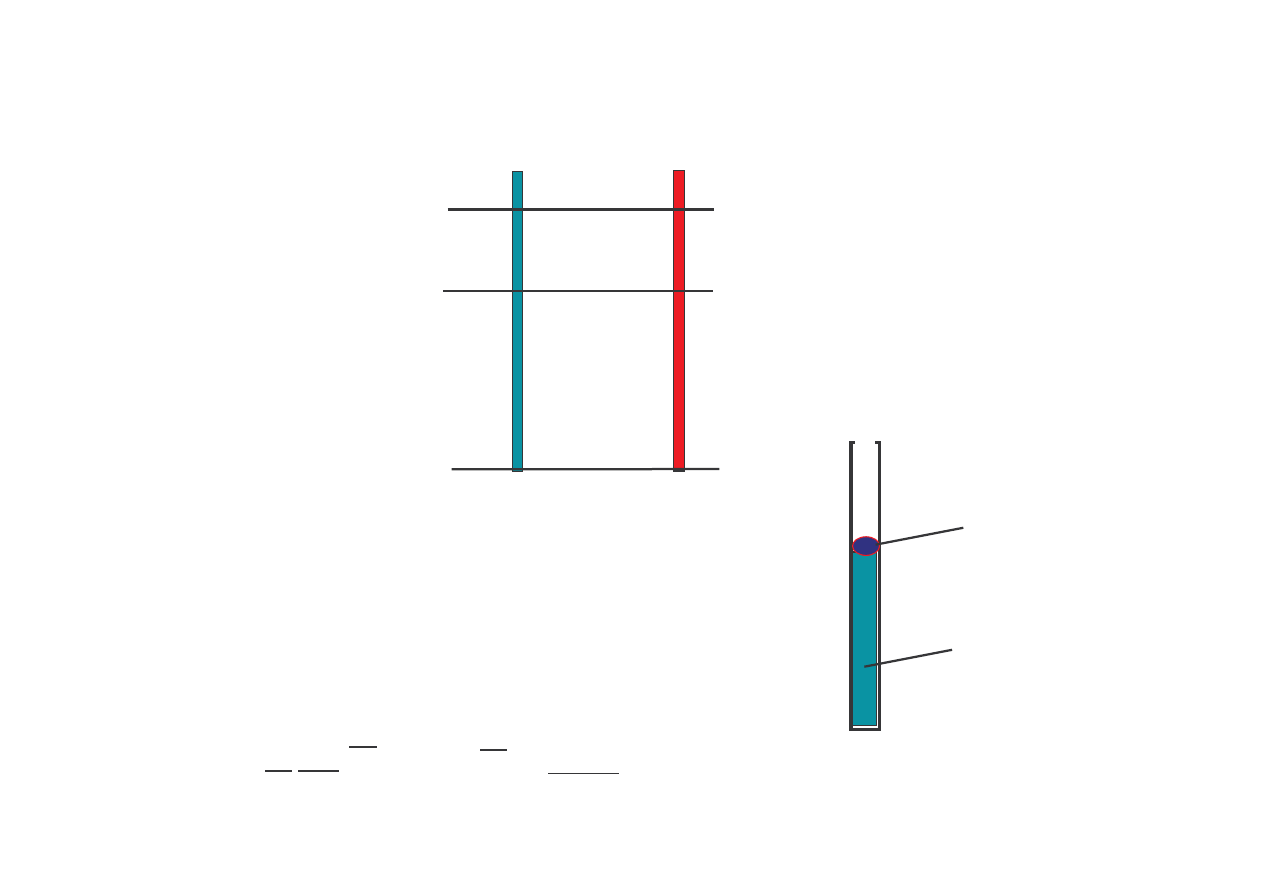
Skala bezwzgl dna T
– skala Kelvina
Punkt wrzenia H
2
O
Punkt zamarzania
H
2
O
Zero bezwzgl dne
Skala Celsjusza
0 K
273
- 273
0
0
C
100
Pomiar T – poprzez pomiar p i V
→
termometr
gaz doskonały
rt
V = N·kT/p
czyli
V
∼∼∼∼
T
E
V
N
p
3
2
=
oraz
2
3kT
E
=

Po przekształceniach:
pV = NkT = nN
A
kT
lub
pV = nRT
gdzie
n
- liczba moli gazu
R = 8.3145 J/(mol·K)
– stała gazowa
N
A
= 6.023·10
23
mol
-1
- stała (liczba) Avogadro
(liczba cz steczek w jednym molu)
R = k·N
A
równanie stanu gazu doskonałego
Clapeyron, XIX w.

W układzie SI:
Mol
jest jednostk liczno ci materii.
1 mol jest to liczno materii układu
zawieraj cego liczb cz stek (np. atomów,
cz steczek, jonów, elektronów itp.) równ liczbie
atomów w masie 12 gramów izotopu w gla
12
C.
W jednym molu znajduje si ok. 6,0221415(10)·10
23
cz stek (2002) – stała (liczb ) Avogadra.

Zerowa zasada termodynamiki
Zerowa zasada termodynamiki
Je eli ciała 1 i 2 s w równowadze termicznej i
ciała 2 i 3 s w równowadze termicznej, to
ciała 1 i 3 s
w tej samej równowadze
termicznej.
rednie energie kinetyczne ruchu post powego (na
cz steczk ) dla dwu kontaktuj cych si gazów s równe
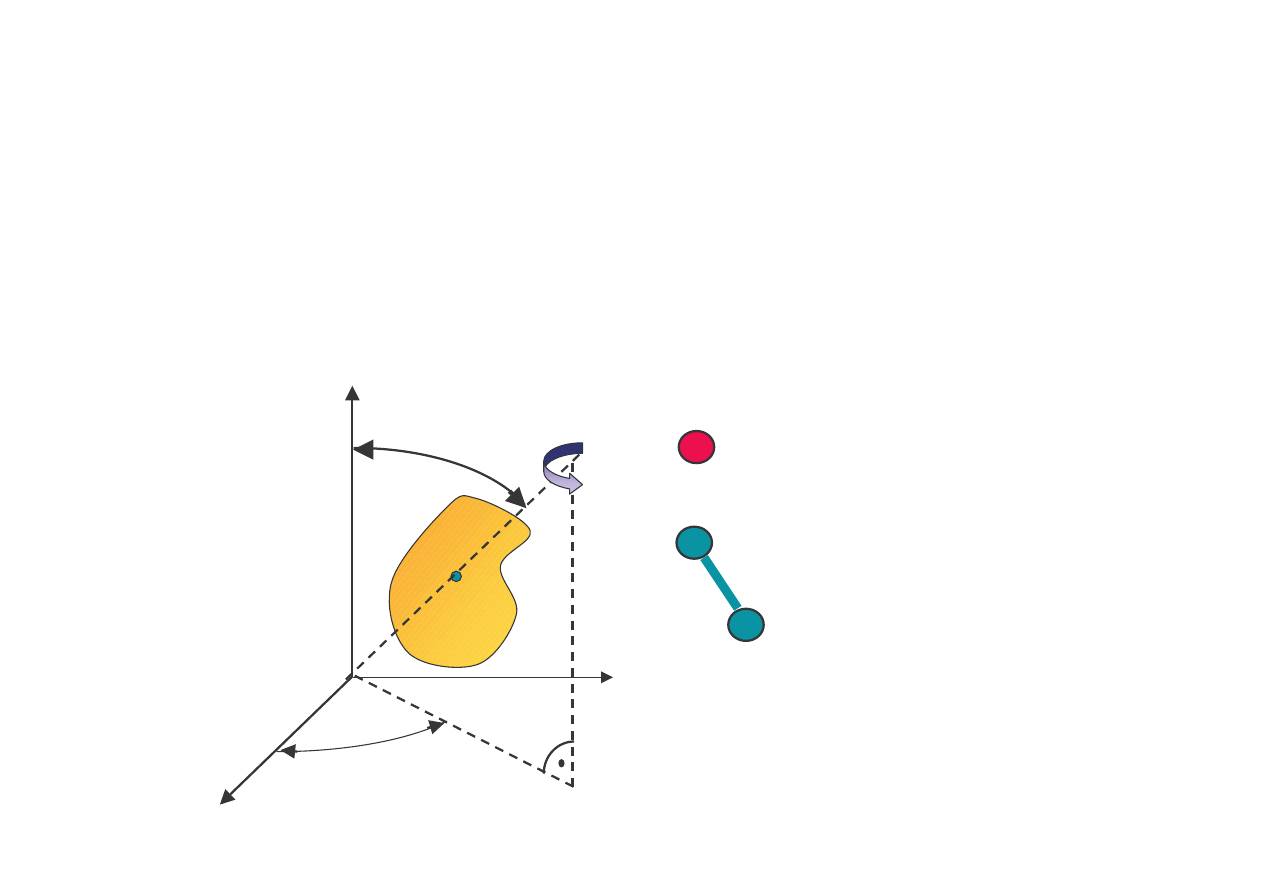
Sposoby absorpcji energii kinetycznej
przez cz steczki
wieloatomowe (bryły sztywne)
→
ruch post powy i obrotowy
→
stopnie swobody
- niezale ne współrz dne potrzebne
do okre lenia poło enia ciała w przestrzeni
liczba stopni swobody -
f
f
cz steczka jednoatomowa
f = 3
cz steczka dwuatomowa
f = 5
cz steczka wieloatomowa
f = 6
0 – rodek
masy
x
z
y
0
ϑϑϑϑ
φφφφ
Ψ
Ψ
Ψ
Ψ
kT
m
2
3
v
2
1
2
=
rednia energia kinetyczna ruchu post powego –
3 stopnie swobody (współrz dne x, y, z):
St d
rednia energia na stopie swobody ruchu
post powego wynosi
E
f
=
kT/2
na cz steczk
(zale y tylko od T)

Zasada ekwipartycji energii
Zasada ekwipartycji energii
rednia energia kinetyczna na ka dy stopie
swobody jest taka sama dla wszystkich
cz steczek i wynosi
kT/2
.
kT
Nf
U
2
=
Dla układu N-cz stek – energia wewn trzna
kT
f
E
2
=
Całkowita energia kinetyczna cz steczki
traktowanej jako bryła sztywna wynosi
Pierwsza zasada termodynamiki
Pierwsza zasada termodynamiki
Zasada zachowania energii ciała - z rozdziałem na energi
• makroskopow (energia mechaniczna ruchu masy)
• mikroskopow (wewn trzna "ukryta" energia cz stek)
Gdy dwa układy (ciała) o ró nych temperaturach zetkniemy
ze sob , to
ciepło
∆∆∆∆
Q
przepływa z ciała cieplejszego do
chłodniejszego.
Ciepło
pobrane przez układ jest równe wzrostowi
energii wewn trznej
układu i
pracy
wykonanej przez
układ nad otoczeniem zewn trznym,
czyli
Umowa:
Q > 0 – dostarczone, W >0 – praca wykonana przez układ
∆∆∆∆Q = ∆∆∆∆U + ∆∆∆∆W
lub
dQ = dU + dW
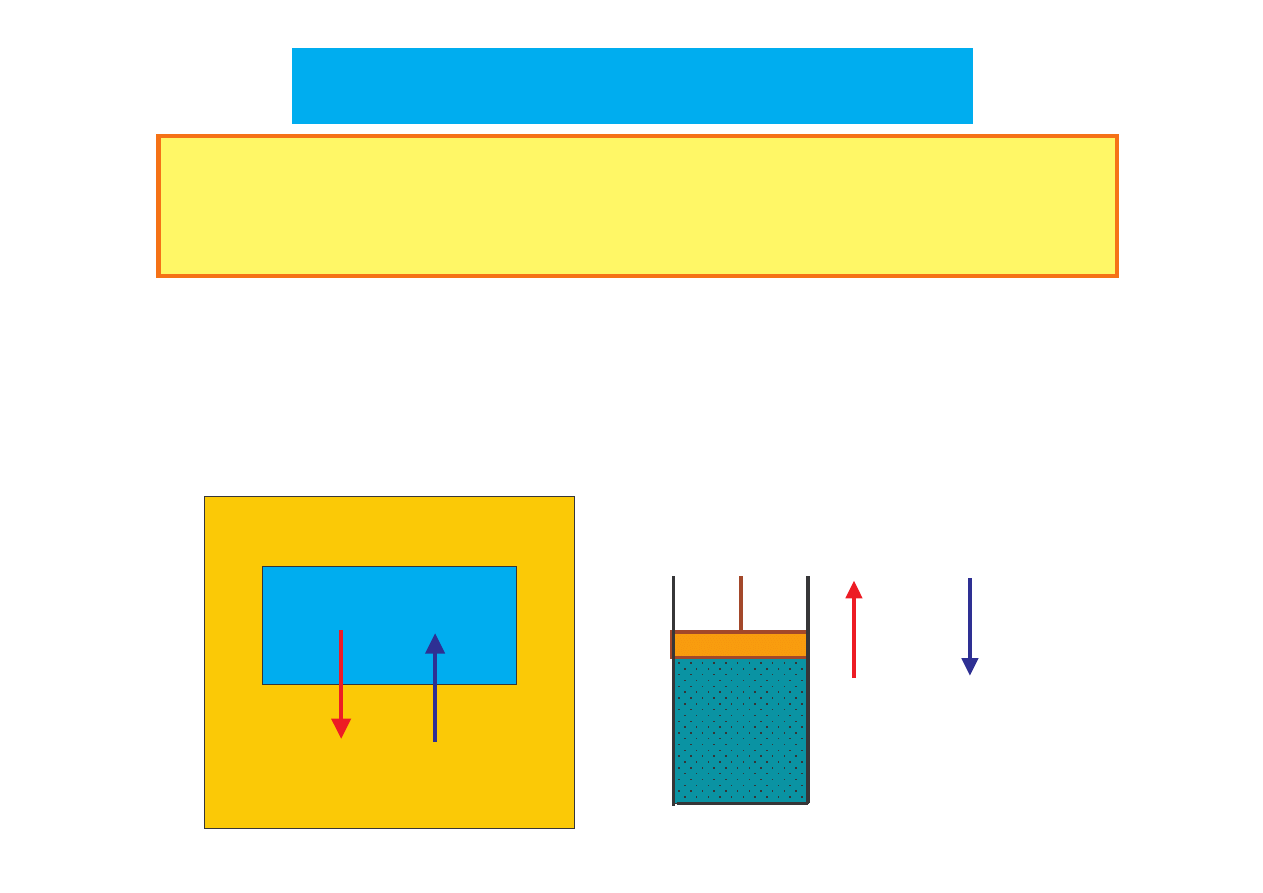
Przekazywanie
energii
– w postaci
ciepła Q
lub
pracy W
(za
po rednictwem siły działaj cej na układ).
Q
i
W
– nie s wła ciwo ciami układu (w przeciwie stwie do
T
,
p
i
V
).
układ
T
U
otoczenie
T
U
>>>>
T
O
T
O
Q
<<<<
0
Q
>>>>
0
T
U
<<<<
T
O
CIEPŁO
W
>>>>
0
W
<<<<
0
PRACA wykonana przez
układ
Ciepło Q
– energia przekazywana mi dzy układem a jego
otoczeniem na skutek istniej cej mi dzy nimi ró nicy
temperatur.
CIEPŁO i PRACA
Energia wewn trzna układu
U
- wzrasta, je eli układ pobiera energi w postaci ciepła
Q
- maleje, gdy układ wykonuje prac
W
.
Przemiana (proces) termodynamiczna:
stan pocz tkowy (p
p
, V
p
, T
p
)
→
stan ko cowy (p
k
, V
k
, T
k
)
ENERGIA WEWN TRZNA
Ró nica
∆∆∆∆
Q –
∆∆∆∆
W =
∆∆∆∆
U
jest dla wszystkich
procesów jednakowa !
P
K
U
– tzw.
funkcja stanu
, w
przeciwie stwie do
Q
i
W
Jednostka
U, Q, W: d ul 1(J)
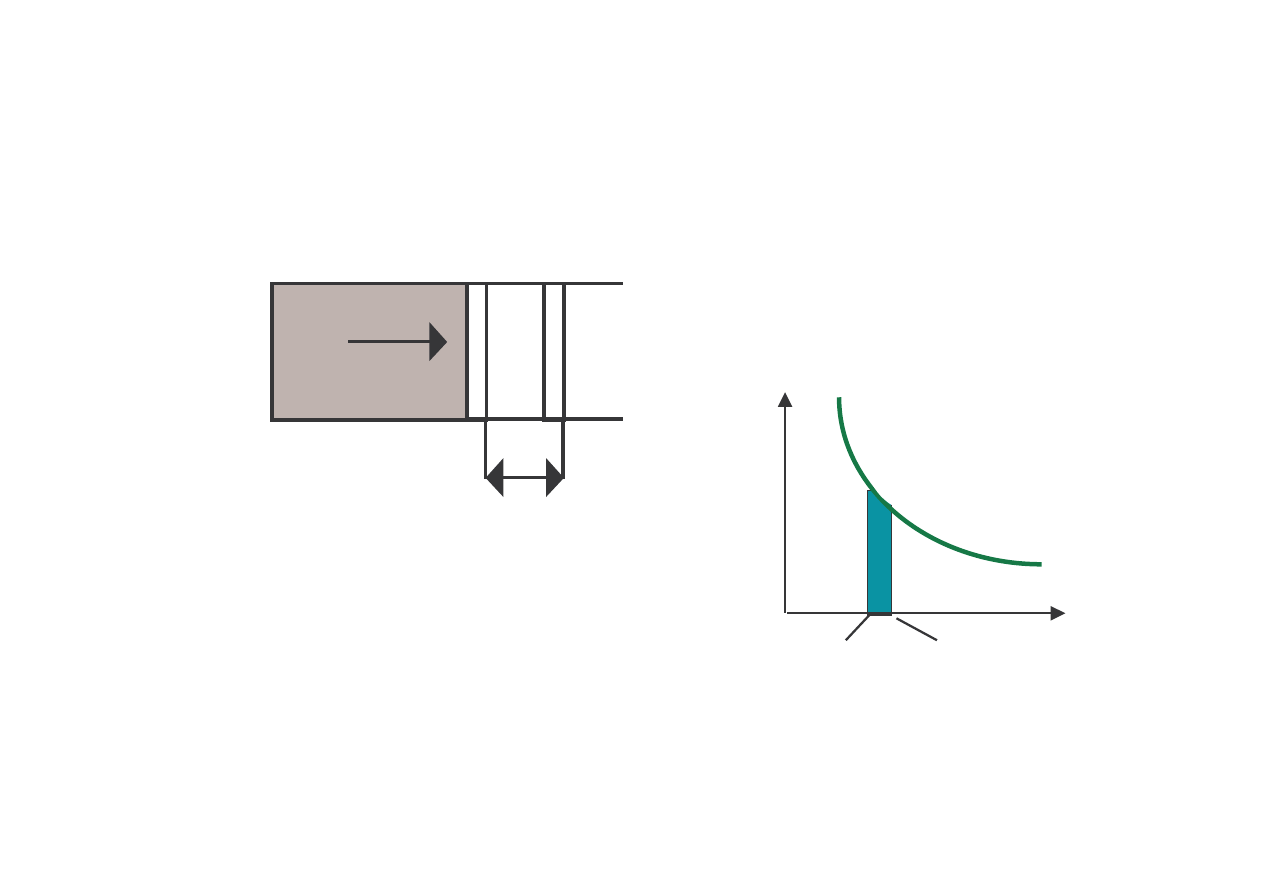
dW = Fdl = (F/S)(Sdl) = pdV
dU = dQ – pdV
F
V
dl
S
dU = dQ – dW
Mo na zwi kszy
energi wewn trzn
U
dostarczaj c ciepło oraz / lub ciskaj c gaz
∆∆∆∆
Q
i
∆∆∆∆
W
– zale od drogi przej cia
∆∆∆∆
U
–
nie zale y od drogi przej cia
V
p
V
V+
∆∆∆∆
V
dW=pdV
p(V)

Def.
Ciepłem wła ciwym
nazywamy wielko
fizyczn równ liczbowo ciepłu, które nale y dostarczy
do jednostki masy substancji, aby podwy szy jej
temperatur o jeden kelwin 1K (1
0
C)
dT
dQ
M
c
w
⋅
= 1
St d:
dQ = Mc
w
dT
Jednostka c
w
: J
·
kg
-1
·
K
-1

Ciepło molowe
- na 1 mol substancji
dT
dQ
M
dT
dQ
n
C
⋅
=
⋅
=
µ
1
gdzie
n=M/
µµµµ
- liczba moli gazu
M- masa gazu
µµµµ
- masa 1 mola
Jednostka C: J
·
mol
-1
·
K
-1
C=c
w
·
µµµµ

Ciep
Ciep
ł
ł
o
o
molowe
molowe
przy sta
przy sta
ł
ł
ej obj
ej obj
to
to
ci
ci
C
C
V
V
Przemiana izochoryczna
dV = 0
dU = dQ
st d:
C
V
= 1/n · dQ/dT = (
µµµµ
/M) · dU/dT
oraz
∆∆∆∆
U = (M/
µµµµ
)C
V
∆∆∆∆
T
Dla
1 mola
gazu
jednoatomowego
zatem
C
V
= (3/2)R
C
V
= (f/2)
R
Dla gazu
dwuatomowego
C
V
= (5/2)R
Dla gazu
wieloatomowego
C
V
= 3R
RT
kT
N
U
A
⋅
=
⋅
=
2
3
2
3
f
- liczba stopni
swobody
cz steczki
gazu
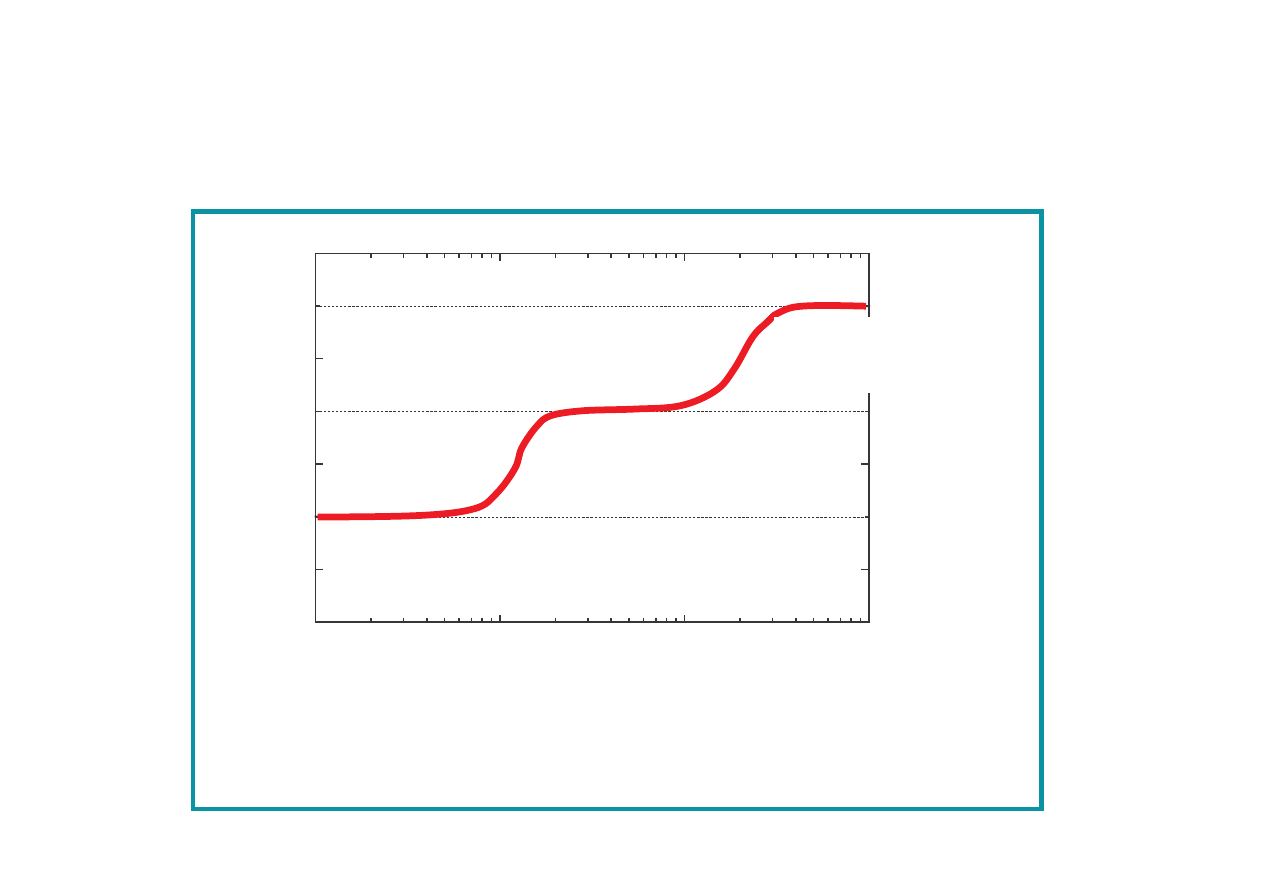
Brak zale no ci C
v
od T – sprzeczno
z eksperymentem !
C
V
dla wodoru (H
2
) w funkcji temperatury
10
100
1000
10000
2
4
6
8
(3/2) R
(5/2) R
(7/2) R
C
v
c
al
/m
ol
K
Temperatra (K)
C
V
/R
7/2
5/2
3/2
ruch post powy
ruch obrotowy
ruch
oscylacyjny

Dla T < 100 K,
C
V
= (3/2)R
brak rotacyjnych stopni
swobody
rednia energia wewn trzna na cz steczk wynosi
U = E
r,kin,post
+ E
r,kin,rot
+ E
r,kin,drg
+ E
r,pot,drg
U = (3/2)kT + (2/2)kT + (1/2)kT + (1/2)kT = (7/2)kT
Dla 1 mola
U = (7/2)RT wi c C
V
= (7/2)
R

Ciep
Ciep
ł
ł
o
o
molowe
molowe
przy sta
przy sta
łym
łym
ci nieniu
ci nieniu
C
C
p
p
Przemiana izobaryczna
Z I zasady termodynamiki:
dQ = dU + pdV
U zale y tylko od T
dla 1 mola gazu
dU = C
V
dT
wi c:
dQ = C
V
dT + pdV
C
p
= [(f+2)/2]
R
dV = RdT/p
dQ = C
V
dT + RdT
St d:
dQ/dT = C
V
+ R
Ostatecznie
C
p
= C
V
+ R

Typ gazu
c
v
c
p
c
p
/
c
v
Jednoatomowy
Dwuatomowy + rotacja
Dwuatomowy + rotacja +
drgania
Wieloatomowy + rotacja (bez
drga )
(3/2)R
(5/2)R
(7/2)R
(6/2)R
(5/2)R
(7/2)R
(9/2)R
(8/2)R
5/3
7/5
9/7
4/3
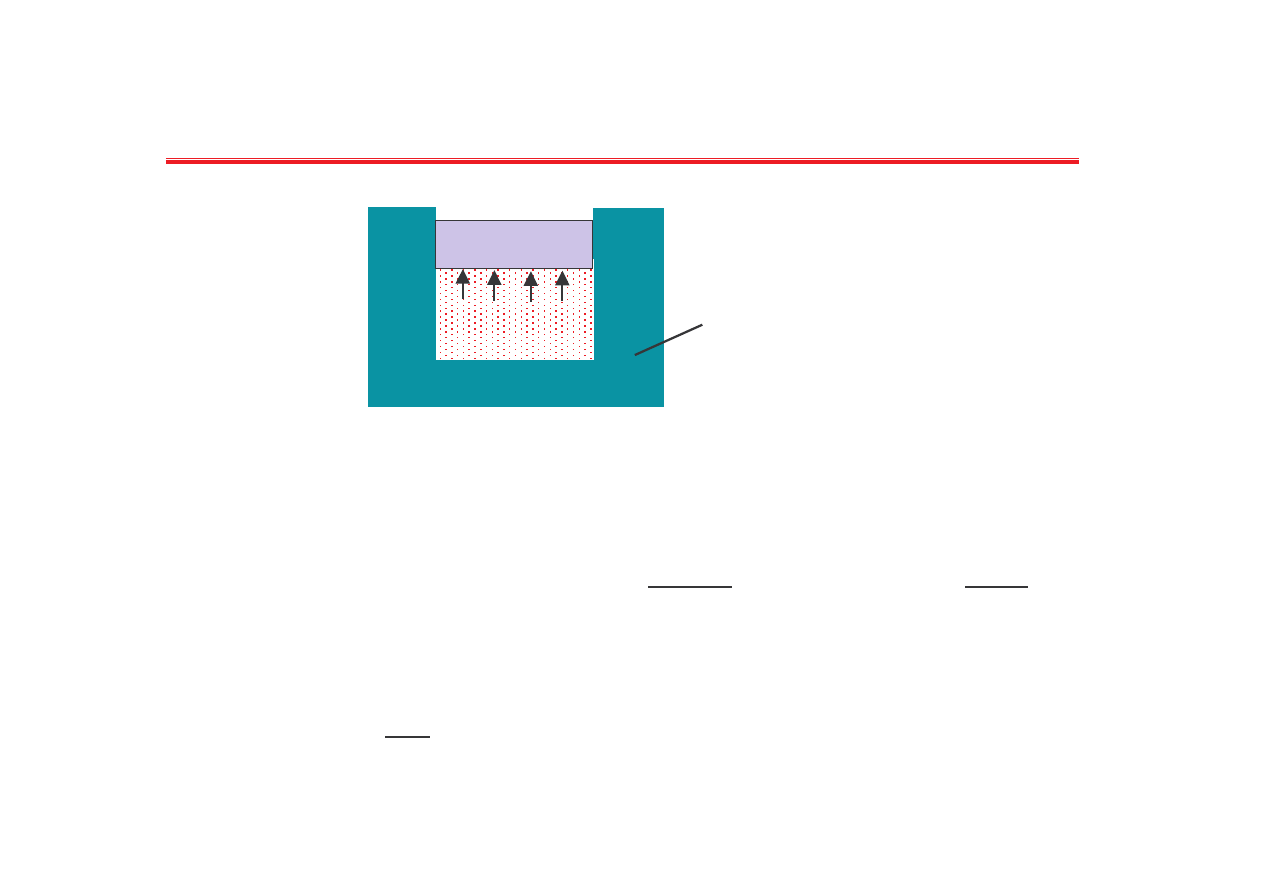
Rozpr
Rozpr
anie izotermiczne
anie izotermiczne
Poniewa
T = const. wi c dU = 0, a st d dQ = dW
=
=
=
=
=
∆
=
∆
1
2
1
ln
d
d
d
2
2
1
2
1
V
V
nRT
v V
V
nRT
V
V
nRT
V
p
W
Q
V
V
V
V
V
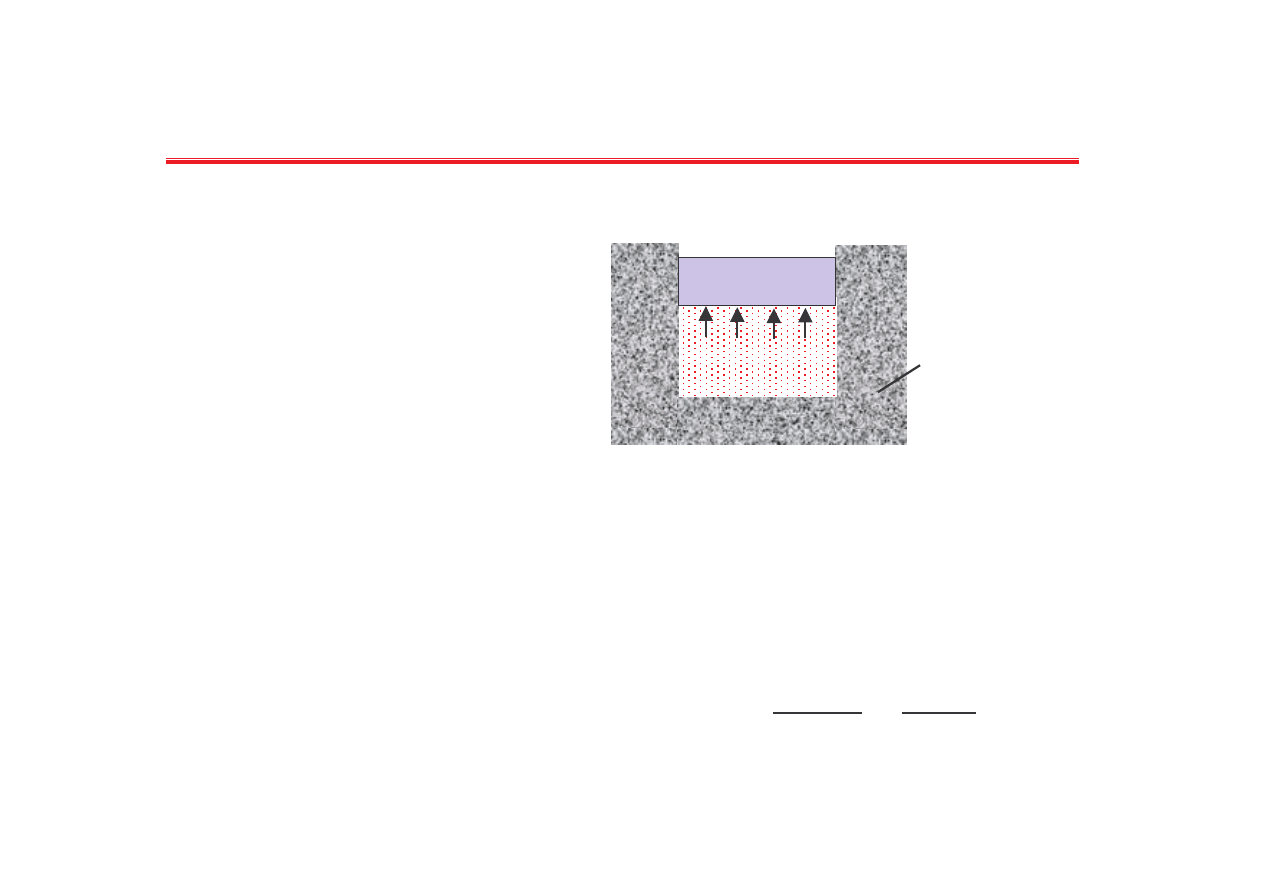
tłok
termostat
T = const.
V
Rozpr
Rozpr
anie
anie
adiabatyczne
adiabatyczne
dQ = 0
dU + pdV = 0
lub na 1 mol:
c
v
dT + pdV = 0
tłok
V
izolacja
termiczna
Brak wymiany ciepła z otoczeniem
R
Vdp
R
pdV
dT
+
=
Vdp
pdV
RdT
+
=
Z równania stanu gazu doskonałego :
pV=RT
dT
0
d
d
0
1
R
c
pd
0
d
d
d
v
v
V
v
=
+
+
=
+
+
=
+
+
p
R
V
c
V
p
R
R
c
dp
R
V
c
V
V
p
R
p
V
R
V
p
c
V
0
=
+
p
dp
c
V
dV
c
V
p
0
=
+
Vdp
R
c
pdV
R
c
V
p
c
v
+ R = c
p

0
d
d
=
+
p
p
V
V
γ
gdzie
γγγγ
= c
p
/
c
v
.
const
ln
ln
0
d
d
=
+
=
+
p
V
p
p
V
V
γ
γ
Po scałkowaniu:
Mamy wi c
ln(pV
γγγγ
) = const.
czyli
pV
γγγγ
= const.
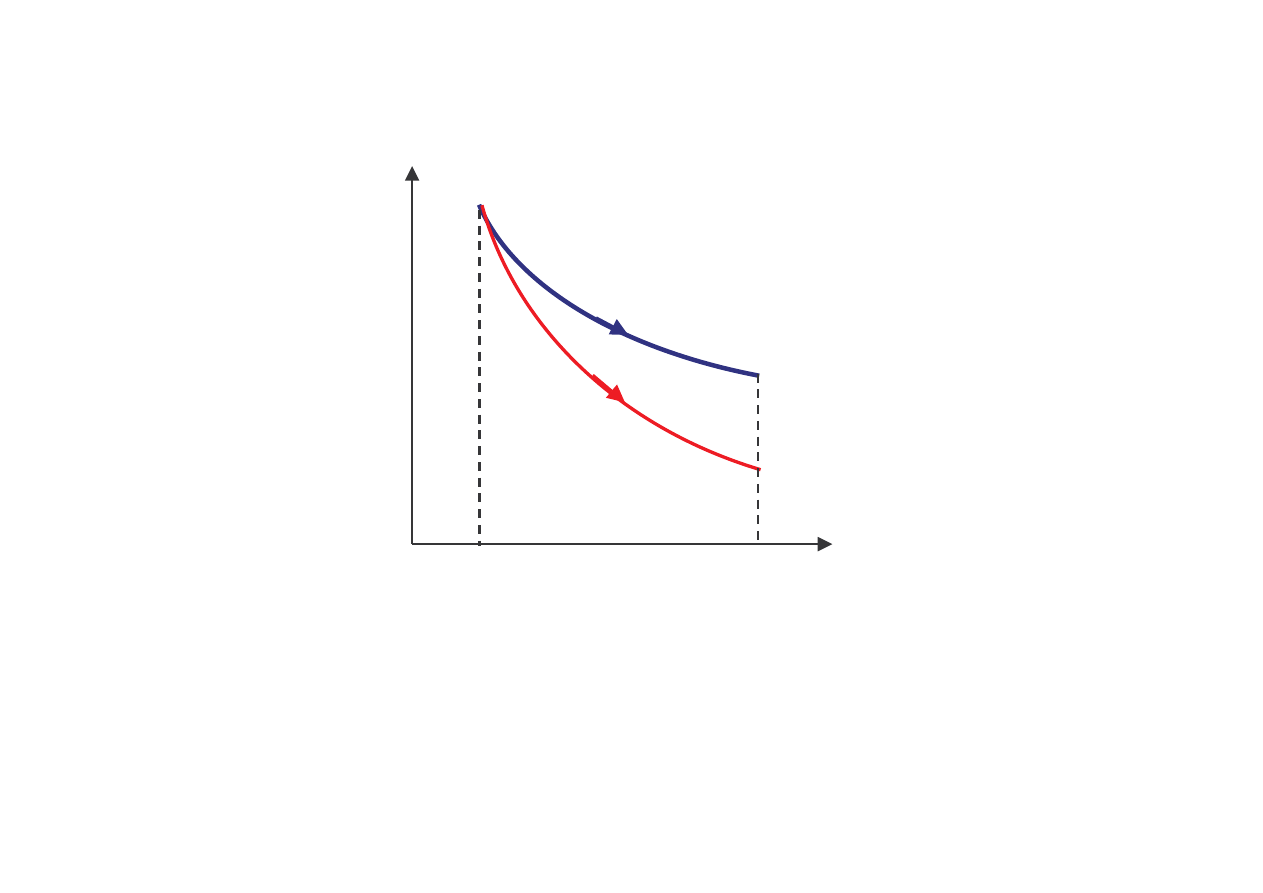
p
V
V
1
V
2
pV= const.
izoterma
pV
γγγγ
= const.
adiabata
Porównanie rozpr ania izotermicznego
i adiabatycznego
Wyszukiwarka
Podobne podstrony:
07 termodynamikaid 6984 Nieznany (2)
07 Termodynamika i termochemia
Termodynamika egzamin 07 2 2015 Nemś
EŚT 07 Użytkowanie środków transportu
07 Windows
07 MOTYWACJAid 6731 ppt
Termodynamika 2
TERMODYNAMIKA
Planowanie strategiczne i operac Konferencja AWF 18 X 07
Wyklad 2 TM 07 03 09
ankieta 07 08
Szkol Okres Pracodawcy 07 Koszty wypadków
Wyk 07 Osprz t Koparki
podstawy termodynamiki(1)
więcej podobnych podstron