TERMODYNAMIKA
I TERMOCHEMIA
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Termodynamika - opisuje zmiany energii towarzyszące przemianom
chemicznym; dział fizyki zajmujący się zjawiskami
cieplnymi.
Termochemia - dział chemii zajmujący się efektami cieplnymi, które
towarzyszą reakcjom chemicznym i innym procesom
fizykochemicznym.
E = E
k
+ E
p
+ U
przedmiot badań
obiekt zainteresowań
mechaniki termodynamiki
energia translacyjna i rotacji
energia oscylacyjna i elektronowa
energia oddziaływań międzymolekularnych
energia jądrowa
nieznany rodzaj energii ???
E -
całkowita energia układu
E
k
-
energia kinetyczna
E
p
-
energia potencjalna
U -
energia wewnętrzna układu
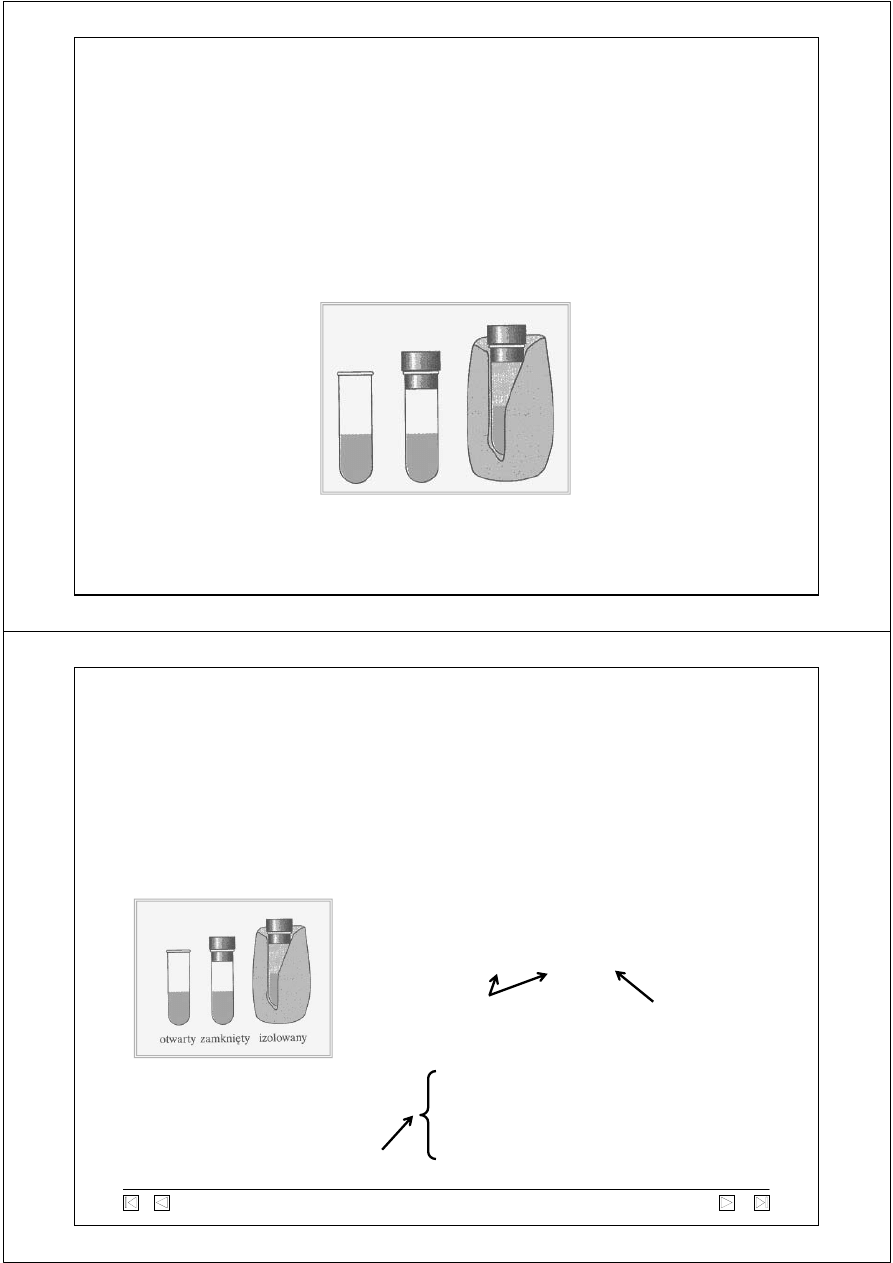
Układ
Układ - „rozpatrywana część świata fizycznego”, zespół obiektów,
które mogą przekazywać sobie nawzajem energię.
Otoczenie - ?
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Funkcje termodynamiczne - parametry układu posiadające określoną
wartość* dla danego stanu układu, niezależnie od drogi na jakiej dany
stan układu został osiągnięty.
* energia wewnętrzna układu (U); entalpia (H); entropia (S); energia
swobodna
≡ potencjał termodynamiczny ≡ potencjał Gibbsa (G)
Przemiana (proces):
izotermiczna,
izobaryczna,
izochoryczna
T = const
p = const
V = const
adiabatyczna - proces podczas, którego nie zachodzi
wymiana ciepła z otoczeniem
(układ izolowany).
Np. 1 mol gazu (N
2
)
(V = const)
stan I: T = 273 K
stan II: T = 546 K
p = 1 atm.
p = 2 atm.
Funkcje termod. (U, H, S, G) zmieniają się przy przejściu od
stanu I do II o wartość, która nie zależy od tego czy gaz będzie:
1) ogrzany a potem sprężony
lub
2) sprężony a potem ogrzany
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
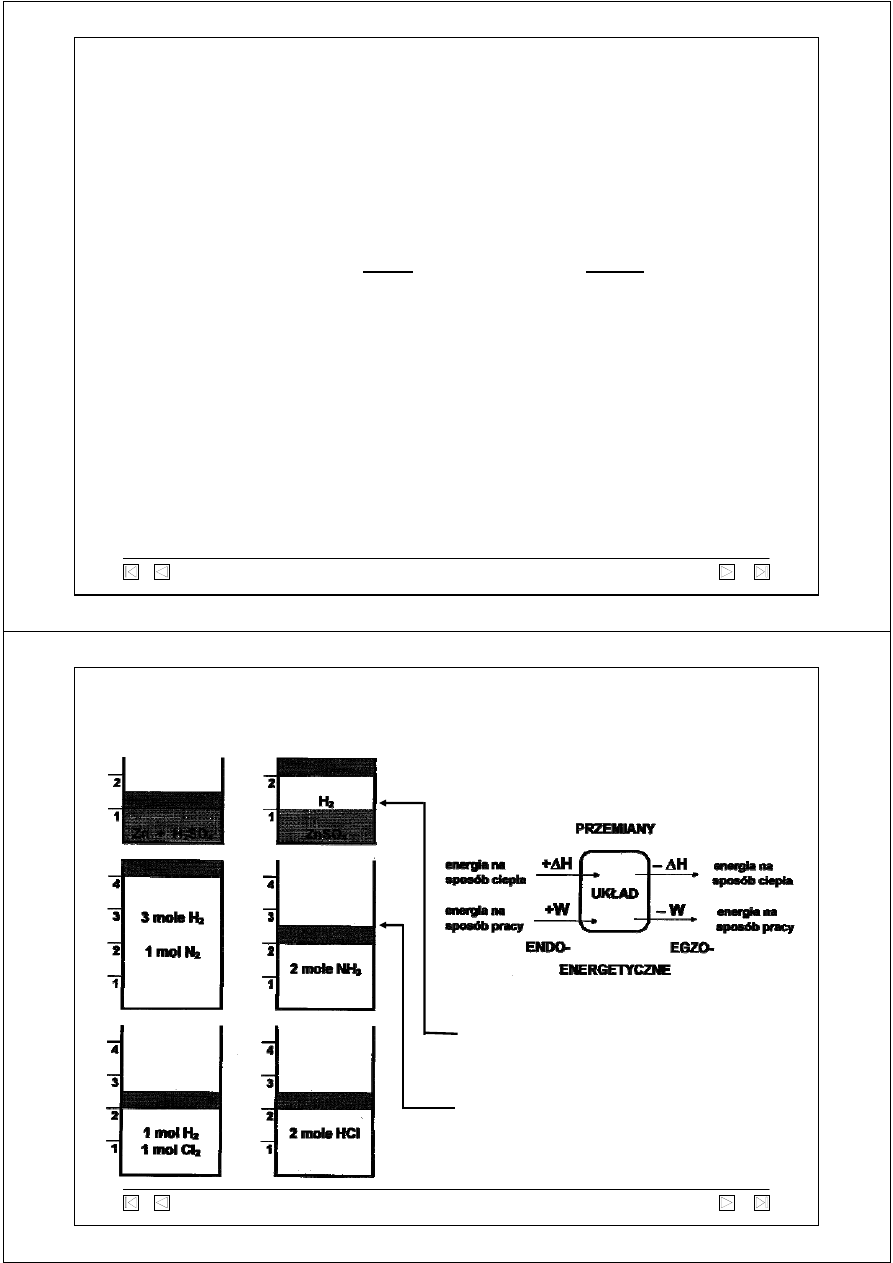
Każdej reakcji chemicznej towarzyszy przepływ energii na sposób ciepła między
układem a otoczeniem.
Podczas niektórych reakcji układ wymienia
energię z otoczeniem na sposób pracy.
układ wykonał pracę na otoczeniu
– W
otoczenie wykonało pracę na układzie
+ W

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
W = F · s
(siła x droga)
W = q ·
ΔE
(ładunek x zmiana potencjału)
W = p ·
ΔV
(ciśnienie x zmiana objętości)
Praca - sposób przekazywania energii miedzy układem i otoczeniem
(nie jest formą energii !)
Ciepło - wielkość fizyczna charakteryzująca sposób przekazywania
energii między układem i otoczeniem za pośrednictwem
nieuporządkowanych zderzeń między cząsteczkami układu
i otoczenia oraz przez promieniowanie.
Energia wewnętrzna układu (U) - całkowity zasób energii układu,
łącznie z energią ruchów translacyjnych, oscylacyjnych i rotacyj-
nych cząsteczek, stanów elektronowych, energią jąder atomowych
i innymi postaciami energii, jednak bez energii kinetycznej ruchu
makroskopowego (E
k
) i energii potencjalnej położenia układu jako
całości (E
p
).
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
PIERWSZA ZASADA TERMODYNAMIKI
(H. Helmholtz, 1847 r.)
ΔU = Q + W
oznaczenia funkcji termodynamicznych dla warunków standardowych:
ΔG
o
ΔH
o
ΔS
o
(zasada ta wyklucza możliwość wykonania pracy bez nakładu energii,
a więc zbudowanie „perpetuum mobile” pierwszego rodzaju)
zmiana energii wewnętrznej układu
ΔU równa się sumie
ciepła Q i pracy W wymienionej przez układ z otoczeniem
Warunki standardowe w termodynamice:
T = 298,15 K (25
o
C)
p = 101325 Pa = 1013,25 hPa = 1 atm. = 760 mmHg
[Uwaga ! Nie mylić z warunkami normalnymi: T = 273,15 K (0
o
C), p = 101325 Pa]
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
ΔU = ΔH + p · ΔV
Ciepło reakcji pod stałym ciśnieniem jest nazywane zmianą
entalpii reakcji (
Δ
H) lub entalpią reakcji (H), więc:
Ciepło reakcji (Q) - to ciepło wymienione między
układem reagentów a otoczeniem
CIEPŁO REAKCJI CHEMICZNEJ
reakcje egzotermiczne - reakcje chemiczne przebiegające
Q > 0
Δ
H < 0
z wydzieleniem ciepła z układu
Np. 2 H
2(g)
+ O
2(g)
→ 2 H
2
O
(g)
+ Q Q = 485 kJ
ΔH = – 485 kJ *
reakcje endotermiczne - reakcje chemiczne przebiegające
Q < 0
Δ
H > 0
z pochłonięciem ciepła z otoczenia
Np. N
2(g)
+ O
2(g)
→ 2 NO
(g)
– Q Q = – 180 kJ
ΔH = 180 kJ *
* dla entalpii znakowanie musi być zgodne z konwencją termodynamiczną
(I zas. termodynamiki)
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
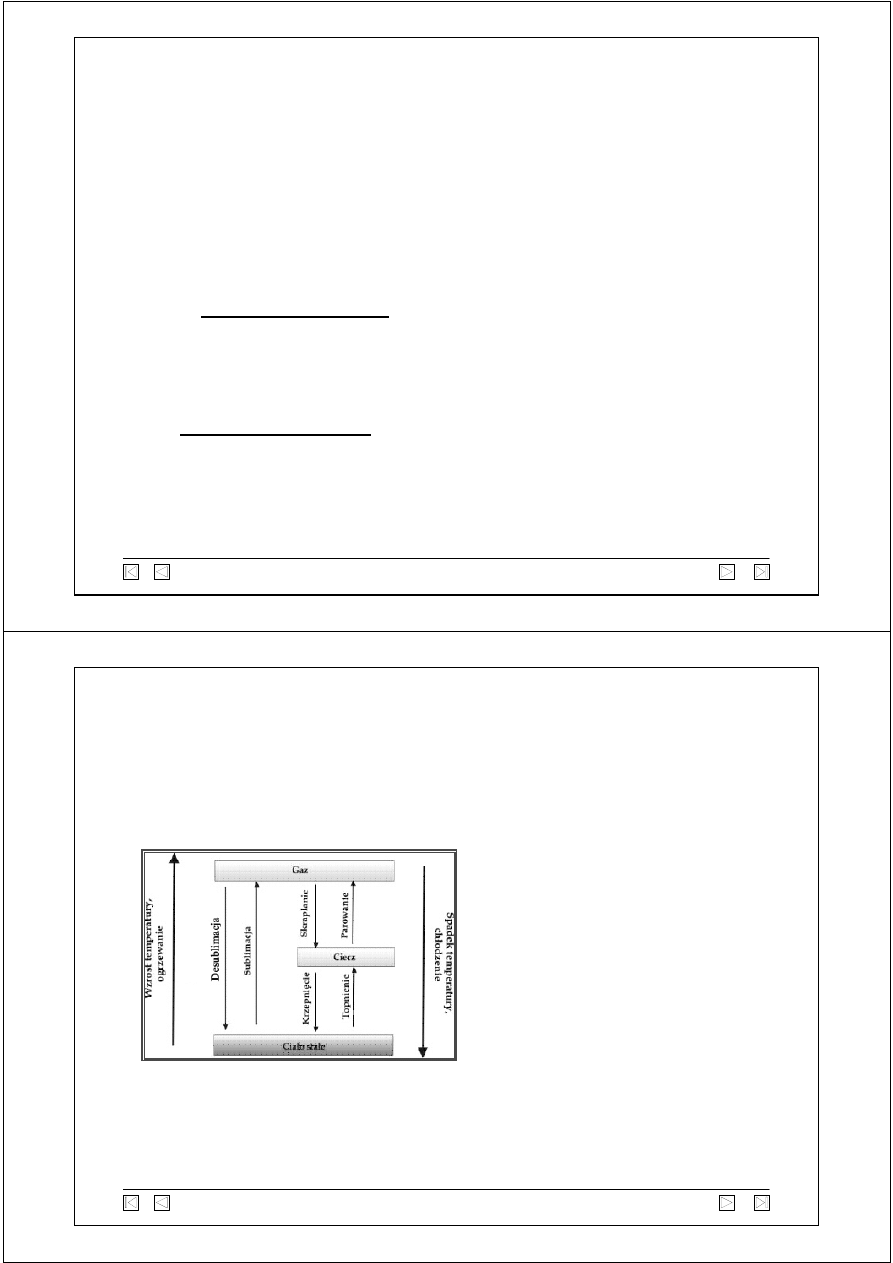
Do podstawowych przemian
fazowych należą:
- topnienie
- parowanie
- krzepnięcie
- skraplanie
- sublimacja
- desublimacja
Molowe ciepło przemiany
ilość energii potrzebna do przeprowadzenia 1 mola substancji z jednej fazy w drugą
Sublimacja - przemiana fazowa polegająca na bezpośrednim przejściu
substancji z fazy stałej do gazowej (bez stopienia).
Temperatura sublimacji musi być niższa od temperatury topnienia.
Substancjami, które łatwo sublimują, są np.:
„suchy lód” (stały CO
2
), „sublimat” (HgCl
2
), jod, kwas benzoesowy.
Przemiana fazowa
to przemiana termodynamiczna polegająca na zanikaniu (stopniowym lub nagłym)
jednej fazy i pojawieniu się na jej miejsce innej.
Przemianami fazowymi są też:
rozpuszczanie i krystalizacja

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Prawo Lavoisiera-Laplace’a (1780 r.)
ΔH = ΔH
1
+
ΔH
2
Np. 2 H
2(g)
+ O
2(g)
→ 2 H
2
O
(g)
+ Q
Q = 485 kJ
ΔH = – 485 kJ
2 H
2
O
(g)
→ 2 H
2(g)
+ O
2(g)
– Q
Q = – 485 kJ
ΔH = 485 kJ
/efekt cieplny reakcji przebiegającej w jednym kierunku jest równy
efektowi cieplnemu reakcji odwrotnej z przeciwnym znakiem/
Np. C + ½ O
2
→ CO
ΔH = – 110,5 kJ
CO + ½ O
2
→ CO
2
ΔH = – 283 kJ
C + O
2
→ CO
2
ΔH = ?
Prawo Hessa (1840 r.)
/efekt cieplny reakcji (czyli Q lub
ΔH) w warunkach izotermiczno-
-izochorycznych lub izotermiczno-izobarycznych nie zależy od
drogi po której jest realizowana dana przemiana, a jedynie
od jej stanu początkowego i końcowego/
ΔH
r. prostej
= –
ΔH
r. odwrotnej
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
Procesy odwracalne i nieodwracalne
proces odwracalny - proces zachodzący nieskończenie powoli, przez wiele
następujących po sobie, blisko siebie położonych stanów równowagi
Entropia - funkcja stanu określająca kierunek przebiegu procesów
samorzutnych w układzie izolowanym;
(entropia jest miarą stopnia nieuporządkowania układu,
miarą swobody cząsteczek w układzie,
Δ
S = S
k
- S
p
)
/do procesów nieodwracalnych należą zjawiska transportu w gazach
i cieczach, np. dyfuzja; przepływ lepki; przewodzenie ciepła;
endotermiczne rozprężanie gazów, np. powietrza; endotermiczne
rozpuszczanie niektórych substancji stałych, np. KNO
3
/
proces nieodwracalny - proces przebiegający samorzutnie; procesy
rzeczywiste przebiegają w sposób nieodwracalny
dla procesów odwracalnych:
ΔS Q
T
>
dla procesów nieodwracalnych:
ΔS Q
T
=
Q - ciepło wymieniane z otoczeniem
T - temperatura

dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
DRUGA ZASADA TERMODYNAMIKI
(zasada ta wyklucza możliwość zamiany ciepła na pracę bez istnienia
różnicy temperatur, tzn. stwierdza niemożliwość zbudowania
„perpetuum mobile” drugiego rodzaju)
w układzie mogą zachodzić samorzutnie tylko
takie przemiany, które spełniają warunek:
„W przyrodzie przebiegają samorzutnie te procesy,
którym towarzyszy wzrost entropii”
T
Q
ΔS
≥
TRZECIA ZASADA
TERMODYNAMIKI
w temperaturze zera bezwzględnego (0 K)
entropia wszystkich doskonałych
substancji krystalicznych
jest równa zeru
dr Henryk Myszka - Uniwersytet Gdański - Wydział Chemii
POTENCJAŁ TERMODYNAMICZNY
/funkcja obejmującą w sposób jednoznaczny i ogólny każdy proces,
uwzględnia stronę energetyczną i entropową/
(energia Gibbsa, potencjał Gibbsa, energia swobodna)
Układ stara się zaspokoić dwie przeciwstawne tendencje:
¾ minimum energii, tj. maksimum stabilności
¾ maksimum entropii, tj. maksimum swobody
ΔG = ΔH – T
.
ΔS
ΔG
o
=
ΔH
o
– T
.
ΔS
o
• Dlaczego gaz nie kurczy się samorzutnie ?
• Dlaczego woda nie zamarza powyżej temp. top. ?
• Dlaczego lód topi się a nie ogrzewa ?
• Dlaczego ciepło nie przepływa od układu o niższej
temperaturze do układu o wyższej ?
Wyszukiwarka
Podobne podstrony:
Termodynamika Termochemia
07 termodynamikaid 6984 Nieznany (2)
07 Termodynamika1
Termodynamika Termochemia
TERMODYNAMIKA I TERMOCHEMIA
I zasada termodynamiki i termochemia
TERMODYNAMIKA CHEMICZNA I TERMOCHEMIA
Termodynamika egzamin 07 2 2015 Nemś
termochemia i termodynamika
TERMODYNAMIKA CHEMICZNA I TERMOCHEMIA 3 12 (6 12)
EŚT 07 Użytkowanie środków transportu
więcej podobnych podstron