
AKADEMIA MEDYCZNA W GDAŃSKU
CHEMICZNE
METODY ANALIZY ILOŚCIOWEJ
ŚRODKÓW LECZNICZYCH
pod redakcją Danuty Rajzer
GDAŃSK 2008

Autorzy:
Danuta Rajzer, Lucyna Konieczna, Alina Plenis,
Ewelina Dziurkowska
Recenzent:
Prof. dr hab. Marek Wesołowski
Wydano za zgodą
Senackiej Komisji Wydawnictw Akademii Medycznej w Gdańsku
© Copyright by Medical University of Gdańsk
ISBN 978-83-602534-1-0
Wydawca: Akademia Medyczna w Gdańsku
Druk: Dział Wydawnictw AMG
ul. Marii Skłodowskiej-Curie 3a,
Zlecenie KW/195/2008

SPIS TREŚCI
WSTĘP .................................................................................................................................. 5
1.
ALKACYMETRIA.......................................................................................................... 6
1.1.
Acydymetria............................................................................................................ 6
1.2.
Alkalimetria ............................................................................................................ 7
1.2.1.
Oznaczanie soli amonowych metodą formalinową.................................... 15
2.
ARGENTOMETRIA ..................................................................................................... 17
2.1.
Miareczkowanie bezpośrednie – metoda Mohra................................................... 17
2.2.
Miareczkowanie pośrednie – metoda Volharda .................................................... 18
3.
AZOTYNOMETRIA ..................................................................................................... 23
4.
BROMIANOMETRIA................................................................................................... 25
5.
CEROMETRIA.............................................................................................................. 30
6.
JODOMETRIA .............................................................................................................. 31
6.1.
Oznaczanie jodków w obecności innych halogenków .......................................... 33
7.
KOMPLEKSOMETRIA ................................................................................................ 34
7.1.
Miareczkowanie bezpośrednie .............................................................................. 34
7.2.
Miareczkowanie pośrednie.................................................................................... 38
8.
MANGANOMETRIA.................................................................................................... 42
9.
MIARECZKOWANIE W ŚRODOWISKU NIEWODNYM ........................................ 44
9.1.
Acydymetria.......................................................................................................... 44
9.1.1.
Oznaczanie amin i zasad heterocyklicznych.............................................. 45
9.1.2.
Oznaczanie soli zasad organicznych.......................................................... 52
9.1.2.1.
Oznaczanie soli zasad organicznych z niektórymi kwasami
nieorganicznymi i organicznymi ................................................ 52
9.1.2.2.
Oznaczanie soli zasad organicznych z kwasami
chlorowcowodorowymi metodą bezpośrednią ........................... 56
9.1.2.3.
Oznaczanie soli zasad organicznych z kwasami
chlorowcowodorowymi metodą pośrednią
(Pifera - Wollish’a) .................................................................... 59
9.1.2.4.
Oznaczanie soli silnych zasad nieorganicznych ze słabymi
kwasami organicznymi............................................................... 78
9.2.
Alkalimetria .......................................................................................................... 80
SKOROWIDZ ..................................................................................................................... 83


5
WSTĘP
Ćwiczenia laboratoryjne z chemii leków mają na celu zapoznanie studentów farmacji z
teoretycznymi i praktycznymi zagadnieniami związanymi z analizą substancji leczniczych.
Poniższe opracowanie umożliwi studentom uzyskanie wiedzy koniecznej do wyboru
właściwej metody ilościowego oznaczania substancji leczniczych oraz prawidłowego jej
przeprowadzenia.
Skrypt obejmuje zagadnienia dotyczące analizy ilościowej substancji leczniczej i jest
dopełnieniem wcześniej opracowanego przez pracowników Katedry i Zakładu Chemii Far-
maceutycznej AMG skryptu pt „Chemiczne metody identyfikacji środków leczniczych”.
Poprzednie opracowanie obejmowało tematykę jakościowej oceny oraz zasady badania czy-
stości wybranych substancji leczniczych.
Niniejsze opracowanie stanowi uzupełnienie i zawiera komentarze do monografii znaj-
dujących się w FP VI.
Skrypt podzielono na rozdziały zgodnie z klasycznymi metodami ilościowego oznacza-
nia związków. Każda z metod została krótko scharakteryzowana. Zasadniczym celem tego
opracowania było przedstawienie schematów reakcji oznaczania szeregu substancji leczni-
czych zarówno farmakopealnych, jak i znajdujących się w USL, które sprawiają trudności
studentom w poprawnym ich przedstawieniu.
Mamy nadzieję, że tak opracowany skrypt przyczyni się do lepszego przygotowania stu-
dentów III roku farmacji do ćwiczeń z chemii leków, zarówno teoretycznego jak i praktycz-
nego.

6
1. ALKACYMETRIA
Alkacymetria jest działem analizy miareczkowej opartym na reakcji przenoszenia proto-
nu z kwasu do zasady z utworzeniem słabo zdysocjowanej cząsteczki wody.
W zależności od rodzaju stosowanego titranta, alkacymetrię dzieli się na acydymetrię
(miareczkowanie mianowanym roztworem kwasu, np.: HCl, H
2
SO
4
) i alkalimetrię (miarecz-
kowanie mianowanym roztworem zasady, np.: NaOH, KOH).
Wybór wskaźnika do identyfikacji punktu końcowego zobojętnienia jest uzależniony od
charakteru chemicznego powstającej soli. Dla soli mocnych kwasów i mocnych zasad roz-
twór miareczkowany ma odczyn obojętny, w przypadku soli hydrolizujących kwaśny lub
zasadowy.
1.1. Acydymetria
WĘGLAN LITU
Zawartość
Odważyć dokładnie ok. 1 g substancji, rozpuścić w 50 ml 1 mol/l roztworu kwasu sol-
nego, doprowadzić do wrzenia, dodać 3 – 4 krople roztworu fenoloftaleiny, ochłodzić i od-
miareczkować nadmiar kwasu 1 mol/l roztworem wodorotlenku sodu do zmiany zabarwienia
na różowe.
Li
2
CO
3
Cl
H
2
LiCl
2
O
H
2
CO
2
1 ml 1 mol/l roztworu kwasu solnego odpowiada 36,95 mg węglanu litu.
WODOROWĘGLAN SODU
Zawartość
Odważyć dokładnie ok. 2 g substancji, rozpuścić w 50 ml wody pozbawionej ditlenku
węgla, dodać 3 – 4 krople roztworu oranżu metylowego i miareczkować 1 mol/l roztworem
kwasu solnego do zmiany zabarwienia z żółtego na pomarańczowe.
NaHCO
3
Cl
H
NaCl
O
H
2
CO
2
1 ml 1 mol/l roztworu kwasu solnego odpowiada 84,01 mg wodorowęglanu sodu.
1.
Alkacymetria 7
1.2. Alkalimetria
KWAS ACETYLOSALICYLOWY
Zawartość
Odważyć dokładnie ok. 1,5 g substancji, rozpuścić w 50 ml 0,5 mol/l roztworu wodoro-
tlenku sodu, ogrzewać przez 15 min na łaźni wodnej pod chłodnicą zwrotną, ochłodzić, do-
dać 3 – 4 krople roztworu fenoloftaleiny i nadmiar wodorotlenku sodu odmiareczkować 0,25
mol/l roztworem kwasu siarkowego(VI) do odbarwienia roztworu.
O
OH
O
O
CH
3
NaOH
O
O
O
O
CH
3
Na
O
H
2
O
O
O
O
CH
3
Na
NaOH
O
O
O
Na
Na
CH
3
COONa
2NaOH
H
2
SO
4
Na
2
SO
4
2H
2
O
1 ml 0,25 mol/l roztworu kwasu siarkowego(VI) odpowiada 45,05 mg kwasu acetylosa-
licylowego.
KWAS MLEKOWY
Zawartość
Odważyć dokładnie ok. 1 g substancji do kolby z doszlifowanym korkiem, dodać 10 ml
wody i 20 ml 1 mol/l roztworu wodorotlenku sodu. Kolbę zamknąć i pozostawić na 30 min
w ciemnym miejscu. Dodać 3 – 4 krople roztworu fenoloftaleiny i miareczkować 1 mol/l
roztworem kwasu solnego do odbarwienia się roztworu.
C
H
3
OH
O
OH
NaOH
C
H
3
O
O
OH
Na
O
H
2
Cl
H
NaOH
NaCl
O
H
2
1 ml 1 mol/l roztworu wodorotlenku sodu odpowiada 90,08 mg kwasu mlekowego.
8
Chemiczne metody analizy ilościowej środków leczniczych
SALICYLAN METYLU
Zawartość
Odważyć dokładnie ok. 1 g substancji, dodać 25 ml 0,5 mol/l etanolowego roztworu wo-
dorotlenku potasu, 5 ml wody, ogrzewać 1 h na łaźni wodnej pod chłodnicą zwrotną, ochło-
dzić, dodać 30 ml wody, 3 – 4 krople roztworu fenoloftaleiny i nadmiar wodorotlenku potasu
odmiareczkować 0,5 mol/l roztworem kwasu solnego do odbarwienia roztworu.
O
O
OH
CH
3
KOH
O
O
OH
K
CH
3
OH
KOH
HCl
KCl
H
2
O
1 ml 0,5 mol/l etanolowego roztworu wodorotlenku potasu odpowiada 76,07 mg salicy-
lanu metylu.
Oznaczanie substancji leczniczych w zobojętnionym rozpuszczalniku
Przygotowanie rozpuszczalnika do analizy
Do 15 ml 96° etanolu, metanolu, mannitolu lub gliceryny dodać 3 – 4 krople roztwo-
ru fenoloftaleiny i miareczkować 0,1 mol/l roztworem wodorotlenku sodu do różowego
zabarwienia. Tak przygotowany odczynnik użyć do rozpuszczenia substancji badanej.
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 15 ml 96° etanolu, zobojętnionego
według przepisu zamieszczonego powyżej. Miareczkować 0,1 mol/l roztworem wodorotlen-
ku sodu do uzyskania różowego zabarwienia.
Zgodnie z powyższą procedurą oznacza się następujące związki:
ACETAZOLAMID
S
N
N
S
O
O
N
H
2
O
NH
CH
3
NaOH
S
N
N
S
O
O
-
N
H
O
NH
CH
3
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 22,22 mg acetazolamidu.
1.
Alkacymetria 9
BARBITAL
NH
N
H
C
H
3
C
H
3
O
O
O
NaOH
N
N
H
C
H
3
C
H
3
O
O
O
-
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 18,42 mg barbitalu.
CHLOROPROPAMID
Cl
NH
S
NH
CH
3
O
O
O
NaOH
Cl
N
S
NH
CH
3
O
-
O
O
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 27,67 mg chloropropamidu.
FENOBARBITAL
NH
N
H
C
H
3
O
O
O
NaOH
N
N
H
C
H
3
O
O
O
-
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 23,22 mg fenobarbitalu.
FUROSEMID
Cl
S
O
O
N
H
2
O
OH
NH
O
NaOH
Cl
S
O
O
N
H
2
O
O
-
NH
O
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 33,07 mg furosemidu.
10
Chemiczne metody analizy ilościowej środków leczniczych
GLIBENKLAMID
Cl
N
O
NH
S
N
O
CH
3
O
O
O
H
H
NaOH
Cl
N
O
N
S
N
O
CH
3
O
-
O
O
H
H
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 49,40 mg glibenklamidu.
HYDROCHLOROTIAZYD
NH
S
N
H
S
O
O
N
H
2
Cl
O
O
NaOH
N
S
N
H
S
O
O
-
N
H
Cl
O
-
O
Na
+
O
H
2
2
2
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 14,88 mg hydrochlorotiazydu.
IBUPROFEN
CH
3
C
H
3
O
OH
CH
3
NaOH
CH
3
C
H
3
O
O
-
CH
3
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 20,63 mg ibuprofenu.
KETOPROFEN
O
CH
3
O
OH
NaOH
O
CH
3
O
O
-
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 25,43 mg ketoprofenu.
1.
Alkacymetria
11
KWAS ACETYLOSALICYLOWY
O
OH
O
O
CH
3
NaOH
O
O
O
O
CH
3
Na
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 18,02 mg kwasu acetylosalicy-
lowego.
KWAS BENZOESOWY
O
OH
NaOH
O
O
-
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 12,21 mg kwasu benzoesowego.
KWAS MEFENAMOWY
O
OH
NH
CH
3
CH
3
NaOH
O
O
-
NH
CH
3
CH
3
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 24,13 mg kwasu mefenamowe-
go.
KWAS SALICYLOWY
O
OH
OH
NaOH
O
O
-
OH
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 13,81 mg kwasu salicylowego.
12
Chemiczne metody analizy ilościowej środków leczniczych
TOLBUTAMID
NH
S
NH
CH
3
O
O
C
H
3
O
NaOH
O
H
2
N
S
NH
CH
3
O
-
O
C
H
3
O
Na
+
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 27,04 mg tolbutamidu.
KLOMETIAZOLU EDYSYLAN
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 50 ml wody, dodać 3 – 4 krople
roztworu fenoloftaleiny i miareczkować 0,1 mol/l roztworem wodorotlenku sodu do różowe-
go zabarwienia.
S
N
+
Cl
CH
3
H
S
O
O
O
-
S
O
O
O
-
2
NaOH
2
2
S
N
Cl
CH
3
O
H
2
S
O
O
O
S
O
O
O
Na
Na
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 25,67 mg edysylanu klometiazo-
lu.
DIWODOROFOSFORAN SODU
Zawartość
Odważyć dokładnie ok. 1 g substancji, rozpuścić w 40 ml wody, dodać 3 – 4 krople roz-
tworu fenoloftaleiny i miareczkować 0,5 mol/l roztworem wodorotlenku sodu do różowego
zabarwienia.
NaH
2
PO
4
2NaOH
2H
2
O
Na
3
PO
4
1 ml 0,5 mol/l roztworu wodorotlenku sodu odpowiada 59,99 mg diwodorofosforanu so-
du.
KWAS CYTRYNOWY
Zawartość
Odważyć dokładnie ok. 1 g substancji, rozpuścić w 40 ml wody, dodać 3 – 4 krople roz-
tworu fenoloftaleiny i miareczkować 0,5 mol/l roztworem wodorotlenku sodu do różowego
zabarwienia.
1.
Alkacymetria
13
O
O
H
O
OH
O
O
H
OH
3 NaOH
O
O
-
O
O
-
O
O
-
OH
Na
+
3
O
H
2
3
1 ml 0,5 mol/l roztworu wodorotlenku sodu odpowiada 32,02 mg kwasu cytrynowego.
KWAS MRÓWKOWY
Zawartość
Odważyć dokładnie ok. 1 g substancji, dodać 20 ml wody, 3 – 4 krople roztworu fenolo-
ftaleiny i miareczkować 1 mol/l roztworem wodorotlenku sodu do różowego zabarwienia.
O
OH
H
NaOH
O
O
-
H
Na
+
O
H
2
1 ml 1 mol/l roztworu wodorotlenku sodu odpowiada 46,03 mg kwasu mrówkowego.
KWAS BOROWY
Zawartość
Odważyć dokładnie ok. 1 g substancji, dodać 15 g mannitolu, 100 ml wody, ogrzać do
rozpuszczenia, ochłodzić, dodać 3 – 4 krople roztworu fenoloftaleiny i miareczkować 1,0
mol/l roztworem wodorotlenku sodu do różowego zabarwienia.
OH
OH
O
H
H
H
OH
H
OH
H
OH
B
OH
O
H
O
H
B
OH
OH
OH
O
H
H
H
OH
H
O
H
O
2
O
H
2
B
OH
OH
OH
O
H
H
H
OH
H
O
H
O
NaOH
B
O
OH
OH
O
H
H
H
OH
H
O
H
O
Na
O
H
2
1 ml 1,0 mol/l roztworu wodorotlenku sodu odpowiada 61,83 mg kwasu borowego.
14
Chemiczne metody analizy ilościowej środków leczniczych
TETRABORAN SODU
Zawartość
Rozpuścić 2 g mannitolu w 10 ml wody, dodać 3 – 4 krople roztworu fenoloftaleiny i
zobojętnić 0,1 mol/l roztworem wodorotlenku sodu. W tak przygotowanym roztworze man-
nitolu rozpuścić 0,3 g dokładnie odważonej substancji, ogrzać, ochłodzić i miareczkować 0,1
mol/l roztworem wodorotlenku sodu do różowego zabarwienia.
(zobojętnienie rozpuszczalnika patrz str. 9)
Na
2
B
4
O
7
3H
2
O
2 NaBO
2
2 H
3
BO
3
NaOH
NaBO
2
O
H
2
H
3
BO
3
2
Dalszy ciąg reakcji – patrz monografia kwas borny.
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 19,07 mg tetraboranu sodu.
FENYLOBUTAZON
Zawartość
Odważyć dokładnie ok. 0,5 g substancji, rozpuścić w 15 ml acetonu, dodać 3 – 4 krople
roztworu błękitu bromotymolowego i miareczkować 0,1 mol/l roztworem wodorotlenku
sodu do niebieskiego zabarwienia utrzymującego się 15 s.
N
N
O
O
CH
3
NaOH
N
N
O
-
O
CH
3
Na
+
O
H
2
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 30,84 mg fenylobutazonu.
TEOBROMINA
Zawartość
Odważyć dokładnie ok. 0,15 g substancji, rozpuścić w 125 ml wrzącej wody, ochłodzić
do temp. 50 - 60˚C, dodać 25 ml 0,1 mol/l roztworu azotanu(V) srebra, zmieszać, dodać 3 –
4 krople roztworu fenoloftaleiny i miareczkować 0,1 mol/l roztworem wodorotlenku sodu do
różowego zabarwienia.
N
N
H
N
N
O
O
CH
3
CH
3
AgNO
3
HNO
3
N
N
N
N
O
O
CH
3
CH
3
Ag
1.
Alkacymetria
15
HNO
3
NaOH
O
H
2
NaNO
3
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 18,02 mg teobrominy.
TEOFILINA
Zawartość
Odważyć dokładnie ok. 0,15 g substancji, rozpuścić w 100 ml wody, dodać 25 ml 0,1
mol/l roztworu azotanu(V) srebra i zmieszać. Dodać 3 – 4 krople roztworu błękitu bromoty-
molowego i miareczkować 0,1 mol/l roztworem wodorotlenku sodu do niebieskiego zabar-
wienia.
N
N
N
N
O
O
CH
3
C
H
3
Ag
AgNO
3
N
N
N
H
N
O
O
CH
3
C
H
3
HNO
3
HNO
3
NaOH
O
H
2
NaNO
3
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 18,02 mg teofiliny.
1.2.1. Oznaczanie soli amonowych metodą formalinową
Oznaczanie jonów amonowych opiera się na reakcji z aldehydem mrówkowym (forma-
liną), w wyniku której powstaje heksahydrometylenotetraamina (urotropina) i wydziela się
równoważna ilość kwasu, który odmiareczkowuje się mianowanym roztworem wodorotlen-
ku sodu.
Reakcja przebiega według schematu:
4NH
4
X
6HCOH
(CH
2
)
6
N
4
4HX
6H
2
O
HX
NaOH
NaX
O
H
2
Zawartość
Zobojętnić 5 ml formaliny wobec 3 – 4 kropli roztworu fenoloftaleiny miareczkując 0,1 mol/l
roztworem wodorotlenku sodu do uzyskania różowego zabarwienia. Do tak zobojętnionej forma-
liny dodać 5 ml (odmierzonych pipetą) oznaczanej soli amonowej i miareczkować 0,1 mol/l roz-
tworem wodorotlenku sodu do ponownego uzyskania różowego zabarwienia.
Zgodnie z powyższą procedurą oznacza się następujące związki:

16
Chemiczne metody analizy ilościowej środków leczniczych
BROMEK AMONU
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 9,79 mg bromku amonu.
CHLOREK AMONU
1 ml 0,1 mol/l roztworu wodorotlenku sodu odpowiada 5,35 mg chlorku amonu.
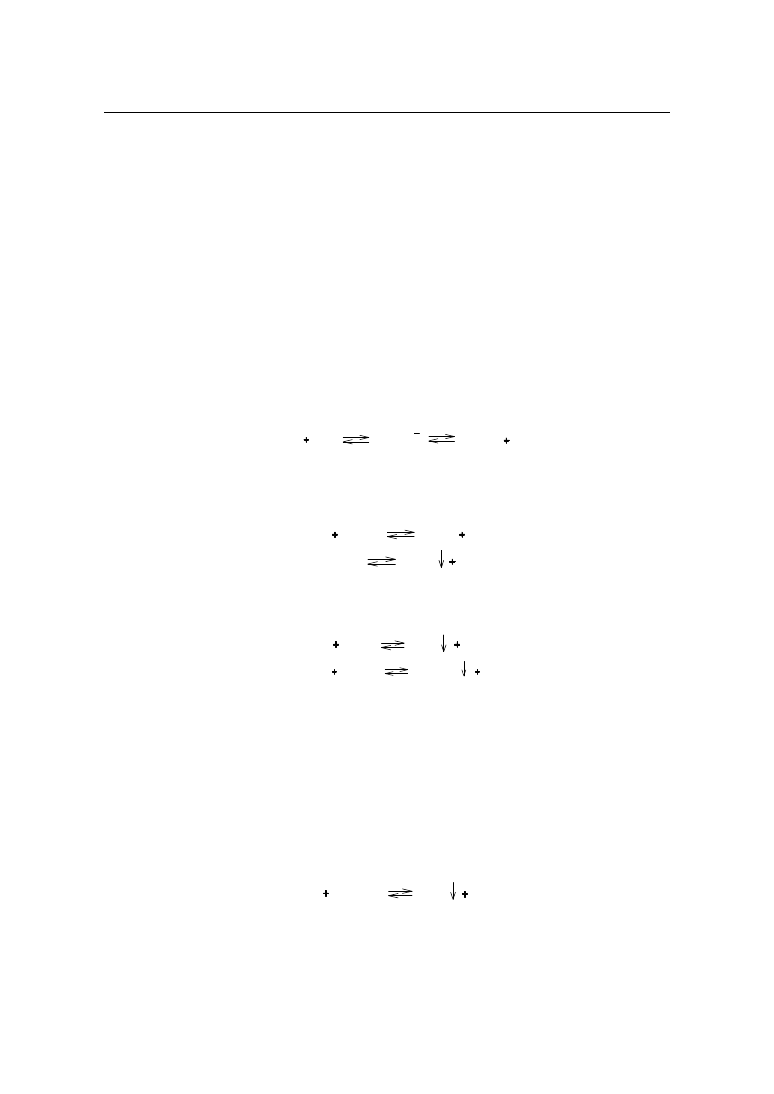
17
2. ARGENTOMETRIA
W analizie farmaceutycznej znalazła zastosowanie miareczkowa analiza wytrąceniowa,
głównie argentometria. Oznaczanie oparte jest na reakcjach tworzenia się trudno rozpusz-
czalnych soli srebra. Metodą tą oznacza się sole silnych zasad nieorganicznych (chlorki,
bromki, jodki) i słabych zasad organicznych z kwasami chlorowcowymi.
2.1. Miareczkowanie bezpośrednie – metoda Mohra
Argentometrycznie metodą Mohra oznacza się jony chlorkowe i bromkowe w solach
nieorganicznych. Oznaczanie prowadzi się w środowisku obojętnym wobec chromianu(VI)
potasu jako wskaźnika. W środowisku kwaśnym jony chromianowe CrO
4
2-
przechodzą w
dichromianowe Cr
2
O
7
2-
, co powoduje zmniejszenie stężenia wskaźnika.
2CrO
4
2-
H
+
2
2HCrO
4
Cr
2
O
7
2-
O
H
2
W silnie kwaśnym środowisku osad chromianu(VI) srebra nie wytrąca się (patrz IV gru-
pa anionów).
W środowisku zasadowym zachodzi reakcja:
AgNO
3
NaOH
AgOH
NaNO
3
AgOH
Ag
2
O
O
H
2
2
Tak więc zarówno odczyn kwaśny, jak i zasadowy roztworu prowadzi do błędnych wy-
ników oznaczeń.
Reakcja oznaczania przebiega według schematu:
MeCl
AgNO
3
AgCl
MeNO
3
AgNO
3
K
2
CrO
4
Ag
2
CrO
4
KNO
3
2
2
Zawartość
Odważyć dokładnie ok. 0,1 g substancji, rozpuścić w 25 ml wody, dodać 3 – 4 krople
roztworu chromianu(VI) potasu i miareczkować 0,1 mol/l roztworem azotanu(V) srebra do
zmiany zabarwienia na żółte.
Przy poszczególnych monografiach podano tylko reakcję oznaczania związku z płynem
mianowanym. Reakcja ze wskaźnikiem przebiega identycznie jak podano powyżej.
Zgodnie z powyższą procedurą oznaczane są następujące związki:
CHLOREK AMONU
NH
4
Cl
AgNO
3
AgCl
NH
4
NO
3
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 5,35 mg chlorku amonu.
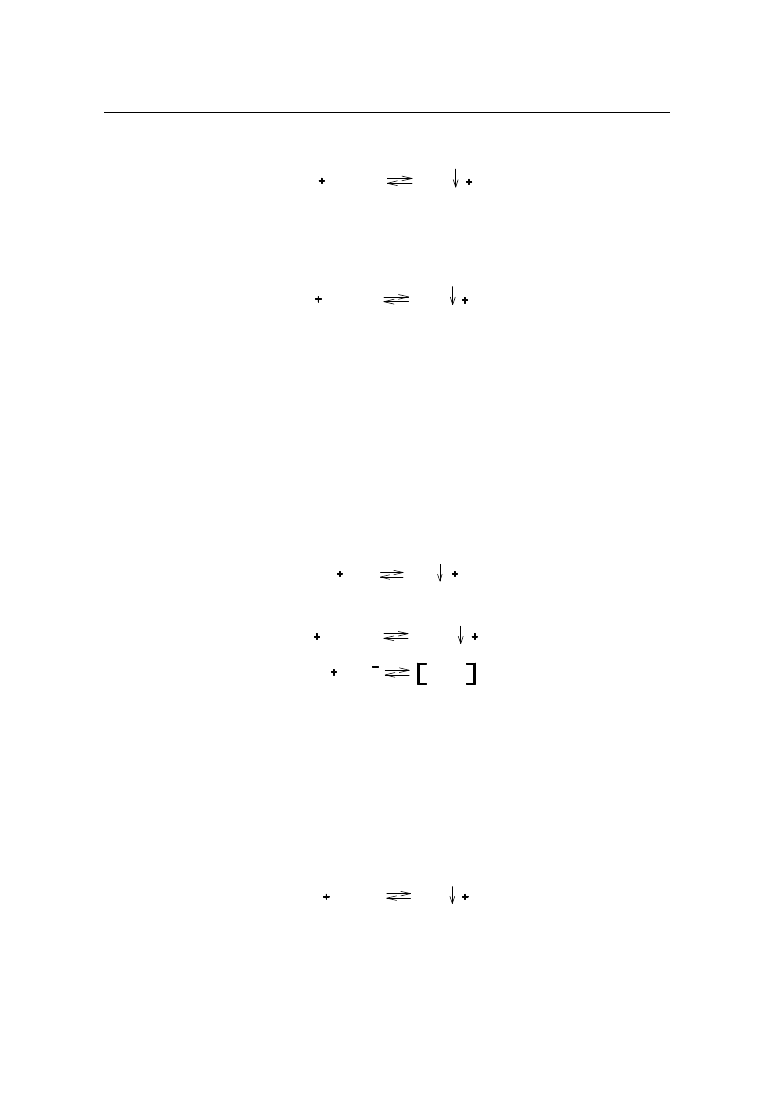
18
Chemiczne metody analizy ilościowej środków leczniczych
CHLOREK POTASU
KCl
AgNO
3
AgCl
KNO
3
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 7,46 mg chlorku potasu.
CHLOREK SODU
NaCl
AgNO
3
AgCl
NaNO
3
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 5,84 mg chlorku sodu.
2.2. Miareczkowanie pośrednie – metoda Volharda
Metodą Volharda oznaczane są jony srebra bezpośrednio, a jony halogenkowe i tiocyja-
nianowe pośrednio. Oznaczanie prowadzi się w środowisku rozcieńczonego kwasu azotowe-
go(V) wobec jonów Fe
3+
pochodzących z siarczanu(VI) żelaza(III) i amonu jako wskaźnika.
Zakwaszenie roztworu zapobiega tworzeniu się Ag
2
O, a jednocześnie cofa hydrolizę żela-
za(III). Powstający wodorotlenek żelaza(III) utrudniałby zaobserwowanie końca miareczko-
wania, ze względu na jego czerwono – brunatne zabarwienie.
Reakcja oznaczania przebiega według schematu:
MeX
AgNO
3
AgX
MeNO
3
Nadmiar azotanu(V) srebra odmiareczkowuje się roztworem tiocyjanianu amonu (ro-
danku amonu) wobec wskaźnika:
AgNO
3
NH
4
SCN
AgSCN
NH
4
NO
3
Fe
3+
SCN
FeSCN
2+
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 40 ml wody, dodać 2 ml 25% roz-
tworu kwasu azotowego(V), 25 ml 0,1 mol/l roztworu azotanu(V) srebra, 1,0 ml roztworu
siarczanu(VI) żelaza(III) i amonu i nadmiar azotanu(V) srebra odmiareczkować 0,1 mol/l
roztworem tiocyjanianu amonu.
Przy poszczególnych monografiach podano tylko reakcję oznaczanego związku z pły-
nem mianowanym. Reakcja ze wskaźnikiem przebiega identycznie jak opisano powyżej.
Zgodnie z powyższą procedurą oznaczane są następujące związki:
BROMEK AMONU
NH
4
Br
AgNO
3
AgBr
NH
4
NO
3
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 9,79 mg bromku amonu.
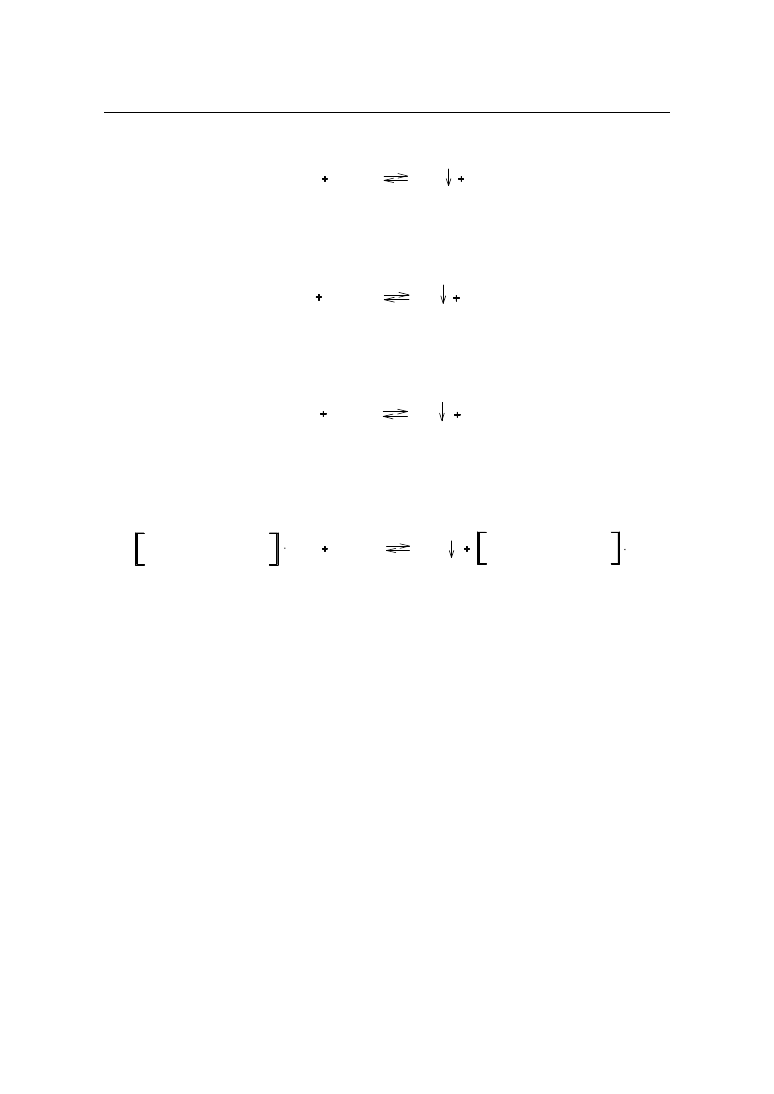
2.
Argentometria
19
BROMEK SODU
NaBr
AgNO
3
AgBr
NaNO
3
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 10,29 mg bromku sodu.
JODEK POTASU
KI
AgNO
3
AgI
KNO
3
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 16,16 mg jodku potasu.
JODEK SODU
NaI
AgNO
3
AgI
NaNO
3
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 14,99 mg jodku sodu.
Argentometrycznie, metodą pośrednią można oznaczać także chlorowodorki zasad orga-
nicznych. Reakcja przebiega według poniższego schematu:
AgNO
3
HNO
3
zasada organiczna
Cl
H
AgCl
zasada organiczna
Dalszy przebieg reakcji jest zgodny ze schematem przedstawionym w punkcie 2.2.
ANTAZOLINY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 30,18 mg chlorowodorku antazo-
liny.
CHLOROPROMAZYNY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 35,53 mg chlorowodorku chloro-
promazyny.
CHLOROPROTYKSENU CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 35,23 mg chlorowodorku chloro-
protyksenu.
DILTIAZEMU CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 45,10 mg chlorowodorku diltia-
zemu.

20
Chemiczne metody analizy ilościowej środków leczniczych
EFEDRYNY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 20,17 mg chlorowodorku efedryny.
FENFORMINY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 24,18 mg chlorowodorku fenfor-
miny.
FLUFENAZYNY DICHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 25,52 mg dichlorowodorku flufe-
nazyny.
FLUOKSETYNY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 34,58 mg chlorowodorku fluokse-
tyny.
IMIPRAMINY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 31,69 mg chlorowodorku imipra-
miny.
LIDOKAINY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 27,08 mg chlorowodorku lidoka-
iny.
MIANSERYNY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 30,08 mg chlorowodorku mianse-
ryny.
OPIPRAMOLU DICHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 21,82 mg dichlorowodorku opi-
pramolu.
PAPAWERYNY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 37,59 mg chlorowodorku papawe-
ryny.
PROKAINAMIDU CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 27,18 mg chlorowodorku proka-
inamidu.
2.
Argentometria
21
PROKAINY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 27,28 mg chlorowodorku proka-
iny.
PROMAZYNY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 32,09 mg chlorowodorku proma-
zyny.
PROMETAZYNY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 32,09 mg chlorowodorku prome-
tazyny.
TIORYDAZYNY CHLOROWODOREK
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 40,70 mg chlorowodorku tioryda-
zyny.
DIMENHYDRAMINA
Zawartość
Odważyć dokładnie ok. 0,8 g substancji i przenieść do kolby stożkowej, dodać 50 ml
wody, 3 ml 10% roztworu wodorotlenku amonu, 6 ml 10% roztworu azotanu(V) amonu i
ogrzewać 5 min na łaźni wodnej, dodać 25 ml 0,1 mol/l roztworu azotanu(V) srebra i po-
nownie mieszając, ogrzewać 15 min na łaźni wodnej, ochłodzić, przenieść ilościowo do
kolby miarowej poj. 200 ml i uzupełnić wodą do kreski, przesączyć, odrzucić pierwsze 20 ml
przesączu. Do 100 ml przesączu dodać 10 ml 25% roztworu kwasu azotowego(V), 1,0 ml
roztworu siarczanu(VI) żelaza(III) i amonu, nadmiar azotanu(V) srebra odmiareczkować 0,1
mol/l roztworem tiocyjanianu amonu do uzyskania czerwonego zabarwienia.
Według powyższej procedury oznacza się 8–chloroteofilinę, będącą składnikiem dimen-
hydraminy.
N
N
N
N
O
O
CH
3
C
H
3
Ag
Cl
AgNO
3
N
N
N
H
N
O
O
CH
3
C
H
3
Cl
HNO
3
1 ml 0,1 mol/l roztworu azotanu(V) srebra odpowiada 21,46 mg 8-chloroteofiliny.

22
Chemiczne metody analizy ilościowej środków leczniczych
AZOTAN SREBRA
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 50 ml wody, dodać 5 ml 25% roz-
tworu kwasu azotowego(V), 1,0 ml roztworu siarczanu(VI) żelaza(III) i amonu, miareczko-
wać 0,1 mol/l roztworem tiocyjanianu amonu.
AgNO
3
NH
4
SCN
AgSCN
NH
4
NO
3
1 ml 0,1 mol/l roztworu tiocyjanianu amonu odpowiada 16,99 mg azotanu(V) srebra.
PROTEINIAN SREBRA
Zawartość
Odważyć dokładnie ok. 2 g substancji, przenieść do kolby stożkowej poj. 500 ml, dodać
15 ml 96% roztworu kwasu siarkowego(VI), 5 ml 65% roztworu kwasu azotowego(V),
przykryć lejkiem i ogrzewać do jasnożółtego zabarwienia. Następnie dodać 100 ml wody,
utrzymywać 30 min we wrzeniu i ochłodzić. Lejek i szyjkę kolby spłukać wodą, dodać 5 ml
65% roztworu kwasu azotowego(V), 1,0 ml roztworu siarczanu(VI) żelaza(III) i amonu,
miareczkować 0,1 mol/l roztworem tiocyjanianu amonu.
1 ml 0,1 mol/l roztworu tiocyjanianu amonu odpowiada 10,79 mg srebra.
23
3. AZOTYNOMETRIA
Metodą azotynową oznacza się większość pierwszorzędowych monoamin aromatycz-
nych oraz niektóre diaminy aromatyczne. W analizie farmaceutycznej azotynometrię stosuje
się do oznaczania sulfonamidów oraz innych pierwszorzędowych amin aromatycznych.
Reakcja przebiega zgodnie z następującym schematem:
Ar
NH
2
NaNO
2
Ar
N
+
N
NaCl
O
H
2
2
HCl
2
Cl
-
Koniec miareczkowania wyznacza się stosując tzw. wskaźnik zewnętrzny - papierek jo-
doskrobiowy. W punkcie końcowym miareczkowania kropla roztworu naniesiona na papie-
rek jodoskrobiowy zabarwia go na niebiesko, zgodnie z reakcją:
KI
2
NaNO
2
2
I
2
KCl
2
NO
2
Cl
H
NaCl
4
O
H
2
2
2
Zabarwienie pochodzi od połączenia kompleksowego skrobi z jodem. Wskaźnik jodo-
skrobiowy nie może być bezpośrednio dodany do roztworu, ponieważ powstający jodowodór
szybciej reagowałby z kwasem azotowym(III) niż przebiegałaby reakcja diazowania aminy
(niebieskie zabarwienie roztworu wystąpiłoby już na początku oznaczania).
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 10 ml 25% roztworu kwasu solne-
go, dodać 50 ml wody, oziębić, dodać 25 g lodu i powoli miareczkować 0,1 mol/l roztworem
azotanu(III) sodu do niebieskiego zabarwienia papierka jodoskrobiowego.
Przy poszczególnych monografiach podano tylko reakcję oznaczanego związku z pły-
nem mianowanym. Reakcja ze wskaźnikiem przebiega identycznie jak podano powyżej.
Zgodnie z powyższą procedurą oznaczane są następujące związki:
AMINOBENZOESAN ETYLU
N
H
2
O
O
CH
3
HCl
N
H
3
+
O
O
CH
3
Cl
-
N
H
3
+
O
O
CH
3
Cl
-
NaNO
2
N
+
O
O
CH
3
N
Cl
-
NaCl
O
H
2
2
HCl
1 ml 0,1 mol/l roztworu azotanu(III) sodu odpowiada 16,52 mg aminobenzoesanu etylu.
24
Chemiczne metody analizy ilościowej środków leczniczych
SULFACETAMID SODOWY
N
H
2
S
O
O
N
O
CH
3
Na
HCl
N
H
3
+
S
O
O
N
O
CH
3
Na
Cl
-
N
H
3
+
S
O
O
N
O
CH
3
Na
Cl
-
NaNO
2
N
+
S
O
O
N
O
CH
3
Na
N
Cl
-
NaCl
O
H
2
2
HCl
1 ml 0,1 mol/l roztworu azotanu(III) sodu odpowiada 23,62 mg sulfacetamidu sodowe-
go.
SULFAKARBAMID
N
H
2
S
O
O
NH
O
NH
2
HCl
N
H
3
+
S
O
O
NH
O
NH
2
Cl
-
N
H
3
+
S
O
O
NH
O
NH
2
Cl
-
NaNO
2
N
+
S
O
O
NH
O
NH
2
N
Cl
-
NaCl
O
H
2
2
HCl
1 ml 0,1 mol/l roztworu azotanu(III) sodu odpowiada 21,52 mg sulfakarbamidu.

25
4. BROMIANOMETRIA
Metoda bromianometryczna znalazła zastosowanie w analizie farmaceutycznej do ozna-
czania:
• fenoli
• fenolokwasów i ich estrów
• kwasów aromatycznych i ich soli
• niektórych amin aromatycznych
• związków heterocyklicznych.
Reakcja chemiczna przebiega zgodnie ze schematem:
KBrO
3
5KBr
3H
2
SO
4
3Br
2
3K
2
SO
4
3H
2
O
Wydzielony brom tworzy z oznaczanym związkiem bromopochodną, a nadmiar bromu
utlenia dodane w nadmiarze jony jodkowe:
Br
2
2KI
I
2
2KBr
Wydzielony jod odmiareczkowuje się mianowanym roztworem tiosiarczanu(VI) sodu:
Na
2
S
2
O
3
I
2
2NaI
Na
2
S
4
O
6
W związkach aromatycznych z wolną grupą aminową, atomy bromu podstawiają się w
pierścieniu benzenowym. Reakcja bromowania umożliwia podstawienie atomów bromu w
pozycji orto i para.
W przypadku związków z dodatkowym pierścieniem heterocyklicznym może zachodzić
podstawienie kolejnego atomu bromu do tego układu.
Zawartość
Odważyć dokładnie ok. 0,1 g substancji, przenieść do kolby stożkowej z doszlifowanym
korkiem poj. 500 ml, rozpuścić w 20 ml wody, dodać 5 ml stężonego roztworu kwasu siar-
kowego(VI) i oziębić. Następnie dodać 30 ml 0,0167 mol/l roztworu bromianu(V) potasu
oraz 1 g bromku potasu i 200 ml wody. Po 30 min dodać 1 g jodku potasu. Pozostawić w
zamkniętej korkiem kolbie na 15 min, a następnie wydzielony jod odmiareczkować 0,1 mol/l
roztworem tiosiarczanu(VI) sodu do słomkowego zabarwienia mieszaniny. Dodać 2 ml 1%
roztworu skrobi i miareczkować do odbarwienia się roztworu. Równolegle wykonać próbę
kontrolną z tymi samymi odczynnikami ale bez substancji. Różnica stanowi ilość ml roztwo-
ru tiosiarczanu(VI) sodu zużytą na zmiareczkowanie oznaczanej substancji leczniczej.
Przy poszczególnych monografiach podano tylko reakcję oznaczanego związku z bro-
mem. Pozostałe reakcje przebiegają identycznie jak opisano powyżej.
Zgodnie z powyższą procedurą oznaczane są następujące związki:
AMINOBENZOESAN ETYLU
2Br
2
2HBr
N
H
2
O
O
CH
3
N
H
2
Br
Br
O
O
CH
3
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 27,53 mg aminobenzoesanu
etylu.
26
Chemiczne metody analizy ilościowej środków leczniczych
FENOL
3Br
2
3HBr
OH
OH
Br
Br
Br
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 15,69 mg fenolu.
FENYLEFRYNY CHLORODOWOREK
3Br
2
3HBr
OH
O
H
N
+
CH
3
H
H
Cl
-
OH
O
H
N
+
CH
3
H
H
Br
Br
Br
Cl
-
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 33,95 mg chlorowodorku fe-
nylefryny
.
PROKAINY CHLOROWODOREK
2Br
2
2HBr
N
H
2
O
O
N
+
CH
3
C
H
3
H
N
H
2
Br
Br
O
O
N
+
CH
3
C
H
3
H
Cl
-
Cl
-
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 68,19 mg chlorowodorku pro-
kainy.
REZORCYNOL
3Br
2
3HBr
OH
OH
OH
Br
Br
Br
OH
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 18,35 mg rezorcynolu.
4.
Bromianometria
27
SULFACETAMID SODOWY
N
H
2
S
O
O
N
CH
3
O
Na
2Br
2
N
H
2
S
O
O
N
CH
3
O
Na
Br
Br
2HBr
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 59,05 mg sulfacetamidu so-
dowego.
SULFADYMIDYNA
N
H
2
S
O
O
NH
N
N
CH
3
CH
3
2Br
2
N
H
2
S
O
O
NH
N
N
CH
3
CH
3
Br
Br
2HBr
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 69,58 mg sulfadymidyny.
SULFAFURAZOL
2Br
2
2HBr
N
H
2
S
O
O
NH
O
N
CH
3
C
H
3
N
H
2
S
O
O
NH
Br
Br
O
N
C
H
3
CH
3
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 66,75 mg sulfafurazolu.
SULFAGUANIDYNA
N
H
2
S
O
O
NH
NH
2
NH
2Br
2
N
H
2
S
O
O
NH
NH
2
NH
Br
Br
2HBr
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 53,56 mg sulfaguanidyny.
28
Chemiczne metody analizy ilościowej środków leczniczych
SULFAMERAZYNA
2Br
2
2HBr
N
H
2
S
O
O
NH
N
N
CH
3
N
H
2
S
O
O
NH
Br
Br
N
N
CH
3
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 66,08 mg sulfamerazyny.
SULFAMETOKSAZOL
2Br
2
2HBr
N
H
2
S
O
O
NH
N
O
CH
3
N
H
2
S
O
O
NH
Br
Br
N
O
CH
3
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 63,32 mg sulfametoksazolu.
SULFAPROKSYLINA
2Br
2
2HBr
N
H
2
S
O
O
NH
O
O
CH
3
CH
3
N
H
2
S
O
O
NH
Br
Br
O
O
CH
3
CH
3
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 55,73 mg sulfaproksyliny.
SULFATIAZOL
3Br
2
3HBr
N
H
2
S
O
O
NH
S
N
N
H
2
S
O
O
NH
Br
Br
S
N
Br
OH
O
H
2
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 42,55 mg sulfatiazolu.
4.
Bromianometria
29
TYMOL
2Br
2
2HBr
CH
3
OH
CH
3
C
H
3
CH
3
Br
Br
OH
CH
3
C
H
3
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 37,56 mg tymolu.
SALICYLAN FENYLU
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, dodać 10 ml 0,5 mol/l roztworu wodoro-
tlenku sodu, ogrzewać 10 min na łaźni wodnej pod chłodnicą zwrotną, ochłodzić, przenieść
ilościowo do kolby miarowej poj. 100 ml i uzupełnić wodą. Odmierzyć 20 ml roztworu do
kolby stożkowej z doszlifowanym korkiem, dodać 200 ml wody, 50 ml 0,0167 mol/l roztwo-
ru bromianu(V) potasu, 0,1 g bromku potasu, 10 ml 20% roztworu kwasu solnego. Po 30 min
dodać 15 ml 10% roztworu jodku potasu i po 15 min miareczkować 0,1 mol/l roztworem
tiosiarczanu(VI) sodu do uzyskania słomkowej barwy roztworu. Następnie dodać 2 ml roz-
tworu skrobi i miareczkować do odbarwienia mieszaniny. Wykonać próbę kontrolną. Z róż-
nicy ilości mililitrów titranta zużytego na zmiareczkowanie próby badanej i próby kontrolnej
oblicza się zawartość oznaczanego związku.
O
O
OH
O
Na
O
O
OH
Na
2NaOH
O
H
2
2HCl
O
Na
O
O
OH
Na
OH
O
OH
OH
2NaCl
6Br
2
OH
O
OH
OH
OH
Br
Br
Br
6HBr
CO
2
2
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 17,85 mg salicylanu fenylu.

30
5. CEROMETRIA
Cerometria jest to metoda oznaczania substancji za pomocą miareczkowania mianowa-
nym roztworem siarczanu ceru(IV). Siarczan ceru(IV) jest związkiem silnie utleniającym w
roztworach kwaśnych i może być stosowany do oznaczania substancji o właściwościach
redukujących.
Farmakopealnymi związkami oznaczanymi cerometrycznie są paracetamol i glukonian
żelaza.
Reakcja przebiega według następującego schematu:
Ce
4+
Ce
3+
e
Oznaczenie prowadzi się w środowisku kwaśnym, gdyż w roztworach obojętnych i słabo
kwaśnych sole ceru(IV) ulegają hydrolizie.
W cerometrii jako wskaźnik stosuje się ferroinę, tj. czerwono zabarwiony kompleks o–
fenantroliny z siarczanem żelaza (II). Kropla nadmiaru siarczanu ceru(IV) reaguje ze wskaźni-
kiem utleniając Fe
2+
do Fe
3+
. Kompleks o-fenantroliny z siarczanem żelaza(III) ma barwę niebie-
ską.
Zielononiebieskie zabarwienie mieszaniny reakcyjnej w punkcie końcowym miareczkowania
powstaje w wyniku mieszaniny barw, uzyskanych z bladoniebiesko zabarwionego kompleksu o-
fenantroliny z siarczanem żelaza(III) oraz żółto zabarwionego 2–metylonaftochinonu.
GLUKONIAN ŻELAZA
Zawartość
Odważyć dokładnie ok. 1 g substancji do kolby stożkowej poj. 200 ml, rozpuścić w mie-
szaninie 30 ml wody i 10 ml 16% roztworu kwasu siarkowego(VI). Po całkowitym rozpusz-
czeniu substancji dodać 3 – 4 krople roztworu o-fenantroliny i miareczkować 0,1 mol/l roz-
tworem siarczanu ceru(IV) do zmiany zabarwienia z czerwonego na zielononiebieskie.
Fe
2+
Ce
4+
Fe
3+
Ce
3+
1 ml 0,1 mol/l roztworu siarczanu ceru(IV) odpowiada 44,61 mg glukonianu żelaza(II).
PARACETAMOL
Zawartość
Odważyć dokładnie ok. 0,05 g substancji, rozpuścić w 2 ml 96˚ etanolu, dodać 30 ml
10% roztworu kwasu solnego, 3 - 4 krople roztworu ferroiny i wolno miareczkować 0,1
mol/l roztworem siarczanu ceru(IV) do zmiany zabarwienia z czerwonego na zielononiebie-
skie, utrzymującego się 1 min.
O
H
O
NH
CH
3
O
NO
2
6Ce(SO
4
)
2
3H
2
O
3Ce
2
(SO
4
)
3
3H
2
SO
4
CH
3
COOH
1 ml 0,1 mol/l roztworu siarczanu ceru(IV) odpowiada 25,20 mg paracetamolu.
31
6. JODOMETRIA
Oznaczanie jodometryczne prowadzi się metodą miareczkowania bezpośredniego lub
pośredniego. Podczas miareczkowania bezpośredniego zachodzi redukcja jodu, zaś w mia-
reczkowaniu pośrednim następuje utlenianie jonów jodkowych do wolnego jodu, który utle-
nia titrant – tiosiarczan(VI) sodu.
JOD
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, przenieść do kolby zawierającej 1 g jodku pota-
su i 2 ml wody, dodać 1 ml 10% roztworu kwasu octowego i mieszać do rozpuszczenia.
Dodać 50 ml wody i miareczkować 0,1 mol/l roztworem tiosiarczanu(VI) sodu do uzyskania
słomkowego zabarwienia roztworu. Następnie dodać 2 ml roztworu skrobi i miareczkować
do odbarwienia roztworu.
Na
2
S
2
O
3
I
2
2NaI
Na
2
S
4
O
6
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 12,69 mg jodu.
KWAS ASKORBOWY
Zawartość
Odważyć dokładnie ok. 0,1 g substancji, rozpuścić w 20 ml świeżo przegotowanej i
ochłodzonej wody, dodać 10 ml 16% roztworu kwasu siarkowego(VI), 2 ml roztworu skrobi
i miareczkować 0,05 mol/l roztworem jodu do uzyskania trwałego niebieskiego zabarwienia
roztworu.
O
O
H
OH
O
O
H
O
H
I
2
O
O
O
O
O
H
O
H
2HI
1 ml 0,05 mol/l roztworu jodu odpowiada 8,81 mg kwasu askorbowego.
METAMIZOL SODOWY
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 5 ml wody, dodać 5 ml 0,02 mol/l
roztworu kwasu solnego i miareczkować 0,05 mol/l roztworem jodu, wobec 2 ml roztworu
skrobi jako wskaźnika, do uzyskania niebieskiego zabarwienia roztworu.
32
Chemiczne metody analizy ilościowej środków leczniczych
N
N
O
CH
3
CH
3
N
C
H
3
S
O
O
O
-
Na
+
N
N
O
CH
3
CH
3
NH
C
H
3
O
H
2
NaHSO
3
C
H
2
O
I
2
HI
NaHSO
3
O
H
2
NaHSO
4
2
1 ml 0,05 mol/l roztworu jodu odpowiada 16,67 mg metamizolu sodowego.
NADMANGANIAN POTASU
Zawartość
Odważyć dokładnie ok. 0,06 g substancji, rozpuścić w 20 ml wody, dodać 10 ml 10%
roztworu jodku potasu, 10 ml 10% roztworu kwasu solnego, 100 ml wody i miareczkować
0,1 mol/l roztworem tiosiarczanu(VI) sodu do uzyskania słomkowego zabarwienia roztworu.
Następnie dodać 2 ml roztworu skrobi i miareczkować do odbarwienia się.
2KMnO
4
10KI
16HCl
12KCl
2MnCl
2
8H
2
O
5I
2
I
2
2Na
2
S
2
O
3
Na
2
S
4
O
6
2NaI
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 3,16 mg nadmanganianu pota-
su.
TIOSIARCZAN SODU
Zawartość
Odważyć dokładnie ok. 0,4 g substancji, rozpuścić w 30 ml wody i miareczkować 0,05
mol/l roztworem jodu do niebieskiego zabarwienia, dodając do miareczkowania 2 ml roz-
tworu skrobi.
Na
2
S
2
O
3
I
2
2
2NaI
Na
2
S
4
O
6
1 ml 0,05 mol/l roztworu jodu odpowiada 24,82 mg tiosiarczanu sodu.
6.
Jodometria
33
6.1. Oznaczanie jodków w obecności innych halogenków
Jony jodkowe można oznaczać w mieszaninie z innymi halogenkami (np.: Cl
-
, Br
-
) sto-
sując poniższą procedurę.
Zawartość
Odmierzyć pipetą 3 ml oznaczanej mieszaniny do kolby z doszlifowanym korkiem, do-
dać 25 ml wody, 4 ml 50% roztworu chlorku żelaza(III), dokładnie wymieszać i pozostawić
na 1,5 h. Po upływie tego czasu dodać 100 ml wody, 10 ml 25% roztworu kwasu fosforowe-
go(V) oraz 1 g jodku potasu. Wydzielony jod odmiareczkować 0,1 mol/l roztworem tiosiar-
czanu(VI) sodu do uzyskania słomkowego zabarwienia. Następnie dodać 2 ml roztworu
skrobi i miareczkować do odbarwienia roztworu.
Przykładowo podano przebieg reakcji dla jodku potasu:
2KI
2FeCl
3
2FeCl
2
2KCl
I
2
Nadmiar dodanego do reakcji utleniacza (FeCl
3
) usuwa się dodając roztwór kwasu fosfo-
rowego(V), który z jonami Fe
3+
tworzy słabo zdysocjowaną sól:
FeCl
3
H
3
PO
4
FePO
4
3HCl
Jodek potasu dodawany jest celem rozpuszczenia wydzielonego jodu, który jest trudno
rozpuszczalny w wodzie.
Wydzielony w reakcji jod odmiareczkowujemy roztworem tiosiarczanu sodu:
Na
2
S
2
O
3
I
2
2NaI
Na
2
S
4
O
6
JODEK POTASU
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 16,60 mg jodku potasu.
JODEK SODU
1 ml 0,1 mol/l roztworu tiosiarczanu(VI) sodu odpowiada 14,99 mg jodku sodu.
34
7. KOMPLEKSOMETRIA
Kompleksometria (kompleksonometria) jest najbardziej uniwersalną metodą oznaczania
związków metali. Komplekson(III) (etylenodiaminotetraoctan disodowy – EDTANa
2
) two-
rzy kompleksy z jonami metali zawsze w stosunku 1:1, niezależnie od wartościowości meta-
lu. Trwałość kompleksów wersenianowych zależy od wartościowości oznaczanych jonów
metali (wzrasta wraz ze wzrostem ich wartościowości) oraz od pH roztworu (tworzący się
kompleks metal – wersenian musi być trwalszy od wcześniej powstałego kompleksu metal –
wskaźnik).
Wskaźniki stosowane w oznaczeniach kompleksometrycznych określane są mianem me-
talowskaźników. Do nich należy: kalces, mureksyd, czerń eriochromowa T, które tworzą z
oznaczanym jonem barwny kompleks. W punkcie końcowym miareczkowania następuje
uwolnienie wskaźnika i jednocześnie zmiana barwy roztworu.
Reakcja kompleksometrycznego oznaczania kationów przebiega według następującego
schematu:
Me
H
2
Ind
MeInd
H
+
2+
2-
2-
2
N
N
O
O
OH
O
O
OH
O
O
Na
Na
Me
2+
N
N
O
O
O
O
O
O
O
O
Na
Na
Me
H
+
2
MeInd
H
+
2-
H
2
Y
2-
MeY
2-
HInd
3-
7.1. Miareczkowanie bezpośrednie
Oznaczanie preparatów bizmutu
Schemat reakcji kompleksometrycznego oznaczania preparatów bizmutu przebiega we-
dług równania:
N
N
O
O
OH
O
O
OH
O
O
Na
Na
N
N
O
O
O
O
O
O
O
O
Na
Bi
H
+
2
Bi
3+
Na
+
7.
Kompleksometria
35
BIZMUTU AZOTAN ZASADOWY
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić lekko ogrzewając w mieszaninie 3 ml
10% roztworu kwasu azotowego(V) i 2 ml wody, dodać 200 ml wody i miareczkować 0,05
mol/l roztworem wersenianu disodowego wobec oranżu ksylenowego do zmiany zabarwie-
nia z czerwonego na żółte.
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 11,65 mg tlenku bizmutu.
BIZMUTU GALUSAN ZASADOWY
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 5 ml 10% roztworu kwasu azoto-
wego(V) z 5 ml wody, ogrzewać 2 min, dodać 0,1 g chloranu(V) potasu i ponownie ogrze-
wać 1 min. Dodać 10 ml wody, ogrzewając aż roztwór stanie się przezroczysty, dodać 200
ml wody, 3 – 4 krople roztworu oranżu ksylenowego i miareczkować 0,1 mol/l roztworem
wersenianu disodowego do zmiany zabarwienia z czerwonego na żółte.
1 ml 0,1 mol/l roztworu wersenianu disodowego odpowiada 20,90 mg bizmutu.
Oznaczanie preparatów cynku
Schemat reakcji kompleksometrycznego oznaczania preparatów cynku przebiega według
równania:
N
N
O
O
OH
O
O
OH
O
O
Na
Na
N
N
O
O
O
O
O
O
O
O
Na
Na
Zn
H
+
2
Zn
2+
Zawartość
Odważyć dokładnie ok. 0,1 g substancji, rozpuścić w 2 ml 10% roztworu kwasu solnego,
dodać 100 ml wody, 10 ml roztworu buforu amonowego o pH 10,0; 0,1 g czerni eriochro-
mowej T i miareczkować 0,05 mol/l roztworem wersenianu disodowego do zmiany zabar-
wienia z czerwonego na niebieskie.
Zgodnie z powyższą procedurą oznacza się następujące związki:
CHLOREK CYNKU
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 6,82 mg chlorku cynku.
TLENEK CYNKU
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 4,07 mg tlenku cynku.
36
Chemiczne metody analizy ilościowej środków leczniczych
SIARCZAN CYNKU
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 40 ml wody, dodać 10 ml roztworu
buforu amonowego o pH 10,0; 0,1 g czerni eriochromowej T i miareczkować 0,05 mol/l
roztworem wersenianu disodowego do zmiany zabarwienia z czerwonego na niebieskie.
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 14,38 mg siarczanu cynku.
Oznaczanie preparatów magnezu
Schemat reakcji kompleksometrycznego oznaczania preparatów magnezu przebiega we-
dług równania:
N
N
O
O
OH
O
O
OH
O
O
Na
Na
N
N
O
O
O
O
O
O
O
O
Na
Na
Mg
H
+
2
Mg
2+
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 40 ml wody, dodać 10 ml roztworu
buforu amonowego o pH 10,0; 0,1 g czerni eriochromowej T i miareczkować 0,05 mol/l
roztworem wersenianu disodowego do zmiany zabarwienia z czerwonego na niebieskie.
Zgodnie z powyższą procedurą oznacza się następujące związki:
CHLOREK MAGNEZU
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 20,33 mg chlorku magne-
zu.
SIARCZAN MAGNEZU
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 12,32 mg siarczanu ma-
gnezu.
Zawartość
Odważyć dokładnie ok. 0,1 g substancji, rozpuścić w 2 ml 10% roztworu kwasu solnego,
dodać 100 ml wody, 10 ml roztworu buforu amonowego o pH 10; 0,1 g czerni eriochromo-
wej T i miareczkować 0,05 mol/l roztworem wersenianu disodowego do zmiany zabarwienia
z czerwonego na niebieskie.
Zgodnie z powyższą procedurą oznacza się następujące związki:
TLENEK MAGNEZU
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 2,02 mg tlenku magnezu.
7.
Kompleksometria
37
WĘGLAN MAGNEZU
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 2,02 mg tlenku magnezu.
Oznaczanie preparatów wapnia
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 50 ml wody, dodać 1 ml 15% roz-
tworu wodorotlenku sodu, około 0,1 g kalcesu i miareczkować 0,05 mol/l roztworem werse-
nianu disodowego do zmiany zabarwienia z fioletowego na niebieskie.
Schemat reakcji kompleksometrycznego oznaczania preparatów wapnia przebiega we-
dług równania:
N
N
O
O
OH
O
O
OH
O
O
Na
Na
N
N
O
O
O
O
O
O
O
O
Na
Na
Ca
H
+
2
Ca
2+
Zgodnie z powyższą procedurą oznacza się następujące związki:
BROMEK WAPNIA
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 9,995 mg bromku wapnia.
CHLOREK WAPNIA
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 10,95 mg sześciowodnego
chlorku wapnia.
GLUKONIAN WAPNIA
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 21,52 mg bezwodnego
glukonianu wapnia.
PANTOTENIAN WAPNIA
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 23,83 mg pantotenianu
wapnia.
MLECZAN WAPNIA
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, ogrzewając rozpuścić w mieszaninie 35 ml wo-
dy z 1 ml 25% roztworu kwasu solnego, dodać 20 ml 25% roztworu wodorotlenku amonu,

38
Chemiczne metody analizy ilościowej środków leczniczych
0,1 g kalcesu i miareczkować 0,05 mol/l roztworem wersenianu disodowego do zmiany
zabarwienia z fioletowego na niebieskie.
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 10,91 mg bezwodnego
mleczanu wapnia.
WĘGLAN WAPNIA
Zawartość
Odważyć dokładnie ok. 0,1 g substancji, rozpuścić w 1 ml 10% roztworu kwasu solnego,
dodać 50 ml wody, ogrzać do wrzenia w celu usunięcia ditlenku węgla, ochłodzić, dodać 2
ml 15% roztworu wodorotlenku sodu, 0,1 g kalcesu i miareczkować 0,05 mol/l roztworem
wersenianu disodowego do zmiany zabarwienia z fioletowego na niebieskie.
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 5,04 mg węglanu wapnia.
Zawartość
Odważyć dokładnie ok. 0,1 g substancji, dodać 1 ml 10% roztworu kwasu solnego, 50
ml wody i ogrzać do wrzenia. Roztwór ochłodzić, dodać 2 ml 10% roztworu wodorotlenku
sodu, 0,1 g kalcesu i miareczkować 0,05 mol/l roztworem wersenianu disodowego do zmia-
ny zabarwienia z fioletowego na niebieskie.
Zgodnie z powyższą procedurą oznacza się następujące związki:
TLENEK WAPNIA
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 2,804 mg tlenku wapnia.
WODOROFOSFORAN WAPNIA
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 8,61 mg diwodnego wodo-
rofosforanu wapnia.
7.2. Miareczkowanie pośrednie
Pośrednio metodą kompleksometryczną oznacza się takie jony metali, których kompleksy z
EDTANa
2
tworzą się powoli, mogą wytrącać się w pH wymaganym przy miareczkowaniu bez-
pośrednim, lub nie można dobrać odpowiedniego wskaźnika do miareczkowania bezpośredniego.
Jedną z technik miareczkowania pośredniego jest dodanie nadmiaru kompleksonu(III) i
jego odmiareczkowanie mianowanym roztworem odpowiedniego metalu.
Oznaczanie preparatów glinu
FOSFORAN GLINU
Zawartość
Odważyć dokładnie ok. 1 g substancji, rozpuścić ogrzewając w 30 ml 1% roztworu kwa-
su solnego. Przenieść ilościowo do kolby miarowej poj. 50 ml i uzupełnić do kreski 1%
7.
Kompleksometria
39
roztworem kwasu solnego. Do kolby stożkowej pobrać 5 ml roztworu, dodać 100 ml wody i
25 ml 0,05 mol/l roztworu wersenianu disodowego, ogrzać do wrzenia i utrzymywać 3 min
we wrzeniu, ochłodzić, dodać 7 g metenaminy, 0,2 g mieszaniny oranżu ksylenowego z
azotanem(V) potasu i odmiareczkować nadmiar 0,05 mol/l roztworu wersenianu disodowego
0,05 mol/l roztworem azotanu(V) ołowiu(II) do zmiany zabarwienia na żółte.
.
N
N
O
O
OH
O
O
OH
O
O
Na
Na
N
N
O
O
O
O
O
O
O
O
Na
Al
H
+
2
Al
3+
Na
+
N
N
O
O
OH
O
O
OH
O
O
Na
Na
N
N
O
O
O
O
O
O
O
O
Na
Na
Pb
H
+
2
Pb
2+
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 6,10 mg fosforanu glinu.
SIARCZAN GLINOWO–POTASOWY
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 20 ml wody, dodać 20 ml 0,05
mol/l roztworu wersenianu disodowego, 10 ml roztworu buforu octanowego o pH 4,5 i
utrzymywać 10 min we wrzeniu, ochłodzić, po 10 min dodać 2 g jodku potasu i odmiarecz-
kować nadmiar 0,05 mol/l roztworu wersenianu disodowego 0,05 mol/l roztworem azota-
nu(V) bizmutu(III) do żółtego zabarwienia.
N
N
O
O
OH
O
O
OH
O
O
Na
Na
N
N
O
O
O
O
O
O
O
O
Na
Al
H
+
2
Al
3+
Na
+
40
Chemiczne metody analizy ilościowej środków leczniczych
N
N
O
O
OH
O
O
OH
O
O
Na
Na
N
N
O
O
O
O
O
O
O
O
Na
Bi
H
+
2
Bi
3+
Na
+
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 23,72 mg siarczanu glino-
wo–potasowego.
SIARCZAN GLINU
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, dodać 10 ml wody, 1 ml 10% roztworu kwasu
solnego i ogrzewać do wrzenia. Ochłodzić, dodać 25 ml 0,05 mol/l roztworu wersenianu
disodowego, 2 g wodoroftalanu potasu, 30 ml 96° etanolu i zmieszać. Dodać 3 ml etanolo-
wego roztworu ditizonu (0,25 mg/ml) i nadmiar wersenianu disodowego odmiareczkować
0,05 mol/l roztworem siarczanu(VI) cynku(II) do zmiany zabarwienia na fioletowe. Wyko-
nać próbę kontrolną.
N
N
O
O
OH
O
O
OH
O
O
Na
Na
N
N
O
O
O
O
O
O
O
O
Na
Al
H
+
2
Al
3+
Na
+
N
N
O
O
OH
O
O
OH
O
O
Na
Na
N
N
O
O
O
O
O
O
O
O
Na
Na
Zn
H
+
2
Zn
2+
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 16,66 mg siarczanu glinu.
WODOROTLENEK GLINU
Zawartość
Odważyć dokładnie ok. 0,4 g substancji, rozpuścić w mieszaninie 2 ml 1 mol/l roztworu
kwasu solnego z 50 ml wody, dodać 50 ml 0,05 mol/l roztworu wersenianu disodowego i
zobojętnić 1 mol/l roztworem wodorotlenku sodu. Roztwór ogrzać do wrzenia, pozostawić
10 min na wrzącej łaźni wodnej, szybko ochłodzić, dodać ok. 50 mg oranżu ksylenowego,

7.
Kompleksometria
41
5 g metenaminy i odmiareczkować nadmiar wersenianu disodowego 0,05 mol/l roztworem
azotanu(V) ołowiu(II) do zmiany zabarwienia z żółtego na czerwone.
Schemat przebiegu reakcji – patrz monografia fosforan glinu.
1 ml 0,05 mol/l roztworu wersenianu disodowego odpowiada 3,90 mg wodorotlenku gli-
nu lub 2,55 mg tlenku glinu.
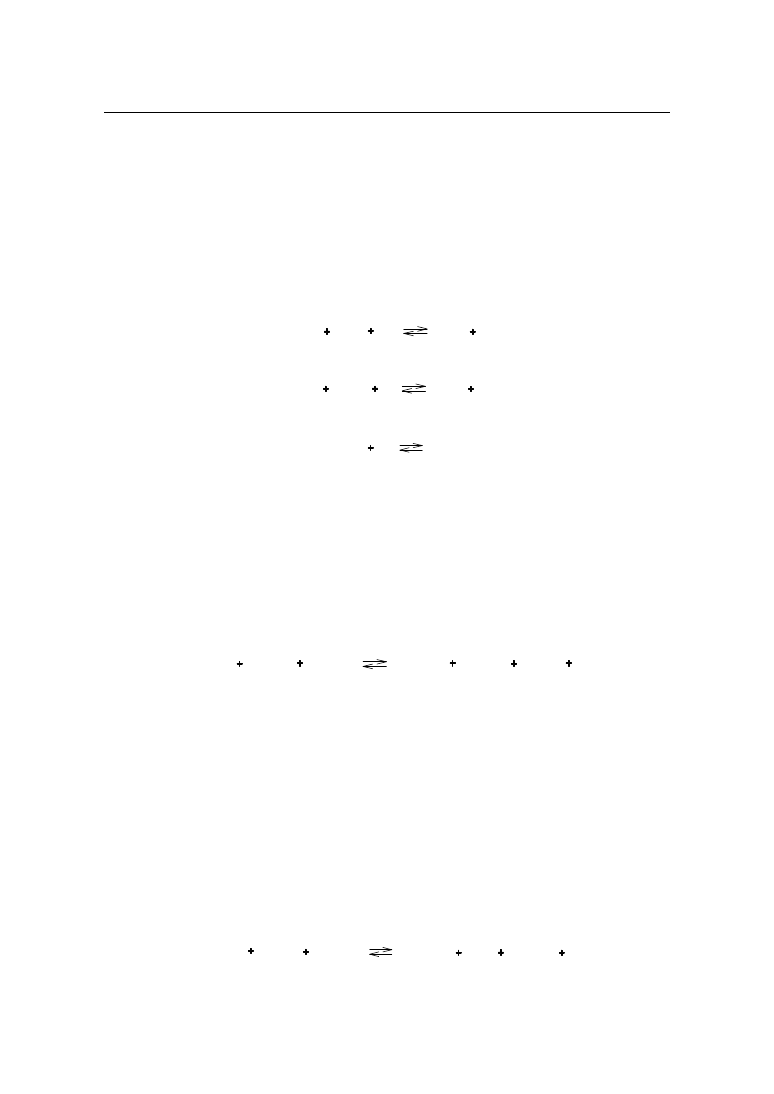
42
8. MANGANOMETRIA
Manganometria jest działem oksydymetrii, w którym oznaczanie substancji przeprowa-
dza się miareczkując roztworem manganianu(VII) potasu.
Oznaczanie ilościowe manganometryczne przeprowadza się na ogół w środowisku kwa-
śnym. Silne zabarwienie roztworu manganianu(VII) potasu eliminuje konieczność stosowa-
nia dodatkowych wskaźników.
Właściwości utleniające manganianu(VII) potasu warunkuje reakcja, której przebieg jest
uzależniony od pH roztworu:
• środowisko silnie kwaśne
4H
2
O
MnO
4
5e
H
+
Mn
2+
8
-
• środowisko obojętne lub słabo alkaliczne
4
2
OH
MnO
4
3e
O
H
2
MnO
2
-
-
• środowisko silnie alkaliczne
MnO
4
1e
MnO
4
-
2-
Manganometrycznie w środowisku silnie kwaśnym oznacza się substancje nieorganiczne
i organiczne o właściwościach redukujących.
AZOTYN SODU
Zawartość
Odważyć dokładnie ok. 1 g substancji, rozpuścić w 70 ml wody w kolbie miarowej poj.
100 ml, uzupełnić wodą i zmieszać. Otrzymanym roztworem powoli miareczkować do zani-
ku różowego zabarwienia, ogrzaną do temp. 40°C mieszaninę 25 ml 0,02 mol/l roztworu
manganianu(VII) potasu z 200 ml wody i 30 ml 16% roztworu kwasu siarkowego(VI).
2KMnO
4
5NaNO
2
3H
2
SO
4
5NaNO
3
3H
2
O
2MnSO
4
K
2
SO
4
Azotanów(III) nie można zakwaszać kwasem siarkowym(VI), ponieważ powoduje to ich
rozkład. Z tej przyczyny stosuje się miareczkowanie odwrócone, w którym zakwaszony
roztwór KMnO
4
miareczkuje się roztworem azotanu(III).
1 ml 0,02 mol/l roztworu manganianu(VII) potasu odpowiada 3,43 mg azotynu sodu.
BROMEK POTASU
Zawartość
Odważyć dokładnie ok. 1,2 g substancji, rozpuścić w wodzie i uzupełnić wodą do 100
ml, odmierzyć pipetą 10 ml roztworu, dodać 100 ml wody, 10 ml 96% roztworu kwasu siar-
kowego(VI) i kilka perełek szklanych, ogrzać do wrzenia i powoli miareczkować 0,02 mol/l
roztworem manganianu(VII) potasu do różowego zabarwienia, utrzymującego się 60 s.
2KMnO
4
10KBr
8H
2
SO
4
2MnSO
4
5Br
2
O
H
2
8
6K
2
SO
4
1 ml 0,02 mol/l roztworu manganianu(VII) potasu odpowiada 11,90 mg bromku potasu.

8.
Manganometria
43
NADTLENEK WODORU
Zawartość
Odmierzyć pipetą 5 ml roztworu i uzupełnić wodą do 100 ml w kolbie miarowej. Do
10,0 ml roztworu dodać 20 ml 10% roztworu kwasu siarkowego(VI) i natychmiast miarecz-
kować 0,02 mol/l roztworem manganianu(VII) potasu do różowego zabarwienia.
2KMnO
4
5H
2
O
2
3H
2
SO
4
5O
2
8H
2
O
2MnSO
4
K
2
SO
4
1 ml 0,02 mol/l roztworu manganianu(VII) potasu odpowiada 1,701 mg nadtlenku wo-
doru.
Organiczne preparaty wapnia
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 100 ml wody, dodać 2 ml 25% roz-
tworu kwasu solnego i ogrzać do wrzenia; dodać 15 ml 4% roztworu szczawianu amonu, 2
krople roztworu czerwieni metylowej i dodawać 10% roztworu amoniaku do zmiany zabar-
wienia. Mieszaninę ogrzewać na łaźni wodnej przez 2 h i odstawić do ochłodzenia. Następ-
nie przesączyć przez twardy sączek, a osad przemywać małymi porcjami wody do zaniku
reakcji na kwas szczawiowy. Sączek wraz z osadem przenieść do kolby stożkowej. Osad
rozpuścić w gorącej wodzie i w 30 ml 16% roztworu kwasu siarkowego(VI). Mieszaninę
ogrzać do 70˚C i miareczkować 0,02 mol/l roztworem manganianu(VII) potasu do trwałego,
różowego zabarwienia.
W zależności od oznaczanego preparatu wapnia w reakcji z HCl powstaje CaCl
2
i odpo-
wiedni kwas organiczny. Dalej reakcja przebiega według schematu:
CaCl
2
(NH
4
)
2
C
2
O
4
CaC
2
O
4
2NH
4
Cl
CaC
2
O
4
H
2
SO
4
H
2
C
2
O
4
CaSO
4
5H
2
C
2
O
4
2KMnO
4
3H
2
SO
4
10CO
2
8H
2
O
2MnSO
4
K
2
SO
4
GLUKONIAN WAPNIA
1 ml 0,02 mol/l roztworu manganianu(VII) potasu odpowiada 22,42 mg glukonianu
wapnia.
MLECZAN WAPNIA
1 ml 0,02 mol/l roztworu manganianu(VII) potasu odpowiada 10,91 mg bezwodnego
mleczanu wapnia.
PANTOTENIAN WAPNIA
1 ml 0,02 mol/l roztworu manganianu(VII) potasu odpowiada 2,004 mg wapnia.

44
9. MIARECZKOWANIE W ŚRODOWISKU
NIEWODNYM
W środowisku niewodnym oznacza się związki o charakterze słabych kwasów lub zasad.
Ze względu na słabą rozpuszczalność lub słabą dysocjację w środowisku wodnym, ich ozna-
czanie w wodzie nie jest możliwe. Rozpuszczalniki w środowisku niewodnym mogą brać
udział w reakcji przekazywania protonu (powstają odpowiednie kationy lub aniony) albo w
niej nie uczestniczą.
Do oznaczeń najczęściej stosuje się rozpuszczalniki :
a)
aprotolityczne – nie biorą udziału w przekazywaniu protonu między substancją
oznaczaną a płynem miareczkującym
b)
amfiprotolityczne – aktywnie uczestniczą w przekazywaniu protonów, wywołu-
jąc jonizację danego związku poprzez tworzenie wiązania jonowego. Wśród
nich wyróżniamy rozpuszczalniki:
• protonogenne – oddają proton oznaczanej substancji, podwyższając jej
charakter zasadowy
• protonofilne (protonofilowe) – przyjmują proton od oznaczanej sub-
stancji, zwiększając jej charakter kwasowy.
9.1. Acydymetria
Acydymetrycznie w środowisku niewodnym oznacza się związki o charakterze zasado-
wym:
• aminy I, II, III rzędowe i zasady amoniowe
• zasady heterocykliczne
• sole zasad organicznych z kwasami nieorganicznymi i organicznymi
• sole mocnych zasad nieorganicznych i słabych kwasów organicznych
Rozpuszczalniki:
W acydymetrii stosuje się rozpuszczalniki protonogenne (kwaśne lub słabo kwaśne), np.
kwas octowy, propionowy, bezwodnik kwasu octowego, propionowego oraz aprotolityczne
(obojętne o małej wartości stałej dielektrycznej), np. toluen, dioksan, chloroform.
Wskaźniki:
Zakresy zmiany barwy wskaźników stosowanych w środowisku niewodnym nie za-
leżą od stężenia jonów H
+
i znajdują się w innych granicach pH niż stosowane w roztworze
wodnym. Do nich należą:
– 0,1% roztwór fioletu krystalicznego w 100% roztworze kwasu octowego
– 0,5% roztwór zieleni brylantowej w 100% roztworze kwasu octowego
– 0,5% roztwór zieleni malachitowej w 100% roztworze kwasu octowego
– 0,2% roztwór 1–naftolobenzeiny w 100% roztworze kwasu octowego
– 0,1% roztwór żółcieni dimetylowej w etanolu.
Płyny miareczkujące:
– 0,1 mol/l roztwór kwasu chlorowego(VII) w 100% roztworze kwasu octowego
– 0,1 mol/l roztwór kwasu chlorowego(VII) w dioksanie
– 0,005 mol/l roztwór kwasu p–toluenosulfonowego w dioksanie.
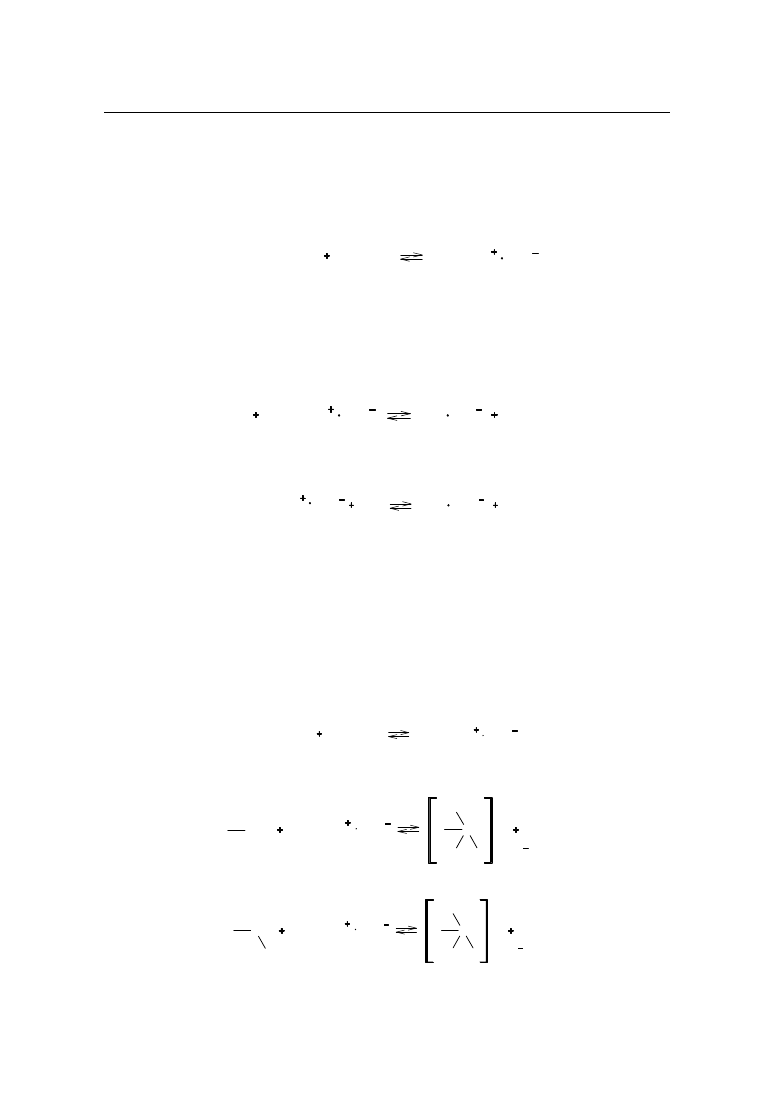
9.
Miareczkowanie
w
środowisku niewodnym
45
Najczęściej stosowanym organicznym rozpuszczalnikiem do miareczkowania słabych
zasad jest kwas octowy, a płynem mianowanym roztwór kwasu chlorowego(VII) w kwasie
octowym.
Kwas octowy wobec silnych kwasów zachowuje się jak zasada i przyjmuje proton two-
rząc sól. Zachodzi więc reakcja protolizy, w której kwas chlorowy(VII) oddaje proton, a
kwas octowy go przyjmuje:
HClO
4
CH
3
COOH
CH
3
COOH
2
ClO
4
Kwas Zasada
Kwas Zasada
(Kw)
(Z)
(Kw)
(Z)
Jednakże charakter zasadowy kwasu octowego jest znacznie słabszy w porównaniu z
wodą. Protony są luźniej związane z cząsteczkami rozpuszczalnika niż w przypadku jonu
hydroniowego (H
3
O
+
). W związku z tym aktywność protonów w roztworach silnych kwasów
w kwasie octowym jest większa niż w wodzie. Słabe zasady są zdolne do odebrania proto-
nów jonom octaniowym (CH
3
COOH
2
+
) powstającym w roztworze po dodaniu kwasu chlo-
rowego(VII).
Z
CH
3
COOH
2
ClO
4
HZ
ClO
4
CH
3
COOH
Obecność wody podwyższa wyniki oznaczeń lub uniemożliwia zauważenie zmiany bar-
wy wskaźnika, ponieważ w jej obecności część jonów CH
3
COOH
2
+
przechodzi w H
3
O
+
o
słabszych właściwościach kwasowych (woda jest silniejszą zasadą niż CH
3
COOH).
O
H
2
O
H
3
+
CH
3
COOH
2
ClO
4
ClO
4
CH
3
COOH
Dodatek niewielkich ilości bezwodnika kwasu octowego stosuje się w celu związania
śladowych ilości wody.
9.1.1. Oznaczanie amin i zasad heterocyklicznych
W przypadku amin i zasad heterocyklicznych reakcja z kwasem chlorowym(VII) prze-
biega według następujących schematów:
HClO
4
CH
3
COOH
CH
3
COOH
2
ClO
4
a)
dla amin:
– I - rzędowych
R
NH
2
CH
3
COOH
2
ClO
4
R
N
+
H
H
H
CH
3
COOH
ClO
4
– II - rzędowych
R
NH
R
1
CH
3
COOH
2
ClO
4
R
N
+
R
1
H
H
CH
3
COOH
ClO
4
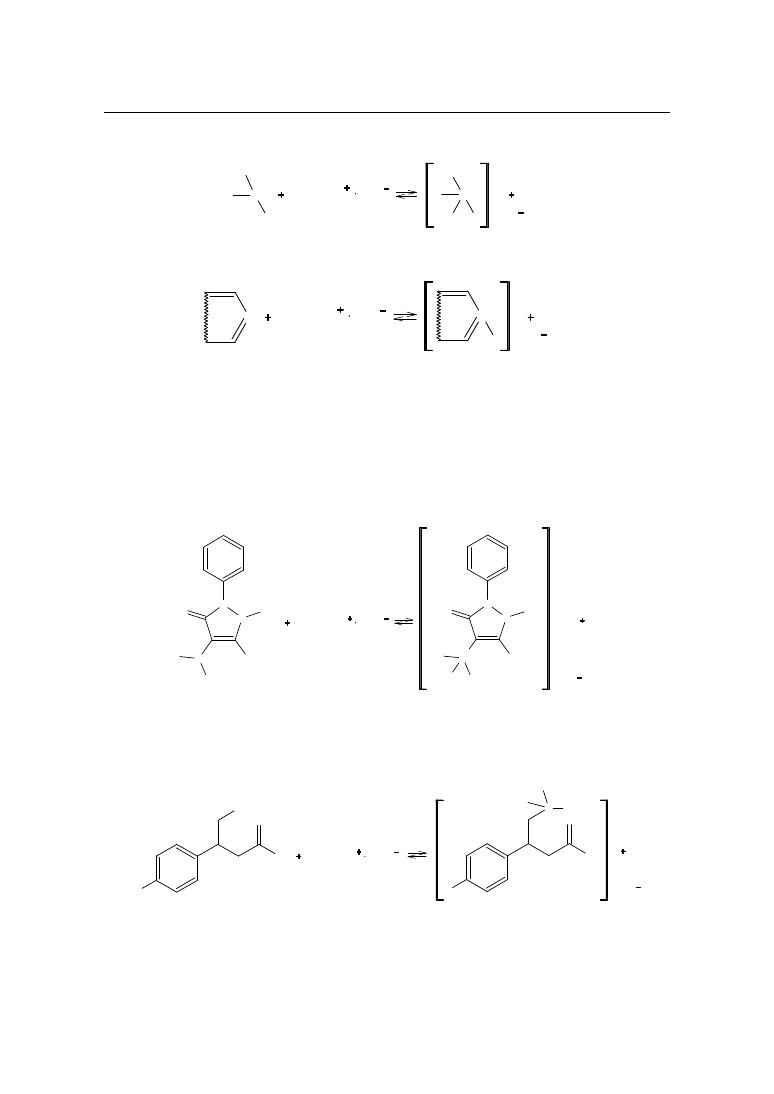
46
Chemiczne metody analizy ilościowej środków leczniczych
– III - rzędowych
R
N
R
1
R
2
CH
3
COOH
2
ClO
4
R
N
+
R
1
R
2
H
CH
3
COOH
ClO
4
b)
dla zasad heterocyklicznych:
N
CH
3
COOH
2
ClO
4
N
+
H
ClO
4
CH
3
COOH
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 20 ml 100% roztworu kwasu
octowego i miareczkować 0,1 mol/l roztworem kwasu chlorowego(VII) wobec 3 - 4 kropli
roztworu fioletu krystalicznego do zmiany zabarwienia z fioletowego na niebieskie. Wyko-
nać próbę kontrolną.
Zgodnie z powyższą procedurą oznaczane są następujące związki:
AMINOFENAZON
N
N
CH
3
CH
3
O
N
CH
3
C
H
3
CH
3
COOH
2
ClO
4
N
N
CH
3
CH
3
O
N
+
CH
3
C
H
3
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 23,13 mg aminofenazonu.
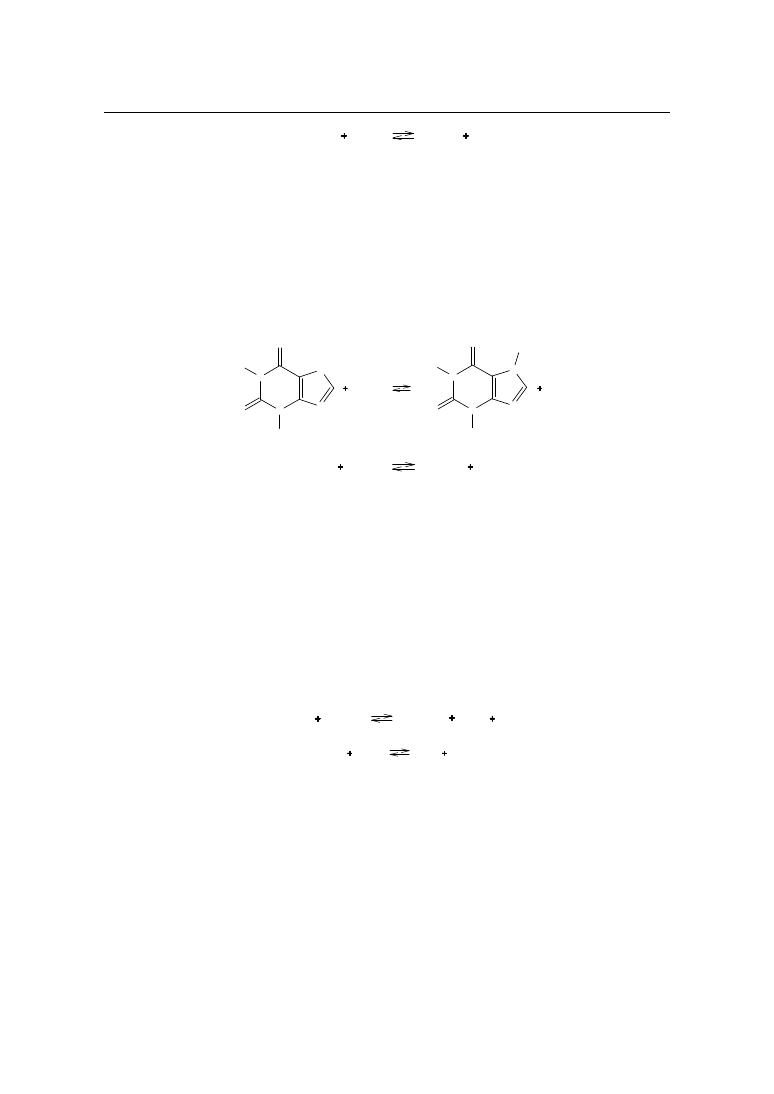
BAKLOFEN
Cl
NH
2
O
OH
CH
3
COOH
2
ClO
4
Cl
N
+
O
OH
H
H
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 21,37 mg baklofenu.
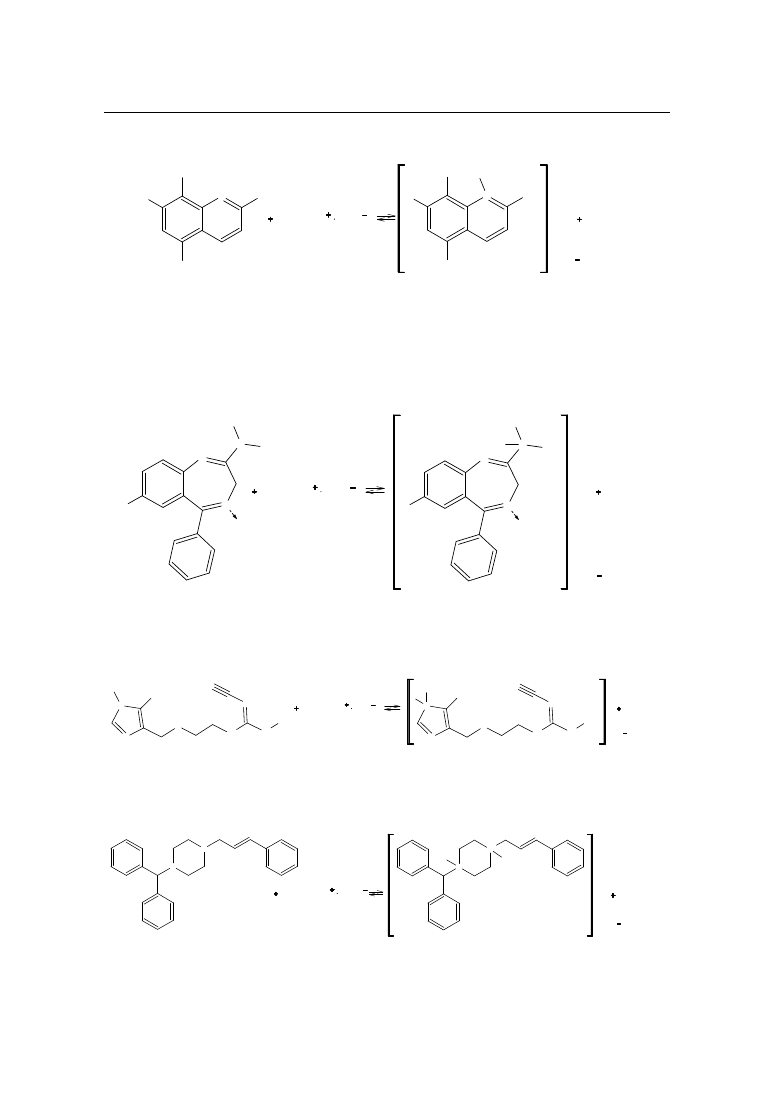
9.
Miareczkowanie
w
środowisku niewodnym
47
CHLORCHINALDOL
N
OH
Cl
Cl
CH
3
CH
3
COOH
2
ClO
4
N
+
OH
Cl
Cl
CH
3
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 22,81 mg chlorchinaldolu.
CHLORODIAZEPOKSYD
Chlorodiazepoksyd posiada grupę aminową przy węglu 2, dlatego też przyłączenie pro-
tonu zachodzi w tej pozycji, w odróżnieniu od pozostałych pochodnych benzodiazepin.
N
N
N
Cl
O
CH
3
H
CH
3
COOH
2
ClO
4
N
N
N
+
Cl
O
CH
3
H
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 29,98 mg chlorodiazepoksydu.
CYMETYDYNA
N
N
CH
3
S
NH
N
NH
CH
3
N
H
CH
3
COOH
2
ClO
4
CH
3
COOH
ClO
4
H
H
N
+
N
CH
3
S
NH
N
NH
CH
3
N
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 25,23 mg cymetydyny.
CYNNARYZYNA
N
N
CH
3
COOH
2
ClO
4
N
+
N
+
H
H
ClO
4
2CH
3
COOH
2
2
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 18,42 mg cynnaryzyny.
48
Chemiczne metody analizy ilościowej środków leczniczych
EPINEFRYNA
N
CH
3
OH
OH
O
H
H
CH
3
COOH
2
ClO
4
N
+
CH
3
OH
OH
O
H
H
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 18,32 mg epinefryny.
HALOPERIDOL
N
OH
Cl
O
F
CH
3
COOH
2
ClO
4
N
+
OH
Cl
O
F
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 37,59 mg haloperidolu.
KLOZAPINA
N
H
N
N
N
Cl
CH
3
CH
3
COOH
2
ClO
4
2
N
H
N
N
+
N
+
Cl
CH
3
H
H
ClO
4
2CH
3
COOH
2
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 16,34 mg klozapiny.
LIDOKAINA
O
N
CH
3
N
CH
3
CH
3
CH
3
H
CH
3
COOH
2
ClO
4
O
N
CH
3
N
+
CH
3
CH
3
CH
3
H
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 23,43 mg bezwodnej lidokainy.
9.
Miareczkowanie
w
środowisku niewodnym
49
LORATADYNA
N
N
O
O
CH
3
Cl
CH
3
COOH
2
ClO
4
N
+
N
O
O
CH
3
Cl
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 38,29 mg loratadyny.
METRONIDAZOL
N
N
OH
NO
2
CH
3
CH
3
COOH
2
ClO
4
CH
3
COOH
ClO
4
N
+
N
OH
NO
2
CH
3
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 17,12 mg metronidazolu.
DIMENHYDRAMINA
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić ogrzewając w 30 ml 100% roztworu
kwasu octowego, ochłodzić i miareczkować 0,05 mol/l roztworem kwasu chlorowego(VII)
wobec 3 - 4 kropli roztworu fioletu krystalicznego do zmiany zabarwienia z fioletowego na
niebieskie. Wykonać próbę kontrolną.
Według powyższej procedury oznacza się difenhydraminę, będącą składnikiem di-
menhydraminy.
O
N
CH
3
CH
3
CH
3
COOH
2
ClO
4
O
N
+
CH
3
CH
3
H
CH
3
COOH
ClO
4
1 ml 0,05 mol/l roztworu kwasu chlorowego(VII) odpowiada 12,77 mg difenhydraminy.
50
Chemiczne metody analizy ilościowej środków leczniczych
Oznaczanie substancji leczniczych w mieszaninie kwasu octowego z bezwodnikiem
octowym (uzasadnienie dodatku bezwodnika kwasu octowego – patrz strona 48 i 60)
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 10 ml 100% roztworu kwasu
octowego, dodać 10 ml roztworu bezwodnika kwasu octowego, 3 - 4 krople roztworu fioletu
krystalicznego i miareczkować 0,1 mol/l roztworem kwasu chlorowego(VII) do zmiany
zabarwienia z fioletowego na niebieskie. Wykonać próbę kontrolną.
Zgodnie z powyższą procedurą oznacza się następujące związki:
NIKETAMID
N
N
CH
3
CH
3
O
CH
3
COOH
2
ClO
4
N
+
N
CH
3
CH
3
O
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 17,82 mg niketamidu.
NIKOTYNAMID
N
NH
2
O
CH
3
COOH
2
ClO
4
CH
3
COOH
ClO
4
N
+
NH
2
O
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 12,21 mg nikotynamidu.
NIKOTYNYLOMETYLOAMID
N
NH
O
OH
CH
3
COOH
2
ClO
4
CH
3
COOH
ClO
4
N
+
NH
O
OH
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 15,22 mg nikotynylomety-
loamidu.
TEMAZEPAM
Pochodne benzodiazepiny wykazują właściwości słabych zasad. W środowisku kwa-
śnym tworzą sole, a przyłączenie protonu następuje w położeniu 4.
9.
Miareczkowanie
w
środowisku niewodnym
51
N
N
O
Cl
OH
C
H
3
CH
3
COOH
2
ClO
4
N
N
+
O
Cl
C
H
3
OH
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 30,07 mg temazepamu.
TYNIDAZOL
N
N
NO
2
CH
3
S
O
O
CH
3
CH
3
COOH
2
ClO
4
N
+
N
NO
2
CH
3
S
O
O
CH
3
H
CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 24,74 mg tynidazolu.
ZOPIKLON
N
N
N
O
N
Cl
O
O
N
N
C
H
3
CH
3
COOH
2
ClO
4
CH
3
COOH
ClO
4
N
N
N
O
N
+
Cl
O
O
N
N
C
H
3
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 38,88 mg zopiklonu.
KOFEINA
Zawartość
Odważyć dokładnie ok. 0,2 g wysuszonej substancji, rozpuścić w 30 ml mieszaniny
(2:1) toluenu z bezwodnikiem kwasu octowego, dodać 3 – 4 krople roztworu fioletu krysta-
licznego i miareczkować 0,1 mol/l roztworem kwasu chlorowego(VII) do zmiany zabarwie-
nia z fioletowego na żółte. Wykonać próbę kontrolną.
N
N
N
N
CH
3
O
C
H
3
O
CH
3
O
O
O
C
H
3
C
H
3
N
N
N
N
+
CH
3
O
C
H
3
O
CH
3
H
O
O
O
C
H
2
-
C
H
3
52
Chemiczne metody analizy ilościowej środków leczniczych
N
N
N
N
+
CH
3
O
C
H
3
O
CH
3
H
O
O
O
C
H
2
-
C
H
3
CH
3
COOH
2
ClO
4
N
N
N
N
+
CH
3
O
C
H
3
O
CH
3
H
ClO
4
CH
3
COOH
O
O
O
C
H
3
C
H
3
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 19,42 mg bezwodnej kofe-
iny.
9.1.2. Oznaczanie soli zasad organicznych
9.1.2.1. Oznaczanie soli zasad organicznych z niektórymi kwasami nie-
organicznymi i organicznymi
Z punktu widzenia definicji kwasów i zasad Brönsteda kationy soli zasad organicznych
są kwasami, są bowiem zdolne do odszczepienia protonu, a aniony zasadami, ponieważ
mogą przyłączyć protony przechodząc w sprzężone z nimi kwasy.
Metodą bezpośrednią możemy oznaczać sole kwasów nieorganicznych (azotany(V),
siarczany(VI) i fosforany(V) oraz słabych kwasów organicznych (octany, winiany, maleinia-
ny i mleczany) z zasadami organicznymi.
Jon octaniowy (CH
3
COOH
2
+
) utworzony w wyniku reakcji kwasu chlorowego(VII) z
rozpuszczalnikiem jest silniejszym kwasem niż kwasy [HZ]
+
sprzężone z zasadami i dlatego
w każdym z tych przypadków jest protonodawcą.
Jon siarczanowy w środowisku kwasu octowego może przyjąć tylko jeden proton, co
odpowiada przejściu jonu SO
4
2-
w HSO
4
-
. Przyjęcie drugiego protonu przez jon HSO
4
-
nie
jest możliwe, ponieważ kwas siarkowy(VI) w środowisku kwasu octowego jest jednym z
najsilniejszych kwasów.
Analogicznie przebiega reakcja dla jonu PO
4
3-
.
Aniony słabych kwasów organicznych jako zasady w środowisku kwasu octowego są w
stanie przyjąć tylko jeden proton od kwasu chlorowego(VII).
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 20 ml 100% roztworu kwasu
octowego i miareczkować 0,1 mol/l roztworem kwasu chlorowego(VII) wobec 3 – 4 kropli
roztworu fioletu krystalicznego do zmiany zabarwienia z fioletowego na niebieskie. Wyko-
nać próbę kontrolną.
Zgodnie z powyższą procedurą oznacza się następujące związki:
9.
Miareczkowanie
w
środowisku niewodnym
53
EPINEFRYNY WODOROWINIAN
N
+
CH
3
OH
OH
O
H
H
H
CH
3
COOH
2
ClO
4
N
+
CH
3
OH
OH
O
H
H
H
CH
3
COOH
ClO
4
O
O
H
O
O
-
OH
O
H
O
O
H
O
OH
OH
O
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 33,33 mg wodorowinianu
epinefryny.
KODEINY FOSFORAN
O
O
CH
3
OH
N
+
C
H
3
H
H
2
PO
4
CH
3
COOH
2
ClO
4
O
O
CH
3
OH
N
+
C
H
3
H
CH
3
COOH
ClO
4
H
3
PO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 39,74 mg bezwodnego fos-
foranu kodeiny.
MIKONAZOLU AZOTAN
Cl
Cl
O
N
N
+
Cl
Cl
H
NO
3
CH
3
COOH
2
ClO
4
Cl
Cl
O
N
N
+
Cl
Cl
H
CH
3
COOH
ClO
4
HNO
3
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 47,91 mg azotanu mikona-
zolu.
54
Chemiczne metody analizy ilościowej środków leczniczych
MORFINY SIARCZAN
O
O
H
OH
N
+
C
H
3
H
SO
4
CH
3
COOH
2
ClO
4
O
O
H
OH
N
+
C
H
3
H
CH
3
COOH
ClO
4
2
2-
O
O
H
OH
N
+
C
H
3
H
HSO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 66,88 mg bezwodnego siar-
czanu morfiny.
NAFAZOLINY AZOTAN
N
N
+
H
H
CH
3
COOH
2
ClO
4
N
N
+
H
H
CH
3
COOH
ClO
4
NO
3
HNO
3
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 27,33 mg azotanu nafazoli-
ny.
NOREPINEFRYNY WODOROWINIAN
N
+
OH
O
H
O
H
H
H
H
CH
3
COOH
2
ClO
4
N
+
OH
O
H
O
H
H
H
H
CH
3
COOH
ClO
4
O
O
H
O
O
-
OH
O
H
O
O
H
O
OH
OH
O
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 31,93 mg bezwodnego wo-
dorowinianu norepinefryny.
ORCYPRENALINY SIARCZAN
N
+
OH
O
H
OH
CH
3
CH
3
H
H
2
SO
4
CH
3
COOH
2
ClO
4
2-
N
+
OH
O
H
OH
CH
3
CH
3
H
H
ClO
4
CH
3
COOH
N
+
OH
O
H
OH
CH
3
CH
3
H
H
HSO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 52,26 mg siarczanu orcy-
prenaliny.
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 20 ml roztworu bezwodnika kwasu
octowego, dodać 3 – 4 krople roztworu fioletu krystalicznego i miareczkować 0,1 mol/l
9.
Miareczkowanie
w
środowisku niewodnym
55
roztworem kwasu chlorowego(VII) do zmiany zabarwienia z fioletowego na niebieskie.
Wykonać próbę kontrolną.
Zgodnie z powyższą procedurą oznacza się następujące związki:
LEWOMEPROMAZYNY MALEINIAN
O
O
O
C
H
2
-
C
H
3
N
S
N
+
H
CH
3
O
CH
3
CH
3
C
H
3
O
O
-
O
OH
O
O
O
C
H
3
C
H
3
N
S
N
+
H
CH
3
O
CH
3
CH
3
C
H
3
O
OH
O
OH
CH
3
COOH
2
ClO
4
ClO
4
O
O
O
C
H
3
C
H
3
CH
3
COOH
O
O
O
C
H
2
-
C
H
3
N
S
N
+
H
CH
3
O
CH
3
CH
3
C
H
3
N
S
N
+
H
CH
3
O
CH
3
CH
3
C
H
3
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 44,45 mg maleinianu lewo-
mepromazyny.
PERAZYNY DIMALEINIAN
O
O
O
C
H
3
C
H
3
N
S
N
+
N
+
CH
3
H
H
2
2
N
S
N
+
N
+
CH
3
H
H
O
O
-
O
OH
2
O
OH
O
OH
O
O
O
C
H
2
-
C
H
3
2
CH
3
COOH
2
ClO
4
ClO
4
2CH
3
COOH
O
O
O
C
H
3
C
H
3
2
2
2
O
O
O
C
H
2
-
C
H
3
N
S
N
+
N
+
CH
3
H
H
2
N
S
N
+
N
+
CH
3
H
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 28,58 mg dimaleinianu pe-
razyny.
PROCHLORPERAZYNY DIMALEINIAN
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 30 ml 100% roztworu kwasu
octowego, dodać 5 ml roztworu bezwodnika kwasu octowego; po upływie 30 min dodać 3 –
4 krople roztworu 1-naftolobenzeiny i miareczkować 0,1 mol/l roztworem kwasu chlorowe-
go(VII) do zmiany zabarwienia z żółtego na niebieskie. Wykonać próbę kontrolną.
56
Chemiczne metody analizy ilościowej środków leczniczych
CH
3
COOH
2
ClO
4
ClO
4
2CH
3
COOH
2
2
2
O
O
-
O
OH
N
S
N
+
N
+
CH
3
Cl
H
H
N
S
N
+
N
+
CH
3
Cl
H
H
2
O
OH
O
OH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 30,30 mg dimaleinianu pro-
chlorperazyny.
ETAKRYDYNY MLECZAN
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 3 ml 100% roztworu kwasu mrów-
kowego, dodać 30 ml roztworu bezwodnika kwasu octowego i miareczkować 0,1 mol/l roz-
tworem kwasu chlorowego(VII) wobec 3 – 4 kropli roztworu fioletu krystalicznego do zmia-
ny zabarwienia z fioletowego na niebieskie. Wykonać próbę kontrolną.
N
+
CH
3
O
N
H
2
NH
2
H
C
H
3
OH
O
O
-
N
+
CH
3
O
N
H
2
NH
2
H
C
H
3
OH
O
OH
O
O
O
C
H
3
C
H
3
O
O
O
C
H
2
-
C
H
3
CH
3
COOH
2
ClO
4
ClO
4
CH
3
COOH
N
+
CH
3
O
N
H
2
NH
2
H
O
O
O
C
H
2
-
C
H
3
N
+
CH
3
O
N
H
2
NH
2
H
O
O
O
C
H
3
C
H
3
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 34,34 mg mleczanu etakry-
dyny.
9.1.2.2. Oznaczanie soli zasad organicznych z kwasami chlorowcowodoro-
wymi metodą bezpośrednią
W metodzie bezpośredniego oznaczania soli zasad organicznych z kwasami chlorowco-
wodorowymi reakcja przebiega w obecności bezwodnika kwasu octowego. W środowisku
niewodnym bezwodnik kwasu octowego jest dawcą protonu dla zasady (jonu chlorkowego).
Reakcja przebiega według następującego schematu:
R
N
+
H
H
H
Cl
-
O
O
O
C
H
3
C
H
3
O
O
O
C
H
2
-
C
H
3
Cl
H
R
N
+
H
H
H
9.
Miareczkowanie
w
środowisku niewodnym
57
O
O
O
C
H
2
-
C
H
3
R
N
+
H
H
H
CH
3
COOH
2
ClO
4
R
N
+
H
H
H
ClO
4
O
O
O
C
H
3
C
H
3
CH
3
COOH
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 20 ml roztworu bezwodnika kwasu
octowego, dodać 3 - 4 krople roztworu odpowiedniego wskaźnika i miareczkować 0,1 mol/l
roztworem kwasu chlorowego(VII) do zmiany zabarwienia. Wykonać próbę kontrolną.
Zgodnie z powyższą procedurą oznacza się następujące związki:
FLUFENAZYNY DICHLOROWODOREK
Miareczkować wobec zieleni malachitowej do zmiany zabarwienia z zielonego na żółte.
O
O
O
C
H
3
C
H
3
O
O
O
C
H
2
-
C
H
3
Cl
-
Cl
H
N
S
F
F
F
N
+
N
+
OH
H
H
2
2
N
S
F
F
F
N
+
N
+
OH
H
H
2
2
CH
3
COOH
2
ClO
4
ClO
4
2CH
3
COOH
O
O
O
C
H
3
C
H
3
O
O
O
C
H
2
-
C
H
3
N
S
F
F
F
N
+
N
+
OH
H
H
2
2
N
S
F
F
F
N
+
N
+
OH
H
H
2
2
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 25,52 mg dichlorowodorku
flufenazyny.
KLONIDYNY CHLOROWODOREK
Miareczkować wobec zieleni brylantowej do zmiany zabarwienia z zielonego na żółte.
O
O
O
C
H
3
C
H
3
O
O
O
C
H
2
-
C
H
3
Cl
-
Cl
H
Cl
Cl
N
N
N
+
H
H
H
Cl
Cl
N
N
N
+
H
H
H
CH
3
COOH
2
ClO
4
ClO
4
O
O
O
C
H
3
C
H
3
O
O
O
C
H
2
-
C
H
3
Cl
Cl
N
N
N
+
H
H
H
Cl
Cl
N
N
N
+
H
H
H
CH
3
COOH
58
Chemiczne metody analizy ilościowej środków leczniczych
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 26,66 mg chlorowodorku
klonidyny.
PROMETAZYNY CHLOROWODOREK
Miareczkować wobec zieleni malachitowej do zmiany zabarwienia z zielonego na żółte.
O
O
O
C
H
3
C
H
3
O
O
O
C
H
2
-
C
H
3
N
S
N
+
CH
3
CH
3
CH
3
H
Cl
-
N
S
N
+
CH
3
CH
3
CH
3
H
Cl
H
O
O
O
C
H
2
-
C
H
3
N
S
N
+
CH
3
CH
3
CH
3
H
CH
3
COOH
2
ClO
4
N
S
N
+
CH
3
CH
3
CH
3
H
ClO
4
CH
3
COOH
O
O
O
C
H
3
C
H
3
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 32,09 mg chlorowodorku
prometazyny.
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 20 ml 100% roztworu kwasu
octowego, dodać 10 ml roztworu bezwodnika kwasu octowego, 3 - 4 krople roztworu odpo-
wiedniego wskaźnika i miareczkować 0,1 mol/l roztworem kwasu chlorowego(VII) do zmia-
ny zabarwienia. Wykonać próbę kontrolną.
Zgodnie z powyższą procedurą oznacza się następujące związki:
NOKSYPTYLINY CHLOROWODOREK
Miareczkować wobec 1-naftolobenzeiny do zmiany zabarwienia z żółtego na niebieskie.
N
O
N
+
C
H
3
CH
3
H
Cl
-
O
O
O
C
H
3
C
H
3
N
O
N
+
C
H
3
CH
3
H
O
O
O
C
H
2
-
C
H
3
HCl
N
O
N
+
C
H
3
CH
3
H
O
O
O
C
H
2
-
C
H
3
CH
3
COOH
2
ClO
4
N
O
N
+
C
H
3
CH
3
H
CH
3
COOH
ClO
4
O
O
O
C
H
3
C
H
3
9.
Miareczkowanie
w
środowisku niewodnym
59
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 33,09 mg chlorowodorku
noksyptyliny.
KSYLOMETAZOLINY CHLOROWODOREK
Miareczkować wobec fioletu krystalicznego do zmiany zabarwienia z fioletowego na
niebieskie.
N
CH
3
N
+
CH
3
CH
3
C
H
3
CH
3
H
H
Cl
-
O
O
O
C
H
3
C
H
3
N
CH
3
N
+
CH
3
CH
3
C
H
3
CH
3
H
H
O
O
O
C
H
2
-
C
H
3
HCl
N
CH
3
N
+
CH
3
CH
3
C
H
3
CH
3
H
H
CH
3
COOH
2
ClO
4
N
CH
3
N
+
CH
3
CH
3
C
H
3
CH
3
H
H
CH
3
COOH
ClO
4
O
O
O
C
H
2
-
C
H
3
O
O
O
C
H
3
C
H
3
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 28,08 mg chlorowodorku
ksylometazoliny.
9.1.2.3.
Oznaczanie soli zasad organicznych z kwasami chlorowcowodoro-
wymi metodą
pośrednią (Pifera - Wollish’a)
Jony halogenkowe w środowisku kwasu octowego mają tak słaby charakter zasadowy,
że nie są zdolne do przyjęcia od niego protonu. Dlatego nie jest możliwe oznaczanie tych
jonów przez bezpośrednie miareczkowanie kwasu chlorowego(VII). Należy je przeprowa-
dzić w octany działaniem octanu rtęci(II) w 100% kwasie octowym. Zarówno powstający
halogenek rtęci(II), jak i nadmiar octanu rtęci(II) nie przeszkadzają w oznaczaniu, ponieważ
są słabo zdysocjowane. Powstający jon octanowy jako najsilniejsza zasada w środowisku
kwasu octowego może być oznaczony kwasem chlorowym(VII).
Reakcja przebiega według następującego schematu:
R
N
+
H
H
H
(CH
3
COO)
2
Hg
2
2
R
N
+
H
H
H
CH
3
COO
Cl
-
HgCl
2
kwas słaba
kwas silna
(Kw) zasada (Z)
(Kw) zasada (Z)
60
Chemiczne metody analizy ilościowej środków leczniczych
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 10 ml 100% roztworu kwasu
octowego, dodać 5 ml roztworu bezwodnika kwasu octowego, 5 ml roztworu octanu rtęci(II)
i miareczkować 0,1 mol/l roztworem kwasu chlorowego(VII) wobec 3 – 4 kropli roztworu
fioletu krystalicznego do zmiany zabarwienia z fioletowego na niebieskie. Wykonać próbę
kontrolną.
Zgodnie z powyższą procedurą oznacza się następujące związki:
ADYFENINY CHLOROWODOREK
Cl
-
(CH
3
COO)
2
Hg
HgCl
2
CH
3
COO
2
O
O
N
+
CH
3
CH
3
H
2
O
O
N
+
CH
3
CH
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
O
O
N
+
CH
3
CH
3
H
O
O
N
+
CH
3
CH
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 34,79 mg chlorowodorku
adyfeniny.
AMITRYPTYLINY CHLOROWODOREK
N
+
CH
3
CH
3
H
Cl
-
(CH
3
COO)
2
Hg
2
HgCl
2
2
N
+
CH
3
CH
3
H
CH
3
COO
9.
Miareczkowanie
w
środowisku niewodnym
61
N
+
CH
3
CH
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
+
CH
3
CH
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 31,39 mg chlorowodorku
amitryptyliny.
ANTAZOLINY CHLOROWODOREK
N
N
N
+
H
H
Cl
-
(CH
3
COO)
2
Hg
HgCl
2
N
N
N
+
H
H
CH
3
COO
2
2
N
N
N
+
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
N
N
+
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 30,18 mg chlorowodorku
antazoliny.
BENZYDAMINY CHLOROWODOREK
N
N
O
N
+
C
H
3
CH
3
H
Cl
-
(CH
3
COO)
2
Hg
2
HgCl
2
2
N
N
O
N
+
C
H
3
CH
3
H
CH
3
COO
62
Chemiczne metody analizy ilościowej środków leczniczych
N
N
O
N
+
C
H
3
CH
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
N
O
N
+
C
H
3
CH
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 34,59 mg chlorowodorku
benzydaminy.
BROMHEKSYNY CHLOROWODOREK
Br
Br
NH
2
CH
3
N
+
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
Br
Br
NH
2
CH
3
N
+
H
CH
3
COO
Br
Br
NH
2
CH
3
N
+
H
CH
3
COO
CH
3
COOH
2
ClO
4
Br
Br
NH
2
CH
3
N
+
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 41,26 mg chlorowodorku
bromheksyny.
BUPIWAKAINY CHLOROWODOREK
CH
3
CH
3
NH
O
N
+
CH
3
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
CH
3
CH
3
NH
O
N
+
CH
3
H
CH
3
COO
CH
3
CH
3
NH
O
N
+
CH
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
CH
3
CH
3
NH
O
N
+
CH
3
H
ClO
4
2CH
3
COOH
9.
Miareczkowanie
w
środowisku niewodnym
63
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 34,29 mg bezwodnego chlo-
rowodorku bupiwakainy.
CHLORODIAZEPOKSYDU CHLOROWODOREK
N
N
Cl
N
+
CH
3
O
H
H
2
Cl
-
(CH
3
COO)
2
Hg
HgCl
2
2
N
N
Cl
N
+
CH
3
O
H
H
CH
3
COO
N
N
Cl
N
+
CH
3
O
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
N
Cl
N
+
CH
3
O
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 33,62 mg chlorowodorku
chlorodiazepoksydu.
CHLOROPROMAZYNY CHLOROWODOREK
N
S
N
+
CH
3
Cl
CH
3
H
2
Cl
-
(CH
3
COO)
2
Hg
2
N
S
N
+
CH
3
Cl
CH
3
H
CH
3
COO
HgCl
2
64
Chemiczne metody analizy ilościowej środków leczniczych
N
S
N
+
CH
3
Cl
CH
3
H
CH
3
COOH
2
ClO
4
CH
3
COO
N
S
N
+
CH
3
Cl
CH
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 35,53 mg chlorowodorku
chloropromazyny.
CHLOROPROTYKSENU CHLOROWODOREK
S
N
+
CH
3
Cl
CH
3
H
Cl
-
2
(CH
3
COO)
2
Hg
2
S
N
+
CH
3
Cl
CH
3
H
CH
3
COO
HgCl
2
S
N
+
CH
3
Cl
CH
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
S
N
+
CH
3
Cl
CH
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 35,23 mg chlorowodorku
chloroprotyksenu.
DEZYPRAMINY CHLOROWODOREK
N
N
+
CH
3
H
H
Cl
-
2
(CH
3
COO)
2
Hg
N
N
+
CH
3
H
H
HgCl
2
2
CH
3
COO
9.
Miareczkowanie
w
środowisku niewodnym
65
N
N
+
CH
3
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
N
+
CH
3
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 30,28 mg chlorowodorku
dezypraminy.
DIFENHYDRAMINY CHLOROWODOREK
O
N
+
CH
3
CH
3
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
O
N
+
CH
3
CH
3
H
CH
3
COO
O
N
+
CH
3
CH
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
O
N
+
CH
3
CH
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 29,18 mg chlorowodorku
difenhydraminy.
DILTIAZEMU CHLOROWODOREK
Cl
-
S
N
O
O
O
C
H
3
N
+
CH
3
C
H
3
O
C
H
3
H
2
(CH
3
COO)
2
Hg
2
S
N
O
O
O
C
H
3
N
+
CH
3
C
H
3
O
C
H
3
H
CH
3
COO
HgCl
2
S
N
O
O
O
C
H
3
N
+
CH
3
C
H
3
O
C
H
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
S
N
O
O
O
C
H
3
N
+
CH
3
C
H
3
O
C
H
3
H
2CH
3
COOH
ClO
4
66
Chemiczne metody analizy ilościowej środków leczniczych
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 45,10 mg chlorowodorku
diltiazemu.
DROTAWERYNY CHLOROWODOREK
N
+
O
O
C
H
3
C
H
3
O
O
CH
3
CH
3
H
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
N
+
O
O
C
H
3
C
H
3
O
O
CH
3
CH
3
H
H
CH
3
COO
N
+
O
O
C
H
3
C
H
3
O
O
CH
3
CH
3
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
+
O
O
C
H
3
C
H
3
O
O
CH
3
CH
3
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 43,40 mg chlorowodorku
drotaweryny.
EFEDRYNY CHLOROWODOREK
N
+
CH
3
OH
CH
3
H
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
N
+
CH
3
OH
CH
3
H
H
CH
3
COO
N
+
CH
3
OH
CH
3
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
+
CH
3
OH
CH
3
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 20,17 mg chlorowodorku
efedryny.
ETAMBUTOLU DICHLOROWODOREK
2
N
+
N
+
O
H
C
H
3
OH
CH
3
H
H
H
H
Cl
-
(CH
3
COO)
2
Hg
HgCl
2
N
+
N
+
O
H
C
H
3
OH
CH
3
H
H
H
H
CH
3
COO
2
9.
Miareczkowanie
w
środowisku niewodnym
67
N
+
N
+
O
H
C
H
3
OH
CH
3
H
H
H
H
CH
3
COO
2
CH
3
COOH
2
ClO
4
2
N
+
N
+
O
H
C
H
3
OH
CH
3
H
H
H
H
2
ClO
4
4CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 13,86 mg dichlorowodorku
etambutolu.
ETYLOMORFINY CHLOROWODOREK
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
O
N
+
CH
3
OH
O
C
H
3
H
CH
3
COO
O
N
+
CH
3
OH
O
C
H
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
O
N
+
CH
3
OH
O
C
H
3
H
ClO
4
2CH
3
COOH
O
N
+
CH
3
OH
O
C
H
3
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 34,99 mg bezwodnego chlo-
rowodorku etylomorfiny.
FENFORMINY CHLOROWODOREK
2
2
(CH
3
COO)
2
Hg
CH
3
COO
HgCl
2
NH
NH
NH
3
+
NH
NH
Cl
-
NH
NH
NH
3
+
NH
NH
CH
3
COOH
2
ClO
4
ClO
4
2CH
3
COOH
CH
3
COO
NH
NH
NH
3
+
NH
NH
NH
NH
NH
3
+
NH
NH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 24,18 mg chlorowodorku
fenforminy.
68
Chemiczne metody analizy ilościowej środków leczniczych
FLUFENAZYNY DICHLOROWODOREK
Cl
-
N
S
F
F
F
N
+
N
+
OH
H
H
2
(CH
3
COO)
2
Hg
N
S
F
F
F
N
+
N
+
OH
H
H
HgCl
2
CH
3
COO
2
N
S
F
F
F
N
+
N
+
OH
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
2
2
N
S
F
F
F
N
+
N
+
OH
H
H
2
ClO
4
4CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 25,52 mg dichlorowodorku
flufenazyny.
FLUOKSETYNY CHLOROWODOREK
F
F
F
O
N
+
CH
3
H
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
F
F
F
O
N
+
CH
3
H
H
CH
3
COO
F
F
F
O
N
+
CH
3
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
F
F
F
O
N
+
CH
3
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 34,58 mg chlorowodorku
fluoksetyny.
HOMATROPINY BROMOWODOREK
N
+
C
H
3
O
O
OH
H
Br
-
2
(CH
3
COO)
2
Hg
HgBr
2
2
N
+
C
H
3
O
O
OH
H
CH
3
COO
9.
Miareczkowanie
w
środowisku niewodnym
69
N
+
C
H
3
O
O
OH
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
+
C
H
3
O
O
OH
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 35,63 mg bromowodorku
homatropiny.
IMIPRAMINY CHLOROWODOREK
N
N
+
C
H
3
CH
3
H
Cl
-
2
(CH
3
COO)
2
Hg
N
N
+
C
H
3
CH
3
H
HgCl
2
2
CH
3
COO
N
N
+
C
H
3
CH
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
N
+
C
H
3
CH
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 31,69 mg chlorowodorku
imipraminy.
KLONIDYNY CHLOROWODOREK
Cl
-
Cl
Cl
N
N
N
+
H
H
H
2
(CH
3
COO)
2
Hg
2
Cl
Cl
N
N
N
+
H
H
H
CH
3
COO
HgCl
2
Cl
Cl
N
N
N
+
H
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
Cl
Cl
N
N
N
+
H
H
H
2CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 26,66 mg chlorowodorku
klonidyny.
70
Chemiczne metody analizy ilościowej środków leczniczych
LIDOKAINY CHLOROWODOREK
O
N
CH
3
N
+
CH
3
CH
3
CH
3
H
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
O
N
CH
3
N
+
CH
3
CH
3
CH
3
H
H
CH
3
COO
O
N
CH
3
N
+
CH
3
CH
3
CH
3
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
O
N
CH
3
N
+
CH
3
CH
3
CH
3
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 27,08 mg bezwodnego chlo-
rowodorku lidokainy.
METOKLOPRAMIDU CHLOROWODOREK
Cl
N
H
2
N
CH
3
O
N
+
CH
3
CH
3
O
H
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
Cl
N
H
2
N
CH
3
O
N
+
CH
3
CH
3
O
H
H
CH
3
COO
Cl
N
H
2
N
CH
3
O
N
+
CH
3
CH
3
O
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
Cl
N
H
2
N
CH
3
O
N
+
CH
3
CH
3
O
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 33,63 mg bezwodnego chlo-
rowodorku metoklopramidu.
MIANSERYNY CHLOROWODOREK
N
N
+
C
H
3
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
N
N
+
C
H
3
H
CH
3
COO
9.
Miareczkowanie
w
środowisku niewodnym
71
N
N
+
C
H
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
N
+
C
H
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 30,08 mg chlorowodorku
mianseryny.
MORFINY CHLOROWODOREK
O
N
+
C
H
3
OH
O
H
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
O
N
+
C
H
3
OH
O
H
H
CH
3
COO
O
N
+
C
H
3
OH
O
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
O
N
+
C
H
3
OH
O
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 32,18 mg bezwodnego chlo-
rowodorku morfiny.
NOKSYPTYLINY CHLOROWODOREK
N
O
N
+
CH
3
C
H
3
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
CH
3
COO
N
O
N
+
CH
3
C
H
3
H
72
Chemiczne metody analizy ilościowej środków leczniczych
CH
3
COO
CH
3
COOH
2
ClO
4
ClO
4
2CH
3
COOH
N
O
N
+
CH
3
C
H
3
H
N
O
N
+
CH
3
C
H
3
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 33,09 mg chlorowodorku
noksyptyliny.
OKSPRENOLOLU CHLOROWODOREK
O
O
CH
2
CH
3
N
+
CH
3
OH
H
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
O
O
CH
2
CH
3
N
+
CH
3
OH
H
H
CH
3
COO
O
O
CH
2
CH
3
N
+
CH
3
OH
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
O
O
CH
2
CH
3
N
+
CH
3
OH
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 30,18 mg chlorowodorku
oksprenololu.
OPIPRAMOLU DICHLOROWODOREK
N
N
+
N
+
OH
H
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
N
N
+
N
+
OH
H
H
CH
3
COO
2
CH
3
COO
2
CH
3
COOH
2
ClO
4
2
N
N
+
N
+
OH
H
H
N
N
+
N
+
OH
H
H
2 ClO
4
4CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 21,82 mg dichlorowodorku
opipramolu.
9.
Miareczkowanie
w
środowisku niewodnym
73
PAPAWERYNY CHLOROWODOREK
N
+
O
CH
3
CH
3
O
O
C
H
3
O
C
H
3
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
N
+
O
CH
3
CH
3
O
O
C
H
3
O
C
H
3
H
CH
3
COO
N
+
O
CH
3
CH
3
O
O
C
H
3
O
C
H
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
+
O
CH
3
CH
3
O
O
C
H
3
O
C
H
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 37,59 mg chlorowodorku
papaweryny.
PETYDYNY CHLOROWODOREK
N
+
CH
3
O
O
CH
3
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
N
+
CH
3
O
O
CH
3
H
CH
3
COO
N
+
CH
3
O
O
CH
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
+
CH
3
O
O
CH
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 28,38 mg chlorowodorku
petydyny.
PILOKARPINY CHLOROWODOREK
N
+
N
O
C
H
3
CH
3
O
H
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
2
N
+
N
O
C
H
3
CH
3
O
H
CH
3
COO
74
Chemiczne metody analizy ilościowej środków leczniczych
N
+
N
O
C
H
3
CH
3
O
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
+
N
O
C
H
3
CH
3
O
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 24,47 mg chlorowodorku
pilokarpiny.
PIRYDOKSYNY CHLOROWODOREK
N
+
C
H
3
O
H
OH
OH
H
2
Cl
-
(CH
3
COO)
2
Hg
HgCl
2
2
N
+
C
H
3
O
H
OH
OH
H
CH
3
COO
N
+
C
H
3
O
H
OH
OH
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
+
C
H
3
O
H
OH
OH
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 20,56 mg chlorowodorku
pirydoksyny.
PROKAINAMIDU CHLOROWODOREK
N
H
2
N
O
N
+
CH
3
CH
3
H
H
2
Cl
-
(CH
3
COO)
2
Hg
HgCl
2
2
N
H
2
N
O
N
+
CH
3
CH
3
H
H
CH
3
COO
N
H
2
N
O
N
+
CH
3
CH
3
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
H
2
N
O
N
+
CH
3
CH
3
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 27,18 mg chlorowodorku
prokainamidu.
9.
Miareczkowanie
w
środowisku niewodnym
75
PROKAINY CHLOROWODOREK
N
H
2
O
O
N
+
CH
3
CH
3
H
2
Cl
-
(CH
3
COO)
2
Hg
HgCl
2
2
N
H
2
O
O
N
+
CH
3
CH
3
H
CH
3
COO
N
H
2
O
O
N
+
CH
3
CH
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
H
2
O
O
N
+
CH
3
CH
3
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 27,28 mg chlorowodorku
prokainy.
PROMAZYNY CHLOROWODOREK
N
S
N
+
CH
3
H
CH
3
Cl
-
2
2
(CH
3
COO)
2
Hg
N
S
N
+
CH
3
H
CH
3
CH
3
COO
HgCl
2
N
S
N
+
CH
3
H
CH
3
CH
3
COO
CH
3
COOH
2
ClO
4
N
S
N
+
CH
3
H
CH
3
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 32,09 mg chlorowodorku
promazyny.
PROMETAZYNY CHLOROWODOREK
N
S
N
+
CH
3
CH
3
CH
3
H
Cl
-
2
(CH
3
COO)
2
Hg
2
N
S
N
+
CH
3
CH
3
CH
3
H
CH
3
COO
HgCl
2
76
Chemiczne metody analizy ilościowej środków leczniczych
N
S
N
+
CH
3
CH
3
CH
3
H
CH
3
COO
CH
3
COOH
2
ClO
4
N
S
N
+
CH
3
CH
3
CH
3
H
2CH
3
COOH
ClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 32,09 mg chlorowodorku
prometazyny.
PROPRANOLOLU CHLOROWODOREK
O
N
+
CH
3
CH
3
OH
H
H
2
Cl
-
(CH
3
COO)
2
Hg
HgCl
2
2
O
N
+
CH
3
CH
3
OH
H
H
CH
3
COO
O
N
+
CH
3
CH
3
OH
H
H
CH
3
COO
CH
3
COOH
2
ClO
4
O
N
+
CH
3
CH
3
OH
H
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 29,58 mg chlorowodorku
propranololu.
PRYDYNOLU CHLOROWODOREK
O
H
N
+
H
2
Cl
-
(CH
3
COO)
2
Hg
HgCl
2
2
O
H
N
+
H
CH
3
COO
O
H
N
+
H
CH
3
COO
CH
3
COOH
2
ClO
4
O
H
N
+
H
ClO
4
2CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 33,19 mg chlorowodorku
prydynolu.
9.
Miareczkowanie
w
środowisku niewodnym
77
TETRAKAINY CHLOROWODOREK
C
H
3
N
O
CH
3
N
+
CH
3
O
H
H
2
Cl
-
(CH
3
COO)
2
Hg
CH
3
COO
HgCl
2
2
C
H
3
N
O
CH
3
N
+
CH
3
O
H
H
CH
3
COOH
2
ClO
4
ClO
4
2CH
3
COOH
CH
3
COO
C
H
3
N
O
CH
3
N
+
CH
3
O
H
H
C
H
3
N
O
CH
3
N
+
CH
3
O
H
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 30,08 mg chlorowodorku te-
trakainy.
TRIFLUOPERAZYNY DICHLOROWODOREK
Cl
-
2
(CH
3
COO)
2
Hg
HgCl
2
CH
3
COO
2
N
S
N
+
N
+
CH
3
F
F
F
H
H
N
S
N
+
N
+
CH
3
F
F
F
H
H
CH
3
COOH
2
ClO
4
2
2
ClO
4
4CH
3
COOH
CH
3
COO
2
N
S
N
+
N
+
CH
3
F
F
F
H
H
N
S
N
+
N
+
CH
3
F
F
F
H
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 24,02 mg dichlorowodorku
trifluoperazyny.
TRIHEKSYFENIDYLU CHLOROWODOREK
CH
3
COO
HgCl
2
2
2
Cl
-
(CH
3
COO)
2
Hg
N
+
OH
H
N
+
OH
H
78
Chemiczne metody analizy ilościowej środków leczniczych
CH
3
COOH
2
ClO
4
ClO
4
2CH
3
COOH
CH
3
COO
N
+
OH
H
N
+
OH
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 33,79 mg chlorowodorku
triheksyfenidylu.
TYMAZOLINY CHLOROWODOREK
CH
3
COO
HgCl
2
2
2
Cl
-
(CH
3
COO)
2
Hg
CH
3
O
CH
3
C
H
3
N
N
+
H
H
CH
3
O
CH
3
C
H
3
N
N
+
H
H
CH
3
COOH
2
ClO
4
ClO
4
2CH
3
COOH
CH
3
COO
CH
3
O
CH
3
C
H
3
N
N
+
H
H
CH
3
O
CH
3
C
H
3
N
N
+
H
H
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 26,88 mg chlorowodorku
tymazoliny.
9.1.2.4. Oznaczanie soli silnych zasad nieorganicznych ze słabymi kwasa-
mi organicznymi
Do tej grupy związków należą sole sodowe i potasowe słabych kwasów organicznych
(octowego, salicylowego, benzoesowego i innych) oraz sole enoli i imidów.
Reakcja oznaczania tych związków przebiega według schematu:
O
O
-
R
Me
O
OH
R
MeClO
4
CH
3
COOH
+
CH
3
COOH
2
ClO
4
Zawartość
Odważyć dokładnie ok. 0,3 g substancji, rozpuścić w 20 ml 100% roztworu kwasu
octowego i miareczkować 0,1 mol/l roztworem kwasu chlorowego(VII) wobec 3 – 4 kropli
9.
Miareczkowanie
w
środowisku niewodnym
79
roztworu fioletu krystalicznego do zmiany zabarwienia z fioletowego na niebieskie. Wyko-
nać próbę kontrolną.
Zgodnie z powyższą procedurą oznacza się następujące związki:
OCTAN POTASU
C
H
3
O
O
-
K
+
CH
3
COOH
2
ClO
4
C
H
3
O
OH
CH
3
COOH
KClO
4
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 9,81 mg octanu potasu.
SALICYLAN SODU
OH
O
O
-
Na
+
CH
3
COOH
2
ClO
4
CH
3
COOH
NaClO
4
OH
O
OH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 16,01 mg salicylanu sodu.
BENZOESAN SODU
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 10 ml 100% roztworu kwasu
octowego, dodać 10 ml roztworu bezwodnika kwasu octowego, 3 - 4 krople roztworu fioletu
krystalicznego i miareczkować 0,1 mol/l roztworem kwasu chlorowego(VII) do zmiany
zabarwienia z fioletowego na niebieskie. Wykonać próbę kontrolną.
O
O
-
Na
+
CH
3
COOH
2
ClO
4
O
OH
NaClO
4
CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 14,41 mg benzoesanu sodu.
Zawartość
Odważyć dokładnie ok. 0,2 g substancji, rozpuścić w 30 ml 100% roztworu kwasu
octowego, dodać 5 ml roztworu bezwodnika kwasu octowego; po upływie 30 min dodać 3 –
4 krople roztworu 1-naftolobenzeiny i miareczkować 0,1 mol/l roztworem kwasu chlorowe-
go(VII) do zmiany zabarwienia z żółtego na zielone. Wykonać próbę kontrolną.
Zgodnie z powyższą procedurą oznacza się następujące związki:
80
Chemiczne metody analizy ilościowej środków leczniczych
CYTRYNIAN SODU
O
O
-
O
O
-
O
O
-
OH
CH
3
COOH
O
OH
O
OH
O
OH
OH
3
Na
+
CH
3
COOH
2
ClO
4
NaClO
4
3
3
3
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 86,03 mg bezwodnego cy-
trynianu sodu.
OCTAN SODU
Na
+
O
O
-
C
H
3
CH
3
COOH
2
ClO
4
O
OH
C
H
3
NaClO
4
CH
3
COOH
1 ml 0,1 mol/l roztworu kwasu chlorowego(VII) odpowiada 8,21 mg bezwodnego octa-
nu sodu.
9.2. Alkalimetria
Alkalimetrycznie w środowisku niewodnym oznacza się substancje o bardzo słabym
charakterze kwasowym:
• enole
• imidy
• fenole
• sulfonamidy
Rozpuszczalniki:
Do oznaczania alkalimetrycznego używane są rozpuszczalniki protonofilowe (zasado-
we), np.: etylenodiamina, 1–butyloamina, pirydyna, dimetyloformamid (DMF) lub aprotoli-
tyczne (obojętne), np.: dioksan, toluen.
Rozpuszczalniki protonofilowe o dużym powinowactwie do protonu stosuje się do ozna-
czania kwasów, gdyż biorąc udział w reakcji zobojętniania zwiększają ich moc.
W przypadku rozpuszczania oznaczanego kwasu (AH) w rozpuszczalniku (S) powstaje
sprzężona zasada tego kwasu (A
-
) i solwatowany proton (SH
+
). W związku z tym moc roz-
puszczonego kwasu wzrasta, a powstający kation SH
+
reaguje z zasadą anionową, co ilustru-
je schemat:
AH
S
SH
A
+
-
CH
3
OH
ANa
CH
3
ONa
SH
A
+
-
S
Wskaźniki:
Najczęściej stosuje się 1% roztwór błękitu tymolowego w metanolu lub 1% roztwór fio-
letu azowego w benzenie.
9.
Miareczkowanie
w
środowisku niewodnym
81
Płyny mianowane:
Płyny mianowane stosowane w alkalimetrii to:
• 0,1 mol/l roztwór metanolanu sodu, potasu lub litu
• wodorotlenki (np. tetrabutyloamoniowy, tetraetyloamoniowy)
Oznaczanie powinno być przeprowadzone w atmosferze azotu wolnego od obecności di-
tlenku węgla, ponieważ CO
2
ma wpływ na obniżenie stężenia metanolanu sodowego na
skutek powstania węglanu metylosodowego.
ACETAZOLAMID
Zawartość
Odważyć dokładnie ok. 0,1 g substancji, rozpuścić w 30 ml roztworu 1-butyloaminy,
dodać 3 – 4 krople roztworu błękitu tymolowego i miareczkować 0,1 mol/l roztworem meta-
nolanu sodu do zmiany zabarwienia z żółtego na niebieskie. Wykonać próbę kontrolną.
S
N
N
S
O
O
NH
2
O
NH
C
H
3
2
2
CH
3
NH
2
CH
3
NH
3
+
S
N
N
S
O
O
-
NH
O
-
N
C
H
3
CH
3
ONa
Na
+
2CH
3
OH
2
2
CH
3
NH
2
2
2
CH
3
NH
3
+
S
N
N
S
O
O
-
NH
O
-
N
C
H
3
S
N
N
S
O
O
-
NH
O
-
N
C
H
3
1 ml 0,1 mol/l roztworu metanolanu sodu odpowiada 11,11 mg acetazolamidu.
Zawartość
Odważyć dokładnie ok. 0,1 g substancji, rozpuścić w 20 ml metanolu, dodać 3 – 4 kro-
ple roztworu błękitu tymolowego i miareczkować 0,1 mol/l roztworem metanolanu sodu do
zmiany zabarwienia z czerwonego na niebieskie. Wykonać próbę kontrolną.
Zgodnie z powyższą procedurą oznacza się następujące związki:
FENYTOINA
N
H
N
H
O
O
CH
3
OH
N
H
N
O
O
-
C
H
3
O
+
H
H
N
H
N
O
O
-
C
H
3
O
+
H
H
CH
3
ONa
N
H
N
O
O
-
Na
+
2CH
3
OH
82
Chemiczne metody analizy ilościowej środków leczniczych
1 ml 0,1 mol/l roztworu metanolanu sodu odpowiada 25,23 mg fenytoiny.
SALICYLAMID
OH
O
NH
2
CH
3
OH
C
H
3
O
+
H
H
O
-
O
NH
2
C
H
3
O
+
H
H
O
-
O
NH
2
CH
3
ONa
Na
+
2CH
3
OH
O
-
O
NH
2
1 ml 0,1 mol/l roztworu metanolanu sodu odpowiada 13,71 mg salicylamidu.
HYDROCHLOROTIAZYD
Zawartość
Odważyć dokładnie ok. 0,15 g substancji, rozpuścić w 30 ml roztworu 1–butyloaminy,
przez 10 min przepuszczać azot wolny od ditlenku węgla; nie przerywając przepływu azotu
dodać 3 – 4 krople roztworu fioletu azowego, miareczkować 0,1 mol/l roztworem metanola-
nu sodu do zmiany zabarwienia z czerwonego na niebieskie. Wykonać próbę kontrolną.
NH
N
H
S
O
O
S
O
O
N
H
2
Cl
N
N
H
S
O
-
O
S
O
-
O
N
H
Cl
2
2
CH
3
NH
2
CH
3
NH
3
+
N
N
H
S
O
-
O
S
O
-
O
N
H
Cl
2
CH
3
ONa
Na
+
2CH
3
OH
2
N
N
H
S
O
-
O
S
O
-
O
N
H
Cl
2
CH
3
NH
3
+
CH
3
NH
2
2
1 ml 0,1 mol/l roztworu metanolanu sodu odpowiada 14,88 mg hydrochlorotiazydu.

83
SKOROWIDZ
A
acetazolamid, 8, 81
adyfeniny chlorowodorek, 60
aminobenzoesan etylu, 23, 25
aminofenazon, 46
amitryptyliny chlorowodorek, 60
antazoliny chlorowodorek, 19, 61
azotan srebra, 22
azotyn sodu, 42
B
baklofen, 46
barbital, 9
benzoesan sodu, 79
benzydaminy chlorowodorek, 61
bizmutu azotan zasadowy, 35
bizmutu galusan zasadowy, 35
bromek amonu, 16, 18
bromek potasu, 42
bromek sodu, 19
bromek wapnia, 37
bromheksyny chlorowodorek, 62
bupiwakainy chlorowodorek, 62
C
chlorchinaldol, 47
chlorek amonu, 16, 17
chlorek cynku, 35
chlorek magnezu, 36
chlorek potasu, 18
chlorek sodu, 18
chlorek wapnia, 37
chlorodiazepoksyd, 47
chlorodiazepoksydu chlorowodorek, 63
chloropromazyny chlorowodorek, 19, 63
chloropropamid, 9
chloroprotyksenu chlorowodorek, 19, 64
cymetydyna, 47
cynnaryzyna, 47
cytrynian sodu, 80
D
dezypraminy chlorowodorek, 64
difenhydraminy chlorowodorek, 65
diltiazemu chlorowodorek, 19, 65
dimenhydramina
(8-chloroteofilina), 21
(difenhydramina), 49
diwodorofosforan sodu, 12
drotaweryny chlorowodorek, 66
E
efedryny chlorowodorek, 20, 66
epinefryna, 48
epinefryny wodorowinian, 53
etakrydyny mleczan, 56
etambutolu dichlorowodorek, 66
etylomorfiny chlorowodorek, 67
F
fenforminy chlorowodorek, 20, 67
fenobarbital, 9
fenol, 26
fenylefryny chlorodoworek, 26
fenylobutazon, 14
fenytoina, 81
flufenazyny dichlorowodorek, 20, 57, 68
fluoksetyny chlorowodorek, 20, 68
fosforan glinu, 38
furosemid, 9
G
glibenklamid, 10
glukonian wapnia, 37, 43
glukonian żelaza, 30
H
haloperidol, 48
homatropiny bromowodorek, 68
hydrochlorotiazyd, 10, 82
I
ibuprofen, 10
imipraminy chlorowodorek, 20, 69

84
Chemiczne metody analizy ilościowej środków leczniczych
J
jod, 31
jodek potasu, 19, 33
jodek sodu, 19, 33
K
ketoprofen, 10
klometiazolu edysylan, 12
klonidyny chlorowodorek, 57, 69
klozapina, 48
kodeiny fosforan, 53
kofeina, 51
ksylometazoliny chlorowodorek, 59
kwas acetylosalicylowy, 7, 11
kwas askorbowy, 31
kwas benzoesowy, 11
kwas borowy, 13
kwas cytrynowy, 12
kwas mefenamowy, 11
kwas mlekowy, 7
kwas mrówkowy, 13
kwas salicylowy, 11
L
lewomepromazyny maleinian, 55
lidokaina, 48
lidokainy chlorowodorek, 20, 70
loratadyna, 49
M
metamizol sodowy, 31
metoklopramidu chlorowodorek, 70
metronidazol, 49
mianseryny chlorowodorek, 20, 70
mikonazolu azotan, 53
mleczan wapnia, 37, 43
morfiny chlorowodorek, 71
morfiny siarczan, 54
N
nadmanganian potasu, 32
nadtlenek wodoru, 43
nafazoliny azotan, 54
niketamid, 50
nikotynamid, 50
nikotynylometyloamid, 50
noksyptyliny chlorowodorek, 58, 71
norepinefryny wodorowinian, 54
O
octan potasu, 79
octan sodu, 80
oksprenololu chlorowodorek, 72
opipramolu dichlorowodorek, 20, 72
orcyprenaliny siarczan, 54
P
pantotenian wapnia, 37, 43
papaweryny chlorowodorek, 20, 73
paracetamol, 30
perazyny dimaleinian, 55
petydyny chlorowodorek, 73
pilokarpiny chlorowodorek, 73
pirydoksyny chlorowodorek, 74
prochlorperazyny dimaleinian, 55
prokainamidu chlorowodorek, 20, 74
prokainy chlorowodorek, 21, 26, 75
promazyny chlorowodorek, 21, 75
prometazyny chlorowodorek, 21, 58, 75
propranololu chlorowodorek, 76
proteinian srebra, 22
prydynolu chlorowodorek, 76
R
rezorcynol, 26
S
salicylamid, 82
salicylan fenylu, 29
salicylan metylu, 8
salicylan sodu, 79
siarczan cynku, 36
siarczan glinowo–potasowy, 39
siarczan glinu, 40
siarczan magnezu, 36
sulfacetamid sodowy, 24, 27
sulfadymidyna, 27
sulfafurazol, 27
sulfaguanidyna, 27
sulfakarbamid, 24
sulfamerazyna, 28
sulfametoksazol, 28
sulfaproksylina, 28
sulfatiazol, 28

Skorowidz
85
T
temazepam, 50
teobromina, 14
teofilina, 15
tetraboran sodu, 14
tetrakainy chlorowodorek, 77
tiorydazyny chlorowodorek, 21
tiosiarczan sodu, 32
tlenek cynku, 35
tlenek magnezu, 36
tlenek wapnia, 38
tolbutamid, 12
trifluoperazyny dichlorowodorek, 77
triheksyfenidylu chlorowodorek, 77
tymazoliny chlorowodorek, 78
tymol, 29
tynidazol, 51
W
węglan litu, 6
węglan magnezu, 37
węglan wapnia, 38
wodorofosforan wapnia, 38
wodorotlenek glinu, 40
wodorowęglan sodu, 6
Z
zopiklon, 51
Wyszukiwarka
Podobne podstrony:
J Minczewski,Z Marczenko T2 Chemia Analityczna Chemiczne Metody Analizy Ilościowej
Cygański A Chemiczne Metody Analizy Ilościowej
J Minczewski,Z Marczenko T2 Chemia Analityczna Chemiczne Metody Analizy Ilościowej
Cz 11 Instrumentalne metody analizy ilościowej Wysokosprawna chromatografia cieczowa (HPLC)
Cz 10 Instrumentalne metody analizy ilościowej Metody chromatograficzne
Metody analizy ilościowej
13. Miareczkowanie amperometryczne, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metod
Obliczenia statystyczne w chemicznej analizie ilościowej
Instrumentalne metody analizy chemicznej egzamin
metody analizy danych dane ilosciowe
Cz 4 Instrumentalne metody analizy chemicznej Spektrometria w podczerwieni
Statystyczne metody analizy?nych Klasyfikacja województw według ilości hoteli
03. Roztwarzanie materiałów w kwasach i przez stapianie, Technologia Chemiczna, Rok III, Semestr II,
04. Metody rozdzielania, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metody analizy,
02. Pobieranie prób i kalibracja sprzętu analitycznego, Technologia Chemiczna, Rok III, Semestr II,
więcej podobnych podstron