
1
ALKACYMETRIA
Acydymetryczne oznaczanie wodorow
ęglanu sodu
Zasada oznaczenia
Acydymetryczne oznaczanie wodorowęglanu sodu za pomocą kwasu solnego jest
przykładem miareczkowania słabej zasady mocnym kwasem:
NaHCO
3
+ HCl
→
NaCl + H
2
O + CO
2
Wskaźnikiem w oznaczeniu może być oranż metylowy lub fenoloftaleina. W
przypadku stosowania oranżu metylowego roztwór wodorowęglanu sodu należy
miareczkować mianowanym roztworem kwasu solnego do pierwszej zmiany barwy z żółtej
na cebulkową. Jeżeli zastosuje się fenoloftaleinę jako wskaźnik, miareczkowanie
mianowanym roztworem kwasu solnego należy prowadzić do zupełnego odbarwienia
roztworu.
Odczynniki i roztwory
Sprz
ęt i aparatura
badany roztwór wodorowęglanu sodu
stężony kwas solny, cz.d.a.
boraks – Na
2
B
4
O
7
×10H
2
O, cz.d.a.
biureta – 25 ml, kolba miarowa – 100 ml,
pipeta jednomiarowa – 25 ml, cylinder
miarowy – 25 ml, kolba stożkowa – 250 ml,
naczyńko wagowe
Przygotowanie roztworu kwasu solnego o stężeniu około 0,1 mol/l. Odmierzyć cylindrem
miarowym 8-9 ml stężonego HCl o gęstości d=1,19 g/ml i rozcieńczyć wodą destylowaną do
objętości 1 l.
Nastawianie miana titrantu – roztworu kwasu solnego na odważkę boraksu,
Na
2
B
4
O
7
×10H
2
O. Podczas miareczkowania roztworu boraksu kwasem solnym zachodzi
reakcja:
Na
2
B
4
O
7
+ 2HCl + 5H
2
O
→
4H
3
BO
3
+ 2NaCl
W celu nastawienia miana roztworu kwasu solnego na boraks odważyć na wadze
analitycznej (w naczyńku wagowym) 0,24-0,25 g boraksu. Następnie odważkę boraksu
przenieść ilościowo do kolby stożkowej o pojemności 250 ml i dodać 70 ml wody
destylowanej, po czy, w obecności 1-2 kropel oranżu metylowego miareczkować uprzednio
sporządzonym roztworem kwasu solnego do momentu wystąpienia pierwszej zmiany z barwy
żółtej na cebulkową. Obliczyć stężenie molowe [mol/l] kwasu solnego wg wzoru:

2
c=
m
Mfv
gdzie: m – odważka boraksu [g], M – masa molowa boraksu [g/mol], f – współczynnik
równoważności boraksu, v – objętość roztworu kwasu solnego zużytego do miareczkowania
roztworu boraksu [l]
Wykonanie oznaczenia
Próbkę roztworu wodorowęglanu sodu przenieść ilościowo do kolby miarowej o
pojemności 100 ml i uzupełnić wodą destylowaną do kreski. Następnie 25 ml tego roztworu
przenieść pipetą jednomiarową do kolby stożkowej, rozcieńczyć wodą destylowaną do
objętości około 50 ml, po czym dodać 1-2 krople oranżu metylowego i miareczkować
mianowanym roztworem HCl do chwili zmiany zabarwienia z żółtego na cebulkowe.
Obliczyć zawartość wodorowęglanu sodu w próbce według wzoru:
x = c v M W
gdzie: c – stężenie molowe roztworu kwasu solnego [mol/l], v – objętość roztworu kwasu
solnego zużytego do miareczkowania roztworu wodorowęglanu sodu [l], M – masa molowa
wodorowęglanu sodu [g/mol], W – współmierność kolby i pipety
Instrukcja została opracowana na podstawie skryptu: D. Rajzer, L. Konieczna, A. Plenis, E.
Dziurkowska, „Chemiczne metody analizy ilościowej środków leczniczych”, Akademia
Medyczna w Gdańsku 2008.
3
ALKACYMETRIA
ĆWICZENIE
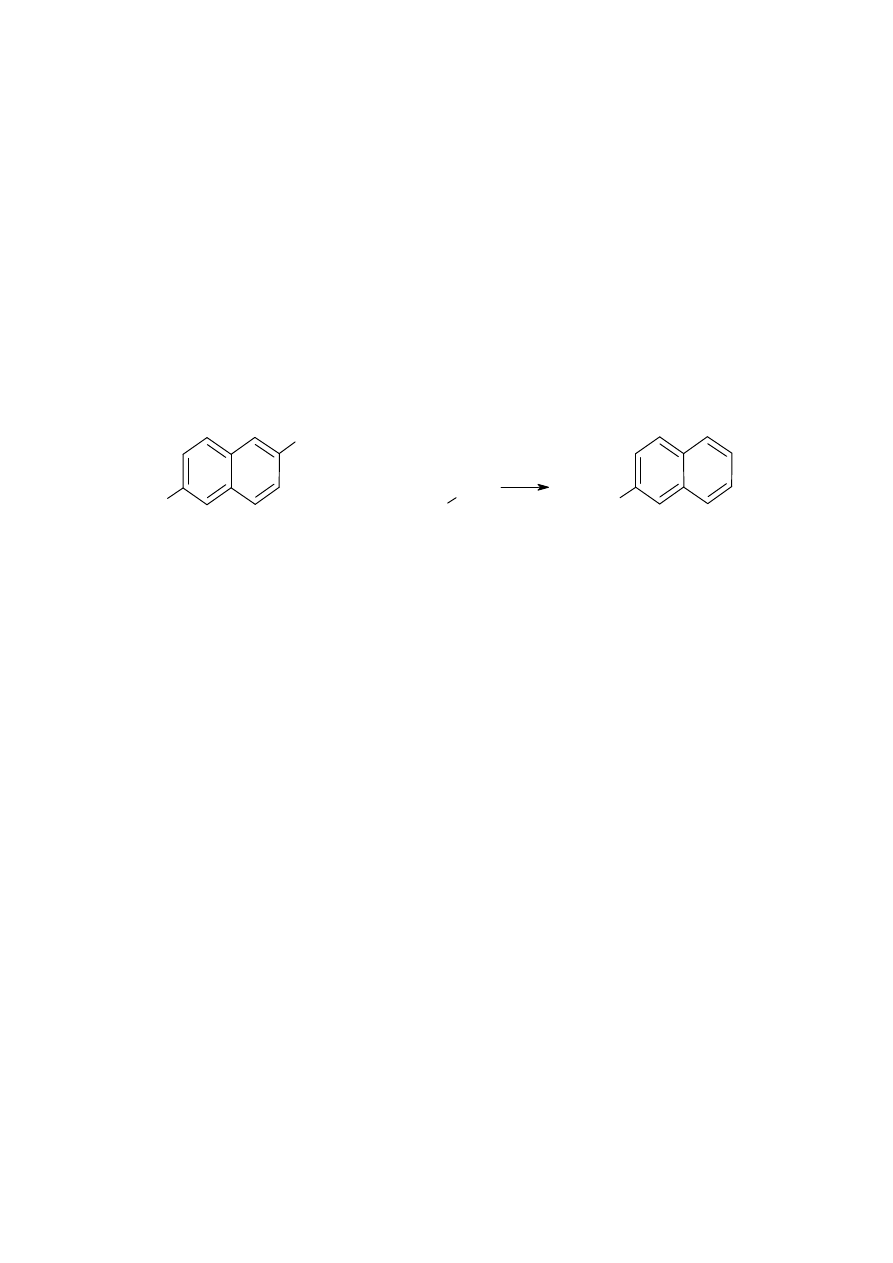
Alkalimetryczne oznaczanie naproksenu
Zasada oznaczania
Alkalimetryczne oznaczanie naproksenu, pochodna kwasu octowego (kwas(2S)-2-(6-
metoksynaftalen-2-ylo)propanowy, jest przykładem miareczkowania słabego kwasu mocną
zasadą
Roztwór tej soli ma odczyn zasadowy. Punkt końcowy miareczkowania określa się, stosując
wskaźnik – fenoloftaleinę, w momencie zmiany zabarwienia roztworu na kolor różowy.
Odczynniki i roztwory
Sprz
ęt i aparatura
badany roztwór naproksenu
(woda +metanol 1:3 v/v),
0,5% roztwór alkoholowy fenoloftaleiny,
około 0,1 mol/ dm
3
roztwór NaOH,
mianowany roztwór HCl
biureta – 25 cm
3
, kolba miarowa – 100 cm
3
,
pipeta jednomiarowa – 25 cm
3
, kolba
stożkowa – 250 cm
3
Nastawianie miana titrantu – roztworu wodorotlenku sodu na mianowany roztwór kwasu
solnego. Pobrać 25 cm
3
mianowanego roztworu kwasu solnego (za pomocą pipety
jednomiarowej) i przenieść do kolby stożkowej o pojemności 250 cm
3
. Roztwór w kolbie
rozcieńczyć wodą destylowaną do objętości 75 cm
3
, wprowadzić 1-2 krople fenoloftaleiny i
energicznie mieszając miareczkować roztworem wodorotlenku sodowego, aż do momentu
pojawienia się różowego zabarwienia. Następnie obliczyć stężenie molowe wodorotlenku
sodu ze wzoru:
H
3
C
O
C
H
(
C
H
3
)C
OOH
+
N
aOH
H
3
C
O
CH(CH
3
)C
OON
a
+ H
2
O

4
1
2
2
1
V
V
c
c
⋅
=
gdzie: c
2
- stężenie molowe kwasu solnego [mol/dm
3
], v
2
- objętość mianowanego roztworu
kwasu solnego pobranego do nastawiania miana wodorotlenku sodu, v
1
– objętość roztworu
wodorotlenku sodu zużytego do zmiareczkowania kwasu solnego [dm
3
].
Wykonanie oznaczenia
Próbkę roztworu naproksenu przenieść ilościowo do kolby miarowej o pojemności 100
cm
3
i uzupełnić roztworem woda + metanol (1:3 v/v) do kreski. Pobrać pipetą jednomiarową
25 cm
3
tak przygotowanego roztworu do kolby stożkowej o poj. 250 cm
3
i po dodaniu 5 kropli
fenoloftaleiny miareczkować mianowanym roztworem wodorotlenku sodu do uzyskania
lekko różowego zabarwienia, utrzymującego się 20-30 sekund.
Obliczyć zawartość [g] naproksenu w próbce wg wzoru:
x = c · v · M · W
gdzie: c – stężenie molowe wodorotlenku sodu [mol/dm
3
], v – objętość wodorotlenku sodu
zużyta do miareczkowania naproksenu [dm
3
], M – masa molowa naproksenu [g/mol], W –
współmierność kolby i pipety.

5
REDOKSYMETRIA
Manganometryczne oznaczanie nadtlenku wodoru.
Zasada oznaczenia
Manganometryczne oznaczanie nadtlenku wodoru opiera się na równaniu reakcji:
2KMnO
4
+ 5H
2
O
2
+ 3H
2
SO
4
→
K
2
SO
4
+ 2MnSO
4
+ 8H
2
O + 5O
2
Początkowo reakcja zachodzi powoli, przyśpieszyć ją można dodając nieco soli manganu (II).
Woda utleniona ma właściwości utleniające, wydziela jod z jodowodoru, czyli ze
związkami redukującymi reaguje jako utleniacz, z utleniającymi zaś jako reduktor i wtedy
zawsze wywiązuje się tlen cząsteczkowy.
Odczynniki i roztwory
badany roztwór nadtlenku wodoru (3%)
rozcieńczony kwas siarkowy (VI)
roztwór KMnO
4
c
1/5KMnO
4
kwas szczawiowy – substancja stała
Sprz
ęt i aparatura
kolba miarowa – 100 ml, biureta – 25 ml,
pipeta jednomiarowa – 25 ml, pipeta
wielomiarowa – 20 ml, kolba stożkowa – 250
ml, naczyńko wagowe
Nastawianie miana titranta – roztworu KMnO
4
na odważkę kwasu szczawiowego
H
2
C
2
O
4
×2H
2
O.
Jony manganianowe (VII) utleniają jony szczawianowe do CO
2
zgodnie z reakcją:
2MnO
4
-
+5C
2
O
4
2-
+16H
+
→2Mn
2+
+10CO
2
+8H
2
O
Reakcja manganianu (VII) potasu z kwasem szczawiowym przebiega wolno, zwłaszcza w
początkowym stadium, lecz powstające jony Mn
2+
przyśpieszają ją (reakcja autokatalityczna).
W naczynku wagowym odważyć na wadze analitycznej 0,1500-0,2000 g kwasu
szczawiowego, przenieść ilościowo do kolby stożkowej o pojemności 250 ml i rozpuścić w
100 ml wody destylowanej. Roztwór w kolbie zakwasić 15 ml kwasu siarkowego (VI) i
miareczkować roztworem manganianu (VII) potasu do momentu uzyskania (utrzymującego
się 30 sekund) bladoróżowego zabarwienia. Stężenie c
1/5KMnO
4
należy obliczyć ze wzoru:
c
1/5KMnO
4
=
m
M f v
gdzie: m – masa odważki kwasu szczawiowego [g], M – masa molowa kwasu szczawiowego
[g/mol], v – objętość roztworu KMnO
4
zużytego do miareczkowania kwasu szczawiowego

6
[dm
3
], f – współczynnik równoważności kwasu szczawiowego w reakcji utleniania C
2
O
4
2-
do
CO
2
.
Wykonanie oznaczenia
Otrzymaną próbkę zawierającą nadtlenek wodoru przenieść ilościowo do kolby
miarowej o pojemności 100 ml, uzupełnić wodą destylowaną do kreski i wymieszać. Pobrać
25 ml roztworu za pomocą pipety jednomiarowej, umieścić w kolbie stożkowej o pojemności
250 ml, dodać 6,5 ml kwasu siarkowego (VI) o stężeniu 1 mol/l miareczkować mianowanym
roztworem manganianu (VII) potasu do uzyskania trwałego różowego zabarwienia.
Następnie obliczyć zawartość nadtlenku wodoru w próbce [g]:
x=c
1/5KMnO
4
v M f W
gdzie: c
1/5KMnO
4
- stężenie ułamka mola roztworu KMnO
4
[mol/dm
3
], v – objętość roztworu
KMnO
4
[dm
3
] zużyta do miareczkowania, M – masa molowa nadtlenku wodoru, f –
współczynnik równoważności nadtlenku wodoru, W – współczynnik kolby i pipety.
Instrukcja została opracowana na podstawie skryptu: Z. Dudzik „Podręcznik do ćwiczeń z
chemii farmaceutycznej”, Państwowy Zakład Wydawnictw Lekarskich, Warszawa 1966.

7
KOMPLEKSOMETRIA
Kompleksonometryczne oznaczanie jonów wapnia i magnezu wyst
ępujących obok
siebie.
Zasada oznaczenia
W celu kompleksonometrycznego oznaczenia obecnych obok siebie (w tym samym
roztworze) jonów Ca
2+
i Mg
2+
przeprowadza się dwa miareczkowania mianowanym
roztworem EDTA (sól sodowa kwasu wersenowego).
Jony Ca
2+
miareczkuje się w środowisku mocno zasadowym o pH 12-13, np. wobec
mureksydu jako wskaźnika. Magnez przy tak wysokim pH strąca się w postaci Mg(OH)
2
i nie
przeszkadza w oznaczeniu.
Jony Mg
2+
oznacza się łącznie z jonami Ca
2+
, lecz wobec czerni eriochromowej T w
roztworze o pH 10-10,5 (gdy występuje największa różnica między barwą powstających
kompleksów oraz barwą wolnego wskaźnika). Zastosowanie czerni eriochromowej T do
oznaczania jonów Ca
2+
w nieobecności Mg
2+
jest utrudnione z powodu małej intensywności
barwy wapniowego kompleksu tego wskaźnika. Dlatego prowadzi się je po dodaniu do
badanego roztworu – lecz oczywiście w znanej ilości – soli magnezu, której kompleks jest
bardziej intensywnie zabarwiony.
MgInd
-
+H
2
Y
2-
→HInd
2-
+MgY
2-
+H
+
(czerwony) (niebieski)
Zgodnie z powyższym równaniem, podczas miareczkowania roztworu jonów Ca
2+
i
Mg
2+
roztworem EDTA ich kompleksy ze wskaźnikiem zostają zastąpione bardziej trwałymi
kompleksami z EDTA (np. w postaci MgY
2-
), a roztwór przyjmuje zabarwienie wolnej soli
sodowej wskaźnika (HInd
2-
).
Oznaczanie sumarycznej zawartości jonów Ca
2+
i Mg
2+
oraz zawartości jonów Ca
2+
w
osobnej porcji roztworu umożliwia obliczenie zawartości Mg
2+
.
Odczynniki i roztwory
badany roztwór jonów Ca
2+
i Mg
2+
,
bufor amoniakalny o pH 10,
ok. 0,01 mol/l EDTA,
1 mol/l roztwór NaOH,
mureksyd (wskaźnik),
czerń eriochromowa T (wskaźnik)
Sprz
ęt i aparatura
kolba miarowa – 100 ml, biureta – 25 ml,
pipeta jednomiarowa – 20 ml, pipeta
wielomiarowa – 10 ml, cylinder miarowy –
100 ml, kolba stożkowa – 250 ml

8
Wykonanie oznaczenia
Oznaczenie zawarto
ści wapnia.
Badany roztwór Ca
2+
i Mg
2+
rozcieńczyć w kolbie miarowej wodą destylowaną do
objętości 100 ml. Dwie próbki tego roztworu o objętości 20 ml odpipetować do kolby
stożkowej o pojemności 250 ml i rozcieńczyć wodą destylowaną do objętości około 100 ml,
po czym dodać 10 ml roztworu wodorotlenku sodu o stężeniu 1 mol/l. Następnie, po dodaniu
6 kropli roztworu mureksydu, przeprowadzić miareczkowanie mianowanym roztworem
EDTA do zmiany zabarwienia z różowego na fiołkowe. Zawartość [g] Ca
2+
obliczyć ze
wzoru:
x
cv MW
gdzie: c – stężenie molowe roztworu EDTA [mol/l], v
1
– objętość roztworu EDTA zużytego
do miareczkowania jonów Ca
2+
[l], M – masa molowa wapnia [g/mol], W – współmierność
kolby i pipety.
Oznaczanie zawarto
ści magnezu.
Odpipetować do kolby stożkowej o pojemności 250 ml, kolejne dwie 20 – mililitrowe
próbki badanego (przygotowanego w kolbce na 100 ml z próbki wyjściowej) roztworu i
rozcieńczyć w kolbie miarowej wodą destylowaną do objętości 100 ml. Dodać 5 ml buforu
amoniakalnego o pH 10, 6 kropli roztworu czerni eriochromowej T do uzyskania różowego
zabarwienia i miareczkować roztworem EDTA do zmiany barwy roztworu z fiołkowej na
niebieską.
Zawartość jonów magnezu w próbce odpowiada różnicy objętości mianowanego
roztworu EDTA zużytego do miareczkowania drugiej (v
2
) i pierwszej (v
1
) próbki badanego
(rozcieńczonego) roztworu. Obliczyć zawartość [g] Mg
2+
w próbce ze wzoru:
x = c v
2
‐v
1
MW
gdzie: c – stężenie molowe roztworu EDTA [mol/l], v
2
– objętość roztworu EDTA zużytego
do miareczkowania sumy wapnia i magnezu [l], v
1
– objętość roztworu EDTA zużytego do
miareczkowania jonów wapnia [l], M – masa molowa magnezu [g/mol], W – współmierność
kolby i pipety.
Instrukcja została opracowana na podstawie skryptu: W. Wardas „Chemia Analityczna.
Ćwiczenia laboratoryjne. Wybrane metody wagowe, miareczkowe oraz elektroanalityczne”,
Śląska Akademia Medyczna, Katowice 2001.
9
POTENCJOMETRIA I
ĆWICZENIE 1
Potencjometryczne wyznaczanie pH roztworu na podstawie
charakterystyki elektrody szklanej
Zasada oznaczenia
Wykorzystanie elektrody szklanej do pomiarów pH roztworów wymaga w każdym
przypadku wyznaczenia jej charakterystyki.
Wyznaczanie charakterystyki elektrody szklanej polega na ustaleniu dla niej zależności SEM
od pH (przedstawionej graficznie w postaci krzywej kalibracyjnej) i wyznaczeniu parametrów
charakteryzujących elektrodę.
Odczynniki i roztwory
Sprz
ęt i aparatura
badany roztwór jonów H
+
,
roztwór mieszaniny kwasów: octowego,
fosforowego i borowego o stężeniu 0,04
mol/dm
3
względem każdego z nich, 0,2
mol/dm
3
roztwór NaOH
zlewki – 100 cm
3
, pipeta – 25 cm
3
, pehametr,
elektroda szklana, elektroda kalomelowa
Wykonanie oznaczenia
W oddzielnych zlewkach sporządzić roztwory buforowe, mieszając podane w tabelce
objętości roztworu mieszaniny kwasów i roztworu NaOH.
Lp.
Roztwór NaOH
[cm
3
]
Mieszanina kwasów
[cm
3
]
pH
1
5,0
50,0
1,98
2
10,0
50,0
3,29
3
20,0
50,0
5,72
4
30,0
50,0
7,96
5
35,0
50,0
9,15
6
50,0
50,0
11,98
W poszczególnych roztworach oraz w roztworze badanym kolejno umieszczać elektrodę
szklaną oraz kalomelową i mierzyć SEM utworzonych ogniw pehametrem wyskalowanym w
mV.

10
Opracowanie wyników
- wykreślić krzywą kalibracyjną (charakterystykę elektrody szklanej) w układzie
SEM
szkl/kal
= f(pH),
- na podstawie zmierzonej wartości SEM roztworu badanego odczytać z krzywej
kalibracyjnej wartości jego pH,
- z wyznaczonej krzywej kalibracyjnej określić nachylenie charakterystyki (mV/pH) elektrody
szklanej i porównać z wartością wyznaczoną z obliczeń teoretycznych, wynoszącą 58 mV/pH
(20°C) lub 59,1 mV/pH (24°C),
- obliczyć wartość pH, odpowiadającą zerowemu potencjałowi elektrody szklanej, czyli
wartość pH jej punktu izoelektrycznego,
- wyznaczyć przedział pH, w którym charakterystyka elektrody jest prostoliniowa.
Instrukcja została opracowana na podstawie skryptu: W. Wardas, Chemia Analityczna
Ćwiczenia Laboratoryjne, Wyd.1, 2001

11
POTENCJOMETRIA I
ĆWICZENIE 2
Potencjometryczne wyznaczanie pH przy u
życiu elektrody chinhydronowej
i nasyconej elektrody chlorosrebrowej
Zasada oznaczenia
Potencjał elektrod wskaźnikowych stosowanych w pomiarach pH powinien zależeć liniowo
od stężenia jonów wodorowych w roztworze. Dotyczy to m.in. elektrody chinhydronowej.
Wartość pH roztworu, wyznaczoną za pomocą ogniwa zbudowanego z elektrody
chinhydronowej i elektrody odniesienia (elektrody platynowo- chlorosrebrowej) zanurzonych
w roztworze badanym, można obliczyć ze wzoru
SEM
ch/Ag/AgCl/KCl(nas)
= 503 – 58,1 pH (1)
Odczynniki i roztwory
Sprz
ęt i aparatura
badany roztwór jonów H
+
,
chinhydron subst.,
roztwór mieszaniny kwasów: octowego,
fosforowego (V) i borowego o stężeniu
0,04 mol/dm
3
względem każdego z nich,
0,2 mol/dm
3
roztwór NaOH
pehametr cyfrowy,
elektroda
kombinowana
platynowo-
chlorosrebrowa,
zlewki – 100 cm
3
, pipeta – 25 cm
3
Wykonanie oznaczenia
Mieszając podane w tabelce objętości roztworu, zawierającego mieszaninę trzech kwasów i
roztworu NaOH, w oddzielnych zlewkach sporządzić 5 roztworów buforowych.
Lp.
Roztwór NaOH
[cm
3
]
Mieszanina kwasów
[cm
3
]
pH
1
2,5
50,0
1,98
2
10,0
50,0
3,29
3
20,0
50,0
5,72
4
25,0
50,0
6,80
5
30,0
50,0
7,96
Do każdej zlewki z buforem oraz do roztworu próbki badanej dodać szczyptę chinhydronu.
Po wymieszaniu w kolejnych roztworach buforowych i w roztworze badanym umieszczać

12
platynową elektrodę kombinowaną i mierzyć SEM utworzonych ogniw za pomocą pehametru
w mV.
Opracowanie wyników
- na podstawie SEM kolejnych roztworów buforowych wykreślić krzywą kalibracyjną w
układzie SEM = f(pH),
- na podstawie zmierzonej wartości SEM roztworu badanego odczytać z krzywej
kalibracyjnej wartość jego pH,
- odczytać pH próbki z podanego wzoru (1).
Instrukcja została opracowana na podstawie skryptu: W. Wardas, Chemia Analityczna
Ćwiczenia Laboratoryjne, Wyd.1, 2001

13
POTENCJOMETRIA II
ĆWICZENIE
Oznaczanie kwasu salicylowego w preparacie farmaceutycznym
metod
ą miareczkowania potencjometrycznego
Zasada oznaczania
Alkacymetryczne miareczkowanie potencjometryczne sposobem klasycznym polega na
bezpośredniej obserwacji SEM ogniwa pomiarowego w miarę dodawania odczynnika
miareczkującego. Ogniwem pomiarowym jest elektroda kombinowana, zbudowana z
elektrody szklanej jako wskaźnikowej i elektrody kalomelowej jako odniesienia. Zamiast
pomiaru SEM ogniwa, można zmierzyć pH roztworu pozostającego jego liniową funkcją.
Przebieg zmian pH w funkcji objętości dodawanego titranta jest analogiczny do zmian SEM.
Odczynniki i aparatura
0,1 mol/dm
3
NaOH, 2% spirytus salicylowy
pehametr cyfrowy; elektroda kombinowana(chlorosrebrowa)
zlewki – 150 cm
3
, pipeta – 5 cm
3
, pipeta – 25 cm
3
Wykonanie
ćwiczenia
Do trzech zlewek odmierzyć pipetą po 5cm
3
spirytusu salicylowego i dodać 75 cm
3
wody
destylowanej. Rozcieńczone roztwory próbek miareczkować roztworem 0,1 mol/dm
3
NaOH,
dokonując pomiaru pH elektrodą kombinowaną za pomocą wyskalowanego pehametru.
Podczas miareczkowania pierwszego roztworu dokonywać pomiarów pH w trakcie
dodawania titrantu po 1,0 cm
3
. W dwóch kolejnych miareczkowaniach powtórzyć pomiary
zagęszczając je do 0,1cm
3
w pobliżu V
PK
(V
PK
± 1cm
3
).
Opracowanie wyników
- wykreślić krzywą miareczkowania w zależności pH od V
titranta
- wyznaczyć V
PK
metodą stycznych
- obliczyć stężenie procentowe kwasu salicylowego
- obliczyć teoretyczne wartości pH poszczególnych punktów pomiarowych oraz obliczone
wartości porównać z wartościami pH odczytanymi z uzyskanej doświadczalnej krzywej
miareczkowania

14
- przyjmując, że uzyskany wynik analizy jest prawidłowy, obliczyć błąd bezwzględny i
względny, jakim jest obarczona informacja o stężeniu kwasu salicylowego w badanym
preparacie.
Instrukcja opracowana na podstawie skryptu: W. Wardas, Chemia Analityczna Ćwiczenia
Laboratoryjne, Wyd.1, 2001

15
KONDUKTOMETRIA
ĆWICZENIE 1
Pomiar stałej naczy
ńka konduktometrycznego
Zasada oznaczenia
Celem
ćwiczenia
jest
doświadczalne
wyznaczenie
wartości
stałej
naczyńka
konduktometrycznego. Każdy układ składający się z elektrody i z naczyńka
konduktometrycznego charakteryzuje się pewną stałą wartością zwaną stałą naczyńka ‘’k”
Aparatura i szkło
Konduktometr, zlewka – 150 cm
3
, kolba miarowa – 100 cm
3
Odczynniki
0,1 mol/ dm
3
roztwór KCl (odważka analityczna)
Wykonanie
ćwiczenia
Wyznaczenie stałej naczyńka konduktometrycznego dokonujemy za pomocą
wzorcowego roztworu KCl o stężeniu 0,01 mol/dm
3
(sporządzonego przez rozcieńczenie 0,1
mol/dm
3
roztworu KCl), którego przewodnictwo właściwe w temperaturze 25°C, wynosi
0,001413 S · cm
-1
(tabela 1). W tym celu w zlewce o pojemności 150 cm
3
, zawierającej 100
cm
3
tego
roztworu,
umieszczamy
czujnik
temperatury
wraz
z
naczyńkiem
konduktometrycznym, tak aby obydwa pierścienie platynowe naczyńka były zanurzone w
roztworze. Patrząc na wyświetlacz konduktometru zaprogramowanego na 25°C,
doprowadzamy wyświetlane wskazania do wartości przewodnictwa właściwego roztworu
wzorcowego (0,001413 S · cm
-1
) i następnie odczytujemy automatycznie wyznaczoną przez
aparat wartość stałej naczyńka k [cm
-1
].
Po zakończeniu opisanych czynności konduktometr wskazuje poprawne wartości
przewodnictwa właściwego κ [mS · cm
-1
lub µS · cm
-1
]
Instrukcja opracowana na podstawie skryptu: W. Wardas, Chemia Analityczna Ćwiczenia
Laboratoryjne, Wyd.1, 2001

16
KONDUKTOMETRIA
ĆWICZENIE 2
Pomiar przewodnictwa wła
ściwego mieszaniny soli
Zasada oznaczenia
Ćwiczenie polega na pomiarze przewodnictwa właściwego trzech roztworów soli
oraz ich roztworu mieszanego o tych samych stężeniach soli. Następnie porównanie
zmierzonej wartości przewodnictwa właściwego mieszaniny trzech soli z obliczoną
teoretycznie. Do obliczeń teoretycznych wykorzystuje się graniczne przewodnictwo
poszczególnych jonów podane w tabeli 2.
Odczynniki i roztwory
Sprz
ęt i aparatura
0,1 mol/dm
3
roztwór NaCl,
0,1 mol/ dm
3
roztwór KBr,
0,1 mol/ dm
3
roztwór KI
kolbka miarowa – 100 cm
3
,
pipeta – 10 cm
3
, konduktometr,
naczyńko konduktometryczne
Wykonanie oznaczenia
W kolbkach miarowych o poj. 100 cm
3
sporządzić 0,01 mol/dm
3
roztwory NaCl, KBr,
KI z roztworów 0,1 mol/dm
3
oraz roztwór mieszaniny o stężeniu 0,01 mol/dm
3
każdej z tych
soli.
Opracowanie wyników
- zsumować wartości κ roztworów badanych soli i porównać z wartością κ roztworu
mieszaniny tych soli; wyciągnąć wnioski na temat zasady addytywności przewodnictwa
roztworów,
- obliczyć przewodnictwo molowe poszczególnych soli na podstawie zmierzonego
przewodnictwa właściwego κ zgodnie ze wzorem:
1000
⋅
=
Λ
c
AB
κ
- obliczyć graniczne przewodnictwo molowe
0
AB
Λ
badanych roztworów soli, korzystając z
prawa Kohlrauscha (wartości granicznego przewodnictwa molowego jonów podano w tabeli
)

17
0
0
−
+
+
=
Λ
B
o
A
AB
λ
λ
λ°
A+
, λ°
B-
- graniczne przewodnictwa jonowe kationu i anionu
- porównać wartości przewodnictwa wyznaczonego doświadczalnie i teoretycznego.
Instrukcja opracowana na podstawie skryptu: W. Wardas, Chemia Analityczna Ćwiczenia
Laboratoryjne, Wyd.1, 2001

18
KONDUKTOMETRIA
ĆWICZENIE 3
Oznaczanie chlorku sodowego w preparacie farmaceutycznym, metod
ą
konduktometrycznego miareczkowania str
ąceniowego
Zasada oznaczenia
Wytrącanie jonów chlorkowych prowadzi się za pomocą jonów srebra dodawanych
w roztworze (titrantu) AgNO
3
. Znajdujące się w roztworze badanym jony chlorkowe zostają
zastąpione przez jony azotanowe, zgodnie z równaniem reakcji
Na
+
+ Cl
-
+ Ag
+
+ NO
3
-
→ AgCl↓ + Na
+
+ NO
3
-
Przewodnictwo molowe jonów chlorkowych (λ° =76,3 S·cm
2
·mol
-1
) jest nieco
większe od przewodnictwa molowego jonów azotanowych (λ° =71,5 S·cm
2
·mol
-1
), a zatem do
punktu równoważnikowego przewodnictwo roztworu nieznacznie maleje. Po punkcie
równoważnikowym nadmiar jonów titrantu powoduje istotny wzrost przewodnictwa.
Odczynniki i roztwory
Sprz
ęt i aparatura
badana próbka Natrium chloratum 0,9% inj.
(fizjologiczny roztwór NaCl), O,1 mol/dm
3
roztwór AgNO
3
(odważka analityczna)
biureta – 25 cm
3
, zlewka – 150 cm
3
, pipeta
jednomiarowa – 5 cm
3
, konduktometr,
naczyńko
konduktometryczne,
mieszadło
magnetyczne
Wykonanie oznaczenia
Pipetą jednomiarową pobrać 5 cm
3
badanego roztworu, przenieść do zlewki o poj.
150 cm
3
i dodać 100 cm
3
wody destylowanej. W roztworze umieścić naczyńko
konduktometryczne oraz element mieszający, umieścić na mieszadle magnetycznym.
Miareczkować roztworem AgNO
3
, dodając z biurety po 1 cm
3
titranta. Miareczkowanie
przeprowadzić dwukrotnie, dla dwóch próbek badanego roztworu, notując objętość titrantu i
wartość przewodnictwa właściwego κ (mS· cm
-1
). Po zakończeniu miareczkowania opłukać
elektrodę w roztworze amoniaku.
Opracowanie wyników
- ze względu na zmieniającą się podczas miareczkowania objętość badanej próbki, należy
obliczyć poprawkę

19
wody
próbki
titrantu
wody
próbki
V
V
V
V
V
p
+
+
+
=
oraz wartość przewodnictwa właściwego κ
p
κ
p
= p · κ
- wykreślić krzywą miareczkowania konduktometrycznego dla obu miareczkowań w układzie
κ
p
= f(V) i wyznaczyć graficznie objętości odpowiadające PK miareczkowania,
- obliczyć średnią wartość V
PK
i zawartość [% m/v] chlorków w próbce,
- zakładając, że oznaczone stężenie NaCl w próbce jest prawidłowe, obliczyć błąd
bezwzględny i względny jakim jest obarczona informacja o zawartości NaCl w próbce.
Instrukcja opracowana na podstawie skryptu: W. Wardas, Chemia Analityczna Ćwiczenia
Laboratoryjne, Wyd.1, 2001
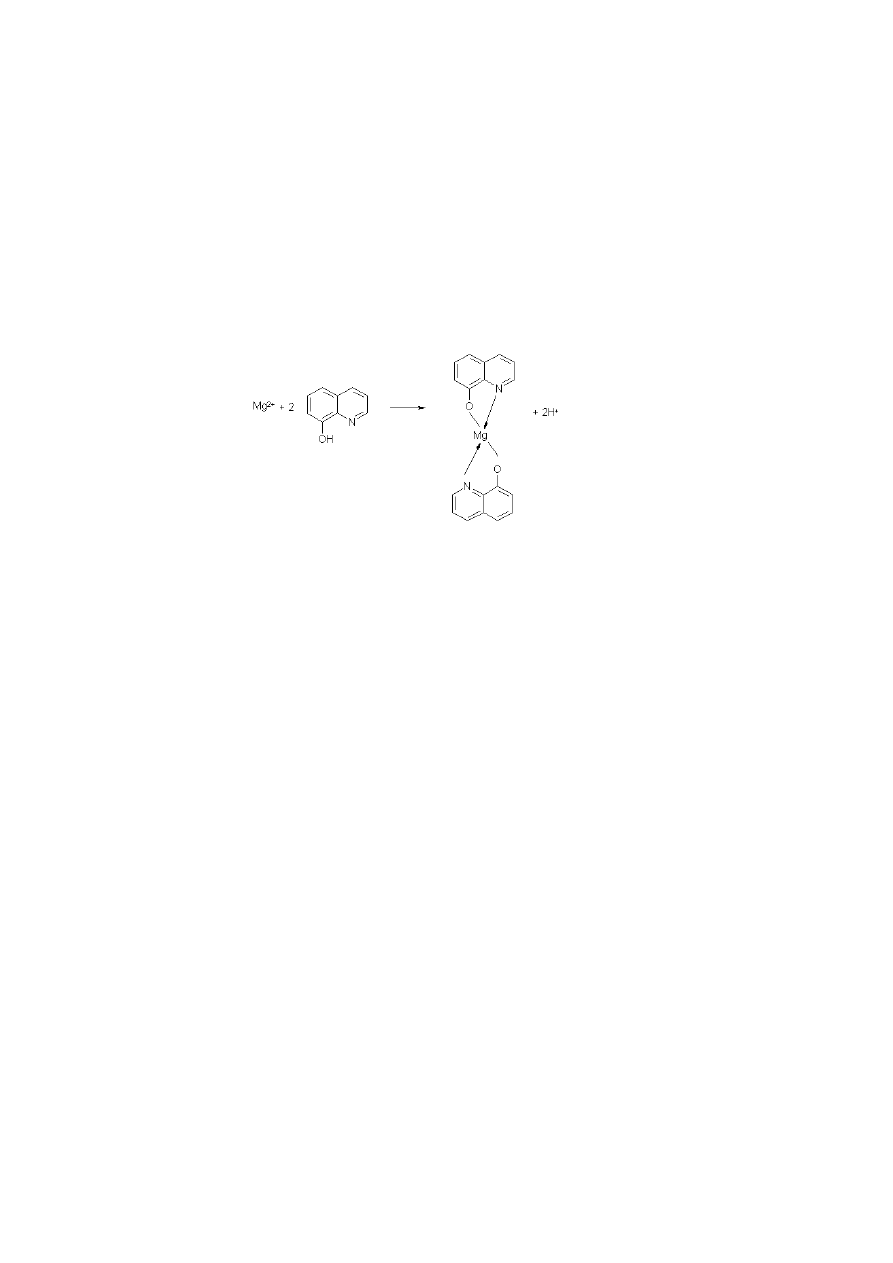
20
GRAWIMETRIA
Wagowe oznaczanie magnezu w postaci 8-hydroksychinolanu.
Zasada oznaczenia
Magnez wytrąca się przy użyciu 8-hydroksychinoliny, zwanej również toksyną.
Podczas oznaczenia zachodzi następująca reakcja:
Reakcja przebiega ilościowo przy pH wyższym od 9. Roztwór 8-hydroksychinoliny
wprowadza się do amoniakalnego roztworu soli magnezowej (roztwór nie może zawierać
żadnych metali poza potasowcami i niewielkimi ilościami wapnia, ponieważ niemal
wszystkie metale tworzą z 8-hydroksychinoliną osady w środowisku amoniakalnym).
Powstaje żółtozielony osad 8-hydroksychinolanu magnezowego, który następnie odsącza się
przez szklany lejek z porowatym dnem i suszy w temperaturze 105°C. Suszony do stałej masy
osad jest opisany wzorem: Mg(C
9
H
6
NO)
2
×2H
2
O.
Odczynniki i roztwory
badany roztwór jonów Mg
2+
8-hydroksychinolina – roztwór 5%
kwas octowy – roztwór 2 mol/l
amoniak – roztwór 10%
Sprz
ęt i aparatura
kolba miarowa – 100 ml, zlewka – 250 ml,
pipeta jednomiarowa – 25 ml, pipeta – 10 ml,
lejek P-4, szkiełko zegarkowe, łaźnia wodna,
suszarka laboratoryjna, pompka wodna
Wykonanie oznaczenia
Otrzymaną próbkę roztworu jonów Mg
2+
przenieść ilościowo do kolby miarowej o
pojemności 100 ml i uzupełnić wodą destylowaną do kreski. Do zlewki odpipetować 25 ml
próbki, rozcieńczyć wodą destylowaną do objętości około 100 ml i ogrzać do temperatury
80°C, dodać 10 ml 5% roztworu 8-hydroksychinoliny w 2M kwasie octowym i kroplami ok. 5
ml 10% amoniaku i 2 ml nadmiaru. Mieszaninę pozostawić do opadnięcia osadu przez ok. 30
minut na łaźni wodnej. Ciecz nad osadem powinna być zabarwiona na żółto. Osad odsączyć

21
na porowatym tyglu, przemyć ciepłą wodą z dodatkiem amoniaku, aż przesącz będzie
bezbarwny i suszyć (ok. 1h) w temperaturze 105°C do stałej masy.
Zawartość jonów magnezu w próbce obliczyć ze wzoru:
x = m×F×W
gdzie: m – masa osadu Mg(C
9
H
6
NO)
2
×2H
2
O, F – mnożnik analityczny do przeliczania
Mg(C
9
H
6
NO)
2
×2H
2
O na masę magnezu (F=0,06976), W – współmierność kolby i pipety.
Instrukcja została opracowana na podstawie podręczników:
1.
Z.S. Szmal, T. Lipiec: „Chemia analityczna z elementami analizy instrumentalnej”,
Wydawnictwo Lekarskie PZWL, Warszawa 1997.
2.
Z. Dudzik „Podręcznik do ćwiczeń z chemii farmaceutycznej”, Państwowy Zakład
Wydawnictw Lekarskich, Warszawa 1966.

22
PRECYPITOMETRIA
ĆWICZENIE
Precypitometryczne oznaczanie jonów cynku
Zasada oznaczenia
Oznaczenie ma charakter miareczkowania strąceniowego. Wykorzystuje się powstawanie
trudno rozpuszczalnego osadu w reakcji jonów cynku z heksacyjanożelazianem (II) potasu
2 K
4
[Fe(CN)
6
] + 3 Zn
2+
→ Zn
3
K
2
[Fe(CN)
6
↓ + 6 K
+
Miareczkowanie próbki zawierającej jony Zn
2+
przeprowadza się wobec wskaźnika –
difenyloaminy w obecności małej ilości heksacyjanożelazianu(III) potasu K
3
[Fe(CN)
6
], który
w odróżnieniu od heksacyjanożelazianu (II) potasu, nie tworzy z jonami Zn
2+
trudno
rozpuszczalnego
związku.
Podczas
miareczkowania
próbki
przed
punktem
równoważnikowym dodawany heksacyjanożelazian (II) potasu wiąże jony Zn
2+
. Stężenie
jonów [Fe(CN)
6
]
-4
w roztworze jest bardzo małe, a potencjał układu wystarczająco wysoki i
difenyloamina
jest
w
barwnej
postaci
utlenionej.
Po
przekroczeniu
punktu
równoważnikowego nadmiar dodanego roztworu heksacyjanożelazianu (II) potasu powoduje
obniżenie potencjału i odbarwienie wskaźnika.
Odczynniki i roztwory
Sprz
ęt i aparatura
badany roztwór jonów cynku, wzorcowy
roztwór
cynku,
roztwór
kwasu
siarkowego(VI) /1+2/, heksacyjanożelazian
(III) potasu 1%,
1% roztwór difenyloaminy w stężonym
kwasie siarkowym, siarczan (VI) amonu
cz.d.a,
amoniak
stężony
25%,
0,05 mol/dm
3
roztwór heksacyjanożelazianu
(II) potasu
biureta – 25 cm
3
, biureta – 10 cm
3
, kolba
miarowa – 100 cm
3
, pipeta jednomiarowa –
25 cm
3
, kolba stożkowa – 250 cm
3
, cylinder
miarowy – 25 cm
3
Nastawianie miana roztworu K
4
[Fe(CN)
6
] na wzorcowy roztwór cynku.
Pobrać 25 cm
3
roztworu wzorcowego cynku i przenieść do kolby stożkowej o poj. 250
cm
3
, następnie rozcieńczyć wodą do 100ml. Dodać 10 cm
3
roztworu kwasu siarkowego (VI)
/1+2/, 5 g siarczanu (VI) amonu, 3 krople difenyloaminy i 14 kropel 1% roztworu
K
3
[Fe(CN)
6
]. Przygotowany roztwór miareczkować powoli 0,05 mol/dm
3
roztworem
K
4
[Fe(CN)
6
](energicznie mieszając) do momentu zmiany zabarwienia zawiesiny z

23
fioletowoniebieskiego na bladozielone, po czym dodać jeszcze 1-2 cm
3
nadmiaru odczynnika.
Z drugiej biurety wprowadzić roztwór cynku aż do powrotu fioletowoniebieskiego
zabarwienia i ponownie miareczkować roztworem heksacyjanożelazianu (II) potasu do
momentu, gdy w cieczy z zawiesiną nastąpi zniknięcie fioletowo niebieskiego zabarwienia od
jednej kropli.
Miano roztworu K
4
[Fe(CN)
6
] , wyrażone w g Zn/ cm
3
, obliczyć ze wzoru
1
3
2
c
V
V
c
⋅
=
gdzie: V
2
i V
3
– objętość roztworu wzorcowego cynku i roztworu K
4
[Fe(CN)
6
] zużyte
podczas miareczkowania (cm
3
), c
1
– stężenie roztworu wzorcowego cynku (g Zn/ cm
3
.
Wykonanie oznaczenia
Badaną próbkę przenieść ilościowo do kolby miarowej o poj. 100 cm
3
, rozcieńczyć wodą
destylowaną do kreski. Przenieść 25 cm
3
tego roztworu do kolby stożkowej o poj. 250 cm
3
,
następnie rozcieńczyć wodą do 100 cm
3
. Dodać 10 cm
3
roztworu kwasu siarkowego (VI)
/1+2/, 5 g siarczanu (VI) amonu, 3 krople difenyloaminy i 14 kropel 1% roztworu
K
3
[Fe(CN)
6
]. Przygotowany roztwór miareczkować powoli 0,05 mol/dm
3
roztworem
K
4
[Fe(CN)
6
](energicznie mieszając) do momentu zmiany zabarwienia zawiesiny z
fioletowoniebieskiego na bladozielone, po czym dodać jeszcze 1-2 cm
3
nadmiaru odczynnika.
Z drugiej biurety wprowadzić roztwór cynku aż do powrotu fioletowoniebieskiego
zabarwienia i ponownie miareczkować roztworem heksacyjanożelazianu (II) potasu do
momentu, gdy w cieczy z zawiesiną nastąpi zniknięcie fioletowo niebieskiego zabarwienia od
jednej kropli.
Zawartość cynku Zn
2+
(g) obliczyć ze wzoru
W
c
V
V
V
V
x
⋅
⋅
⋅
−
=
2
3
1
V i V
1
– objętość roztworu K
4
[Fe(CN)
6
] i roztworu wzorcowego cynku zużyta do
miareczkowania (cm
3
)
2
3
V
V
– współczynnik przeliczenia objętości (na V
2
roztworu wzorcowego Zn zużywa się
podczas miareczkowania V
3
ml roztworu K
4
[Fe(CN)
6
] ).
c – miano roztworu K
4
[Fe(CN)
6
] (g Zn/cm
3
),
W – współmierność kolby i pipety.

24
Instrukcja została opracowana na podstawie skryptu: G.Bieniek, J.Czogała, R. Różańska,
J.Szczałuba: Ćwiczenia laboratoryjne i rachunkowe z chemii analitycznej, Przewodnik dla
studentów Wyziału Farmaceutycznego i Oddziału Analityki Medycznej, Śląska Akademia
Medyczna, Katowice 1985.
Wyszukiwarka
Podobne podstrony:
Chemia analityczna - ściąga, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia analityczna, instrukc
Chemia Analityczna instrukcje do Cwiczen id 111956
Chemia Analityczna instrukcje do ćwiczeń
chemia analityczna instrukcje do lab, Technologia chemiczna, Chemia analityczna, analityczna
Chemia analityczna laboratorium Instrukcje do ćwiczeń
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
ćw.4 zadania pH, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I se
ćw.3 -alkacymetria, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I
ćw.1 kompleksy, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I sem
ćw.2 roztw.stęż, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I se
Instrukcje do ćwiczeń laboratoryjnych Chemia I rok WGIG
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
Instrukcja do cwiczenia 1
Instrukcje do ćwiczeń 2013
INSTRUKCJA do ćwiczenia pomiar temperatury obrabiarek v3 ver robocza
więcej podobnych podstron