atom wodoropodobny
1
ATOM WODOROPODOBNY
Równanie Schrödingera:
0
)]
(
[
2
2
=
Ψ
−
+
∆Ψ
r
U
E
h
µ
µ
- masa efektywna elektronu, w przybliżeniu równa masie spoczynkowej elektronu.
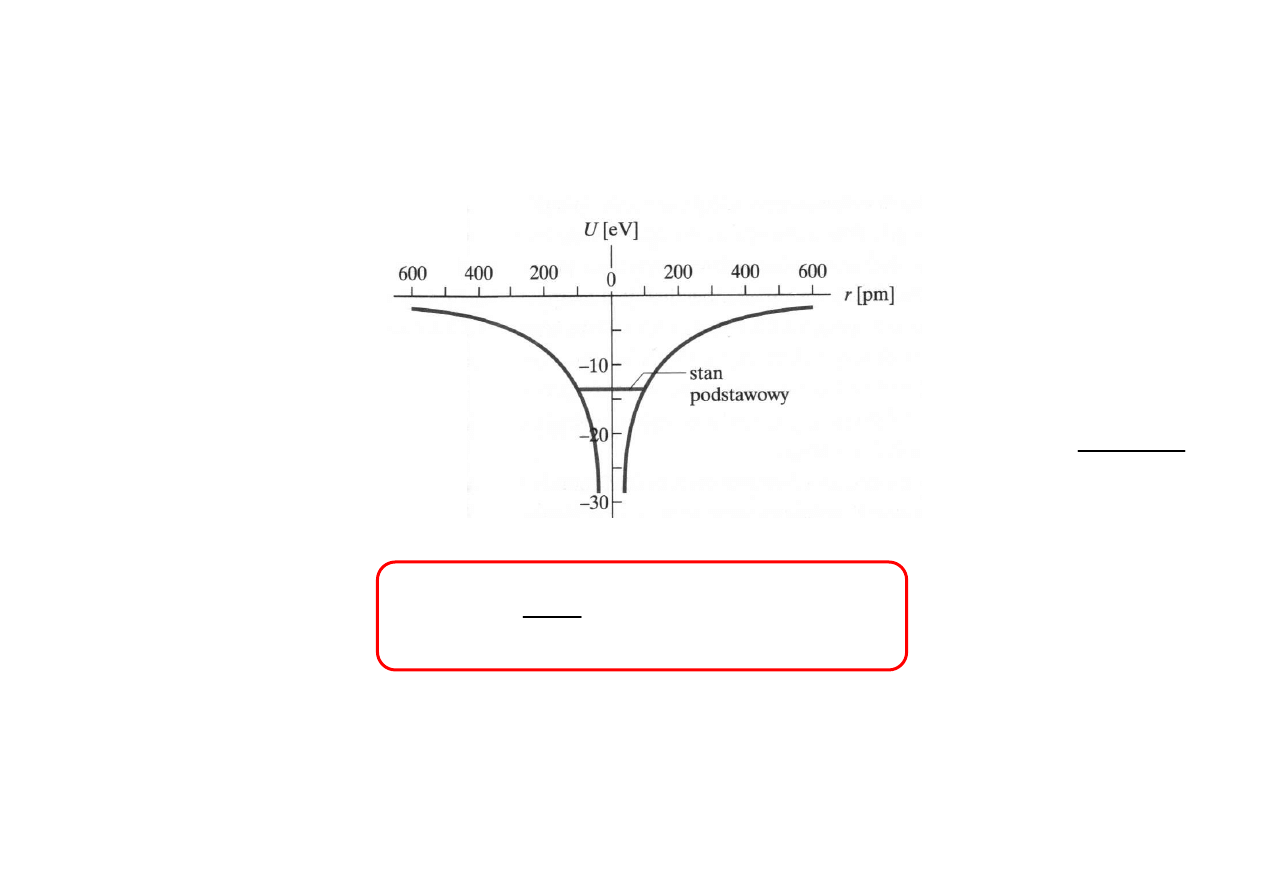
U(r) - Energia potencjalna w polu dodatniego ładunku punktowego:
U r
Zq
r
( )
=
2
0
4
πε

atom wodoropodobny
2
POZIOMY ENERGETYCZNE
Energia elektronu w atomie wodoru może być równa:
2
4
2
2
2
n
Z e
E
n
µ
= −
h
gdzie
n = 1, 2, 3, ....
n - główna liczba kwantowa
ℜ
−
=
2
1
n
E
n
ℜ
- stała Rydberga
atom wodoropodobny
3
m
n
E
E
hf
−
=
:
fotonu
Energia
Długość fali:
−
ℜ
=
2
2
,
1
1
1
m
n
m
n
λ
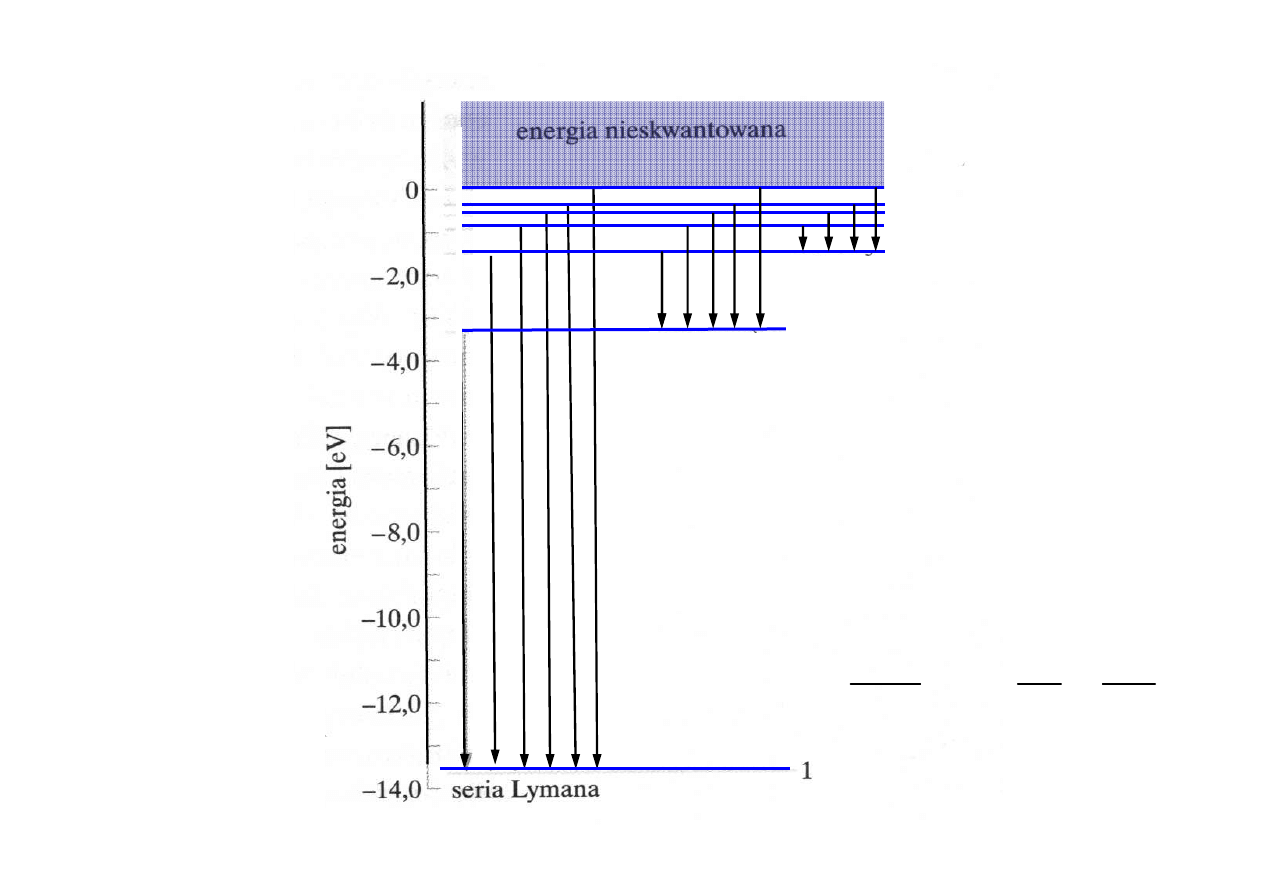
PRZEJŚCIA
MIĘDZY
POZIOMAMI
seria
Balmera
seria
Paschena
atom wodoropodobny
4
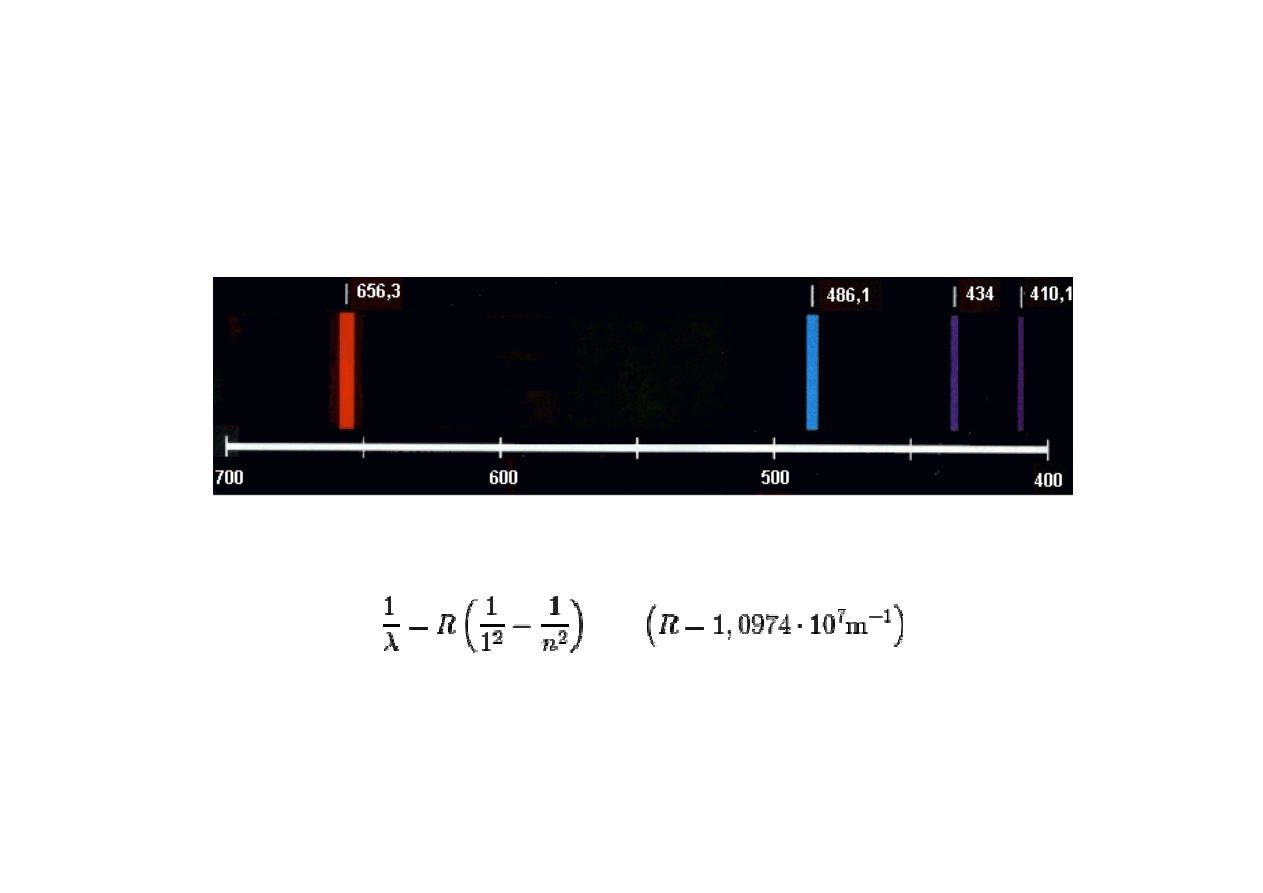
WIDMO WODORU
Część widzialna widma wodoru - przejście na orbital n = 2 (seria Balmera)
atom wodoropodobny
5
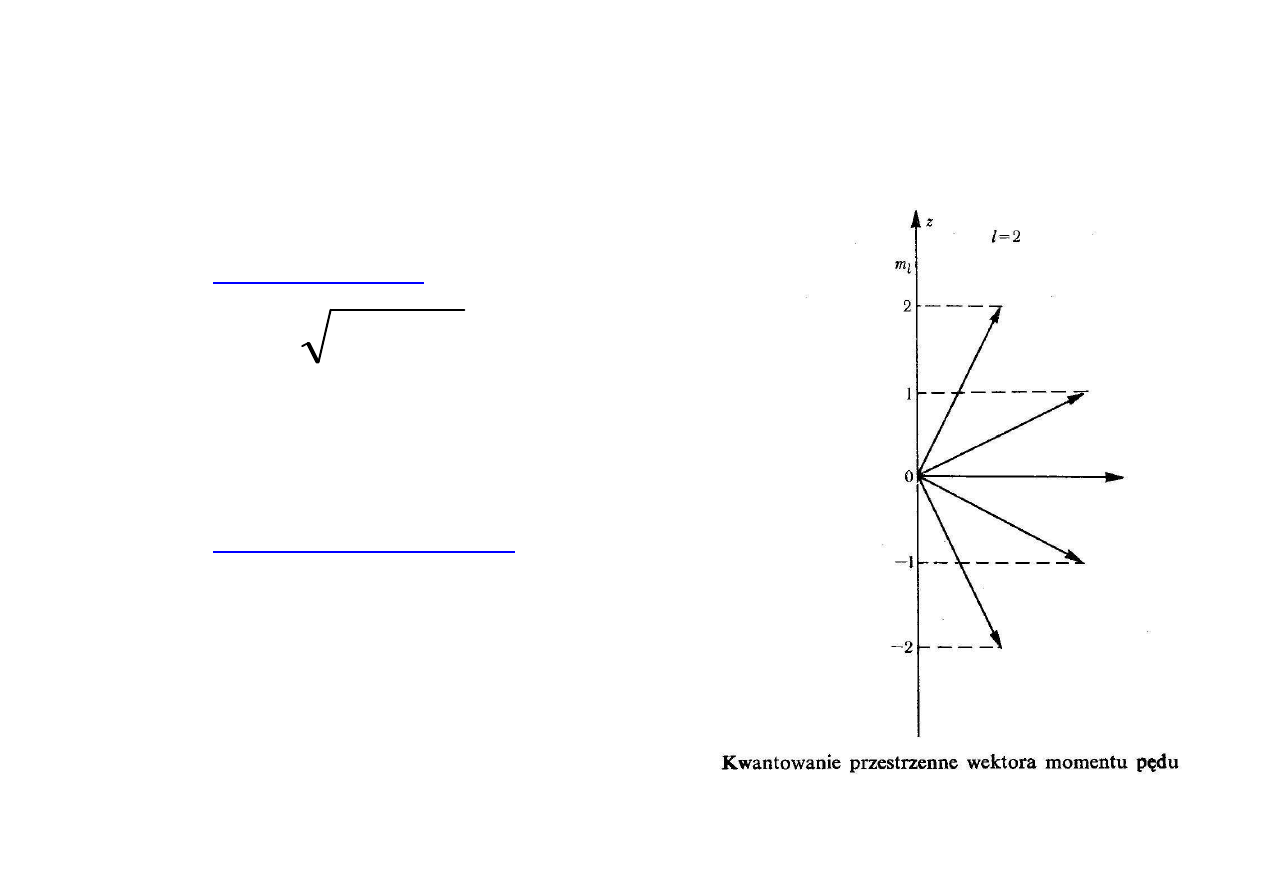
MOMENT PĘDU ELEKTRONU
Moment pędu:
h
)
1
(
+
=
l
l
L
l = 0, 1, 2, ... (n-1)
Rzut momentu pędu:
h
m
L
z
=
l
l
m
,..,
0
,..,
−
=
n
2
stanów kwantowych

atom wodoropodobny
6
ORBITALE ATOMU WODORU
Funkcje falowe elektronów w atomie nazywa się orbitalami
atomowymi
)
,
(
)
(
)
,
,
(
,
,
φ
ϑ
φ
ϑ
lm
nl
m
l
n
Y
r
R
r
=
Ψ
Są one jednoznacznie określone przez podanie 3 liczb kwantowych
n = 1, 2, 3, .... główna liczba kwantowa
l = 0, 1, 2, ... (n-1) orbitalna liczba kwantowa
m = 0, ±1, ±2, ... ±l magnetyczna liczba kwant.
OZNACZENIA ORBITALI
l
= 0, 1, 2, 3, 4, 5,
s p d f g h
nl
m

atom wodoropodobny
7
ORBITALE ATOMU WODORU
n
n
2
stanów kwantowych
1
1s
0
2
2s
0
2p
-1
2p
0
2p
+1
3
3s
0
3p
-1
3p
0
3p
+1
3d
-2
3d
-1
3d
0
3d
+1
3d
+2
n = 1, 2, 3, .... główna liczba kwantowa
l = 0, 1, 2, ... (n-1) orbitalna liczba kwantowa
m = 0, ±1, ±2, ... ±l magnetyczna liczba kwant.
nl
m
atom wodoropodobny
8
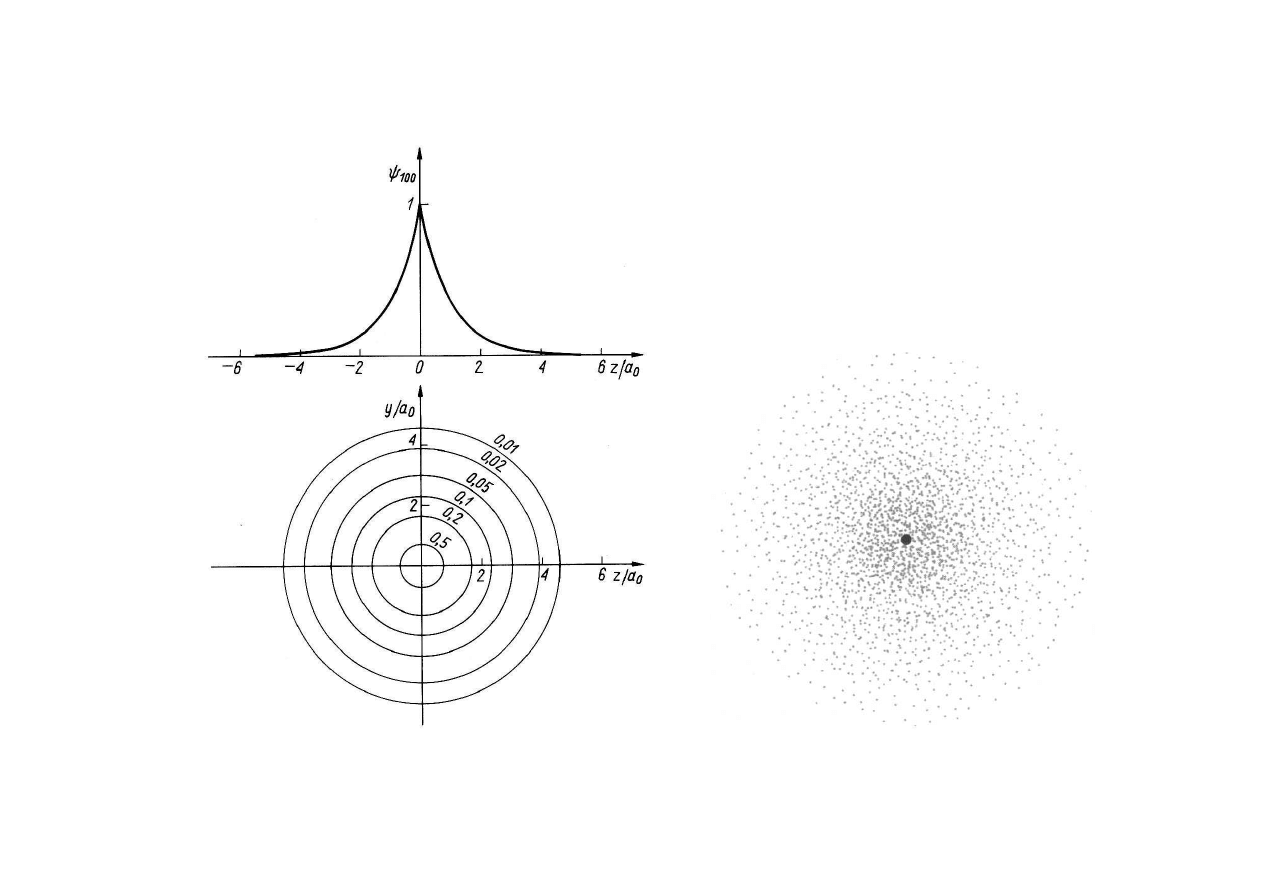
ATOM WODORU – STAN PODSTAWOWY
atom wodoropodobny
9
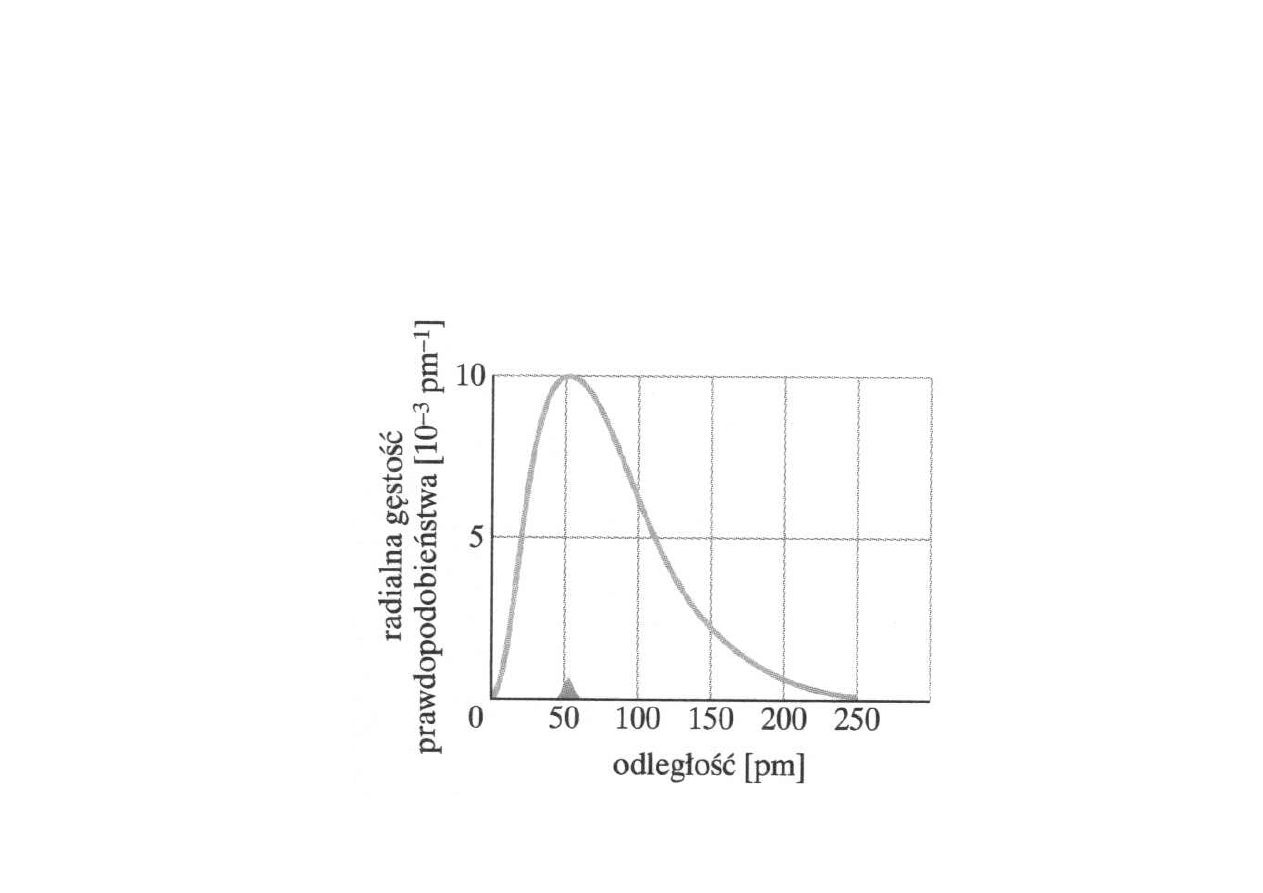
ATOM WODORU – STAN PODSTAWOWY
Radialna gęstość prawdopodobieństwa
P(r) = 4
π
r
2
I
Ψ(
r)
I
2
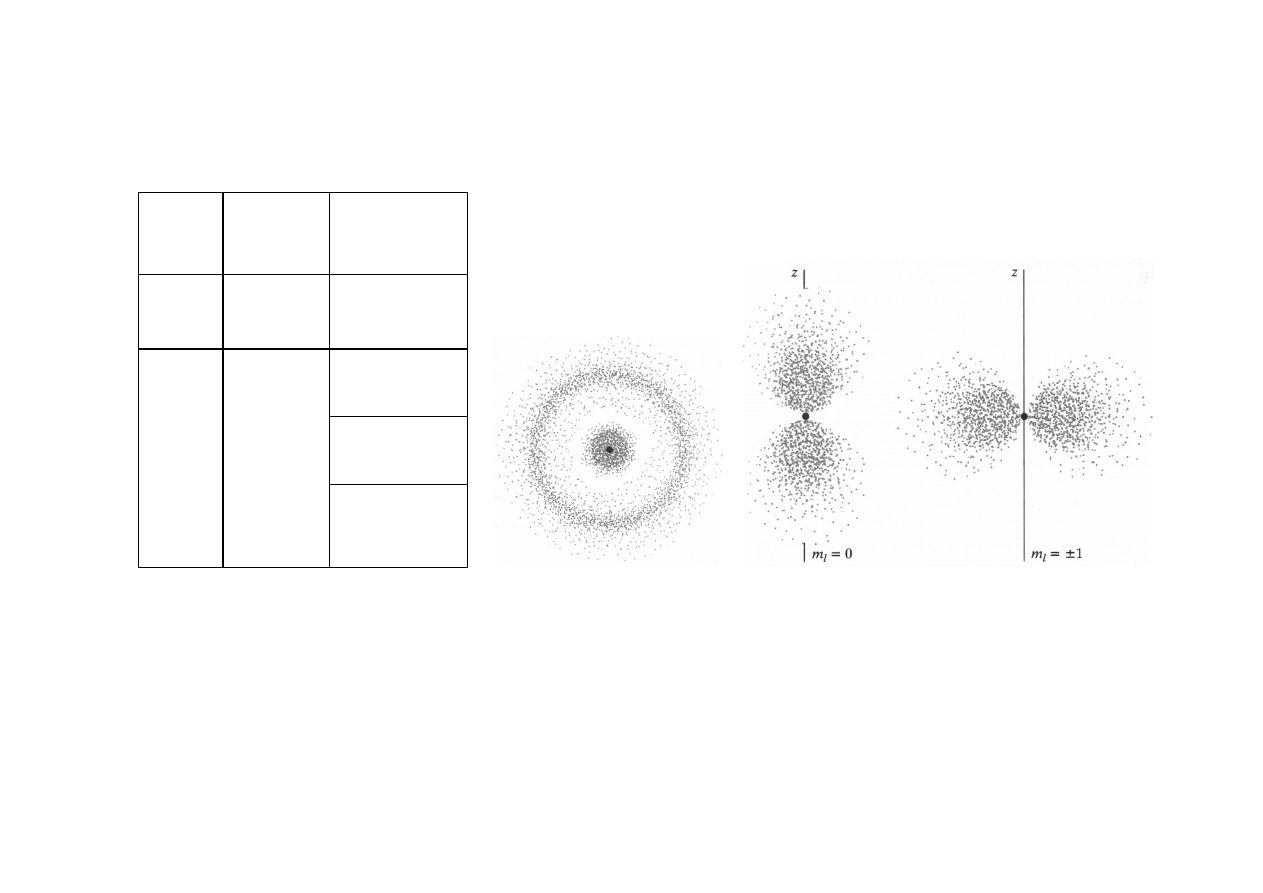
atom wodoropodobny
10
ATOM WODORU – ORBITAL n=2
n
l
m
l
2
0
0
+1
0
2
1
-1
2s 2p
n = 1, 2, 3, .... główna liczba kwantowa
l = 0, 1, 2, ... (n-1) orbitalna liczba kwantowa
m = 0, ±1, ±2, ... ±l magnetyczna liczba kwant.
atom wodoropodobny
11
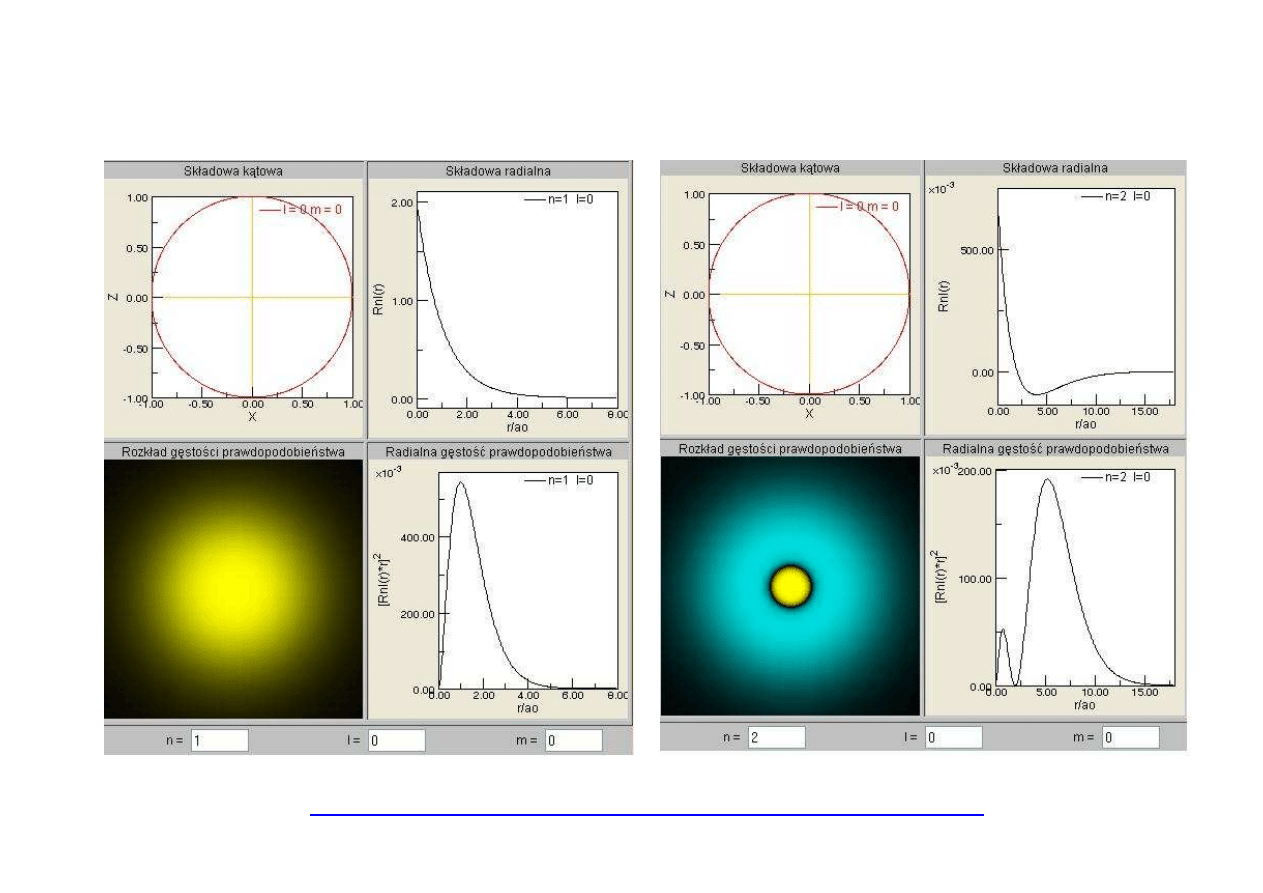
ORBITALE ATOMU WODORU
http://www.ch.pw.edu.pl/~janzac/Orbitals/start/hydrogen.html
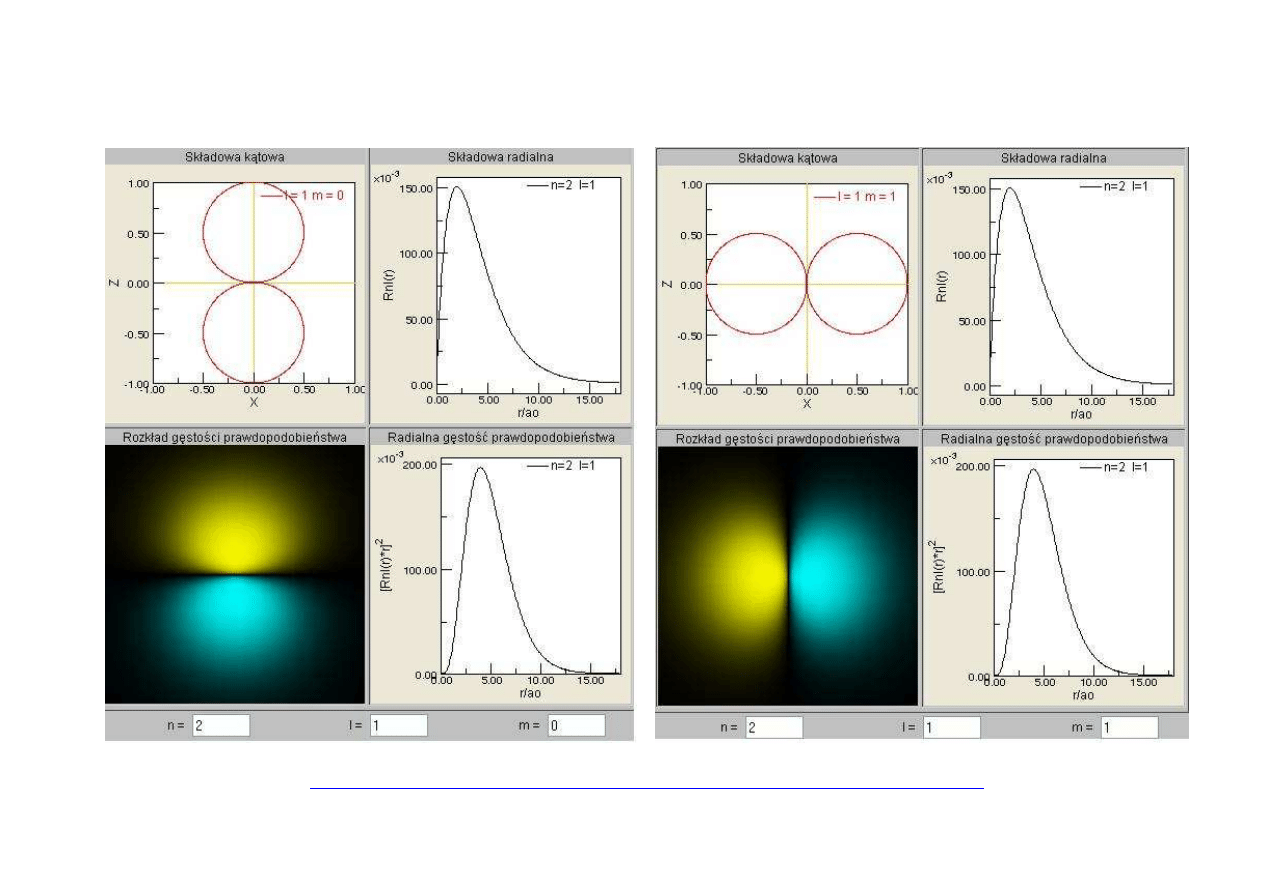
atom wodoropodobny
12
ORBITALE ATOMU WODORU
http://www.ch.pw.edu.pl/~janzac/Orbitals/start/hydrogen.html
atom wodoropodobny
13
SPIN ELEKTRONU
Spin elektronu (własny moment pędu):
h
)
1
(
+
=
s
s
S
s
- spinowa liczba kwantowa
s = 1/
2
Rzut spinu na wybraną oś
S
z
= m
s
ħ
m
s
= ± 1/
2
m
s
- magnetyczna liczba spinowa
•
Stan elektronu w atomie wodoru opisują
4 liczby kwantowe: n, l, m, m
s

atom wodoropodobny
14
ZAKAZ PAULIEGO
W dowolnym układzie fizycznym dwie jednakowe cząstki o spinie
połówkowym nie mogą znajdować się w tym samym stanie
kwantowym.
Nie mogą mieć jednakowych wszystkich 4 liczb kwantowych.

atom wodoropodobny
15
ATOMY WIELOELEKTRONOWE
Przybliżenie jednoelektronowe
Każdy elektron w atomie porusza się w uśrednionym polu elektrostatycznym
wytworzonym przez jądro i wszystkie pozostałe elektrony.
Każdemu przyporządkowujemy
n, l, m, m
s
Powłoki elektronowe
zawierają elektrony o wspólnej głównej liczbie kwantowej:
1, 2, 3, 4, 5, 6,
K, L, M, N, O, P, Q po
2n
2
elektronów każda
Podpowłoki elektronowe - wspólne liczby
n
i
l,
prawie taka sama energia
Konfiguracje elektronowe:
Li - 1s
2
2s
2
C - 1s
2
2s
2
2p
2
O - 1s
2
2s
2
2p
4

atom wodoropodobny
16
ELEKTRONY WALENCYJNE
Najsłabiej związane elektrony z zewnętrznych podpowłok.
Atomy mają od 0 do 8 elektronów walencyjnych
.
Atomy o tej samej liczbie elektronów walencyjnych mają podobne właściwości
fizyczne i chemiczne.
C - 2s
2
2p
2
Si - 3s
2
3p
2
Ge - 4s
2
4p
2
Wyszukiwarka
Podobne podstrony:
fizyka sprawozdania, Właściwości elektryczne dielektryków, B-7
fizyka atomy, jądra atomowe, promieniowania
Fizyka 1 26 termodynamika fenomenologiczna S1E
fizyka ?danie właściwości magnetycznych ciał stałych
Fizyka 1b, AGH, agh, programinski, Laborki, Laborki, Lab, FIZYKA - Laboratorium, WAHADŁA FIZYCZNE
Fizyka 1c wiązania atomów w kryształach S1 E
Fizyka drgania, fizyk atomowa
2.12 molowe ciepło właściwe, materiały, Fizyka
Zegar atomowy, Fizyka
Fizyka laboratorium 4?danie ciepła właściwego cieczy i ciał stałych
sprawozdanie 4 wyznaczanie gęstości i ciężaru właściwego ciał, politechnika krakowska transport nie
tabele 1B+, Prz inf 2013, I Semestr Informatyka, Fizyka, [FIZYKA] Laborki, laboratorium stare, 1b
Fizyka atomowa
fizyka lab3 cieplo wlasciwe Wstęp laboratorium 3
więcej podobnych podstron