Pieczęć
KONKURS CHEMICZNY
dla uczniów gimnazjów województwa lubuskiego
15 lutego 2008 r. – zawody II stopnia (rejonowe)
Witamy Cię na drugim etapie Konkursu Chemicznego.
Przed przystąpieniem do rozwiązywania zadań przeczytaj uważnie polecenia.
Podczas konkursu możesz korzystać z układu okresowego pierwiastków, tabeli
rozpuszczalności, wykresów rozpuszczalności oraz prostego kalkulatora.
Odpowiedzi udzielaj w miejscach do tego przeznaczonych. Brudnopis nie
podlega sprawdzeniu.
ś
yczymy Ci powodzenia!
Maksymalna liczba punktów: 40. Czas rozwiązywania zadań: 60 minut.
W zadaniach 1-7 wybierz jedną odpowiedź i zaznacz ją krzyżykiem (X) na teście.
W przypadku pomyłki błędną odpowiedź obwiedź kółkiem, a znak (X) postaw tam, gdzie Twoim
zdaniem powinien być. Każda poprawna odpowiedź to jeden punkt, razem 7 punktów.
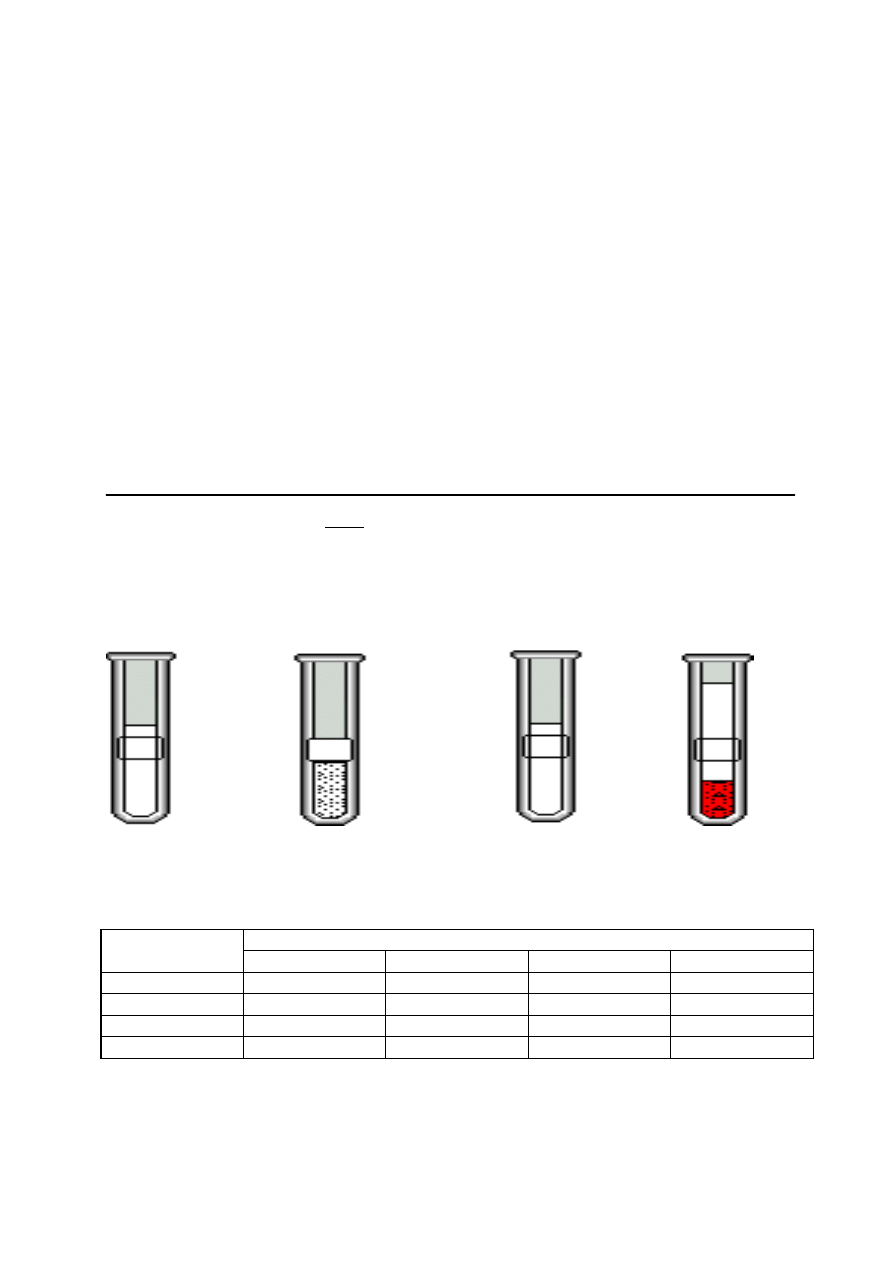
Zadanie 1. W czterech probówkach znajdują się odpowiednio:
I II III IV
woda
z solą
woda
z mąką
woda
z kwasem octowym
woda
ze żwirem
Rozdzielenia poszczególnych składników można dokonać poprzez:
Numer probówki
I
II
III
IV
A)
dekantację
destylację
sączenie
destylację
B)
destylację
sączenie
destylację
dekantację
C)
sączenie
destylację
sączenie
dekantację
D)
destylację
sączenie
dekantację
sączenie
Zadanie 2. Podaj nazwę procesu, któremu zawdzięczamy to, że pranie wysycha na mrozie.
A) parowanie
B) krzepnięcie
C) sublimacja
D) resublimacja

Zadanie 3. Która drobina ma tyle samo elektronów co jon Fe
3+
?
A) jon Cu
3+
B) jon Ni
2+
C) atom wanadu V
D) atom sodu Na
Zadanie 4. Roztwór kwasu siarkowego (VI) o pH=4 jest bardziej stężony od roztworu tego
kwasu o pH równym:
A) 2
C) 3
B) 5
D) pH roztworu nie zależy od stężenia kwasu
Zadanie 5. Gazowy wodór możemy otrzymać w wyniku reakcji:
A) tlenku wapnia z wodą
C) dysocjacji kwasu chlorowodorowego
B) tlenku siarki z wodą
D) sodu z wodą
Zadanie 6. Którą parę węglowodorów można rozróżnić stosując wodę bromową?
A) C
4
H
6
i C
7
H
14
C) C
2
H
6
i C
8
H
18
B) C
3
H
4
i C
5
H
8
D) C
5
H
10
i C
3
H
8
Zadanie7. Cząsteczki alkoholu metylowego zawierają grupy –OH. Ich obecność
w cząsteczce alkoholu powoduje, że:
A) metanol dobrze rozpuszcza się w wodzie
B) metanol łatwo ulega dysocjacji, w wyniku której powstają jony OH
-
C) wodne roztwory metanolu mają odczyn silnie zasadowy
D) poprawne są odpowiedzi B i C
Zadanie 8. (1 punkt)
Podaj nazwę pierwiastka, którego atomy mają po 3 powłoki elektronowe, a ich maksymalna
wartościowość względem tlenu wynosi V.
Zadanie 9. (1 punkt)
Ile atomów węgla zawiera cząsteczka alkanu, jeżeli w tej cząsteczce jest 46 atomów wodoru?
Zadanie 10. (1 punkt)
Ile wynosi liczba elektronów w jednej cząsteczce tlenku azotu (V)?
Zadanie 11. (3 punkty)
Oblicz, ile gramów wody należy dolać do 80 g roztworu soli o stężeniu 20%, aby otrzymać
roztwór tej soli o stężeniu 12%?
Obliczenia:
Odpowiedź:

Zadanie 12. (2 punkty)
Oblicz, ile gramów tlenu znajduje się w 100g hydratu węglanu sodu, którego skład można
przedstawić za pomocą wzoru Na
2
CO
3
• 10 H
2
O.
Obliczenia:
Odpowiedź:
Zadanie 13. (2 punkty)
Ustal wzór sumaryczny związku chemicznego, wiedząc, że jego masa cząsteczkowa wynosi
102u oraz że jego cząsteczka zawiera 3 atomy pierwiastka o łącznej masie 48u i 2 atomy
innego pierwiastka.
Obliczenia:
Odpowiedź:
Zadanie 14. (3 punkty)
W trzech nieopisanych naczyniach znajdują się odpowiednio: kwas solny, zasada sodowa
i woda. Ustal zawartość poszczególnych probówek, wykorzystując tylko fenoloftaleinę
i dowolną ilość pustych probówek. Opisz lub przedstaw schematem tok postępowania,
obserwacje i wnioski.

Zadanie 15. (5 punktów)
Zapisz pięć równań reakcji chemicznych, korzystając z podanych niżej substancji jako
substratów (nie możesz użyć dodatkowych substratów).
Substraty: sód, tlenek wapnia, chlorek żelaza (III), woda, kwas azotowy (V), zasada sodowa,
tlenek siarki (VI).
1.
2.
3.
4.
5.
Zadanie 16. (4 punkty)
Zapisz cztery równania reakcji, których produktem jest tlenek węgla (IV). Tak dobierz
pozostałe reagenty, aby poszczególne reakcje spełniały podane niżej warunki.
1. reakcja analizy
2. reakcja wymiany pojedynczej
3. reakcja wymiany podwójnej
4. substratem jest związek organiczny
Zadanie 17. (1 punkt)
Napisz wzory sumaryczne trzech substancji, które należy rozpuścić w wodzie, aby roztwór
zawierał następujące jony: H
+
, Na
+
, Fe
3+
, CH
3
COO
-
, Cl
-
, NO
3
-
.
Substancja 1.
Substancja 2.
Substancja 3.
Zadanie 18. (4 punkty)
Podaj wzory strukturalne i nazwy najprostszych węglowodorów, w których stosunek liczby
atomów węgla do liczby atomów wodoru wynosi odpowiednio:
A) 2:5
Wzór Nazwa
B) 2:3
Wzór Nazwa

Zadanie 19. (3 punkty)
Za pomocą równań reakcji chemicznych przedstaw przemiany opisane poniższym
schematem. Wzory substancji A, B i C zapisz w formie strukturalnej.
CaC
2
→
O
H
2
A
→
2
H
B
→
2
Cl
C
1.
2.
3.
Zadanie 20. (3 punkty)
W wyniku rozkładu azotanu (V) potasu powstaje tlenek potasu, azot i tlen. Oblicz:
A)
ile moli tlenku potasu powstanie w wyniku tej reakcji, jeżeli jednocześnie wydzieli się
11,2 dm
3
azotu (odmierzonego w warunkach normalnych),
B)
ile gramów azotanu (V) potasu uległo rozkładowi, jeżeli w jego wyniku powstało
10,03 • 10
23
cząsteczek tlenu.
Obliczenia:
Odpowiedź:

BRUDNOPIS
(nie podlega sprawdzeniu!)
Wyszukiwarka
Podobne podstrony:
Etap rejonowy 2007 2008 klucz
Etap wojewódzki 2007 2008 arkusz
Etap rejonowy 2007 2008
Etap rejonowy 2007 2008 klucz
Etap rejonowy 2010 2011 arkusz
Etap wojewódzki 2007 2008
Etap rejonowy 2009 2010 arkusz 2
Etap szkolny 2007-2008, GEOGRAFIA, olimpiada- woj. małopolskie
Etap szkolny 2007 2008
Etap rejonowy 2009 2010 arkusz Nieznany
Etap wojewódzki 2007-2008, Matura chemia
Etap szkolny 2007 2008 klucz
Etap rejonowy 2010 2011 arkusz
KONKURS J ANGIESKIEGO ETAP REJONOWY 2007 test z kluczem
Etap rejonowy 2006 2007 arkusz
Etap rejonowy 2006 2007 arkusz
więcej podobnych podstron